Способ визуализации для различения здоровой ткани и опухолевой ткани
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к онкологии, и может быть использовано для визуализации опухоли с использованием гиперполяризованного 13С-пирувата в качестве магнитно-резонансного визуализирующего агента, позволяющего различать опухолевую ткань и здоровую ткань. Осуществляют: а) получение прямых 13С-МР изображений 13С-пирувата и его 13С-содержащих метаболитов аланина и лактата у субъекта, которому предварительно введена композиция,
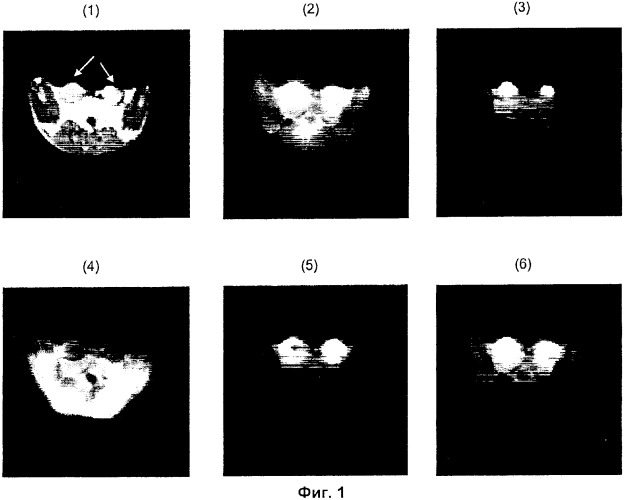
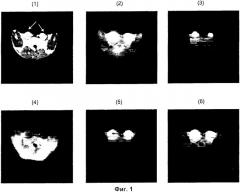
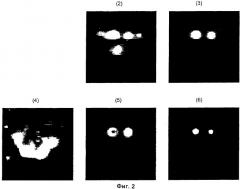
содержащая гиперполяризованный 13С-пируват, б) корректирование лактатного сигнала в отношении количества пирувата и/или аланина с получением взвешенного лактатного относительно пируватного и/или лактатного относительно аланинового изображения. При этом на опухолевую ткань в указанных 13C-изображениях указывает самый высокий лактатный сигнал и/или высокий взвешенный лактатный относительно пируватного и/или лактатный относительно аланинового сигнал. Способ обеспечивает повышение точности визуализации различения здоровой ткани от опухолевой за счет использования гиперполяризованного 13С-пирувата. 7 з.п. ф-лы, 2 ил.
Реферат
Данное изобретение относится к способу визуализация опухоли с использованием гиперполяризованного 13С-пирувата в качестве МР визуализирующего агента, позволяющего различать опухолевую ткань и здоровую ткань.
Магнитно-резонансная (МР) визуализация (МРВ) представляет собой метод визуализации, который стал особенно привлекательным для врачей, поскольку он позволяет получать изображения организма пациента или его частей неинвазивным способом, не подвергая пациента и медицинский персонал воздействию потенциально опасного излучения, такого как рентгеновское излучение. Благодаря высокому качеству изображений МРВ является предпочтительным методом визуализации мягких тканей и органов, который позволяет различать нормальную ткань и больную ткань, например опухоли, и патологические изменения.
МР визуализацию опухоли можно осуществлять с использованием или без использования МР контрастных агентов. На МР изображении, полученном без использования контрастного агента, довольно четко будут видны опухоли размером от примерно 1-2 сантиметров и больше. Однако МРВ с контрастным усилением обеспечивает обнаружение гораздо меньших изменений ткани, то есть гораздо меньших опухолей, что делает МР визуализацию с контрастным усилением мощным инструментом обнаружения опухолей на ранних стадиях и обнаружения метастазов.
В МР визуализации опухолей используется несколько типов контрастных агентов. Водорастворимые хелаты парамагнитных металлов, например хелаты гадолиния, такие как Omniscan™ (Amersham Health), широко используются в качестве МР контрастных агентов. При введении в сосудистую сеть, благодаря своей низкой молекулярной массе они быстро распределяются во внеклеточное пространство (то есть в кровь и интерстиций). Они также относительно быстро выводятся из организма. Было обнаружено, что хелаты гадолиния особенно полезны для увеличения процента обнаружения метастазов и небольших опухолей и для улучшения классификации опухолей, причем последнее обеспечивается дифференцированием витальной опухолевой ткани (высокая степень перфузиии и/или нарушение гематоэнцефалического барьера) от центрального некроза и от окружающего отека или макроскопически незатронутой ткани (см., например, С.Claussen et al., Neuroradiology 1985; 27:164-171).
С другой стороны, МР контрастные агенты кровяного пула, например частицы суперпарамагнитного оксида железа, остаются в сосудистой сети в течение длительного времени. Оказалось, что они чрезвычайно полезны для усиления контраста в печени, а также для обнаружения аномалий проницаемости капилляров, например "имеющих течь" стенок капилляров в опухолях, например, в результате ангиогенеза.
Несмотря на бесспорно превосходные свойства указанных контрастных агентов, их использование не лишено риска. Хотя хелатные комплексы парамагнитных металлов обычно имеют высокие константы стабильности, возможно, что ионы токсичных металлов высвобождаются в организм после введения. Кроме того, контрастные агенты этого типа демонстрируют плохую специфичность.
В WO-A-99/35508 раскрыт способ МР исследования пациента с использованием гиперполяризованного раствора агента с высоким T1 в качестве МР визуализирующего агента. Термин "гиперполяризация" означает усиление ядерной поляризации ЯМР активных ядер, присутствующих в агенте с высоким Т1, то есть ядер с ненулевым ядерным спином, предпочтительно ядер 13С или 15N. При усилении ядерной поляризации ЯМР активных ядер разница между населенностями возбужденного и основного ядерных спиновых состояниях этих ядер значительно увеличивается, и в силу этого интенсивность МР сигнала усиливается в сто раз и более. При использовании гиперполяризованного 13С- и/или 15N-обогащенного агента с высоким T1 помехи от фоновых сигналов практически отсутствуют, поскольку распространенность 13С и/или 15N в природе пренебрежимо мала и поэтому контрастность изображения будет преимущественно высокой. Раскрыт целый ряд возможных агентов с высоким T1, подходящих для гиперполяризации и последующего использования в качестве МР визуализирующих агентов, включая, но не ограничивая ими, неэндогенные и эндогенные соединения, такие как ацетат, пируват, оксалат или глюконат, сахара, такие как глюкоза или фруктоза, мочевина, амиды, аминокислоты, такие как глутамат, глицин, цистеин или аспартат, нуклеотиды, витамины, такие как аскорбиновая кислота, производные пенициллина и сульфонамиды. Установлено также, что промежуточные соединения в нормальных метаболических циклах, таких как цикл лимонной кислоты, такие как фумаровая кислота и пировиноградная кислота, являются предпочтительными визуализирующими агентами для визуализации метаболической активности.
Необходимо подчеркнуть, что сигнал от гиперполяризованного визуализирующего агента ослабевает из-за релаксации и после введения в организм пациента из-за разбавления. Следовательно, значение Т1 визуализирующих агентов в биологических жидкостях (например, в крови) должно быть достаточно высоким, чтобы обеспечить распределение агента в сайт-мишень в организме пациента в высокогиперполяризованном состоянии.
Теперь авторы изобретения неожиданно нашли способ МР визуализации опухоли, позволяющий различать опухолевую ткань и здоровую ткань, где в качестве визуализирующего агента используют гиперполяризованный 13С-пируват.
Таким образом, согласно настоящему изобретению предложен способ различения здоровой ткани и опухолевой ткани, включающий
а) получение прямых 13С-МР изображений 13С-пирувата и его 13С-содержащих метаболитов аланина, лактата и, возможно, бикарбоната у субъекта, которому предварительно введена композиция, содержащая гиперполяризованный 13С-пируват;
б) возможно корректирование лактатного сигнала в отношении количества пирувата и/или аланина с получением взвешенного лактатного относительно пируватного и/или лактатного относительно аланинового изображения,
при этом на опухолевую ткань в указанных 13С-изображениях указывает самый высокий лактатный сигнал и/или в случае проведения корректирования на стадии (б) высокий взвешенный лактатный относительно пируватного и/или лактатный относительно аланинового сигнал.
Гиперполяризация ЯМР активных 13С-ядер может быть достигнута различными методами (например, методами, описанными в WO-A-99/35508). Предпочтительными методами являются перенос поляризации от благородного газа, "метод грубой силы", замораживание спинов и ДПЯ (динамическая поляризация ядер). Предпочтительно для получения гиперполяризованного 13С-пирувата либо поляризуют непосредственно сам 13С-пируват либо поляризуют 13С-пировиноградную кислоту и превращают поляризованную 13С-пировиноградную кислоту в поляризованный 13С-пируват, например, нейтрализацией основанием.
Предпочтительным методом получения гиперполяризованного 13С-пирувата является перенос поляризации от гиперполяризованного благородного газа. Благородные газы, имеющие ненулевой ядерный спин, могут быть гиперполяризованы, то есть их поляризация может быть повышена относительно равновесной поляризации, например, использованием поляризованного вкруговую света. Для осуществления гиперполяризации 13С-ядер можно использовать гиперполяризованный благородный газ, предпочтительно Не или Хе, или смесь таких газов. Гиперполяризация может быть достигнута также с использованием обогащенного изотопом гиперполяризованного благородного газа, предпочтительно 3He или 129Хе. Гиперполяризованный газ может находиться в газовой фазе, он может быть растворенным в жидкости/растворителе, или гиперполяризованный газ сам может служить в качестве растворителя. Альтернативно этот газ можно конденсировать на охлажденную твердую поверхность и использовать в этой форме или дать ему возможность сублимироваться. Тщательное перемешивание гиперполяризованного газа с соединением, которое должно быть поляризовано, является предпочтительным. Следовательно, если поляризуют 13С-пировиноградную кислоту, которая при комнатной температуре является жидкостью, гиперполяризованный газ предпочтительно растворен в жидкости/растворителе или служит в качестве растворителя. Если поляризуют 13С-пируват, гиперполяризованный газ предпочтительно растворен в жидкости/растворителе, которая(ый) растворяет также и пируват.
Другой предпочтительный метод получения гиперполяризованного 13С-пирувата заключается в передаче поляризации ЯМР активным ядрам термодинамическим уравновешиванием при очень низкой температуре и в очень сильном поле. Гиперполяризацию осуществляют, используя очень сильное поле и очень низкую температуру (метод грубой силы) по сравнению с рабочими полем и температурой ЯМР спектрометра. Напряженность используемого магнитного поля должна быть как можно более высокой, приемлемо выше 1 Тл, предпочтительно выше 5 Тл, более предпочтительно 15 Тл или выше и особенно предпочтительно 20 Тл или выше. Температура должна быть очень низкой, например 4,2 К или ниже, предпочтительно 1,5 К или ниже, более предпочтительно 1,0 К или ниже, особенно предпочтительно 0,1 К или ниже.
Другим предпочтительным методом получения гиперполяризованного 13С-пирувата является метод замораживания спинов. Этот метод включает поляризацию спина твердого соединения или системы путем поляризации замораживанием спина. В систему вводят подходящие парамагнитные вещества или систему смешивают до гомогенного состояния с подходящими парамагнитными веществами, такими как Ni2+, ионы лантанидов или актинидов, в кристаллической форме с осью симметрии третьего или более порядка. Аппаратура проще, чем требуется для ДПЯ, не требуется однородное магнитное поле, поскольку поле резонансного возбуждения не прикладывается. Этот процесс осуществляют физическим вращением образца вокруг оси, перпендикулярной направлению магнитного поля. Предварительным условием для этого метода является то, что парамагнитные вещества должны иметь высокоанизотропный g-фактор. В результате вращения образца электронный парамагнитный резонанс входит в контакт с ядерными спинами, что приводит к уменьшению температуры ядерного спина. Вращение образца выполняют до тех пор, пока поляризация ядерного спина не достигает нового равновесия.
В более предпочтительном воплощении для получения гиперполяризованного 13С-пирувата используют метод динамической поляризации ядер (ДПЯ). Поляризацию осуществляют парамагнитным соединением, так называемым парамагнитным агентом или ДПЯ агентом. Во время осуществления процесса ДПЯ подводят энергию, обычно в форме микроволнового излучения, которая первоначально возбуждает парамагнитный агент. При угасании до исходного состояния происходит перенос поляризации от неспаренного электрона парамагнитного агента к ЯМР активным ядрам образца. Обычно в процессе ДПЯ используют умеренное или сильное магнитное поле и очень низкую температуру, например проводят процесс ДПЯ в жидком гелии и в магнитном поле около 1 Тл или выше. Альтернативно можно использовать умеренное магнитное поле и любую температуру, при которой достигается достаточное усиление поляризации. Методика ДПЯ описана, например, в международных публикациях WO-A-98/58272 и в WO-A-01/96895, которые обе включены в данное описание изобретения ссылкой на них. Для получения гиперполяризованного 13С-пирувата методом ДПЯ в качестве поляризуемого соединения используют либо 13С-пируват либо 13С-пировиноградную кислоту.
В зависимости в основном от используемого в процессе ДПЯ парамагнитного агента используют 13С-пировиноградную кислоту и/или 13С-пируват. Если парамагнитный агент растворим в 13С-пировиноградной кислоте, то предпочтительно используют 13С-пировиноградную кислоту и образуют жидкую смесь, предпочтительно жидкий раствор парамагнитного агента и 13С-пировиноградной кислоты. Если парамагнитный агент не растворяется в 13С-пировиноградной кислоте, то используют 13С-пируват и/или 13С-пировиноградную кислоту и по меньшей мере один сорастворитель для образования жидкой смеси, предпочтительно жидкого раствора. Было установлено, что успешное осуществление ДПЯ и, следовательно, уровень поляризации зависит от нахождения поляризуемого соединения и парамагнитного агента в тесном контакте друг с другом. Следовательно, сорастворителем предпочтительно является сорастворитель или смесь сорастворителей, который(ая) растворяет как парамагнитный агент, так и 13С-пировиноградную кислоту и/или 13С-пируват. Для 13С-пирувата в качестве сорастворителя предпочтительно используют воду.
Было также обнаружено, что более высокие уровни поляризации достигаются методом ДПЯ, когда образец-смесь при охлаждении/замораживании образует стекло, а не кристаллизованный образец. Опять же, образование стекла обеспечивает более тесный контакт парамагнитного агента и подвергаемого поляризации соединения. 13С-пировиноградная кислота является хорошим стеклообразующим веществом и поэтому предпочтительно ее используют в процессе ДПЯ, когда парамагнитный агент растворим в 13С-пировиноградной кислоте. 13С-пируват представляет собой соль и при замораживании жидкой смеси водного раствора 13С-пирувата и парамагнитного агента будет образовываться кристаллизованный образец. Чтобы предотвратить это, предпочтительно добавлять также сорастворители, которые являются хорошими стеклообразующими веществами, такие как глицерин, пропандиол или гликоль.
Следовательно, в одном воплощении 13С-пируват растворяют в воде с получением водного раствора и добавляют парамагнитный агент, глицерин и, возможно, также сорастворитель с образованием жидкой смеси. В предпочтительном воплощении 13С-пировиноградную кислоту, парамагнитный агент и сорастворитель объединяют с образованием жидкой смеси. В наиболее предпочтительном воплощении 13С-пировиноградную кислоту и парамагнитный агент объединяют с образованием жидкой смеси. Смешивание соединений до гомогенного состояния может быть достигнуто несколькими способами, известными в данной области, такими как перемешивание, вортексирование или обработка ультразвуком.
Жидкую смесь затем замораживают, после чего проводят процесс ДПЯ. Охлаждение/замораживание жидкой смеси может быть достигнуто способами, известными в данной области, например замораживанием жидкой смеси в жидком азоте или просто помещением ее в поляризатор, где образец будет заморожен жидким гелием.
Как указано выше, динамическая поляризация ядер (ДПЯ) представляет собой метод поляризации, заключающийся в том, что поляризацию соединения, которое поляризуют, осуществляют агентом ДПЯ, то есть парамагнитным агентом/соединением.
В качестве агентов ДПЯ могут быть использованы многие известные парамагнитные соединения, например переходные металлы, такие как ионы хрома (V), органические свободные радикалы, такие как нитроксидные радикалы, тритильные радикалы или магнитные частицы. Такие агенты ДПЯ описаны, например, в WO-A-99/35508, WO-A-88/10419, WO-A-90/00904, WO-A-91/12024, WO-A-93/02711 или WO-A-96/39367.
В предпочтительном воплощении в качестве парамагнитного агента для получения 13С-пирувата способом ДПЯ используют тритильный радикал формулы (I)
где М представляет собой водород или один эквивалент катиона; и
R1, которые являются одинаковыми или разными, каждый представляет собой, возможно, гидроксилированную C1-С6-алкильную группу с прямой или разветвленной цепью или группу -(CH2)n-X-R2, где n равно 1, 2 или 3;
X представляет собой О или S; и
R2 представляет собой, возможно, гидроксилированную С1-С4-алкильную группу с прямой или разветвленной цепью.
В предпочтительном воплощении М представляет собой водород или один эквивалент физиологически переносимого катиона. Термин "физиологически переносимый катион" означает катион, который переносим живым организмом человека или животного, не являющегося человеком. Предпочтительно М представляет собой водород или катион щелочного металла, ион аммония или ион органического амина, например меглумина. Наиболее предпочтительно М представляет собой водород или натрий.
В еще одном предпочтительном воплощении R1 одинаковые или разные, предпочтительно одинаковые, и каждый представляет собой возможно гидроксилированную С1-С4-алкильную группу с прямой или разветвленной цепью, наиболее предпочтительно метил, этил, изопропил, гидроксиметил или гидроксиэтил.
В еще одном предпочтительном воплощении R1 одинаковые или разные, предпочтительно одинаковые, и каждый представляет собой -СН2-O-(С1-С3-алкил), -(СН2)2-O-СН3, -(С1-С3-алкил)-O-СН3, -СН2-S-(С1-С3-алкил), -(СH2)2-S-СН3, -(С1-С3-алкил)-S-СН3, -СН2-O-СН3, -СН2-O-С2Н5, -СН2-O-С2Н4OН, -СН2-СН2-O-СН3, -СН2-S-СН3, -CH2-S-C2H5, -CH2-S-C2H4OH или -СН2-СН2-S-СН3, наиболее предпочтительно -СН2-СН2-O-СН3.
В более предпочтительном воплощении М представляет собой водород или натрий, и R1 одинаковые и каждый представляет собой -СН2-СН2-O-СН3.
Тритильные радикалы формулы (I) могут быть синтезированы способами, которые подробно описаны в WO-A-91/12024, WO-A-96/39367, WO 97/09633 и WO-A-98/39277. Коротко, радикалы могут быть синтезированы путем взаимодействия трех мольных эквивалентов металлированного мономерного арильного соединения с одним мольным эквивалентом соответствующим образом защищенного производного карбоновой кислоты с образованием тримерного промежуточного соединения. Это промежуточное соединение металлируют и затем подвергают взаимодействию, например, с диоксидом углерода с получением трикарбокситритилкарбинола, который на следующей стадии обрабатывают сильной кислотой с образованием триарилметильного катиона. Этот катион затем восстанавливают с образованием стабильного тритильного радикала.
Жидкая смесь, содержащая 13С-пируват и/или 13С-пировиноградную кислоту и, возможно, растворитель, предпочтительно содержит от 5 до 100 мМ тритильных радикалов формулы (I), более предпочтительно от 10 до 20 мМ, особенно предпочтительно от 12 до 18 мМ и наиболее предпочтительно от 13 до 17 мМ. Было обнаружено, что время нарастания для поляризации в процессе ДПЯ короче при использовании большего количества радикала, однако достигается более низкий уровень поляризации. Следовательно, эти два эффекта должны быть сбалансированы один относительно другого.
Методика ДПЯ описана, например, в международных публикациях WO-A-98/58272 и в WO-A-01/96895, которые обе включены в данное описание ссылкой на них. Обычно в процессе ДПЯ используют умеренное или сильное магнитное поле и очень низкую температуру, например проводят процесс ДПЯ в жидком гелии и в магнитном поле примерно 1 Тл или выше. Альтернативно можно использовать умеренное магнитное поле и любую температуру, при которой достигается достаточное усиление поляризации. В предпочтительном воплощении способа по изобретению процесс ДПЯ проводят в жидком гелии и в магнитном поле примерно 1 Тл или выше. Подходящие установки для поляризации описаны, например, в WO-A-02/37132. В предпочтительном воплощении установка для поляризации содержит криостат и поляризующее устройство, например микроволновую камеру, соединенную волноводом с источником микроволнового излучения, в центральном канале, окруженном создающим магнитное поле устройством, таким как сверхпроводящий магнит. Канал тянется вертикально вниз до по меньшей мере уровня области Р рядом со сверхпроводящим магнитом, где сила магнитного поля достаточно высока, например от 1 до 25 Тл, для осуществления поляризации 13С-ядер. Канал для образца предпочтительно выполнен с возможностью герметизации и его можно откачивать до низких давлений, например давлений порядка 1 мбар (100 Па) или менее. Внутрь этого канала может быть помещено устройство для ввода образца (например смеси, содержащей парамагнитный агент и 13С-пируват или 13С-пировиноградную кислоту), например извлекаемая транспортирующая образец трубка, и эта трубка может быть вставлена в канал сверху вниз до позиции внутри микроволновой камеры в области Р. Область Р охлаждают жидким гелием до температуры, достаточно низкой, для того, чтобы происходила поляризация, предпочтительно до температуры порядка 0,1-100 К, более предпочтительно 0,5-10 К, наиболее предпочтительно 1-5 К. Устройство для ввода образца предпочтительно выполнено с возможностью герметизации на его верхнем конце любым подходящим способом для сохранения частичного вакуума в канале. В нижнем конце устройства для ввода образца может быть установлен с возможностью извлечения удерживающий образец контейнер, например удерживающий образец стакан. Удерживающий образец контейнер предпочтительно изготовлен из легкого по массе материала с низкой удельной теплоемкостью и хорошими криогенными свойствами, такого как, например, KelF (полихлортрифторэтилен) или PEEK (полиэфирэфиркетон). Контейнер для образца может вмещать в себя один или более чем один подлежащий поляризации образец.
Образец вставляют в удерживающий образец контейнер, погружают в жидкий гелий и подвергают микроволновому облучению, предпочтительно при частоте примерно 94 ГГц при 200 мВт. Мониторинг уровня поляризации можно выполнять путем получения 13С-ЯМР сигналов от образца в твердом состоянии во время микроволнового облучения, поэтому на стадии (б) предпочтительно используют установку для поляризации, содержащую устройство для получения 13С-ЯМР спектров в твердом состоянии. Обычно получают кривую насыщения на графике зависимости 13С-ЯМР сигнала от времени. Следовательно, можно определить, когда достигается оптимальный уровень поляризации.
Если гиперполяризацию осуществляют методом, который требует, чтобы образец был в твердом состоянии, например методом ДПЯ, то для использования в способе по изобретению твердый образец должен быть переведен в жидкое состояние. Твердую поляризованную смесь либо растворяют подобно тому, как описано, например, в WO-A-02/37132, либо расплавляют, как описано, например, в WO-A-02/36005. Предпочтительным является растворение твердого гиперполяризованного образца, более предпочтительно растворение в буфере, предпочтительно в физиологически переносимом буфере с получением жидкой композиции. Термин "буфер" в контексте данной заявки означает один или более буферов, то есть также смеси буферов.
Предпочтительными буферами являются физиологически переносимые буферы, более предпочтительно буферы, которые обеспечивают рН в пределах примерно от 7 до 8, такие как, например, фосфатный буфер (KH2PO4/Na2HPO4), ACES, PIPES, имидазол/HCl, BES, MOPS, HEPES, TES, TRIS, HEPPS или TRICIN. Более предпочтительными буферами являются фосфатный буфер и TRIS, наиболее предпочтительным является TRIS. В еще одном воплощении используют более чем один из вышеуказанных предпочтительных буферов, то есть смесь буферов.
Когда в качестве соединения, подлежащего поляризации, используют 13С-пировиноградную кислоту, растворение также включает превращение 13С-пировиноградной кислоты в 13С-пируват. Чтобы достичь этого, 13С-пировиноградную кислоту подвергают взаимодействию с основанием. В одном воплощении 13С-пировиноградную кислоту подвергают взаимодействию с основанием с превращением ее в 13С-пируват, а затем добавляют буфер. В другом предпочтительном воплощении буфер и основание объединяют в одном растворе, и этот раствор добавляют к 13С-пировиноградной кислоте, при этом она растворяется и превращается в 13С-пируват одновременно. В предпочтительном воплощении основание представляет собой водный раствор NaOH, Nа2СО3 или NаНСО3, и наиболее предпочтительным основанием является NaOH. В особенно предпочтительном воплощении для растворения 13С-пировиноградной кислоты и ее превращения в натриевую соль 13С-пирувата используют раствор буфера TRIS, содержащий NaOH.
В другом предпочтительном воплощении буфер или, где это применимо, объединенный раствор буфер/основание дополнительно содержит одно или более соединений, которые способны связывать свободные парамагнитные ионы или образовывать с ними комплексы, например хелатирующие агенты, такие как DTPA (диэтилентриаминпентауксусная кислота) или EDTA (этилендиаминтетрауксусная кислота). Было обнаружено, что свободные парамагнитные ионы могут вызывать уменьшение T1 гиперполяризованного соединения и этого предпочтительно избегают.
Растворение может быть осуществлено предпочтительно с использованием методов и/или устройств, раскрытых в WO-A-02/37132. Если гиперполяризацию проводят методом ДПЯ, то может быть использована установка для растворения, которая либо физически отделена от поляризатора либо является частью аппарата, который содержит поляризатор и установку для растворения. В предпочтительном воплощении растворение осуществляют при повышенном магнитном поле для улучшения релаксации и сохранения максимума гиперполяризации. Узлов магнитного поля следует избегать, и, несмотря на вышеуказанные меры, слабое поле может приводить к усилению релаксации.
Если гиперполяризацию проводят методом ДПЯ, то парамагнитный агент и/или его реакционные продукты предпочтительно удаляют из раствора, содержащего 13С-пируват. Парамагнитный агент и/или реакционные продукты могут быть удалены частично, в значительной степени или в идеале полностью, причем полное удаление является предпочтительным. Реакционными продуктами, например, тритильных радикалов формулы (I) могут быть сложные эфиры, которые могут образовываться в результате реакции пировиноградной кислоты с радикалами формулы (I), содержащими гидроксильные группы. Способы, используемые для удаления парамагнитного агента и/или его реакционных продуктов, известны в данной области. Как правило, выбор способа зависит от природы парамагнитного агента и/или его реакционных продуктов. При растворении твердого образца после поляризации радикал может осаждаться и его легко можно выделить из жидкой композиции фильтрованием. Если в качестве парамагнитных агентов используют магнитные частицы, то эти частицы также без труда удаляют фильтрованием. Если осаждение не происходит, парамагнитный агент может быть удален хроматографическими методами разделения, например жидкостной хроматографией, такой как хроматография с обращенными фазами, прямофазная или ионообменная хроматография, или экстракцией.
Так как тритильный радикал формулы (I) имеет характеристический спектр поглощения в УФ/видимой области, можно использовать измерение поглощения в УФ/видимой области в качестве метода проверки его присутствия в жидкой композиции после его удаления. Для получения количественных результатов, то есть концентрации радикала, присутствующего в растворенном гиперполяризованном образце, оптический спектрометр может быть откалиброван таким образом, что поглощение при конкретной длине волны для образца дает соответствующую концентрацию радикала в образце.
Изотопное обогащение 13С-пирувата, используемого в способе по изобретению, и/или 13С-пировиноградной кислоты, которую предпочтительно используют для получения гиперполяризованного 13С-пирувата методом ДПЯ, предпочтительно составляет по меньшей мере 75%, более предпочтительно по меньшей мере 80% и особенно предпочтительно по меньшей мере 90%, причем изотопное обогащение свыше 90% является наиболее предпочтительным. В идеале обогащение составляет 100%. 13С-пировиноградная кислота и/или 13С-пируват могут быть обогащены изотопом в положении С1 (что ниже обозначено как 13С1-пировиноградная кислота и 13С1-пируват), в положении С2 (что ниже обозначено как 13С2-пировиноградная кислота и 13C2-пиpyвaт), в положении С3 (что ниже обозначено как 13С3-пировиноградная кислота и 13С3-пируват), в положениях С1 и С2 (что ниже обозначено как 13С1,2-пировиноградная кислота и 13С1,3-пируват), в положениях С1 и С3 (что ниже обозначено как 13С2,3-пировиноградная кислота и 13С2,3-пируват), в положениях С2 и С3 (что ниже обозначено как 13C2,3-пировиноградная кислота и 13C2,3-пиpyвaт) или в положениях С1, С2 и С3 (что ниже обозначено как 13С1,2,3-пировиноградная кислота и 13С1,2,3-пируват), причем положение С1 является предпочтительным.
В данной области известно несколько способов синтеза 13C1-пировиноградной кислоты. Коротко, в Seebach et al., Journal of Organic Chemistry 40(2), 1975, 231-237, описан путь синтеза, основанный на защите и активации карбонилсодержащего исходного вещества в виде S,S-ацеталя, например 1,3-дитиана или 2-метил-1,3-дитиана. Дитиан металлируют и подвергают взаимодействию с метилсодержащим соединением и/или 13СО2. С использованием соответствующего обогащенного изотопом 13C-компонента, как описано в этой ссылке, может быть получен 13С1-пируват, 13C2-пиpyвaт или 13С1,2-пируват. Карбонильную функциональную группировку затем высвобождают общепринятыми способами, описанными в литературе. Другие пути синтеза начинаются с уксусной кислоты, которую сначала превращают в ацетилбромид, а затем подвергают взаимодействию с Cu13CN. Полученный нитрил превращают в пировиноградную кислоту через амид (см., например, S.H.Anker et al., J. Biol. Chem. 176 (1948), 1333 или J.E.Thirkettle, Chem Commun. (1997), 1025). 13С-пировиноградная кислота может быть получена также протонированием коммерчески доступного 13С-пирувата натрия, например способом, описанным в патенте США 6232497.
Для использования в способе по изобретению гиперполяризованный 13С-пируват предоставляется в виде композиции, которая подходит для введения в живой организм человека или животного, не являющегося человеком. Композиция предпочтительно содержит буфер или смесь буферов, как описано выше. Композиция может дополнительно содержать традиционные фармацевтически приемлемые носители, эксципиенты и вспомогательные вещества, используемые для приготовления препаратов. Так, композиция может содержать, например, стабилизаторы, агенты, регулирующие осмотическое давление, солюбилизирующие агенты и тому подобное.
Пируват является эндогенным соединением, которое организм человека переносит очень хорошо даже в высоких концентрациях. В качестве предшественника в цикле лимонной кислоты пируват играет важную метаболическую роль в организме человека. Пируват превращается в разные соединения: в результате его трансаминирования образуется аланин, в результате окислительного декарбоксилирования пируват превращается в ацетил-KoA и бикарбонат, в результате восстановления пирувата образуется лактат, а в результате его карбоксилирования образуется оксалоацетат.
Теперь обнаружено, что превращение гиперполяризованного 13С-пирувата в гиперполяризованный 13С-лактат, гиперполяризованный 13С-бикарбонат (только в случае 13С-гпирувата, 13С1,2-пирувата или 13С1,2,3-пирувата) и гиперполяризованный 13С-аланин может быть использовано для различения опухолевой ткани и здоровой ткани с использованием МР визуализации in vivo. Это неожиданно, поскольку известно, что T1 гиперполяризованных соединений снижается из-за релаксации и разбавления. В цельной крови человека при 37°С 13С-пируват имеет релаксацию T1 примерно 42 сек, однако было обнаружено, что превращение гиперполяризованного 13С-пирувата в гиперполяризованный 13С-лактат, гиперполяризованный 13С-бикарбонат и гиперполяризованный 13С-аланин является достаточно быстрым, чтобы иметь возможность детектировать сигнал от 13С-пируватного исходного соединения и его метаболитов. Количество аланина, бикарбоната и лактата зависит от метаболического статуса исследуемой ткани. Интенсивность МР сигнала гиперполяризованного 13С-лактата, гиперполяризованного 13С-бикарбоната и гиперполяризованного 13С-аланина связана с количеством этих соединений и степенью поляризации, оставшейся к моменту детектирования. Следовательно, мониторинг превращения гиперполяризованного 13С-пирувата в гиперполяризованный 13С-лактат, гиперполяризованный 13С-бикарбонат и гиперполяризованный 13С-аланин дает возможность исследовать метаболические процессы in vivo в организме человека или животного, не являющегося человеком, с использованием неинвазивной МР визуализации.
Было обнаружено, что амплитуды МР сигналов от разных метаболитов пирувата меняются в зависимости от типа ткани. Уникальная картина метаболических пиков, образуемая аланином, лактатом, бикарбонатом и пируватом, может быть использована в качестве характерного признака для метаболического состояния исследуемой ткани и, следовательно, обеспечивает различение здоровой ткани и опухолевой ткани. Это делает композицию, содержащую 13С-пируват, превосходным агентом для МР визуализации опухоли in vivo.
Субъекта, которого подвергают исследованию, например пациента или животное, обычно помещают в МР магнит. Специально предназначенные 13С-МР радиочастотные катушки расположены так, что они охватывают интересующую область.
Композицию, содержащую 13С-пируват, вводят парентерально, предпочтительно внутривенно, внутриартериально или непосредственно в интересующую область или орган. Дозировка и концентрация композиции по изобретению зависят от целого ряда факторов, таких как токсичность, способность направленно доставляться в орган и путь введения. Обычно композицию вводят в концентрации вплоть до 1 ммоль пирувата на 1 кг массы тела, предпочтительно от 0,01 до 0,5 ммоль/кг, более предпочтительно от 0,1 до 0,3 ммоль/кг. Скорость введения составляет предпочтительно менее 10 мл/сек, более предпочтительно менее 6 мл/сек и наиболее предпочтительно от 5 мл/сек до 0,1 мл/сек. Через менее чем 400 сек после введения, предпочтительно менее чем 120 сек, более предпочтительно менее чем 60 сек после введения, особенно предпочтительно через 20-50 сек после введения и наиболее предпочтительно через 30-40 сек после введения применяют последовательность МР визуализации, которая кодирует интересующий объем объединенным избирательным по частоте и пространственным характеристикам способом. Это приводит к получению метаболических изображений 13С-лактата, 13С-аланина и 13С-пирувата и, более предпочтительно, метаболических изображений 13С-лактата, 13С-аланина, 13С-бикарбоната и 13С-пирувата. В тот же самый период времени может быть получено протонное изображение с протонным МРВ контрастным агентом или без него с получением анатомической и/или перфузионной информации.
Кодирование интересующего объема может быть достигнуто с использованием так называемой последовательности спектроскопической визуализации, как описано, например, в T.R.Brown et al., Proc. Natl. Acad. Sci. USA 79, 3523-3526 (1982); A.A.Maudsley, et al., J. Magn. Res 51, 147-152 (1983). Данные спектроскопического изображения содержат множество элементов объема, при этом каждый элемент содержит полный 13С-МР спектр. 13С-пируват и его 13С-метаболиты все имеют свою уникальную позицию в 13С-МР спектре, и их резонансная частота может быть использована для их идентификации. Интеграл от пика при его резонансной частоте прямо связан с количеством 13С-пирувата и его 13С-метаболитов соответственно. Когда количество 13С-пирувата и каждого 13С-метаболита оценивают с использованием, например, рутинных методов выравнивания во временной области, как описано, например, в L.Vanhamme et al., J. Magn. Reson. 129, 35-43 (1997), можно генерировать изображения для 13С-пирувата и каждого 13С-метаболита, в которых цветовое кодирование или яркостное ко