Новые гем-дифторированные соединения, способы их получения, и их применение
Иллюстрации
Показать всеИзобретение относится к новому гем-дифторированному соединению формулы
где R1 представляет собой группу, содержащую алкильную цепь, замещенную, по меньшей мере, одной аминогруппой, кислотную функциональную группу или амидную группу;
R2 представляет собой атом водорода, либо свободную или защищенную функциональную группу спирта; R3 представляет собой группу СН2ОН, CH2-OGP, где GP представляет собой защитную группу, такую как алкил, бензил (Bn), триметилсилил (TMS), трет-бутилдиметилсилил (TBDMS), трет-бутилдифенилсилил (TBDPS), ацетат (Ac); Y, Y', Y'' представляют собой независимые группы OR, где R представляет собой Н, бензил, Ac, TMS, TBDMS, TBDPS, которое используется для получения противоопухолевых, противовирусных, гипогликемических и противовоспалительных лекарственных средств, и соединений для иммунологии и косметологии или гликопептидных аналогов молекул антифризов. Изобретение относится, в частности, также к новому гем-дифторированному соединению общей формулы
и к способу получения гем-дифторированного соединения формулы
3 н. и 4 з.п. ф-лы, 24 ил.
Реферат
Настоящее изобретение относится к способу синтеза гем-дифторированных соединений. Более конкретно, но не исключительно оно может применяться для получения гликоконъюгированных соединений и C-гликозидов, в основном, для получения противоопухолевых, противовирусных, гипогликемических, противовоспалительных агентов или даже в иммунологии, косметологии, и для получения гликопептидных аналогов молекул антифризов.
В последние годы количество исследований, относящихся к фторированным органическим молекулам, значительно увеличилось. Подобный интерес к таким исследованиям объясняется пониманием влияния фтора на биологическую активность молекул. В самом деле, физиологические свойства биологически активных соединений изменяются при введении фтора, и биохимики горячо приветствуют новые способы селективного введения фтора.
Однако основной вклад, касающийся новых важных биологических молекул, достигнут, в основном, при монофторировании и трифторировании.
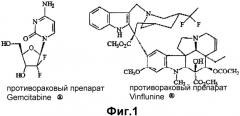
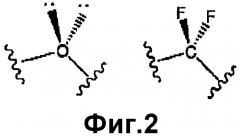
Тем не менее, существенная важность введения дифторметиленовой группы CF2 показана на примере таких соединений, как Gemcitabine® (Gemzar, Lilly) и Vinflunine® (Pierre Fabre), которые в настоящее время проходят клинические испытания в качестве противоопухолевых агентов (фиг.1).
Такой интерес к селективному фторированию биологических соединений относится к специфической природе атомов фтора: его электроотрицательности (самый электроотрицательный элемент), энергии связывания C-F (484 кДж·моль-1; C-C: 348 кДж·моль-1).
В качестве замены кислорода дифторметиленовая группа CF2 оказалась особенно привлекательным кандидатом:
- с одной стороны, электроотрицательность кислорода (3,5) достаточно близка к электроотрицательности группы CF2 (3,3);
- с другой стороны, во время предварительных исследований, проведенных в 1984 году, по замене кислорода в фосфатном аналоге в структурах типа аденозиндифосфата (АДФ) было показано, что CF2 представляет собой тетраэдрический эквивалент кислорода по пространственному расположению обоих атомов фтора, как иллюстрируется на фиг.2.
Более того, поскольку электроотрицательности очень близки, электронные эффекты, связанные с заменой, сводятся к минимуму.
По этой причине недавно были синтезированы аналоги фосфотирозина и фосфосерина, представленные на фиг.3.
Эти соединения являются ингибиторами фосфатазных ферментов, вовлеченных в передачу межклеточных сигналов.
Кроме того, тщательно исследуется синтез аналогов гликоконъюгированных соединений. Они представляют собой соединения, образуемые путем связывания (конъюгирования) сахара и другого соединения (агликон), такого как аминокислота (гликопротеин, гликопептид), липид (гликолипид), стероид или тритерпен, алкалоид, кетон.
Действительно, последние, включая гликопротеин и гликолипид, которые являются составляющими клеточных мембран, представляют собой соединения, широко вовлеченные во множество биохимических процессов, таких как межклеточное распознавание или контроль роста клеток. По этой причине, на гликоконъюгированные соединения делается ставка в терапии, и они находят применение в качестве противоопухолевых или противовирусных агентов.
В настоящее время эти соединения, благодаря присутствию озидной связи (связи, содержащей кислород, так сказать, в аномерном положении), являются неустойчивыми по отношению к нескольким ферментативным системам, включая протеазные ферменты и гидролазные ферменты.
Чтобы иметь компоненты, сохраняющие свои биологические свойства, представляет интерес такая замена кислорода озидной связи, чтобы эта связь не разрушалась под действием ферментативного процесса.
Были синтезированы аналоги, где кислород заменен на CH2, но, несмотря на повышение стабильности и стерическое затруднение, аналогичное имеющемуся у кислорода, оказалось, что группа CH2 хорошо не воспроизводит биологические свойства первоначального соединения.
С целью повышения стабильности гликоконьюгированных соединений в биологической среде исследуются и другие классы соединений, где кислород заменен на азот или серу, а недавно на дифторметиленовую группу.
Преобразование O/CF2 выглядит особенно подходящим для воспроизведения свойств кислорода на электронном уровне; оба атома фтора играют роль обоих свободных электронных пар кислорода (фиг.2).
Несколько исследовательских групп изучают подходы к C-гликозидам (соединениям, где аномерный кислород заменен на углерод), но к настоящему времени не сообщалось об эффективном способе, который можно использовать для широкого ряда сахаров, встречающихся в гликоконъюгированных соединениях (D-глюкоза, D-галактоза, D-галактозамин, D-глюкозамин.).
Более конкретно, целью настоящего изобретения является устранение таких недостатков.
С этой целью предлагается гем-дифторированное C-гликозидное соединение общей формулы I:
где R1 представляет собой группу, содержащую алкильную цепь, замещенную, по меньшей мере, одной аминогруппой, амидную или кислотную функциональную группу,
R2 представляет собой атом водорода H или свободную или защищенную функциональную группу спирта,
R3 представляет собой группу H, CH3, CH2OH, CH2-OGP, где GP представляет собой защитную группу, такую как алкил, бензил (Bn), триметилсилил (TMS), трет-бутилдиметилсилил (TBDMS), трет-бутилдифенилсилил (TBDPS), ацетат (Ac)...,
Y, Y', Y'' представляют собой независимые группы,
где Y, Y', Y'' представляют собой H, OR, N3, NR'R'', SR'''...
где R представляет собой H, Bn, Ac, TMS, TBDMS, TBDPS,...,
R', R'' представляют собой H, алкил, аллил, Bn, тозилат (Ts), C(O)-алкил, C(=O)-Bn,...,
R''' представляет H, алкил, Ac.
В дополнение к этому, данное соединение общей формулы I может быть получено взаимодействием лактона общей формулы II:
где R3 представляет собой H, CH3, CH2-OGP, где GP представляет собой защитную группу, такую как алкил, бензил (Bn), триметилсилил (TMS), трет-бутилдиметилсилил (TBDMS), трет-бутилдифенилсилил (TBDPS), ацетат (Ac)...,
Y, Y', Y" представляют собой независимые группы,
где Y, Y', Y" представляют собой H, OR, N3, NR'R'', SR'''...
где R представляет собой H, Bn, Ac, IMS, TBDMS, TBDPS,...,
R', R'' представляют собой H, алкил, аллил, Bn, тозилат (Ts), C(=O)-алкил, C(=O)-Bn,...,
R''' представляет собой H, алкил, Ac;
в присутствии цинка или лантанидного производного и, по меньшей мере, одного галогенированного производного общей формулы XCF2CO2R'', где X представляет собой галоген, и R8 = алкил, арил...
Указанное лантанидное производное может представлять собой, например, дийодид самария SmI2.
В соответствии с альтернативой, в указанном способе можно использовать цинк, связанный с титаноценом.
Деоксигенирование, для перехода от соединения формулы I, где R2 = OH, к соединению формулы I, где R2 = H, может, например, достигаться путем либо непосредственного, либо радикального восстановления, или даже через ацетатные, тозилатные, ксантатные, оксалатные производные с последующим радикальным восстановлением.
В соответствии с одним из альтернативных вариантов осуществления, более конкретно, гем-дифторированные соединения могут иметь общую формулу III:
где R5 и R6 представляют собой H либо функционализированную или нефункционализированную группу, такую как функционализированная углеродная цепь, несущая, среди прочего, аминогруппу, аминокислотную функциональную группу, аминосложноэфирную функциональную группу, пептидную цепь, белок, углевод, стероид, или тритерпен, алкалоид, лигнан, или соединения, представляющие фармакологический интерес.
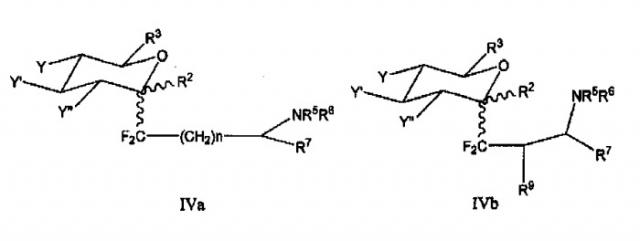
В соответствии с другим вариантом, гем-дифторированные соединения могут, более конкретно, иметь общие формулы IVa и IVb:
где R5, R6, R7 и R9 представляют собой H либо функционализированную или нефункционализированную группу, такую как функционализированная углеродная цепь, несущая, среди прочего, аминогруппу, аминокислотную функциональную группу, аминосложноэфирную функциональную группу, пептидную цепь, белок, углевод, стероид или тритерпен, алкалоид, лигнан, или соединения, представляющие фармакологический интерес.
Одно из промежуточных соединений, получаемых с целью получения соединения формулы I, может представлять собой соединение общей формулы V, содержащее сложноэфирную функциональную группу:
где R4 может представлять собой такую группу, как алкильная, арильная, аллильная группа, эта группа является либо функционализированной, либо нет.
Такая сложноэфирная функциональная группа -CO2R4 может быть омылена, с получением кислоты формулы VI:
Указанную сложноэфирную функциональную группу -CO2R4 можно также восстановить до функциональной группы спирта, например, с использованием тетраборгидрида натрия (NaBH4) или литийалюминийтетрагидрида (LiAlH4) с получением C-гликозидных соединений общей формулы VII:
Соединения общей формулы VII, сами по себе, можно окислить до альдегидов различными способами, такими как способы Сверна, Десса-Мартина, с получением соединений общей формулы VIII:
Соединения VIII также могут быть получены из сложных эфиров V через тиоэфир и восстановление.
Соединение VIII может быть получено в форме полуацеталя.
Неозидные соединения формулы I, где R1 = CH2-OH, также можно окислить до альдегидов с помощью любого из указанных выше способов.
В дополнение к этому, в соответствии с другим вариантом осуществления изобретения, соединения формулы I, где R1=СООН, можно использовать в реакции Уги с амином, альдегидом и изонитрилом, с получением соединений формулы III,
где R1=-С(=O)-NR5R6.
В соответствии с последним альтернативным вариантом осуществления, соединения общей формулы I могут быть получены реакцией сочетания производного сахара с амином, например аминокислотой или пептидом.
Наконец, группа СF2 является особенно устойчивой к процессам биохимической деградации и поэтому делает возможным синтез негидролизируемых структур.
Фармакофорные свойства в данной системе определяются структурой фрагмента конъюгированного с гемфторированным гликозидом, который в свою очередь выполняет роль носителя, обеспечивая доставку активного фрагмента в биологическую среду. При этом стабильность данного конъюгата определяется гемфторированным соединением, который не влияет на биологическую активность конъюгата и, таким образом, не зависит от природы носителя фармакофорных свойства.
Соединения общих формул I-VIII, а также их возможные производные и фармацевтически приемлемые аддитивно-кислотные соли минеральных или органических кислот могут, например, существовать в виде таблеток, капсул, драже, пероральных растворов или суспензий, эмульсий, суппозиториев. В дополнение к фармацевтически приемлемым и нетоксичным, инертным наполнителям, таким как дистиллированная вода, глюкоза, крахмал, лактоза, тальк, растительные масла, этиленгликоль, …, полученные таким образом композиции могут также содержать консерванты.
В эти композиции могут добавляться другие активные ингредиенты.
Количество соединений по настоящему изобретению и других возможных активных ингредиентов в таких композициях может изменяться в соответствии с применениями, возрастом и массой пациента.
Примеры получения соединений в соответствии с настоящим изобретением далее будут описаны посредством неограничивающих примеров.
Встречающиеся сокращенные наименования единиц определяются следующим образом:
экв.: эквивалент
г: грамм
Гц: герц
мг: миллиграмм
МГц: мегагерц
мин.: минут
мл: миллилитр
ммоль: миллимоль
мкмоль: микромоль
нмоль: наномоль
В примерах далее описано получение гем-дифторированных гликоконъюгированных соединений общей формулы I:
Данные соединения могут быть синтезированы различными способами.
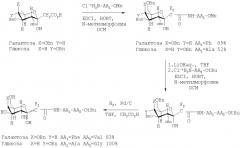
Для уменьшения количества стадий во время синтеза гем-дифторированных гликоконъюгированных соединений, лактоны 1 были использованы в качестве электрофильных веществ (фиг.4). Производные 2 получали из лактонов 1 под действием этилбромдифторацетата 3 в присутствии цинка Zn или дийодида самария
SmI2.
Необходимо отметить, что настоящий способ является общим и может применяться ко всем классам замещенных различным образом глюкопираноз (Y, Y', Y" = OR, N3, NR'R'', SR''...), исходные лактоны легко доступны в одну или несколько стадий из коммерческих продуктов (например, в ряду глюкоз, путем окисления коммерческих продуктов на одной стадии).
Синтез промежуточных С-гликозидных соединений 6 и 7 (фиг.5 и 6).
В примере на фиг.5, 0,82 г активированного цинка (Zn) (0,82 г, 12,5 ммоль, 7 экв.) вводят в двугорлый сосуд, емкостью 100 мл, в верхней части которого находится холодильник и входной клапан. Все это помещается в вакуум, и цинк нагревают с помощью теплового пистолета примерно в течение 5 мин, затем вакуум заполняют аргоном из надувной камеры.
Добавляют 15 мл безводного тетрагидрофурана (ТГФ), и полученный раствор нагревают с обратным холодильником. В этот раствор вводят смесь, полученную в атмосфере аргона и состоящую из лактона 4 (0,960 г, 1,782 ммоль, 1 экв.), этилбромдифторацетата BrCF2COOEt 5 (0,69 мл, 5,346 ммоль, 3 экв.) и безводного тетрагидрофурана (15 мл).
Установку оставляют под нагревом с обратным холодильником в течение 2 час 30 мин (после реакции проводят тонкослойную хроматографию (ТСХ) со смесью (3:7) этилацетат/циклогексан, в качестве элюента), затем добавляют к раствору 30 мл 1н хлористоводородной кислоты и дихлорметан.
Фазы разделяют, и проводят экстракцию дихлорметаном (3×10 мл дихлорметана последовательно добавляют к водной фазе и экстрагируют), органические фазы собирают, сушат над безводным сульфатом магния (MgSO4), фильтруют и концентрируют с использованием испарителя в вакууме.
Разделение осуществляют с помощью хроматографии на колонке с силикагелем, со смесью циклогексан/этилацетат, в качестве элюента, в соотношении девять к одному. После концентрирования собранных фракций продукт 6 получен в виде желтоватого масла с выходом 89 мас.% в виде единственного диастереоизомера.
Если вместо цинка используют дийодид самария, соединение 6 получают в виде разделяемой смеси обоих диастереоизомеров (смесь (2:1)), выход 62 мас.%.
Характеристики приборов, используемых для проведения анализа всех соединений, описанных в настоящей заявке, указываются ниже.
Спектры 1H, 13C, l9F ЯМР записывают на спектрометрах BRUKER DPX 300 и DPX 600. Для спектров 1H и 13C ЯМР в качестве внутреннего стандарта используется тетраметилсилан. Для спектров 19F-ЯМР в качестве внутреннего стандарта использовали трихлорфторметан (CFCl3). Химические сдвиги выражены в миллионных долях (м.д.), константы спин-спинового взаимодействия J в герцах (Гц).
Использованы следующие сокращения:
С - для синглета, ушир. - для широкого синглета, д - для дублета, т - для триплета, кв - для квадруплета, м - для мультиплета или массива, дд - для дублета дублетов.
Инфракрасные спектры зарегистрированы на Фурье-ИК приборе PERKIN-ELMER PARAGON 500, в жидкой пленке на кристалле хлорида натрия или в таблетке KBr (для твердых продуктов). Частоты поглощения выражены в см-1.
Масс-спектры получены на спектрофотометре JEOL AX 500 с пушкой FAB JEOL (Xe, 4 кВ, 10 мА).
Разделение с помощью колоночной хроматографии осуществляют при небольшом давлении, следуя хроматографическим методикам, на силикагеле Kieselgel 60 (230-400 меш, Merck).
Контроль осуществляют с помощью тонкослойной хроматографии (ТСХ) на пластинках Kieselgel 60F-254-0,25 mm. Отношение расстояния, пройденного соединением, на данной подложке, и расстояния, пройденного элюентом, называют коэффициентом удерживания (Rf).
Анализы, осуществляемые для подтверждения структуры получаемого продукта 6, представлены ниже:
Тонкослойная хроматография (ТСХ)
Rf = 0,55, элюент: этилацетат/циклогексан 3:7
Данные ЯМР:
19F-ЯМР (282 МГц; растворитель: дейтерированный хлороформ (CDCl3)) -117,67, д, 2JF-F=256 Гц; -120,03, д, 2JF-F=256 Гц
1H-ЯМР (300 МГц; растворитель: дейтерированный хлороформ (CDCl3))
1,19, т, 3J=7,14 Гц, 3H: CH3(OEt); 3,52-3,70, м, 3H (H5+2H6); 3,90-3,95, м, 3H: H2+H3+H4, 4,18, кв, 3J=7,14 Гц, 2H: CH2(OEt); 4,39-5,19, м, 8H: 4 CH2(OBn); 7,14-7,24, м, 20H; 4x 5 CH(Ph).
13C-ЯМР (75,5 МГц; растворитель: дейтерированный хлороформ(CDCl3))
14,29, CH3(OEt); 63,89, CH2(OEt); 68,68, CH2(C6); 73,06, CH; 73,82, 75,47, 75,67, 76,37: 4xCH2(OBn); 77,83, CH; 78,62, CH; 83,79, CH; 96,59, дд, 2JC-F=28,17 Гц и 2JC-F=26,44Гц, -CF2C(OH)O-; 112,79, дд, 1JC-F=263,6 Гц и 1JC-F=259,6Гц, CF3; 137-138 CH(Ph); 163,32,дд, 2JC-F=31,6 Гц и 2JC-F=31,0 Гц, CFCOOEt.
ИК (см-1)
4059,6, 3478,5, 3089,5, 3064,3, 3031,6, 2923,7, 2852,0, 2257,3, 2925,7, 1875,4, 1769,3, 1663,6, 1605,9, 1586,4, 1497,3, 1454,0 1396,7, 1372,1, 1315,6, 1087,7, 1027,9, 910,6, 856,8, 802,1, 736,7, 698,1, 648,9, 605,5, 540,9, 462,7.
Масс-спектрометрия: FAB+ (Xe, 4кВ, матрица 3-нитробензилового спирта)
686(2%)=(M+Na)+, 663(4%)=М+, 661(6%), 572(3%)=(M-Bn)+, 554(3%)=(M-Bn-H20)+, 463(4%), 391(12%), 307(14%), 289(12%), 271(16%), 181(96%), 154(100%), 136(84%), 107(50%), 91(100%), 81(46%), 69(40%), 55(76%), 43(64%), 29(20%).
Затем для получения производных 7 может осуществляться деоксигенирование с использованием различных способов (непосредственное или радикальное восстановление, через ацетатные, тозилатные, ксантатные производные).
Омыление может осуществляться почти количественно, при различных условиях, с гидроксидами натрия, калия либо лития, в водном растворе этанола или ТГФ (фиг.6):
В колбу, содержащую сложный эфир 6 (0,5 г, 1,75 ммоль 1 экв.) в тетрагидрофуране (5 мл) или в этаноле (5 мл), добавляют водный раствор литина LiOH (2M, 0?75 мл, 2 экв.) или водный раствор каустической соды NaOH (0,07 г, 1,6 ммоль), затем перемешивание продолжают в течение двенадцати часов. Если используется этанол, реакционную смесь упаривают, затем к остатку добавляют дихлорметан. Смесь подкисляют 1M соляной кислотой, HCl, затем экстрагируют несколько раз дихлорметаном. Органические фазы собирают, сушат над MgSO4, фильтруют и концентрируют.
Полученный продукт представляет собой бесцветное масло, и выход является количественным.
Данные ЯМР:
19F-ЯМР (CDCl3, 282,5 МГц)
-117,4, д (2JF-F =258Гц); -119,1, д (2J F-F =258Гц).
1H-ЯМР (CDCl3, 300 МГц):
3,40-3,60, м, 3H, H5 и H6; 3,90-4,00, м, 3H, H2, H3 и H4; 4,38-4,79, м, 8H, 4 CH2(OBn); 7,05-7,22, м, 20H, H аром.
13C-ЯМР (CDCl3, 75,5 МГц)
68,6 (C6); 72,2 (C5); 73,5, 75,5, 75,9, 76,4 (4 CH2(OBn)); 77,7, 78,5, 83,6 (C2; C3 и C4); 96,0, дд, 2JC-F=27,0Гц и 2JC-F=28,7Гц, -CF2C1(OH)О-; 112,4, дд, 1JC-F=260,3 Гц и 1JC-F=259,2Гц, CF2; 128,1, 128,2, 128,4, 128,8, 128,9 129,0 (аром. С); 137,2, 137,7, 137,9, 138,6 (аром. С, четвертичный) 163,6, дд, 2JC-F=30,5Гц и 2JC-F=32,8Гц, CF3COOH.
Синтез гем-дифторированного соединения из соединений 6 и 7
Взаимодействие с аминами
Эти реакция делает возможным доступ к очень интересным соединениям, аналогам гликопептидов.
Производные соединения 6 взаимодействуют с различными первичными или вторичными аминами с получением соответствующих амидов. Используемые амины представляют собой алифатические, бензильные или ароматические амины и производные аминокислот, такие как лизин (фиг.7):
В инертной атмосфере в колбу, содержащую раствор исходного продукта 6 (50 мг; 0,075 ммоль; 1 экв.) и Boc-лизин-OMe ацетат 8 (48 мг; 0,15 ммоль; 2 экв.) в дихлорэтане ДХЭ (3 мл), добавляют триэтиламин Et3N (53 мкл; 0,375 ммоль; 5 экв.). Смесь нагревают при кипении с обратным холодильником в течение сорока восьми часов, а затем растворитель упаривают.
Очистка сырого продукта осуществляется с помощью хроматографии на колонке с силикагелем с использованием смеси циклогексан/этилацетат в пропорции семь к трем в качестве элюента.
После концентрирования продукт 9 получен в виде светло-желтого твердого продукта с выходом 84 мас.%.
Данные ЯМР:
19F-ЯМР (CDCl3, 282,5 МГц)
-117,4, д, (2JF-F=259Гц); -121,9, д, (2JF-F=259Гц).
1H-ЯМР (CDCl3, 300 МГц)
1,18-1,60, м, 15 H, (CH3)3C и (CH2)3; 3,06-3,19, м, 2H, CH2N; 3,52-3,69, м, 6 H, H5; H6 и CO2CH3; 3,84-4,18, м, 4H, H2; Н3; Н4 и CHN; 4,36-4,85, м, 8H, 4 CH2Bn; 5,01, д, J=8,3Гц, 1H, NHBoc; 6,60, м, 1H, NH; 7,10-7,23, м, 20Н, аром. Н.
13C-ЯМР (CDCl3, 75,5 МГц)
22,7, 28,8 ((CH2)2); 28,9 ((CH3)3C); 32,5 (CH2); 39,6 (CH2N); 52,7 (CО2CH3); 53,6 (CHN); 68,7 (C6); 73,6, 75,3, 75,8, 76,4 (4 СН2Bn); 72,1, 77,9, 78,6, 83,6 (C2, C3, C4 и C5); 96,1, дд,
2JC-F=27,4Гц (CF2CO(OH)); 112,5, дд, 1JC-F=261,7Гц (CF2); 127,6, 127,7, 127,8, 128,3, 128,4, 128,5 (аром. С), 137,5, 137,9,138,0, 138,3 (аром. С, четвертичный); 155,6 (CO2Me); 163,7, дд, 2JC-F=27,4 Гц (CF2CONH); 173,3 (NHCO2tBu).
Гликозированное производное аланина может быть получено из соединения 6 (фиг.8) или из соединения 7 (фиг.9) в соответствии с тремя различными методами.
Первый метод A идентичен способу, который использовали для соединения 9, получаемого из лизина. Выход по массе для соединения 11 составляет 30% (фиг.8).
Второй метод B (фиг.9) представляет собой следующее.
В инертной атмосфере BOP (бензотриазол-1-илокси-трис(диметиламино)фосфоний гексафторфосфат) (35 мг; 7,87·10-3 ммоль; 1 экв.) и диизопропилэтиламин DIEA (28 мкл; 0,016 ммоль; 2 экв.) вводят в колбу, содержащую кислоту 7 (50 мг; 7,87·10-3 ммоль; 1 экв.) в дихлорметане ДХМ (2 мл). Реакционную смесь перемешивают в течение одного часа, а затем добавляют к ней раствор, состоящий из аланина 10 (11 мг; 7,87·10-3 ммоль; 1 экв.) и DIEA (14 мкл; 7,87·10-3 ммоль; 1 экв.) в дихлорметане (2 мл). Перемешивание продолжают в течение двадцати четырех часов. Затем смесь промывают 1M раствором хлористоводородной кислоты HCl. Органическую фазу сушат над сульфатом магния, фильтруют и упаривают.
Затем сырой продукт очищают на препаративной пластинке силикагеля, используя смесь циклогексан/этилацетат, в качестве элюента в пропорции семь к трем.
Продукт 11 получают в виде белых кристаллов с выходом 77 мас.%.
Третий метод C (фиг.9) представляет собой следующее:
В инертной атмосфере в колбу, содержащую кислоту 7 (50 мг; 7,87·10-3 ммоль; 1 экв.) в дихлорметане (2 мл), вводят BOPCl (бис-(2-оксо-3-оксазолидинил)фосфинхлорид) (40 мг; 7,87·10-3 ммоль; 1 экв.) и диизопропилэтиламин DIEA (28 мкл; 0,016 ммоль; 2 экв.). После этого перемешивание продолжают в течение одного часа, после чего добавляют в реакционную смесь раствор, состоящий из аланинового производного 10 (22 мг; 0,016 моль; 2 экв.) и диэтиламина DIEA (44 мкл; 0,023 ммоль; 3 экв.) в дихлорметане (2 мл). Перемешивание продолжают в течение двадцати четырех часов, затем смесь промывают 1M раствором HCl. Органическую фазу сушат над сульфатом магния, фильтруют и упаривают.
Затем сырой продукт очищают на препаративной пластинке силикагеля с использованием смеси циклогексан/этилацетат в пропорции семь к трем в качестве элюента.
Продукт 11 получают в виде белых кристаллов с выходом 44 мас.%.
Данные ЯМР:
19F-ЯМР (CDCl3, 282,5 МГц)
-118,0, д, (2JF-F =259Гц); -122,2, д, (2JF-F =259Гц).
1H-ЯМР (CDCl3, 300 МГц)
1,26, д, 3J=7,2Гц, 3 H, CH3; 3,50-3,66, м, 3H, H5 и H6; 3,63, с, 3 H, CО2CH3; 3,89-3,96, м, 3H, Н2, H3 и Н4; 4,40-4,81, м, 10 H, NH; CHN и 4 CH2Bn; 7,11-7,21, м, 20H, аром. H
13C-ЯМР (CDCl3, 75,5 МГц)
16,7 (CH3); 47,2 (CHN); 51,7 (CO2CH3); 67,3 (C6); 72,3, 73,9, 74,3, 75,0 (4CH2Bn); 70,9, 76,2, 77,1, 82,2 (C2, C3, C4 и C5); 126,6-127,4, м (аром. C); 136,5, 136,9, 137,0, 137,4 (аром. С, четвертичный); 171,0 (CO2Me).
Реакции связывания со следующими аминокислотами, такими как фенилаланин, треонин, метионин, пролин, а также с дипептидом, осуществляют с использованием BOPCl в качестве конденсирующего агента, то есть в соответствии с тем же способом С, который использовали при связывании с аланином (фиг.10).
Продукт 12b получают в виде белых кристаллов с выходом 42 мас.% (фиг.11).
Данные ЯМР:
19F-ЯМР (CDCl3, 282,5 МГц)
-117,7, д, (2JF-F =261Гц); -121,6, д, (2JF-F=261Гц).
1H-ЯМР (CDCl3, 300 МГц)
3,07, м, 2 H, CH2Ph; 3,44-3,67, м, 3 H, H5 и H6; 3,57, с, 3 H, CO2CH3; 3,91-3,98, м, 3 H, H2, H3 и H4; 4,25-4,85, м, 10 H, NH, CHN и 4 CH2Bn; 7,00-7,14, 25 H, аром.H.
13C-ЯМР (CDCl3, 75,5 МГц)
37,5 (CH2Ph); 52,4 (CO2CH3); 53,1 (CHN); 68,3 (C6); 73,2, 75,0, 75,3, 76,0 (4 CH2Bn); 72,0, 77,0, 78,2, 83,2 (C2, C3, C4 и C5); 127,3-129,3, м (аром. С); 135,0, 137,5, 137,9, 138,0, 138,4 (аром.С, четвертичный); 170,3 (CO2Me).
Продукт 12c получают в виде белых кристаллов, с выходом 28% по весу (фиг.12).
Данные ЯМР:
19F-ЯМР (CDCl3, 282,5 МГц)
-118,3, д, (2JF-F=257Гц); -121,2, д, (2JF-F =257Гц).
1H-ЯМР (CDCl3, 300 МГц)
1,12, д, 3J=6,4Гц, 3H, CH3; 3,48-3,64, м, 3H, H5 и H6; 3,7, с, 3H, CO2CH3; 3,89-4,00, м, 3H, H2, H3 и H4; 4,22-4,82, м, 11H, NH; CHN,CHOH и 4 CH2Bn; 7,0-7,24, м, 20H, аром H.
13C-ЯМР (CDCl3, 75,5 МГц)
20,5 (CH3); 53,2 (CО2CH3); 57,8 (CHN); 68,6 (CHOH); 68,7 (C6); 73,5, 75,4, 75,8, 76,4 (4 CH2Bn); 72,2, 77,2, 78,4, 83,6 (C2, C3, C4 и C5); 128,1-128,9 м (аром. C); 137,8, 137,9, 138,1, 138,7 (аром. С, четвертичный); 170,5 (CO2Me).
Продукт 12d получают с выходом 36 мас.% (фиг.13).
Данные ЯМР:
19F-ЯМР (CDCl3, 282,5 МГц)
-117,4, д, (2JF-F=260Гц), -121,7, д, (2JF-F=260 Гц).
1H-ЯМР (CDCl3, 300 МГц)
1,89-1,99, м, 2H, CH2; 2,09, с, 3H, SCH3; 2,46, т, 3J=7,0Гц, 2H, CH2S; 3,58-3,77, м, 3H, H5 и H6; 3,68, с, 3H, CO2CH3; 3,96-4,03, м, 3H, H2, H3 и Н4; 4,43-4,88, м, 10Н, NH; CHN и 4 CH2Bn; 7,14-7,30, м, 20H, аром. H.
13C-ЯМР (CDCl3, 75,5 МГц)
15,7 (СН2); 29,9 (SCH3); 31,6 (CH2S); 51,8 (CO2CH3); 53,2 (CHN); 68,6 (C6); 73,6, 75,4, 75,8, 76,4 (4 CH2Bn); 72,4, 77,4, 78,5, 85,6 (C2, C3, C4 и C5); 128,1-128,9 м (аром. C); 137,9, 138,3, 138,5, 138,8 (аром.С, четвертичный); 171,5 (CО2Me).
Продукт 12e получают в виде белых кристаллов с выходом 32 мас.% (фиг.14).
Данные ЯМР:
19F-ЯМР (CDCl3, 282,5 МГц)
-112,6, д, (2JF-F=267Гц); -113,7, д, (2JF-F =261Гц); -117,2 д (2JF-F =261Гц); -117,3, д,(2JF-F=267Гц).
1H-ЯМР (CDCl3, 300 МГц)
1,52-1,89, м, 4H, (CH2)2; 3,5-3,63, м, 3H, H5 и H6; 3,67, с, 3H, CО2CH3; 3,82-4,06, м, 5H, CH2N; H2; H3 и H4; 4,33-4,92, м, 9H, CHN и 4 CH2Bn; 7,10-7,20, м, 20H, аром. H.
Продукт 12f получают в виде белых кристаллов с выходом 17 мас.% (фиг.15).
Данные ЯМР:
19F-ЯМР (CDCl3, 282,5 МГц)
-117,6, д, (2JF-F =257Гц); -122,4, д, (2JF-F =257Гц).
1H-ЯМР (CDCl3, 300 МГц)
1,35, д, 3J=7,2Гц, 3H, CH3; 3,05, м, 2H, CH2Ph; 3,5-3,71, м, ЗН, Н5 и H6; 3,70, с, 3H, CO2CH3; 3,89-4,01, м, 3H, H2; H3 и H4; 4,26-4,89, м, 11H, NH, 2 CHN и 4 CH2Bn; 6,05, м, 1 H, NH; 7,10-7,20, м, 25H, аром. H.
Соединение 7 также может использоваться в реакции Уги с амином, таким как бензиламин 18, с альдегидом 19 и изонитрилом, таким как этилизоцианат 20, для получения соединений 13-17.
Это способ для осуществления синтеза терапевтических соединений (манно- и фукопептидов), которые являются ингибиторами связывания между селектином и тетрасахаридом, сиалилом-Льюисаx (sLex).
Лейкоциты играют важную роль во множестве воспалительных и иммунологических явлений. Во многих из таких явлений первые стадии представляют собой взаимодействия между эндотелиальными клетками и лейкоцитами, находящимися в кровотоке.
Исследования молекул, специфичных к поверхности клеток, вовлеченных в эти взаимодействия, показали, что лейкоциты и эндотелиальные клетки имеют на своей поверхности специфические лектины, называемые селектинами. Они представляют собой молекулы из семейства кальцийзависимых молекул, ответственные за клеточную адгезию. sLex представляет собой один из лигандов, вовлеченных в связывание между селектинами, тем самым вызывая адгезию лейкоцитов на эндотелиальной ткани, приводящую к острым формам заболеваний, таких как ревматический артроз, псориаз, рак.
Как следствие, разработка sLex-ингибирующих молекул малого размера представляет собой привлекательный терапевтический подход.
Синтез соединения 13 (фиг.17).
Все реагенты разбавляют сухим метанолом для получения концентраций 1M.
В 25 мл колбу помещают раствор гексанала (0,081 мл; 0,675 ммоль) с раствором бензиламина 18 (0,059 мл; 0,54 ммоль) и смесь перемешивают в атмосфере аргона в течение двух часов при комнатной температуре.
Затем в раствор добавляют этилизоцианоацетат 20 (0,074 мл; 0,675 ммоль) и раствор гем-дифторированной D-глюкозы в качестве кислоты 7 (286 мг; 0,45 ммоль) и смесь перемешивают в атмосфере аргона в течение двадцати четырех часов при комнатной температуре.
Затем метанол упаривают и очистку продукта проводят хроматографией на колонке с силикагелем при градиентном элюировании смесью этилацетат/циклогексан в качестве элюента в пропорциях, находящихся в диапазоне от 1:9 до 2:8.
ТСХ
Rf = 0,18, элюент: этилацетат/циклогексан (2:8).
Данные ЯМР:
19F-ЯМР (CDCl3)
-104,39 (д, 2JF-F=260,1Гц); -104,85 (д, 2JF-F=257,9Гц); -108,61 (д, 2JF-F=255,8Гц); -108,89 (д, 2JF-F=254,7Гц); -108,95 (д, 2JF-F=260,1Гц); -112,49(д, 2JF-F=255,8Гц); -114,35 (д, 2JF-F=254,7Гц); -116,17 (д, 2JF-F=257,9Гц).
1H-ЯМР (CDCl3)
0,69, т, 3H, H2O, 3JH19-H20=6,9Гц; 0,90-1,10, м, 6H, 1,15, т, 5H, H1 3JН1-Н2=7,1Гц; 3,41-3,74, м, 4H; 3,78-3,99, м, 4H; 4,07, кв, 2H, H2, 3JН1-Н2=7,1Гц; 4,36-4,55, м, 4H; 4,61-6,97, м, 8H; 6,76, т, 0,7H, H5, 3JH4-H5=5,5Гц; 6,82, т,0,3H, H5 ротамер, 3JH4-H5=5,3Гц; 7,00-7,26, м, 25H, НPh.
Масс спектрометрия: (прямой ввод, FAB+):
M+Na = 959,6
M+K = 975,7
Синтез соединения 14 (фиг.18):
Все реагенты разбавляют сухим метанолом для получения концентраций 1M.
Раствор триметилацетальдегида (0,073 мл; 0,675 ммоль) вместе с раствором бензиламина 18 (0,059 мл; 0,54 ммоль) помещают в колбу емкостью 25 мл и смесь перемешивают в атмосфере аргона в течение двух часов при комнатной температуре.
Затем добавляют раствор этилизоцианоацетата 20 (0,074 мл; 0,675 ммоль) и раствор гем-дифторированной D-глюкозы в качестве кислоты 7 (286 мг; 0,45 ммоль) и смесь перемешивают в атмосфере аргона в течение двадцати четырех часов при комнатной температуре.
Метанол упаривают и очистку продукта осуществляют с помощью хроматографии на колонке с силикагелем с использованием градиентного элюирования смесью этилацетат/циклогексан в качестве элюента в пропорциях от 1:9 до 3:7.
Полученный продукт представляет собой желтое масло в виде двух диастереоизомеров, которые разделяют.
Анализы 1-ого диастереоизомера 14a
ТСХ
Rf = 0,70, элюент: этилацетат/циклогексан (4:6).
Данные ЯМР:
19F-ЯМР (CDCl3)
-105,31 (д, 2JF-F=267,0Гц); -106,69 (д, 2JF-F=267,0Гц).
1H-ЯМР (CDCl3)
0,99, с, 9H, H18; 1,16, т, 3H, H1, 3JH1-Н2=6,9Гц; 3,39-3,65, м, 4H; 3,90, дд, 2H, J=8,9Гц; 4,00-4,15, кв, 3H, H2, 3JH1-Н2=6,9Гц; 4,37, д, 1H, J=11,7Гц; 4,49, т, 2H, J=I0,7Гц; 4,69-4,97, м, 7H; 5,53, с, 1H, H7; 6,49, м, 1 H, H5; 7,08-7,27, м, 25Н, HPh.
Масс-спектрометрия: (прямой ввод, FAB+):
M+Na = 945,4
Анализы 2-го диастереоизомера 14b
ТСХ
Rf = 0,65, элюент: этилацетат/циклогексан (4:6).
Данные ЯМР:
19F-ЯМР (CDCl3)
-107,15 (д,2JF-F=255,7Гц).
1H-ЯМР (CDCl3)
1,02, с, 9H, H18; 1,16, т, 3Н, Н1, 3JH1-Н2=7,0 Гц; 3,52-4,00, м, 9H; 4,09, кв, 2H, H2,
J3 H1-H2=7,0 Гц; 4,33-4,86, м, 8H; 4,97, дд, 2Н, Н16, Н16', 2JH16-H16'=17,3 Гц; 5,33, c, 1H, H7; 6,49, м, 1Н, Н5; 6,98-7,27, м, 25Н, НPh.
Масс-спектрометрия: (MALDI+):
M+Na = 945,4
Синтез соединения 15 (фиг.19)
Все реагенты разбавляют сухим метанолом для получения концентрации 1M.
Раствор 3,4,5-триметоксибензальдегида 22 (0,132 г; 0,675 ммоль) вместе с раствором бензиламина 19 (0,059 мл; 0,54 ммоль) помещают в колбу емкостью 25 мл и смесь перемешивают в атмосфере аргона в течение двух часов при комнатной температуре.
Затем добавляют раствор этилизоцианоацетата 20 (0,074 мл; 0,675 ммоль) и раствор гем-дифторированной D-глюкозы в качестве кислоты 7 (286 мг; 0,45 ммоль) и смесь перемешивают в атмосфере аргона в течение двадцати четырех часов при комнатной температуре.
Метанол упаривают и очистку продукта осуществляют с помощью хроматографии на колонке с силикагелем с использованием градиентного элюирования смесью этилацетат/циклогексан в качестве элюента в пропорции, находящейся в диапазоне от 1:9 до 3:7.
Полученный продукт представляет собой желтое масло в виде двух диастереоизомеров 15a, 15b, которые разделяют.
Анализы 1-го диастереоизомера 15a
ТСХ
Rf = 0,4l, элюент: этил ацетат/циклогексан (4:6).
Данные ЯМР:
19F-ЯМР (CDCl3)
-111,63, с.
1H-ЯМР (CDCl3)
1,18, т, 3Н, Н1, 3JH1-Н2=7,2Гц; 3,38, т, 1 H, J=6,6Гц; 3,58, с, 9H, H17, 3,65, с, 4H; 3,93-4,14, м, 7H; 4,40-4,53, м, 3H; 4,70-4,87, м, 3H; 4,86, дд, 2H, H16, Н16', 2JH16-H16'=16,9Гц; 5,33, с, 1H; 6,38, с, 1H, H7; 6,43, т, 1 H, H5, 3JH4-H5=4,5Гц; 6,90-7,25, м, 27H, HPh.
Масс-спектрометрия: (прямой ввод, FAB+);
M+Na= 1055,7
Анализы 2-го диастереоизомера 15b
ТСХ
Rf = 0,32, элюент: этилацетат/циклогексан (4:6).
Данные ЯМР:
19F-ЯМР (CDCl3)
-108,12 (д, 2JF-F=251,9Гц); -115,19 (д, 2JF-F=251,9Гц)
1H-ЯМР (CDCl3)
1,17, т, 3H, H1, 3JH1-H2=7,0Гц; 3,32-3,41, м, 1H; 3,65, с, 9H, H17; 3,70, с, 3H; 3,78-3,98, м, 5H; 4,08, кв, 4H, H2, 3JH1-H2=7,0Гц Гц; 4,32, с, 2H; 4,60, дд, 2H, J=10,54Гц; 4,67, с, 2H; 4,87, с, 1H; 5,09, с, 1H; 6,30, т, 1H, H5, 3JH4-H5=4,9Гц; 6,52, с, 2H, H7; 6,86-7,23, м, 271, HPh.
Масс-спектрометрия: (прямой ввод, FAB+):
M+Na = 1055,7
Синтез соединения 16 (фиг.20)
Все реагенты разбавляют сухим метанолом для получения концентрации 1M.
В колбу емкостью 25 мл помещают раствор бензальдегида (0,059 мл; 0,54 ммоль) и раствор бензиламина 18 (0,059 мл; 0,675 ммоль) и смесь перемешивают в атмосфере аргона в течение двух часов при комнатной температуре.
Затем добавляют раствор этилизоцианоацетата 20 (0,074 мл; 0,675 ммоль) и раствор гем-дифторированной D-глюкозы в качестве кислоты 7 (286 мг; 0,45 ммоль) и смесь перемешивают в атмосфере аргона в течение двадцати четырех часов при комнатной температуре.
Метанол упаривают и очистку продукта осуществляют с помощью хроматографии на колонке с силикагелем с использованием градиентного элюирования смесью этилацетат/циклогексан в качестве элюента в пропорции, находящейся в диапазоне от 1:9 до 3:7.
Продукт получают в виде двух диастереомеров 16a, 16b, которые разделяют.
Анализы 1-ого диастереоизомера 16a
ТСХ
Rf = 0,26, элюент: этилацетат/циклогексан (3:7).
Данные ЯМР:
19F-ЯМР (CDCl3)
-111,66, с, 2F.
1H-ЯМР (CDCl3)
1,15, т, 3H, H1, 3JН1-Н2=7,0Гц; 3,52-3,79, м, 3H; 3,83, дд, 1H, J=4,5Гц; 3,90-4,01, м, 4H, 4,07, кв, 2H, H2, J=7,0Гц; 4,36-4,52, м, 4H; 4,68-4,82, м, 5H; 4,94, дд, 2H, H16, 2JH16-H16'=15,8Гц; 5,20, с, 1H, H7; 6,29, т, 1H, H5, 3JН4-Н5=4,5Гц; 6,96-7,23, м, 30Н, HPh.
13C-ЯМР (CDCl3):
14,2, C1; 41,6, C4; 52,0, 61,6, C2; 66,2, 68,5, 71,7, 73,5, 75,1, 75,4, 75,9, 77,5, 78,6, 83,5, 96,9, т, С10, 2JС10-F=27,6Гц; 114,3, т, C9 , 1JCF=262,9Гц; 126,9, 127,2, 127,7, 127,8, 127,9, 128,0, 128,1, 128,2, 128,3, 128,4, 128,5, 128,5, 128,6, 128,8, 130,0, 133,0, 136,3, 137,8, 138,0, 128,6, 165,1, т, С8, 2JС8-F=26,4Гц; 168,3; 169,7.
Масс-спектрометрия: (MALDI+):
M+Na = 965,5
M+K = 981,5
Анализы 2-го диастереоизомера 16b
ТСХ
Rf = 0,71, элюент: этилацетат/циклогексан (5:5).
Данные ЯМР:
19F-ЯМР (CDCl3)
-107,71(д, 2JF-F=253,1Гц); -115,09 (д, 2JF-F=253,1Гц).
1H-ЯМР (CDCl3)
1,16, т, 3H, H1, 3JH1-H2=7,0Гц, 3,35-3,40, м, 1H; 3,51-3,70, м, 4H; 3,84-4,00, м, 5H; 4,08, кв, 2H, H2, 3JH1-H2=7,0Гц; 4,23, с, 1H; 4,62, дд, 2H, J=9,98Гц; 4,67, с, 1H; 4,81, д, 1H, J=3,8Гц; 4,98, с, 1H; 5,08, д, 1H, H16 или H16', Н16', 2JH16-H16'=18,0Гц; 6,08, т, 1H, H5, 3JH4-H5=4,9Гц; 6,76-6,85, м, 1H; 6,95-7,29, м, 30Н, HPh.
Масс-спектрометрия: (MALDI+):
M+Na = 965,4
M+K = 981,3
Синтез соединения 17 (фиг.21)
Первый диастереоизомер этилового эфира (2-{бензил-[2,2-дифтор-2-(3(R),4(S)-трис-бензилокси-6(R)-бензилоксиметил-2(R)-гидрокситетрагидропиран-2-ил)ацетил)амино}-2-фенилацетиламино)уксусной кислоты 16a (0,139 г; 0,147 ммоль) помещают в колбу емкостью 25 мл вместе с 6,6 мл метанола и щепоткой 10% палладия на активированном угле (Pd/C) со шпателя. После установления вакуума подсоединяют надувную камеру с водородом и перемешивание продолжают в течение ночи при комнатной температуре.
Раствор фильтруют на целите, затем упаривают, получая продукт 17 в виде белых кристаллов.
Данные ЯМР:
19F-ЯМР (CD3OD)
-108,37 (д, 2JF-F=261,7Гц); -109,29 (д, 2JF