Способ диагностики рассеянного склероза
Иллюстрации
Показать всеИзобретение относится к медицине, а именно, к медицинской диагностике. Предложен способ диагностики рассеянного склероза путем измерения уровня антител против гликанов в образцах крови, сыворотки или плазмы. Предпочтительно, антитела представляют собой IgM против мальтозы. Способ позволяет провести диагностику заболевания до начала второй атаки и своевременно начать лечение, а также вести точный мониторинг эффективности терапии. 5 н. и 32 з.п. ф-лы, 5 табл., 21 ил.
Реферат
Область техники, к которой относится изобретение
Данное изобретение в общем относится к способу диагностики рассеянного склероза и, более конкретно, к способу диагностики рассеянного склероза путем измерения уровней антител к гликанам в биологическом образце.
Уровень техники изобретения
Рассеянный склероз (РС) представляет собой хроническое аутоиммунное воспалительное заболевание центральной нервной системы. Оно является обычной причиной постоянной нетрудоспособности молодых взрослых людей. У пациентов, страдающих от РС, иммунная система разрушает миелиновую оболочку аксонов в головном и спинном мозге, вызывая различные неврологические патологии. В наиболее распространенной форме РС, рецидивирующей с ремиссиями, за эпизодами острого ухудшения функции нервной системы (обострения, атаки) следуют периоды частичного или полного восстановления (ремиссии), во время которых заболевание не прогрессирует (стабильное состояние). Имеются сообщения, что девяносто процентов пациентов с РС вначале характеризовались клинически изолированным синдромом вследствие воспалительного демиелинизирующего повреждения зрительного нерва, ствола головного мозга или спинного мозга. Примерно тридцать процентов из таких пациентов с клинически изолированным синдромом прогрессируют до клинически определенного РС в течение 12 месяцев после проявления синдрома. Последующее прогрессирование может существенно изменяться от пациента к пациенту. Прогрессирование может варьировать от доброкачественного течения до классического рецидивирующего с ремиссиями, хронического прогрессирующего или редкого молниеносного течения.
Способ диагностики РС, который облегчает раннее выявление клинически определенного РС, был бы ценен для лечения заболевания и для консультирования пациента. Например, пациентам, у которых рано поставлен диагноз клинически определенного РС, можно предложить изменяющие ход заболевания схемы лечения, которые, по современным данным, являются благоприятными при раннем РС.
Современные способы оценки и мониторинга РС основаны на оценке и классификации функционирования организма пациентов при атаках и возрастающей во время атак недееспособности. Одна из оценок, используемая для характеристики РС, представляет собой обычно применяемую расширенную шкалу статуса недееспособности (EDSS). Однако EDSS основана на субъективной оценке функционирования организма пациента.
Способы диагностики также могут охватывать мониторинг очагов повреждения головного мозга путем визуализации методом ядерно-магнитного резонанса (ЯМР) или тестирования цереброспинальной жидкости (CSF) на предмет олигоклональных полос (OCB). ЯМР представляет собой физический метод оценки очагов повреждения головного мозга и дорог для рутинного применения. Более того, корреляция между результатами ЯМР и активностью заболевания слабая. Цереброспинальная пункция является неприятной инвазивной процедурой, которая не подходит для рутинного применения. Кроме того, в обоих способах оценивается повреждение только после того, как оно произошло; ни один из способов не может предсказать начало атаки. Дальнейшим недостатком при тестировании на предмет OCB в CSF и проведении ЯМР в качестве пути диагностики РС является то, что отрицательные OCB или ЯМР не исключают наличия РС.
Имеется потребность в способе, который использует объективно оцениваемые маркеры для диагностики РС и для предсказания начала атак у пациентов, страдающих от РС.
Сущность изобретения
Изобретение частично основано на том открытии, что пациенты с РС характеризуются повышенными уровнями аутоантител IgG, IgA, IgM, которые связываются с гликановыми структурами Glc(α), или Glc(α 1-4) Glc(α), или Glc(α 1-4) Glc(β), по сравнению с сывороточными уровнями данных антител у здоровых субъектов. Кроме того, те же аутоантитела, специфичные в отношении данных гликановых структур, повышаются во время состояния обострения по сравнению с уровнем, наблюдаемым у пациентов при ремиссии и здоровых субъектов. Сильная корреляция также наблюдалась между уровнями антитела IgM против Glc(α) у пациентов женского пола с клиническим диагнозом РС (рецидивирующий с ремиссиями) и коэффициентом EDSS данных женщин. Высокая корреляция указывает на то, что уровень IgM против α-глюкозы в сыворотке может функционировать в качестве клинического заместительного конечного маркера активности заболевания, с его помощью можно вести мониторинг эффективности лекарственного соединения в клинических испытаниях.
Мониторинг уровня данных антител в крови субъектов, подозреваемых в наличии РС, облегчает быструю и эффективную по стоимости раннюю диагностику пациентов с РС и раннее предписание изменяющих ход заболевания лекарственных средств, и раннее выявление атак, что обеспечивает ранее профилактическое лечение.
Дополнительным преимуществом изобретения является то, что присутствие у пациентов РС может определяться на ранней стадии заболевания, когда его симптомы могут напоминать многие другие подобные РС заболевания. Ранний диагноз позволяет врачам лечить РС ранее по ходу заболевания, что, таким образом, минимизирует или предотвращает повреждение, вызванное разрушением миелина и недееспособность, связанную с данным повреждением. Кроме того, описанные здесь способы позволяют врачам регулярно следить за пациентами с РС для оценки тяжести заболевания, вести мониторинг хода лечения и изменять лечение при появлении признаков начала атаки. Например, повышение уровня биомаркеров, указывающих на атаку РС, может гарантировать введение пациенту метилпреднизона, который представляет собой основное противовоспалительное средство, обычно вводимое при атаках.
Описанные здесь способы также могут использоваться для выбора лучшей лекарственной терапии конкретного пациента. Например, пациент может начать курс лечения с конкретного лекарственного средства, и изменение уровней маркера может являться индикатором эффективности лекарственного средства. Возвращение уровней маркера к состоянию, наблюдавшемуся при заболевании, указывает на то, что данное лекарственное средство теряет эффективность, и его следует заместить вторым лекарственным средством через небольшой период времени. Альтернативно, врач дождется следующих атак для определения того, эффективно ли данное лекарственное средство для конкретных пациентов.
Описанные здесь биомаркеры могут, кроме того, действовать в качестве заместительных конечных маркеров для оценки ответа пациента на тестируемое лекарственное средство рентабельным способом. Заместительная конечная точка, основанная на серологическом тесте, облегчает эффективное тестирование новых потенциальных лекарственных средств против РС.
В одном из аспектов изобретение относится к способу диагностики у субъекта рассеянного склероза. Способ включает в себя получение тестируемого образца от субъекта и выявление в тестируемом образце, по меньшей мере, одного биомаркера, который представляет собой антитело, специфично связывающееся с гликановой структурой. Антитело может представлять собой, например, антитело против Glc(α), антитело против Glc(α 1-4), антитело против Glc(α 1-4) Glc(α), антитело против Glc(α 1-4) Glc(β), антитело против Glc(β), антитело против Gal(β); антитело против Glc(β 1-4) Glc(β 1-4) Glc(β), антитело против GlcNAc(β 1-4) GlcNAc(β), антитело против L-Araf(α), антитело против L-Rha(α), антитело против Gal(β 1-3)[GlcNAc(β 1-6)] GalNAc(α), антитело против Gal(β 1-4) GlcNAc(α), антитело против Gal(β 1-3) GalNAc(α), антитело против Gal(β 1-3) GlcNAc(β), антитело против GlcA(β) или антитело против GlcA(β), или антитело против Xyl(α). Уровень антитела или антител в тестируемом образце сравнивают с контрольным образцом, который получен от одного или нескольких субъектов, у которых выявлены симптомы рассеянного склероза, или у которых выявлены симптомы рассеянного склероза с известным статусом рассеянного склероза, или от субъекта или субъектов, у которых не выявлены симптомы рассеянного склероза. Статус РС может включать в себя, например, обострения, атаки, ремиссии и стабильные стадии заболевания.
В различных осуществлениях выявляют, по меньшей мере, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или 18 данных антител. В некоторых осуществлениях антитело, тестируемое в образце, представляет собой антитело против Glc(α), антитело против Glc(α 1-4) Glc(α) или оба антитела против Glc(α) и против Glc(α 1-4) Glc(α).
В некоторых осуществлениях контрольный образец, по существу, состоит из группы образцов от одного или нескольких субъектов, у которых не выявлены симптомы рассеянного склероза. Наличие РС в контрольном образце может определяться с использованием способов, известных в данной области, например, оценки с помощью расширенной шкалы статуса недееспособности (EDSS) или оценки путем визуализации методом ядерно-магнитного резонанса (ЯМР), или оценки двумя данными способами.
Тестируемый образец может, например, представлять собой биологическую жидкость. Примеры биологических жидкостей охватывают, например, цельную кровь, сыворотку, плазму, спинномозговую жидкость, мочу или слюну.
Субъект может являться женщиной или мужчиной.
Выявляемое антитело может, например, относиться к типу антител IgM или к типу антител IgA, или к типу антител IgG.
В некоторых осуществлениях тип выявляемого рассеянного склероза представляет собой ранний рассеянный склероз.
Также изобретение относится к способу диагностики обострения рассеянного склероза у субъекта. Способ включает получение тестируемого образца от субъекта и выявление в тестируемом образце антитела типа IgM против Glc(α) и/или антитела типа IgM против Glc(α 1-4) Glc(α). Уровни антитела в тестируемом образце сравнивают с таковыми в контрольном образце, который получают от одного или нескольких субъектов с известным статусом рассеянного склероза.
В некоторых осуществлениях контрольный образец состоит, по существу, из группы образцов от одного или нескольких субъектов, у которых не выявлены симптомы обострения рассеянного склероза, и статус рассеянного склероза у которых соответствует ремиссии. У субъекта диагностируют обострение рассеянного склероза, если в тестируемом образце присутствует больше антитела против Glc(α) или антитела против Glc(α 1-4) Glc(α), чем в контрольном образце. В других осуществлениях контрольный образец состоит, по существу, из группы образцов от одного или нескольких субъектов, у которых выявлены симптомы обострения рассеянного склероза, причем у субъекта диагностируют обострение рассеянного склероза, если в тестируемом образце и в контрольном образце присутствуют сходные количества антитела типа IgM против Glc(α) и/или антитела типа IgM против Glc(α 1-4) Glc(α).
Тестируемый образец может, например, представлять собой биологическую жидкость. Примеры биологических жидкостей охватывают, например, цельную кровь, сыворотку, плазму, спинномозговую жидкость, мочу или слюну.
Субъект может являться женщиной или мужчиной.
Выявляемое антитело может, например, относиться к типу антител IgM, или к типу антител IgA, или к типу антител IgG.
В некоторых осуществлениях диагностика представляет собой раннюю диагностику обострения рассеянного склероза.
В некоторых осуществлениях субъекта лечили терапевтическим средством против РС, например интерфероном бета или глатирамера ацетатом, вводимым подкожно.
Также изобретение относится к способу оценки у субъекта тяжести заболевания рассеянным склерозом. Способ включает в себя получение тестируемого образца от субъекта и определение того, содержит ли тестируемый образец антитело типа IgM против Glc(α) и/или антитело типа IgM против Glc(α 1-4) Glc(α). Количество антитела в тестируемом образце сравнивают с количеством антитела в контрольном образце, который получают от одного или нескольких субъектов, тяжесть рассеянного склероза у которых известна.
В некоторых осуществлениях контрольный образец состоит, по существу, из группы образцов от одного или нескольких субъектов, тяжесть заболевания рассеянным склерозом у которых определена с помощью расширенной шкалы статуса недееспособности (EDSS), изменений коэффициента EDSS или оценки путем визуализации методом ядерно-магнитного резонанса (ЯМР).
Тестируемый образец, например, может представлять собой биологическую жидкость. Примеры биологических жидкостей охватывают, например, цельную кровь, сыворотку, плазму, спинномозговую жидкость, мочу или слюну.
Если требуется, способ может далее охватывать выбор терапевтического средства для лечения рассеянного склероза путем выбора терапевтического средства и режима дозировки на основании относительных уровней антитела или антител в тестируемом образце и контрольном образце.
В некоторых осуществлениях более высокие уровни антител в тестируемом образце относительно контрольного образца указывают на выбор терапевтического средства и режима дозировки, что представляет собой подкожное введение интерферона бета (BETAFERON®, AVONEX®, REBIF®) или подкожное введение глатирамера-ацетата (COPAXONE®).
Субъект может являться женщиной или мужчиной.
Также изобретение относится к набору для диагностики симптомов, связанных с рассеянным склерозом. Данный набор включает в себя первый реагент, который специфично выявляет антитело против Glc(α), второй реагент, который специфично выявляет антитело против Glc(α 1-4) Glc(α), и инструкции по применению набора. Набор необязательно включает в себя реагент, который специфично выявляет антитело типа IgM.
Также изобретение относится к субстратам, которые включают в себя реагенты, которые специфично выявляют описанные здесь антитела, например антитело против Glc(α), антитело против Glc(α 1-4), антитело против Glc(α 1-4) Glc(α), антитело против Glc(α 1-4) Glc(β), антитело против Glc(β), антитело против Gal(β); антитело против Glc(β 1-4) Glc(β 1-4) Glc(β), антитело против GlcNAc(β 1-4) GlcNAc(β), антитело против L-Araf(α), антитело против L-Rha(α), антитело против Gal(β 1-3)[GlcNAc(β 1-6)] GalNAc(α), антитело против Gal(β 1-4) GlcNAc(α), антитело против Gal(β 1-3) GalNAc(α), антитело против Gal(β 1-3) GlcNAc(β), антитело против GlcA(β), или антитело против GlcA(β) или антитело против Xyl(α). Субстрат может, например, представлять собой плоскость.
В следующем аспекте изобретение относится к способу выбора терапевтического средства для лечения рассеянного склероза. Способ включает в себя получение тестируемого образца от субъекта, которому поставлен диагноз рассеянного склероза или который имеет риск возникновения данного заболевания, определение, содержит ли тестируемый образец антитело против Glc(α). Уровни антитела в тестируемом образце сравнивают с уровнями антитела в контрольном образце, который, по существу, состоит из образцов одного или нескольких субъектов, тяжесть рассеянного склероза у которых известна. Терапевтическое средство и режим дозировки выбирают на основе относительных уровней антитела в образце субъекта и контрольном образце.
В некоторых вариантах осуществления способ далее включает определение того, содержит ли тестируемый образец антитело против Glc(α 1-4) Glc(α), и сравнение уровней антитела против Glc(α 1-4) Glc(α) в тестируемом образце с уровнями данного антитела в контрольном образце, который, по существу, состоит из образцов одного или нескольких субъектов, тяжесть рассеянного склероза которых известна.
В некоторых вариантах осуществления контрольный образец состоит, по существу, из группы образцов от одного или нескольких субъектов, статус которых представляет собой отсутствие рассеянного склероза или стабильный рассеянный склероз.
Кроме определенных иначе случаев все используемые здесь технические и научные термины имеют то значение, которое обычно понимают под ними рядовые специалисты в области, к которой относится данное изобретение. Хотя при воплощении или тестировании настоящего изобретения могут использоваться способы и материалы, сходные или эквивалентные описанным здесь, ниже описаны подходящие способы и материалы. Все публикации, заявки на выдачу патента, патенты и другие указанные здесь ссылки включены сюда полностью в качестве ссылки. В случае конфликта настоящая спецификация, включая определения, будет служить для контроля. Кроме того, материалы, способы и примеры являются только иллюстративными и не подразумеваются как ограничивающие.
Другие свойства и преимущества изобретения будут понятны из последующего подробного описания и формулы изобретения.
Краткое описание чертежей
На фиг.1 показано дерево решений для определения того, что пациент, у которого подозревается наличие РС, действительно имеет РС.
На фиг.2 показано дерево решений для выбора лекарственного средства и дозы для пациента с РС на основе уровней антител против Glc(α 1-4) Glc(α) или против Glc(α).
На фиг.3 показано дерево решений для предсказания и ранней диагностики атак у пациентов с РС.
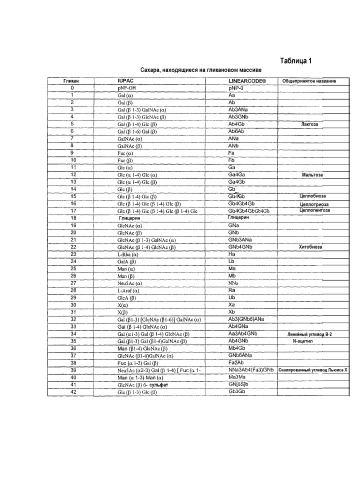
Фиг.4 представляет собой таблицу, в которой показан относительный уровень флуоресценции от связывания различных антител против гликанов у пациентов с MS, а также у нормальных субъектов. Структуры гликанов представлены на верхней строке таблицы согласно синтаксису LINEARCODE® (линейный код).
На фиг.5 показано среднее значение и медиана сигнала антигликановых антител против различных гликанов из сывороток, полученных от пациентов с РС, по сравнению с сыворотками нормальных контрольных субъектов. Структуры гликанов представлены согласно синтаксису LINEARCODES®.
Фиг.6 представляет собой график, на котором показаны различия между средним сигналом от пациентов с РС и здоровыми субъектами, планки представляют собой стандартное отклонение. Структуры гликанов представлены согласно синтаксису LINEARCODES®.
Фиг.7A представляет собой график, на котором показан средний сигнал от связывания IgM против Glc(α), (гликан #11) и против Glc(α 1-4) Glc(α) (гликан #12) в группе с РС и группе здоровых субъектов.
Фиг.7B представляет собой график, на котором показан средний сигнал от связывания IgM против Glc(α) (гликан #11) и против Glc(α 1-4) Glc(α) (гликан #12) в группе пациентов с РС при атаке, пациентов со стабильным РС, и в группе здоровых субъектов.
Фиг.8 представляет собой график, на котором показана корреляция между относительным уровнем флуоресценции от адгезии антител IgM против альфа-глюкозы в образцах позитивных в плане анти-Glc(α) пациентов с РС (левая часть) и негативных в плане анти-Glc(α) пациентов с РС (правая часть), и значениями их EDSS.
Фиг.9 представляет собой график, на котором показана временная стабильность сигнала от связывания антител IgM, IgG и IgA против гликанов в течение 13 недель у 7 здоровых субъектов.
На фиг.10A-10E показан гликановый массив; химическая структура, специфичность лектинового взаимодействия и воспроизводимость. На фиг.10A показан п-аминофенил-P-сахарид, ковалентно связанный на своем восстанавливающем конце с твердой поверхностью через линкер.
На фиг.10B показана воспроизводимость от серии к серии связывания биотинилированного WGA с гликановым массивом. Три отдельных серии массивов анализировали одновременно с биотинилированным WGA.
На фиг.10C показан конкурентный анализ с ConA в отношении связанной Man(α). Возрастающие концентрации растворимой маннозы или Gal(β 1-4) Glc инкубировали с биотинилированным ConA (1,5 мкг/мл) в течение 1 ч и выявляли стрептавидином, конъюгированным с европием.
На фиг.10D показана специфичность связывания лектина с различными аномерами. Связывание ConA с отрицательным контролем глицерином (19), Man(α) (26) и Man(β) (27). Связывание GSI с Gal(α) (1), Gal(β) (2), GalNAc (α) (7) и GalNac(β) (8).
На фиг.10E показана воспроизводимость от планшета к планшету гликанового массива. Пять идентичных планшетов, представляющих GlcNac(β), тестировали с биотинилированным WGA.
На фиг.11 показан профиль связывания гликанов в популяции здоровых людей. Антитело против углеводов, связанное с выбранными гликанами (см. таблицу 5 для структур гликанов) в образцах сыворотки от 72 субъектов, измерено с использованием биотинилированного белка А. Каждая точка представляет собой среднее двух экспериментов, где каждый проведен в четырех параллелях. Прямоугольник включает в себя сигналы 50% популяции. Толстые и тонкие линии в прямоугольнике представляют собой средние значения и медианы, соответственно. Граница прямоугольника, ближайшая к нулю, означает 25-тый процентиль, граница прямоугольника, дальнейшая от нуля, означает 75-тый процентиль. Планки выше и ниже прямоугольника означают 90-тый и 10-тый процентили. Уровень измеренного неспецифического сигнала определяли эмпирически; гликаны, уровень антител против которых, как было обнаружено, был относительно низким и сильно варьировал от эксперимента к эксперименту, были предназначены для определения фонового уровня (не показано). Среднее значение сигнала для данных гликанов рассчитывали и вычитали из сигнала, полученного для каждого образца сыворотки и конкретного гликана. Среднее значение фона составляло 3Ч105 RFU. TBST представляет собой Tris-солевой буфер с Tween-20 (см. экспериментальный протокол).
На фиг.12 показаны сигналы от индивидуальных сывороток, полученные против серии гликанов. Связывание антител против гликанов, измеренное в относительных единицах флуоресценции (RFU), преобразовывали с использованием способа, подобного уравниванию гистограмм, в котором используется монотонное нелинейное картирование. Таким способом значения RFU преобразовывали в интервал от 0 (голубой) и 255 (красный). Данные объединяли в кластеры с использованием алгоритма симулированной нормализации.
На фиг.13A-13C показан профиль связывания аффинно очищенных (A) антитела против L-Rha(α) (B) антител против GIcNAc(α) и GIcNAc(β 1-4) GlcNAc(β) и (C) антител против Glc(β 1-4) Glc(β 1-4) Glc(β) и GlcNAc(β 1-4) GlcNAc(β) с массивом, содержащим 33 гликана. Структуры гликанов описаны в таблице 5. Количество связанных антител измеряли с использованием биотинилированного антитела козы против человеческих IgG.
На фиг.14A и 14B показана специфичность антитела против Glc(β 1-4) Glc(β 1-4) Glc (β). (A) Конкурентное ингибирование связывания антитела против Glc(β 1-4) Glc(β 1-4) Glc(β). Ингибирование связывания аффинно очищенного антитела против Glc(β 1-4) Glc(β 1-4) Glc(β) с п-аминофенил-β-Glc(β 1-4) Glc(β 1-4) Glc(β), иммобилизованным на поверхности лунки, как функция концентрации Glc(β 1-4) Glc(β 1-4) Glc или Gal(β 1-4) Glc. Количество связанного антитела измеряли с использованием биотинилированного антитела козы против человеческих IgG. (B) Связывание антител против Glc(β 1-4) Glc(β 1-4) Glc(β) (A) и против L-Rha(α) (B) с распознающими их сахарами после инкубации с кристаллической или аморфной целлюлозой. Количество связанного антитела измеряли с использованием биотинилированного антитела козы против человеческих IgG.
Фиг.15A-15C являются графическим представлением связывания изотипов IgG, IgA и IgM здоровых субъектов с указанными гликанами.
Фиг.16A является представлением в виде матрицы гликанов, использованных для оценки сывороток пациентов с атеросклерозом, страдающих нестабильной или стабильной стенокардией. Гликаны, против которых были получены значимо различные в разных группах пациентов уровни антител, отмечены закрашенными квадратами. Гликаны перечислены в таблице 4.
Фиг.16B является графическим представлением, на котором показаны уровни антител против гликанов #2 и #29 в трех группах пациентов: стабильной, нестабильной и без атеросклероза. Прямоугольник включает в себя сигналы 50% популяции. Толстые и тонкие линии в прямоугольнике представляют собой средние значения и медианы, соответственно. Граница прямоугольника, ближайшая к нулю, означает 25-тый процентиль, граница прямоугольника, дальнейшая от нуля, означает 75-тый процентиль. Планки выше и ниже прямоугольника означают 90-тый и 10-тый процентили.
Фиг.17 представляет собой гистограмму, на которой показано число образцов в трех группах пациентов, позитивных в плане антител IgA против гликана #2 или гликана #29.
Фиг.18A представляет собой гистограмму, в которой показано распределение уровней антител против против гликанов #2 и #15 в трех группах пациентов. Прямоугольник включает в себя сигналы 50% популяции. Толстые и тонкие линии в прямоугольнике представляют собой средние значения и медианы, соответственно. Граница прямоугольника, ближайшая к нулю, означает 25-тый процентиль, граница прямоугольника, дальнейшая от нуля, означает 75-тый процентиль. Планки выше и ниже прямоугольника означают 90-тый и 10-тый процентили.
Фиг.18B представляет собой гистограмму, на которой показано число образцов в трех группах пациентов, позитивных в плане антител IgA против гликана #2 или гликана #15.
Фиг.19 является графическим представлением специфичности и чувствительности, основанных на уровнях антител IgA против гликана #2, гликана #15, гликана #17, и гликана #49. A - Атеросклероз; S - Стабильные; US - Нестабильные; NA - Отсутствие атеросклероза.
Фиг.20 представляет собой гистограмму, на которой показан профиль связывания клеток CD4+ из одного субъекта с различными гликанами. Структуры гликанов представлены согласно синтаксису LINEARCODES®.
Фиг.21A представляет собой график, на котором показана средняя относительная флуоресценция клеток CD4+ для каждого из семи субъектов. Структуры гликанов представлены согласно синтаксису LINEARCODES®.
На фиг.21B показаны сигналы от индивидуальных сывороток против серии гликанов. Связывание антитела против гликанов, измеренное в единицах относительной флуоресценции (RFU), преобразовывали с использованием способа, подобного уравниванию гистограмм, в котором используется монотонное нелинейное картирование. Таким способом значения RFU преобразовывали в интервал от 0 (голубой) и 255 (красный). Данные объединяли в кластеры с использованием алгоритма симулированной нормализации.
Подробное описание изобретения
Предоставленные здесь способы обеспечивают раннюю диагностику начального и рецидивирующего рассеянного склероза с использованием объективно оцениваемого уровня биомаркеров. Настоящее дерево решений для диагностики пациента с РС описано на фиг.1. Пациент с острым ухудшением функции нервной системы вначале должен диагностироваться как пациент с определенным РС перед назначением ему лечения воздействующими на заболевание лекарственными средствами. Врач должен определить, имеет ли данный пациент симптомы, подобные РС (такие как ранний инсульт, волчанка, дефицит витамина B-12, антифосфолипидный синдром, тяжелая мигрень) или же он действительно имеет РС. Пациент должен перенести второе острое ухудшение функции нервной системы (атаку) до того, как ему будет поставлен диагноз РС, и он сможет начать длительное лечение терапевтическим средством против РС, таким как интерферон бета и глатирамера-ацетат.
В настоящее время врачи используют ЯМР для определения наличия очагов повреждения головного мозга и/или тестирование цереброспинальной жидкости (CSF) на предмет олигоклональных полос (OCB). Если ЯМР дает четкий результат касательно наличия очагов повреждения головного мозга, или в CSF присутствуют OCB, врач может начать лечение немедленно для предотвращения бессимптомных очагов повреждения головного мозга. Окончательная диагностика РС в настоящее время происходит только после второй атаки. Если ЯМР не дает ясного результата или в CSF пациентов нет OCB, РС не диагностируется, и лечение откладывается до второй атаки.
Описанный здесь способ может осуществляться путем получения крови от пациента с острым ухудшением функции нервной системы, который заподозрен в наличии РС. По данному способу можно определить наличие РС путем измерения уровней IgM против Glc(α) и Glc(α 1-4) Glc(α). Если уровень, по меньшей мере, одного из данных антител значительно превышает средний уровень данных антител в сыворотке здоровых субъектов, пациенту ставится диагноз РС без необходимости ожидания второй атаки. Кроме того, быстрая диагностика позволяет незамедлительно начать лечение.
Терапией выбора при лечении РС является интерферон β (например, ИФН β-1a и ИФН β-1b). Современная оценка эффективности и требуемой дозы лекарственного средства основана на длительном мониторинге различных клинических коэффициентов. В настоящее время коэффициент EDSS и его изменение в течение времени (например, сравнение различий EDSS каждые 3-6 месяцев) является главным клиническим параметром для управления заболеванием. Важным компонентом оценки является уровень усталости и депрессии, испытываемый пациентом. Усталость и/или депрессия могут являться симптомами РС, как аутоиммунного заболевания, или побочным эффектом применения интерферона бета. Определение причины усталости важно для управления лечением. Например, если усталость является результатом побочного действия интерферона, врач решит снизить дозу или даже заменить его на другое лекарственное средство. Однако если усталость развивается вследствие симптомов РС, врач должен решить увеличить дозировку лекарственного средства (см. фиг.2).
Скрининг крови пациента и определение уровня описанных здесь биомаркеров, например, антител IgM против Glc(α) и против Glc(α 1-4) Glc(α) обеспечивает здесь точный мониторинг терапии. Значимое снижение уровня антител указывает на то, что пациент благоприятно реагирует на введенное лекарственное средство.
Раннее выявление атак
В настоящее время нет способа предсказать начало атак у пациентов с РС. ЯМР и клиническая оценка пациентов может лишь выявить повреждение, которое уже произошло. Периодическое измерение уровня нескольких антител против гликанов (например, IgM против Glc(α) или IgM против Glc(α 1-4) Glc(α)) в крови пациентов описанным здесь способом позволяет врачам определить наступающие атаки, основываясь на повышении уровня данных антител. Уровень данных антител значимо выше в крови пациентов в ситуациях атак РС по сравнению с их уровнем у пациентов в стабильном состоянии (см. фиг.7). После выявления повышения уровня этих антител врач может начать агрессивное лечение стероидами для снижения воспаления и предотвращения повреждения миелина (см. фиг.3).
Также здесь предоставляются способы выявления и оценки субъектов с атеросклерозом при риске стабильной и нестабильной стенокардии с использованием биомаркеров-антител, специфичных в отношении гликанов, а также применение иммобилизованных гликанов для выявления интересующих клеток.
Различные структуры гликанов обсуждаются в данном применении. Гликаны представлены в сжатой форме представления номенклатуры углеводов Международного союза теоретической и прикладной химии (IUPAC) или согласно синтаксису LINEARCODE®; принципы для синтаксиса линейного кода см. (Banin E. Neuberger Y. Altshuler Y. Halevi A. Inbar O. Dotan N. and Dukler A. (2002) A Noval Liner Code Nomenclature for complex Carbohydrates. Trends in Glycoscience andGlycotechnology Vol.14 № 77 pp.127-137). Перевод представления LINEARCODE в представление IUPAC находится в таблице 1. Все гликановые структуры, которые обсуждаются в данном описании, кроме указанных иначе, связаны через линкер с твердой фазой с указанием аномера α или β, как описано на фиг.10A.
Изобретение будет проиллюстрировано следующими неограничивающими примерами.
Пример 1
Сравнение антигликановых антител в сыворотках пациентов с рассеянным склерозом (РС) и нормальной популяции
Профиль антигликановых антител (Ig) получали с использованием массивов GlycoChip (Glycominds, Ltd., Лод, Израиль, кат. № 9100). Массивы конструировали с использованием процедур, описанных в WO00/49412. Сравнивали профили антител против гликанов 40 пациентов с рассеянным склерозом и 40 равнозначных по полу и возрасту нормальных доноров крови.
Все образцы сыворотки тестировали с использованием планшетов GlycoChip (Glycominds Ltd., Лод, Израиль, кат. № 9100), которые представляют собой массив моно- и олигосахаридов, ковалентно присоединенных к 384-луночному планшету для микротитрования сниженного объема. Моно- и олигосахариды, представленные в массиве, перечислены на фиг.4. Перевод синтаксиса LinearCode, использованного для описания структуры гликанов, в номенклатуру IUPAC, может быть найден в таблице 1.
Сыворотки здоровых добровольцев и пациентов с РС, которые подписали формы информированного согласия, собирали в вакуумированные покрытые силиконом, содержащие гель пробирки (Estar Technologies, кат. № 616603GLV). Сыворотки отделяли от клеток крови и хранили замороженными при -25°C до использования. Их анализировали в двух отдельных экспериментах, каждый из которых повторяли дважды в разные дни.
Сыворотки от добровольцев разбавляли (1:20) TBST, распределенным в планшете GlycoChip® с использованием робота Tecan Genesis Workstation 200 (10 мкл/лунку), и инкубировали 30 мин при 25°C. Для каждого гликана и образца сыворотки в планшете делали 4 повтора.
Планшеты промывали 250 мкл/лунку буфера с высоким содержанием солей (0,15 M KNa, pH 7,2, NaCl 2 M, MgSО4 0,085 M, 0,05% Tween 20) в автоматическом устройстве для промывки планшетов (Tecan, PowerWasher™). 10 мкл/лунку биотинилированного белка A (ICN 62-265), 1 мкг/мл в TBST, раскапывали вручную и инкубировали планшеты в течение 30 мин при 25°C. Планшет промывали опять буфером с высоким содержанием солей.
Конъюгированный со стрептавидином европий, Wallac, AD0062 (1 мкл/мл, 10 мкл/лунку) добавляли вручную с последующей инкубацией в течение 30 мин при 25°C в темноте. Промывку планшетов буфером с высоким содержанием солей повторяли. Усиливающий буфер Delfia™ (Wallac, 730232, 10 мкл/лунку) добавляли в лунки, и планшеты инкубировали, по меньшей мере, в течение 30 мин в темноте. Флуоресценцию лунок считывали посредством Victor 1420 (Wallac) с использованием разрешенных по времени настроек флуоресценции с испусканием при 612 нм и возбуждением при 340 нм.
Профили всех тестируемых пациентов приведены на фиг.4. Верхние 40 линий (MS) описывают уровень антител против углеводов в образцах РС, а нижние 40 линий (NC) описывают уровень антител против углеводов в образцах из нормальной контрольной популяции. Представленные значения являются абсолютными значениями без вычитания фона. Поскольку детекцию связанных антител проводили биотинилированным белком A, который связывается с IgG, IgA и IgM, сигнал представляет собой общее связывание антител всех субтипов IgG, IgA и IgM.
Сравнение между средними значениями и медианами уровня антител против углеводов при РС и в нормальной популяции выявило значимые различия между образцами от пациентов с РС и образцами от нормальной популяции, см. фиг.5. Одним из примеров большой разницы, наблюдаемой между двумя группами, является средний сигнал от гликана Ga4Gb. t-тест показал, что данное различие является весьма значимым статистически (α=0,05; p<0,001). Другим примером является Ab3(GNb6)ANa (α=0,05; p<0,001). Имеются значимые различия между медианами сигналов от РС и нормальной популяции, имеющих отношение к антителам к следующим гликанам: Glc(α), Glc(α 1-4) Glc(α), Glc(α 1-4) Glc(β), Glc(β), Gal(β), Glc(β 1-4) Glc(β 1-4) Glc(β), GlcNAc(β 1-4) GlcNAc(β), L-Araf(α), L-Rha(α), Gal(β 1-3) [GlcNAc(β 1-6)] GalNAc(α), Gal(β 1-4) GlcNAc(α), Gal(β 1-3) GalNAc(α), Gal(β 1-3) GlcNAc(β), GlcA(β), GlcA(β), Xyl(α). Сигнал от связанных антител в группе РС выше сигнала в нормальной контрольной группе.
На фиг.6 представлена разница между средними значениями связывания антигликановых антител в указанных популяциях.
Пример 2
Различия в уровне антител IgM против Glc(α), против Glc(α1-4) Glc(α) в сыворотке пациентов с РС при атаке, пациентов со стабильным РС и здоровой популяции
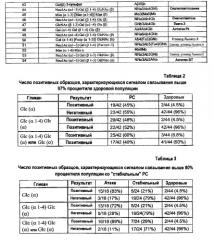
Массив гликанов использовали для поиска биомаркеров в репертуаре сывороточных антител человека, связывающих гликаны, которые различаются между здоровой популяцией и пациентами с рассеянным склерозом (РС), и между пациентами с РС при обострении и на стадии ремиссии. Данный пример демонстрирует, что два антитела IgM, против Glc(α) и Glc(α 1-4) Glc(α), как было обнаружено, характеризуются значимо более высоким уровнем у пациентов с РС, чем у здоровых людей (чувствительность и специфичность 60% и 93%, соответственно), и у пациентов с РС на стадии обострения, относительно пациентов на стадии ремиссии (чувствительность и специфичность 89% и 71%, соответственно). Также предоставляется профиль антигликановых антител для здоровой популяции, включая пределы вариации в течение интервала длиной 13 недель.
Временная стабильность профиля антигликановых антител в течение 13 недель у очевидно здоровых субъектов была высокой. Низкий уровень антител IgM против Glc(α) и антител против Glc(α1-4) Glc(α) в нормальной популяции и их высокий уровень у пациентов с РС, и высокая временная стабильность антигликановых антител указывает на то, что данные IgM против Glc(α) и антител против Glc(α 1-4) Glc(α) могут служить в качестве биомаркера для ранней диагностики, раннего предпи