Способ получения индуцирующих воспринимаемость трансплантата клеток моноцитарного происхождения, способ получения фармацевтической композиции для подавления реакций отторжения трансплантата, индуцирующие воспринимаемость трансплантата клетки моноцитарного происхождения, клеточный препарат для индукции воспринимаемости трансплантата, фармацевтическая композиция для подавления реакций отторжения трансплантата, применение индуцирующих воспринимаемость трансплантата клеток (варианты), способ получения и/или размножения регуляторных т-лимфоцитов, гибридомная клеточная линия, антитело и применение антитела
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению индуцирующих воспринимаемость трансплантата клеток моноцитарного происхождения, экспрессирующих антигены CD3 и CD14, и может быть использовано в трансплантологии. Из крови выделяют моноциты, размножают их в культуральной среде с 1-20 мкг/л фактора роста клеток M-CSF и культивируют в течение 24-72 часов в культуральной среде с 0,1-20 нг/мл интерферона γ-IFN. После этого выделяют клетки из культуральной среды. Для выделения CD3 и CD14 клеток используют антитела, продуцируемые гибридомой DSM АСС2542. Полученные клетки при необходимости суспендируют и подвергают заморозке. Изобретение позволяет получить индуцирующие воспринимаемость трансплантата клетки моноцитарного происхождения, которые обладают эффектом подавления реакций отторжения трансплантата. 11 н. и 15 з.п. ф-лы, 29 ил., 1 табл.
Реферат
Изобретение относится к индуцирующим воспринимаемость трансплантата клеткам моноцитарного происхождения и их получению, а также к их применению для создания воспринимаемости трансплантата.
Предпочтительно, изобретение относится к индуцирующим воспринимаемость трансплантата клеткам (в дальнейшем также называемым TAIC), происходящим из человеческих моноцитов.
Кроме того, изобретение относится к моноклональному антителу GM-7, специфически распознающему индуцирующие воспринимаемость трансплантата клетки по изобретению, получаемые от человека.
Кроме того, изобретение относится к применению антитела GM-7 для выявления и/или выделения индуцирующих воспринимаемость трансплантата клеток.
Термин "трансплантация" в области иммунологии применяют для обозначения пересадки клеток, ткани или органов от одного организма другому. Необходимость трансплантации является результатом открытия того, что многие заболевания можно лечить пересадкой (трансплантацией) здоровых органов, ткани или клеток от одного индивидуума, здоровому в данном отношении - донора, другому индивидууму, страдающему соответствующим заболеванием - реципиенту или хозяину.
В зависимости от родства между донором и реципиентом можно различать следующие типы трансплантатов:
1. Аутологичные трансплантаты. Они представляют собой ткани или клетки, трансплантированные у одного и того же индивидуума из одной области организма в другую.
2. Изогенные трансплантаты. Это включает в себя пересадку между генетически идентичными индивидуумами. Примерами данного типа являются инбредные линии крыс и мышей. У людей изогенными (сингенными) трансплантатами можно считать трансплантаты у генетически идентичных (монозиготных) близнецов.
3. Аллогенные трансплантаты. Данный термин обозначает трансплантаты у генетически различных представителей одного вида, такие как, например, от одного человеческого индивидуума другому или, в случае экспериментальных животных, от одной инбредной линии другой.
4. Ксеногенные трансплантаты. Они включают в себя пересадку между различными видами, такой как, например, пересадка сердца обезьяны человеку.
Как правило, аутологичные и изогенные трансплантаты не вызывают иммунологических проблем в смысле реакции отторжения. Однако это не верно в случае аллогенных и ксеногенных трансплантатов. Такие трансплантаты иммунной системой реципиента распознаются как чужеродные и отторгаются после сравнительно короткого промежутка времени. В случае реакции отторжения аллогенных/ксеногенных трансплантатов центральную роль играют T-лимфоциты (далее называемые T-клетками). Данные клетки распознают чужеродные клетки посредством их главного комплекса гистосовместимости (MHC). Чужеродный комплекс MHC сенсибилизирует реагирующие на антигены T-клетки реципиента, а затем активированные таким образом T-клетки приводят к разрушению донорных клеток или донорной ткани, соответственно. Клетки с другими комплексами MHC также называют "отличающимися по MHC".
Трансплантация аллогенных или ксеногенных клеток, тканей или органов неизбежно приводит к ситуации, когда клетки двух различных индивидуумов, т.е. отличающиеся по MHC клетки, представлены в крови реципиента одновременно. Данный феномен назвали "химеризм". Необходимо делать отличия между микрохимеризмом и макрохимеризмом. Микрохимеризм относится к состоянию, в котором полученные от донора клетки, например, после переливания крови или пересадки костного мозга или после трансплантации богатых лимфоцитами органов, таких как тонкий кишечник или печень, остаются персистирующими у отличающегося по MHC хозяина, но их можно обнаружить только в немногих отдельных случаях. Термин макрохимеризм применяют, когда более чем 5% клеток, обнаруживаемых у реципиента, происходят от донора, при этом в обоих случаях необходимо делать различия между химеризмом крови и органным химеризмом с соответствующим выявлением донорных клеток в крови или органах реципиента.
До некоторой степени химеризм может вести к толерантности по отношению к трансплантатам. Таким образом, в случае индивидуумов, подвергшихся, например, в результате лейкоза или лимфомы, трансплантации аллогенного костного мозга со значительным соответствием структуры MHC у донора и реципиента, после создания соответствующего миелоаблативного состояния (разрушение у индивидуума собственного костного мозга и происходящих из него клеток крови) и последующей трансплантации стволовых клеток наблюдали "донорный химеризм". В случае данных пациентов более чем 99% клеток, обнаруживаемых в крови, происходили от стволовых клеток донора, а данный химеризм формировал основу для толерантности по отношению ко всем органам, трансплантируемым от данного донора. Данное наблюдение подтверждено в ряде клинических примеров последующего донорства почек, печени и долей легкого [Dey B., et al., "Outcomes of Recipients of both bone marrow and solid organ transplants: A review". Medicine (Baltimore) 77, 355-369 (1989)]. При возникновения индукции толерантности существование полного донорного химеризма, определенного как присутствие более чем 90% донорных клеток в периферической крови аллогенного реципиента, не имеет решающего значения; напротив, обнаружено, что для индукции толерантности достаточно доли донорных клеток в размере 5%, называемой "смешанным" химеризмом [ср. обзор Acholonu I.N. и Ildstad S. T., "The role of bone marrow transplantation and tolerance: Organ-specific and cellular grafts", Curr. Opin. Organ. Transplant 4, 189-196 (1999)].
Хотя по существу, таким образом, предоставлено доказательство того, что донорный химеризм, сопровождающий трансплантацию костного мозга (BMTx), индуцирует толерантность, тем не менее, до настоящего времени не являлось возможным произвести успешную аллогенную BMTx в случае групп с полностью отличными по MHC донором и реципиентом. Это происходит вследствие того факта, что необходимая для этого предварительная подготовка, т.е. приведение реципиента в требуемое состояние (см. выше) содержит в себе три существенных вида риска для реципиента. Во-первых, токсичность для костного мозга применяемых химиотерапевтических средств, вводимых совместно с дополнительной радиационной обработкой или без нее, приводит к значительной смертности; во-вторых, существует риск отторжения трансплантированного костного мозга, несмотря на предшествующую подготовку; и, наконец, существует риск заболевания "трансплантат против хозяина" (GvHD) в том случае, когда пересаженные хозяину вместе с трансплантатом T-клетки действуют против организма хозяина [ср. Wolff S.N., "Hematopoietic cell transplant from volunteer unrelated or partially matched related donors: Recent developments." Curr. Opin. Organ. Transplant 5, 372-381 (2000)]. Данное заболевание имеет место каждый раз, когда иммунная система реципиента ослаблена предшествующей подготовкой до такой степени, что пересаженные вместе с костным мозгом T-клетки способны вызывать летальное отторжение у реципиента.
Во избежание указанных выше проблем в настоящее время предпринимаются попытки разработать настолько слабые режимы подготовки реципиента, насколько это возможно. Однако, чем больше различие между MHC донора и реципиента, тем более строгий режим подготовки необходимо выбрать для предотвращения отторжения трансплантированного костного мозга; это снова приводит к увеличенному риску заболевания "трансплантат против хозяина" (GvHD).
До настоящего времени не проводили подробного исследования в отношении времени, в течение которого в крови реципиента должен выявляться индуцированный химеризм для обеспечения состояния стабильной толерантности для донорского органа. Однако достоверные данные, полученные из модели на мышах, указывают на то, что выявляемого в течение двух недель макрохимеризма уже достаточно для возникновения толерантности [Weckerle, T. et al. "Allogeneic bone marrow transplantation with co-stimulatory blockade induces macro-chimerismand tolerance without cytoreductive host treatment. "Nat. Med. 6, 464-469 (2000)].
Необходимость разработки альтернатив доступным в настоящее время иммунодепрессантам для создания толерантности возникает с двух основных точек зрения. С одной стороны клинически доступные в настоящее время иммунодепрессанты не способны предотвращать хронического отторжения трансплантата, а с другой стороны, постоянный прием иммунодепрессантов сопровождается существенными побочными эффектами, приводящим к повышенной чувствительности пациента к вирусным, бактериальным и грибковым инфекциям и создающим значительные риски вследствие формирования малигномы и заболеваний сердечно-сосудистой системы, в частности, вследствие инфаркта миокарда и сердечной недостаточности [см. Wheeler, D. C. and Steiger, J. "Evolution and Etiology of Cardiovascular Diseases in Renal Transplant Recipients" Transplantation 70, 41-45 (2000)].
Munn et al. описали индуцированную макрофагами супрессию T-клеток, основанную на селективной элиминации триптофана и/или увеличении одного или нескольких метаболитов триптофана в окружающей клетку среде [см. Munn et al. "Inhibition of T Cell Proliferation by Macrophage Tryptophan Catabolism" J. Exp. Med. 189, 1363-1372 (1999)]. Начиная с данного исследования, авторы предлагают модифицировать опосредованные T-клетками иммунологические реакции изменением локальной внеклеточной концентрации триптофана, в частности ингибированием или увеличением опосредованного IDO метаболизма триптофана, см., например патенты США 6482416 и 6451840. Таким образом, данный подход предоставляет только дополнительную, независимую от антигена и неспецифическую иммуносупрессию, направленную против T-клеток.
Однако то, что экстренно необходимо, представляет собой клинически приемлемую концепцию для индукции зависящей от донора толерантности, т.е. концепцию, согласно которой иммунный ответ хозяина против тканевых антигенов на пересаженном от донора органе специфически подавлен, но при этом, в остальном, иммунокомпетентность хозяина полностью сохраняется.
Посредством такой концепции в средние сроки можно достичь значительного уменьшения несоответствия между необходимостью органов и предложением органов, так как в таком случае, в результате процессов острого или хронического отторжения, пропадет значительно меньшее количество органов. Недостаток подходящих органов можно продемонстрировать посредством статистических данных по США, датируемых февралем 2001 года:
| Таблица 1 | |
| Новейшие данные из "UNOS (реестр объединенной сети для обмена органами) государственный список пациентов, ожидающих трансплантации органов (февраль 2001 года)" | |
| Тип трансплантата | Количество пациентов в списках ожидания |
| Почка | 47996 |
| Печень | 17151 |
| Поджелудочная железа | 1060 |
| Островковые клетки поджелудочной железы | 185 |
| Почка-поджелудочная железа | 2442 |
| Кишечник | 151 |
| Сердца | 4222 |
| Сердце-легкое | 210 |
| Легкое | 3721 |
| Общее количество пациентов | 74800 |
Это объясняет те огромные усилия на государственном и международном уровне, прилагаемые для разработки концепций индукции зависящей от донора толерантности.
Следовательно, лежащая в основе изобретения проблема представляет собой предоставление способов воздействия на T-клетки организма реципиента таким образом, чтобы они оставались толерантными к соответствующим чужеродным клеткам, тканям или органам и/или воспринимали их в течение длительного времени без отторжения. Характер данных средств и их получение или применение не должны вызывать каких-либо этических и/или правовых проблем и должна существовать возможность их быстрого получения для планируемого терапевтического применения в необходимых для данной цели количествах и при приемлемых затратах на производство.
Для разрешения данной проблемы по настоящему изобретению предоставлены индуцирующие воспринимаемость трансплантата клетки моноцитарного происхождения позвоночных, конкретно млекопитающих, а более предпочтительно - людей. Неожиданно обнаружили, что модифицированные по изобретению моноциты донорской крови (донорского органа) в случае предоперационного и/или послеоперационного введения способны защищать организм реципиента от активированных чужеродным комплексом MHC T-клеток его собственного организма, таким образом предотвращая отторжение трансплантата. При применении в качестве "клеточных терапевтических средств" для индукции толерантности к трансплантату, модифицированные клетки у соответствующих пациентов не вызывают никаких или не вызывают заслуживающих внимания побочных эффектов в смысле клеточного отторжения, индукции опухолей, в частности злокачественных опухолей, и заболевания "трансплантат против хозяина".
Неожиданно обнаружили, что способ по изобретению приводит к модификации моноцитов in vitro таким образом, что получают клетки, способные после инъекции аллогенному реципиенту без иммуносупрессии предотвращать природный иммунный ответ против клеток или ткани донора и способные, таким образом, циркулировать в периферической крови, по меньшей мере, в течение трех недель. После введения приблизительно 105 клеток/кг массы тела (BW), образующийся в результате химеризм из связывающихся с GM-7 клеток (см. ниже) находится в области 5-20%. Данный временный химеризм индуцирует
a) долговременную воспринимаемость для последующих трансплантаций органов от того же донора, предпочтительно в пределах 10 дней после внутривенного введения клеток и
b) долговременную воспринимаемость в сочетании с кратковременным иммуносупрессирующим воздействием, когда применяют клетки после трансплантации органа.
Как показано в примере 10, иммуносупрессирующее действие клеток по изобретению не связано с индуцированной макрофагами супрессией T-клеток посредством экспрессии разрушающего триптофан фермента индоламин-2,3-диоксигеназы (IDO), как исследовано Munn et al., (см. выше). Предпочтительно, TAIC по изобретению индуцируют у реципиента специфическую толерантность к донору посредством инактивации аллореактивных T-клеток, с одной стороны, и посредством формирования у реципиента регуляторных T-клеток, с другой стороны, см. примеры 12 и 13.
Следовательно, полученные из моноцитов макрофаги, ингибирующие пролиферацию T-клеток посредством опосредованной IDO элиминации триптофана в окружающей клетки среде не включены в данное изобретение.
Описание фигур
Фиг.1: Определение посредством проточной цитометрии связывающей способности GM-7 в отношении исходных моноцитарных клеток перед модификацией по изобретению (диаграмма на левой стороне) и после нее (диаграмма на правой стороне). Ось x означает количество связавшихся клеток.
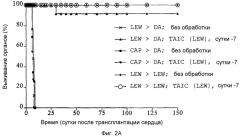
Фиг.2A: Кривые выживания Каплан-Мейер трансплантатов сердца после гетеротопической трансплантации сердца с предоперационным введением полученных от донора TAIC и без него в модели на крысах (n = 10 животных в группе).
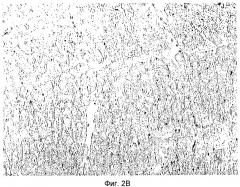
Фиг.2B: Гистологический препарат аллогенного трансплантата LEW на POD (сутки после операции) 150 после гетеротопической трансплантации в брюшную полость реципиентной крысы DA, предварительно обработанной 106 TAIC, полученных из LEW на сутки -7. Кратность увеличения: 40.
Фиг.2C: Гистологический препарат из тимуса крысы DA, предварительно обработанной 106 TAIC, полученных из LEW, после мечения препарата моноклональными антителами I1.69, специфичными для MHC класса I LEW. Кратность увеличения: 40.
Фиг.2D: Определение посредством проточной цитометрии полученных от донора клеток у четырех реципиентных крыс DA, не подвергнутых иммуносупрессии с последующей инъекцией TAIC, полученных из LEW, (крысы 1-3: 106 клеток/кг × BW; крыса 4: 104 клеток/кг × BW).
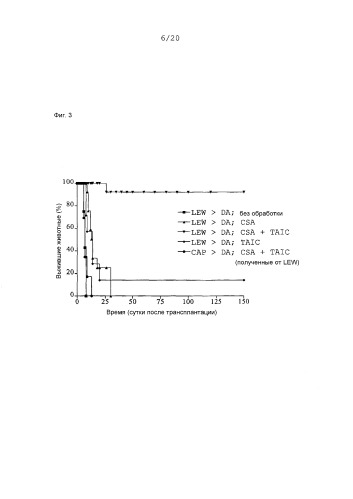
Фиг.3: Кривые выживания Каплан-Мейер трансплантатов сердца после гетеротопической трансплантации сердца с предоперационным введением TAIC, полученных от донора, и без него в сочетании с начальным введением 4 циклов циклоспорина A (CSA; 5 мг/кг × BW) в модели на крысах (n=6-10 животных в группе).
Фиг.4A-C: Кривые выживания Каплан-Мейер трансплантатов сердца (A), печени (B) и почки (C) после гетеротопической (A и C) или ортотопической (B) трансплантации, соответственно, с предоперационным введением TAIC, полученных от донора, и без него (n=6 животных в группе).
Фиг.4D-F: Гистологические препараты трансплантатов почки (D), печени (E) и кожи (F) DA после гетеротопической трансплантации в реципиентную крысу LEW.
Фиг.5A: Кривые выживания Каплан-Мейер трансплантатов сердца после гетеротопических трансплантаций сердца при различных сочетаниях инбредных линий с предоперационным введением полученных от донора TAIC в сочетании с начальным введением 4 циклов CSA (5 мг/кг × BW) в модели на крысах (n=6 животных в группе).
Фиг.5B: Кривые выживания Каплан-Мейер трансплантатов сердца после гетеротопических трансплантаций сердца через 7 суток после введения различным образом обработанных моноцитов крови от донорных животных LEW (n=6 животных в группе).
Фиг.6A: Кривые выживания Каплан-Мейер трансплантатов легкого после ортотопических левосторонних трансплантаций легкого у свиней ("аутбредные карликовые свиньи") с применением тройной иммуносупрессии CSA, азатиоприном (AZA) и стероидами (STE) (n=4 животных в группе).
Фиг.6B: рентгеновский снимок грудной клетки (заднепередний способ) двух свиней с односторонней пересадкой левого легкого ("аутбредные карликовые свиньи") на POD (сутки после операции) 41 и 55. Тройную иммуносупрессию CSA, AZA и стероидами прерывали на 28 сутки после трансплантации.
Фиг.7: Смешанная культура лимфоцитов из CD14+-моноцитов индивидуума B
(GM-7-: серый столбец; GM-7+: черный столбец), отвечающих клеток донора A с несоответствующим MHC и облученных клеток донора B для сравнения супрессорной активности CD14+/GM-7+- и CD14+/GM-7--клеток.
Фиг.8: Смешанная культура лимфоцитов из стимулированных PHA лимфоцитов (PhaLy) и TAIC ("Mo+Ly" или "Mo"), предварительно инкубированная в двух экспериментах с ингибитором (1-MT) индоламин-2,3-диоксигеназы (IDO) для определения влияния 1-MT на супрессорную активность TAIC.
Фиг.9: Определение проточной цитометрией количества CD14+-моноцитов и CD2+-лимфоцитов в моноцитарной фракции, а также количества CD14+/CD3+-клеток, действующих в качестве TAIC, для определения влияния очистки клеток для обогащения моноцитами в начале культивирования на формирование иммуносупрессирующих CD14+/CD3+-клеток.
Фиг.10: Определение проточной цитометрией экспрессии GM-7 после операции в крови пациентов до (левая фигура) и после (правая фигура) инъекции TAIC, для определения влияния TAIC на экспрессию GM-7 в клетках крови in vivo.
Сущность изобретения
Основные стадии способа по изобретению для получения TAIC моноцитарного происхождения включают в себя:
(a) Выделение моноцитов из крови, предпочтительно из крови человека.
(b) Размножение моноцитов в подходящей культуральной среде, содержащей макрофагальный колониестимулирующий фактор (в дальнейшем обозначаемый как M-CSF) в качестве стимулирующего рост средства.
(c) Стимуляцию моноцитов интерфероном γ (в дальнейшем называемом γ-IFN); и
(d) Получение сформированных на стадии c) индуцирующих воспринимаемость трансплантата клеток посредством выделения клеток из культуральной среды.
По изобретению показано, что стимуляция γ-IFN представляет собой решающую стадию в получении TAIC (см. пример 7).
В настоящем изобретении термин TAIC (индуцирующие воспринимаемость трансплантата клетки моноцитарного происхождения) обозначает клеточную популяцию, получаемую на стадии (d) описанного выше способа. Данная клеточная популяция вместе с происходящими из моноцитов эффективными по изобретению клетками также содержит лимфоциты, см. пример 11, а также, необязательно, дополнительные клетки, полученные из лейкоцитарной пленки, например гранулоциты. Количество полученных из моноцитов клеток в популяции TAIC предпочтительно составляет от 50 до 90%, более предпочтительно - от 60 до 70% относительно общего количества клеток.
В настоящем изобретении термин "общее количество клеток" относится к количеству живых клеток в рассматриваемой клеточной популяции. Данное количество можно определить "способом исключения по красителю трипановый синий", так как данный краситель позволяет отличать живые клетки от неживых оптическими средствами.
По изобретению, TAIC для индукции воспринимаемости трансплантата, как правило, можно применять в количестве 104-106 клеток на килограмм массы тела, предпочтительно - в количестве 105 клеток на килограмм массы тела. Введение TAIC в случае больших различий в MHC можно проводить повторно, предпочтительно три раза через интервалы длительностью приблизительно 10 суток, где введение клеток можно проводить до трансплантации или после нее (см. ниже). Общее количество клеток, необходимых для данной цели, можно получить в пределах от 6 до 8 суток после забора крови.
И в тестах на животных и в культуре доказано, что клетки по изобретению (TAIC) не создают риска формирования малигномы; данный результат являлось невозможным ожидать в любом другом случае вследствие природы исходных моноцитарных клеток, от которых происходят клетки по изобретению.
Как раскрыто ниже, из фракции клеток, существующей в TAIC, происходящих из моноцитов, можно выделить дополнительные субпопуляции клеток с оптимизированным действием по изобретению.
После культивации in vitro и стимуляции исходных клеток (моноцитов) интерфероном γ формируются TAIC, содержащие субпопуляцию клеток, см. пример 9, связывающуюся с моноклональным антителом GM-7, экспрессируемым гибридомной клеточной линией DSM ACC2542. Моноклональное антитело GM-7 представляет собой антитело иммуноглобулинового изотипа IgG2a, легкая цепь которого представляет собой изотип каппа. Характеристическим свойством данного антитела является его узконаправленная способность связываться с моноцитами, модифицированными посредством условий культивирования по изобретению, тогда как исходные моноцитарные клетки не распознаются, т.е. связывания антитела с исходными клетками не происходит (см. пример 9). Кроме того, на 20 добровольцах показано, что GM-7 не связывается с человеческими клетками в периферической крови, см. Фиг.10.
Антитело получали посредством иммунизации мышей TAIC, полученными из человеческих моноцитов, с применением способов, известных специалистам в данной области (Davis, W. C. "Methods in Molecular Biology: Monoclonal Antibody Protocols", New York: Humana Press Inc. Totowa, 1995). Затем посредством слияния образующей антитела B-клетки и миеломной клетки мыши получали гибридомную линию. Применяемые для получения таких клеточных линий способы в настоящее время известны в данной области (Davis, W. C. "Methods in Molecular Biology: Monoclonal Antibody Protocols", New York: Humana Press Inc. Totowa, 1995; Kohler, G., Milstein, C. "Continuous cultures of fused cells secreting antibody of predefined specificity", Nature 256, 495-497 (1975)). Продуцирующую антитела GM-7 гибридомную клеточную линию депонировали по правилам Будапештского соглашения в DSMZ (Deutsche Sammlung von Mikroorganismen und Zellkultur GmbH, Braunschweig, Germany) под инвентарным № DSM ACC2542.
На Фиг.1 показана связывающая способность GM-7 по отношению к моноцитарным клеткам после модификации in vitro по изобретению, определенная посредством проточной цитометрии. Можно видеть, что полученные непосредственно из лейкоцитарной пленки несущие CD14 моноциты не связывают антитело GM-7 (заштрихованная серым область соответствует незаштрихованной с антителами контроля). Напротив, после культивирования в присутствие M-CSF и стимуляции γ-IFN, часть моноцитов экспрессирует антиген, распознаваемый моноклональным антителом GM-7. Моноклональное антитело GM-7 характеризуется как изотип κ-IgG2a. Следовательно, способ по изобретению приводит к изменению фенотипического профиля экспрессии антигенов на клеточной мембране модифицированных моноцитов (Фиг.1).
Моноклональное антитело GM-7 специфически связывается с той клеточной популяцией, которая среди образуемых способом по изобретению клеток индуцирует наиболее эффективную воспринимаемость трансплантата (см. Фиг.9).
Таким образом, предпочтительное осуществление изобретения относится к таким TAIC, которые способны к связыванию с антителом GM-7. Данные клетки впоследствии обозначали как TAICGM-7.
Следовательно, антитело по изобретению GM-7 представляет собой чрезвычайно эффективное и легкое в обращении средство для отбора и очистки индуцирующих воспринимаемость трансплантата клеток (TAIC). Посредством антитела по изобретению возможно получать гомогенную и высокоэффективную популяцию TAIC.
По предпочтительному осуществлению изобретения образуемые на стадии c) описанного выше способа по изобретению индуцирующие воспринимаемость трансплантата клетки, экспрессирующие связывающийся с антителом GM-7 антиген, можно или непосредственно выделить из клеточной среды после стадии c) или их можно выделить из клеточной популяции, полученной после выделения клеток из клеточной среды на стадии d) указанного выше способа по изобретению, посредством связывания с антителом GM-7, получаемого посредством гибридомной клеточной линии DSM ACC2542.
Для отбора TAIC по изобретению антитело приводят в контакт с образцом в условиях, позволяющих связывание антитела с индуцирующими воспринимаемость трансплантата клетками, присутствующими в образце. Затем образующиеся вследствие реакции связывания комплексы выделяют из образца. Для данной цели антитело можно иммобилизовать на носителе перед контактом с образцом; например, его можно связать с матриксом, пригодным для применения в хроматографии или с так называемыми "магнитными шариками". Данная процедура позволяет выделять и концентрировать индуцирующие воспринимаемость трансплантата клетки из образца большого объема.
Для получения индуцирующих воспринимаемость трансплантата клеток после выделения реакционного комплекса из образца связь между антителом и индуцирующими воспринимаемость трансплантата клетками разрушают. Это можно проводить известными в настоящее время в данной области способами, такими как, например, конкурентное замещение или отмывкой растворами солей. Соответствующие способы описаны, например, у Utz U. et al. ("Analysis of the T-cell Receptor repertoire of human T-cell leukemia virus type-1 (HTLV-1) Tax-specific CD8+ Cytotoxic T Lymphocytes from patients with HTLV-1 associated disease: Evidence for the oligoclonal expansion "J. of Virology Feb. 1996, 843-851).
Кроме того, моноклональное антитело GM-7 позволяет проводить качественное и количественное выявление индуцирующих воспринимаемость трансплантата клеток моноцитарного происхождения по изобретению в образцах крови и/или ткани пациента in vitro. Данный пациент, например, может представлять собой реципиента, которому необходимо трансплантировать или уже трансплантирован орган. Формирование реакционных комплексов в образце, указывающих на присутствие и, если применимо, количество индуцирующих воспринимаемость трансплантата клеток выявляют известными способами.
Для выявления реакционных комплексов, например, в данном случае, возможно непосредственно связывать ("метить") антитело GM-7 с детектируемой молекулой, например, ковалентно связанной с антителом. В области молекулярной диагностики описаны в большом количестве пригодные детектируемые молекулы и включают в себя, среди других, флуоресцентные красители, такие как флуоресцеинизотиоцианат или тетраметилродамин-5-изотиоцианат, люминесцентные красители, радиоактивно меченные молекулы и ферменты, такие как, пероксидазы (ср. Lottspeich, F., Zorbas, H. "Bioanalytik", Spektrum Akademischer Verlag GmbH, Heidelberg-Berlin, 1998).
Выявление антител проводят в зависимости от предварительно выбранной для мечения молекулы. В контексте настоящего изобретения антитело GM-7 связывали с флуоресцентной молекулой флуоресцеинизотиоцианата (FITC) так, чтобы выявление антитела являлось возможным проводить посредством проточной цитометрии и/или флуоресцентной микроскопии. Способы мечения антител FITC хорошо известны специалисту в данной области, работающему в данной сфере.
Альтернативно, реакционный комплекс можно также выявлять в двустадийном процессе с применением вторичных антител. В данном контексте немеченое антитело GM-7 в реакционном комплексе можно выявлять с применением дополнительного меченого антитела (ср. Lottspeich, F., Zorbas, H. "Bioanalytik", Spektrum Akademischer Verlag GmbH, Heidelberg-Berlin, 1998). Данный двустадийный способ выявления является значительно более чувствительным, чем прямое выявление связывания антитела по изобретению, так как с одним антителом GM-7 могут связываться несколько вторичных антител (усиление сигнала).
Следовательно, антитело GM-7 позволяет выявлять TAIC в периферической крови пациента, обработанного TAIC, например, в форме "мониторинга", в течение которого через конкретные временные интервалы определяют количество клеток в периферической крови. В настоящем изобретении в тестах на животных обнаружено, что присутствие полученных из моноцитов донора TAIC в периферической крови реципиента трансплантата коррелирует с толерантностью к трансплантируемому органу. Следовательно, данное открытие позволяет клиницистам постепенно прекратить или уменьшить дозировки необязательно вводимых иммунодепрессантов. Ранее с клинической точки зрения являлось невозможным предоставить точное доказательство того, проявляет ли иммунная система пациента толерантность в данный момент времени после трансплантации.
Как очевидно специалисту в данной области также возможно получение моноклональных антител к TAIC из моноцитов позвоночных, не являющихся людьми, в частности из моноцитов приматов и свиней, модифицированных по изобретению. В данном отношении иммунизацию соответствующего животного-хозяина и получение соответствующей гибридомной клеточной линии проводят, как описано для TAIC человеческого происхождения. Получение эффективных популяций TAIC других видов представляет собой важный вклад в область медицины ксеногенной трансплантации.
Особенно предпочтительное осуществление изобретения относится к субпопуляции TAIC по изобретению, одновременно экспрессирующей на своей клеточной поверхности антигены CD3 и CD14. Данные клетки далее обозначают как TAICCD3+/CD14+. О таких клетках в данной области до настоящего времени не сообщали. Моноциты и известные происходящие из моноцитов клетки несут поверхностный маркер CD14, однако они в то же время дополнительно не несут поверхностный маркер CD3.
Одновременно экспрессирующие поверхностные антигены CD3 и CD14 TAIC можно или непосредственно выделить из индуцирующих воспринимаемость трансплантата клеток, образуемых на стадии c) указанного выше способа по изобретению, или их можно выделить из клеточной популяции, полученной после выделения клеток из культуральной среды по стадии d) указанного выше способа по изобретению, или, альтернативно, их можно выделить из популяции TAICGM-7.
Кроме того, в настоящем изобретении показано, что TAICCD3+/CD14+ интенсивно экспрессируют гены Foxp3, CTLA4 и ген интегрина αEβ7 (см. пример 12). Напротив, исходные моноциты не экспрессируют данные гены совсем или экспрессируют их в малой степени. Следовательно, стимуляция экспрессии генов Foxp3, CTLA4 и гена интегрина αEβ7 представляет собой характеристику клеток TAICCD3+/CD14+.
Как обсуждается в примере 12, экспрессия маркеров Foxp3, CTLA4 и интегрина αEβ7 ранее описана только для регулирующих T-лимфоцитов. T-лимфоциты, одновременно экспрессирующие поверхностные антигены CD4 и CD25, представляют собой субпопуляцию регуляторных T-лимфоцитов, которые также обозначают как "супрессорные клетки". Их функцией является подавление иммунного ответа в организме. В частности, Foxp3 рассматривают как специфический транскрипционный фактор, служащий в качестве контрольного гена для развития регуляторных T-клеток, и специфически экспрессируемый данными клетками. По изобретению предпочтительно, чтобы клетки TAICCD3+/CD14+ экспрессировали, по меньшей мере, 1×10-9, более предпочтительно - по меньшей мере, 5×10-9, а в особенно предпочтительном способе - по меньшей мере, 1×10-8 мкг РНК Foxp3 на мкг общей РНК.
Подобным образом, CTLA4 рассматривают в качестве маркера для выявления регулирующего действия T-лимфоцитов, в частности, несущих CD4/CD25 T-лимфоцитов (см. литературу, цитируемую в примере 12). По изобретению клетки TAICCD3+/CD14+ предпочтительно должны экспрессировать, по меньшей мере, 5×10-7, более предпочтительно - по меньшей мере, 3×10-6, а в особенно предпочтительном способе - по меньшей мере, 5×10-6 мкг РНК CTLA4 на мкг общей РНК.
Интегрин αEβ7, распознающий эндотелиальный кадгерин, недавно описан Lehmann et al. в PNAS 99, страницы 13031-13036 (2002) в качестве нового маркера субпопуляции высокоэффективных регуляторных T-лимфоцитов, взаимодействующих с эпителиальным окружением. Экспрессия РНК интегрина αEβ7 по изобретению предпочтительно должна составлять в клетках TAICCD3+/CD14+, по меньшей мере, 1×10-12, более предпочтительно - по меньшей мере, 1×10-11, а в особенно предпочтительном способе - по меньшей мере, 1×10-10, а наиболее предпочтительно - по меньшей мере, 5×10-9 мкг РНК на 1 мкг общей РНК.
Как показано в таблице в примере 12, прямое совместное культивирование TAIC по изобретению с лимфоцитами приводит к значительному увеличению количества регуляторных T-лимфоцитов, в частности двойных позитивных по CD4/CD25 клеток в популяции лимфоцитов с сильной положительно регулируемой экспрессией генов Foxp3, CTLA4 и гена интегрина αEβ7. Кроме того, в примере показано, что данный эффект не наблюдают, если TAIC совместно культивируют с лимфоцитами непрямым способом.
Данные результаты означают, что стимуляция формирования и/или размножения регуляторных T-лимфоцитов посредством TAIC вовлечена в индукцию воспринимаемости трансплантата посредством TAIC по изобретению.
В примере 13 подтверждается данное предположение. В данном примере лимфоциты от реципиентных животных из примеров 3, 4, 5, 6 и 7 инкубировали in vitro с TAIC от соответствующих донорных животных. Для индукции толерантности, TAIC, предварительно инкубированные с лимфоцитами от реципиентов, инъецировали животным вместо TAIC. Таким образом, данным способом также можно индуцировать зависящую от донора толерантность, в то же время животные, которым вводили лимфоциты реципиентов, не культивированные совместно с полученными от доноров TAIC, не развивали толерантность.
TAIC по изобретению можно применять в качестве фармацевтического препарата. Клетки, полученные на стадии d) способа по изобретению, описанного выше, можно применять непосредственно. Приблизительно 10-50% общего количества полученных таким образом клеток в популяциях сформировано лимфоцитами и гранулоцитами, происходящими из исходного изолята моноцитов (лейкоцитарная пленка). Данные клетки поддерживают формирование происходящих из моноцитов TAIC на стадии культивирования по изобретению (см. пример 11); они не препятствуют индукции толерантности, если TAIC по изобретению применяют в качестве фармацевтического препарата.
Однако по дополнительным предпочтительным осуществлениям изобретения из общей популяции TAIC, полученной способом по изобретению (см. выше), можно выделить субпопуляции TAICGM-7 и/или TAICCD3+/CD14+ и их можно применять для индукции толерантности.
В культуральной среде (см. пример 2) без потери способности индуцировать толерантность TAIC или TAICGM-7 и/или TAICCD3+/CD14+ могут оставаться, по меньшей мере, 48 часов.
Для применения в качестве фармацевтического препарата TAIC или субпопуляции TAICGM-7 и/или TAICCD3+/CD14+, суспендированные, например, в человеческой сыворотке AB (универсально пригодной для применения), можно вводить внутривенно в качестве кратковременной трансфузии. Для индукции воспринимаемости трансплантата в случае аллогенной трансплантации, полученные из моноцитов донора TAIC или субпопуляции TAICGM-7 и/или TAICCD3+/CD14+ можно инъецировать отличающемуся по MHC реципиенту или до операции или после нее. В случае введения до операции TAIC необходимо инъецировать от одного до трех раз приблизительно за 1 неделю до операции. В случае введения после операции период между операцией и однократным введением клеток должен составлять не более чем 7 суток. Тогда TAIC по изобретению или субпопуляции TAICGM-7 и/или TAICCD3+/CD14+ способны оказывать сопротивление T-клеточному ответу иммунной системы реципиента против трансплантата и находиться в крови реципиента в течение достаточно длительного периода времени, чтобы гарантировать долгов