Способ инвертирующей ортотопической илеоцистопластики при короткой брыжейке подвздошной кишки
Иллюстрации
Показать всеИзобретение относится к области медицины, урологии и может быть использовано для лечения больных после удаления мочевого пузыря. Формируют U-образный ортотопический кишечный резервуар низкого давления из подвздошной кишки. При этом резецируют 55 см подвздошной кишки на расстоянии 20-25 см от илеоцекального угла. Рассекают резецированную подвздошную кишку по противобрыжеечному краю на протяжении 40 см. Приводящий сегмент сохраняют на протяжении 15 см. Детубуляризированную часть складывают симметрично U-образно так, что вершина U направлена каудально и максимально приближена к культе уретры. Сшивают прилежащие края. Совмещают противоположные длинные стороны таким образом, чтобы получить трубчатый резервуар U-образной формы и ушивают его наглухо. Выполняют выворачивание и разворот сформированного резервуара в малом тазу между листками брыжейки. Разворот осуществляют так, чтобы задняя стенка резервуара, свободная от брыжейки, располагалась кпереди и свободное ее низведение в малый таз дополнительно сокращало расстояние до культи уретры на 3-4 см. В нижней точке резервуара накладывают анастомоз с уретрой. Стентированные мочеточники анастомозируют с верхним краем приводящего сегмента по рефлюксной методике. Мочеточниковые стенты выводят через резервуар по уретре наружу. В обратном направлении в полость неоциста устанавливают катетер Foley. Способ прост и надежен; позволяет уменьшить объем хирургической травмы, избежать конверсии с применением более сложных и дорогостоящих методик деривации при короткой брыжейке подвздошной кишки. Способ позволяет также добиться максимального качества жизни больных после цистэктомии, снижения риска развития осложнений за счет низведения нижней точки резервуара в малый таз, создания антирефлюксной защиты. 13 ил.
Реферат
Изобретение относится к области медицины, урологии и может быть использовано для хирургического лечения больных после удаления мочевого пузыря.
До недавнего времени радикальная цистэктомия рассматривалась как инвалидизирующая операция, сопряженная с высокой летальностью, риском развития тяжелых послеоперационных осложнений и последующим непродолжительным прогнозом в отношении жизни больных. Это было обусловлено как несовершенством техники радикальной цистэктомии, так и несовершенством методов послеоперационной деривации мочи. Современная техника цистэктомии и варианты интестиноцистопластики принципиально изменили отношение к радикальной цистэктомии и способствовали ее популяризации. Ортотопическое замещение мочевого пузыря - теперь стандартная форма замены мочевого пузыря после цистэктомии, при отсутствии противопоказаний. Обоснованием к выполнению ортотопической замены мочевого пузыря является простота хирургической техники с низким риском осложнений и хорошими отдаленными функциональными результатами. Основная цель создания ортотопических резервуаров - медицинская и социальная реабилитация больных, подвергнутых удалению мочевого пузыря. Основными условиями для реабилитации данной категории пациентов являются:
- создание ортотопического резервуара с достаточной емкостью и низким давлением в нем;
- защита верхних мочевых путей адекватным антирефлюксным механизмом.
Для этих целей чаще всего используются сегменты подвздошной кишки, восходящей, поперечной и нисходящей толстой кишок, сочетание этих сегментов, реже - стенка желудка.
Современным условием полноценной социальной и психологической реабилитации пациентов следует считать восстановление самостоятельного мочеиспускания. В середине 90-х годов ортотопическое замещение мочевого пузыря в большинстве медицинских центров стало стандартным методом отведения мочи, а у 90% больных используется для отведения мочи ортотопический мочевой пузырь из подвздошной кишки (J.F.Moutie 1997 г., R.Е.Studer et al 1998 г., R.E.Hautmann et al 1999, 2001 г.г.). В патентной и научно-медицинской литературе описано достаточно большое разнообразие методов замещения мочевого пузыря после радикальной цистэктомии.
Известен способ пластики мочевого пузыря свободным кожно-мышечным лоскутом на сосудистой ножке (Патент РФ №2161448, 2001.01.10), включающий выполнение цистэктомии, выделение двух свободных кожно-мышечных лоскутов на сосудистой ножке, формирование артифициального пузыря из кожно-мышечного лоскута, наложение уретронео- и уретеронеоцистоанастомозов. Способ отличается тем, что выделение двух свободных кожно-мышечных лоскутов осуществляют в торакодорзальной области справа или слева на единой сосудистой ножке, состоящей из частей дорзальной артерии и вены грудной клетки, причем основной кожно-мышечный лоскут имеет форму клеверного листка, а дополнительный имеет вытянутую эллипсовидную форму. В пределах доступа выделяют части артерии и вены нижних надчревных сосудов, после чего выполняют сосудистые анастомозы с частями дорзальной артерии и вены грудной клетки, выполняют анастомоз верхнего лепестка основного кожно-мышечного лоскута с задней уретрой на предварительно установленном в уретру катетере Фоли. В полость формируемого мочевого пузыря через стенку лоскута проводят мочеточники с интубационными трубками, мочеточники фиксируют к наружной и внутренней стенке формируемого пузыря, затем края лепестков основного лоскута сшивают для получения полости правильных размеров. Из образовавшегося резервуара наружу выводят обе мочеточниковые интубационные трубки, в полость вновь образованного мочевого пузыря устанавливают дренажную трубку и рану в надлобковой области ушивают с оставлением дренажа и выведением на переднюю брюшную стенку дополнительного кожно-мышечного лоскута наружной поверхностью для возможности контроля в последующем состоянии сформированного артифициального пузыря. При этом осуществляют забор в торакодорзальной области основного кожно-мышечного лоскута размерами 30×20 см и дополнительного - 15×4 см.
Описанный способ цистопластики имеет ряд недостатков. Забор кожно-мышечных лоскутов из торако-дорзальной области значительно увеличивает как время операции, так и ее травматичность. Это значительно удлиняет период медицинской и социальной реабилитации пациентов. Формируемый неоцист в сравнении со стенкой кишки имеет недостаточную растяжимость, что обусловливает неадекватность накопительной и эвакуаторной функций неоциста в отдаленном периоде.
Один из немаловажных недостатков - операция технически сложна, является весьма дорогостоящей, требует применения микрохирургической техники, длительной анестезии с изменением положения пациента в ходе операции из положения на спине в положение для торакотомии и обратно. Наличие выводимых через стенку неоциста мочеточниковых дренажей и дополнительного дренажа обусловливает необходимость их последующего удаления при дополнительной госпитализации. Таким образом, в настоящее время описанный способ цистопластики не соответствует в полной мере задачам социальной и медицинской реабилитации пациентов после перенесенной радикальной цистэктомии.
Известен способ формирования мочевого резервуара (Патент РФ №2195881, 2003.01.10), заключающийся в мобилизации петли тонкой кишки с последующим вшиванием в нее интубированных катетерами мочеточников и формированием подвесной энтеростомы, отличающийся тем, что проводят левый мочеточник через брыжейку сигмовидной кишки, сшивают медиальные стенки дистальных концов мочеточников между собой на протяжении 3-4 см отдельными швами, проводят катетеры через тонкую кишку, отдельными швами, циркулярно сшивают мочеточники с проксимальным краем тонкой кишки, подтягивая за катетеры, погружают линию швов в тонкую кишку на 3-4 см, накладывают второй ряд швов между стенкой мочеточников и стенкой тонкой кишки, сшивают отдельными серозно-мышечными швами стенки тонкой кишки между мочеточниками, фиксируют тонкую кишку к тканям забрюшинного пространства и к брыжейке сигмовидной кишки отдельными швами.
Описанный способ является аналогом метода кондуитного отведения мочи на переднюю брюшную стенку, предложенного Бриккером в 1950 году. Как и ранее выполняемые кондуитные методики, описанный способ не приводит к восстановлению самостоятельного мочеиспускания. Моча постоянно изливается на кожу передней брюшной стенки через сформированную подвесную энтеростому. Пациент вынужден постоянно пользоваться накожными мочеприемниками. Это ведет к резкому ухудшению качества жизни пациентов в сравнении с ортотопической реконструкцией, не решает в полной мере задач социальной и медицинской реабилитации пациентов перенесших цистэктомию.
Известен способ ортотопической кишечной пластики мочевого пузыря (Патент №2279254, 2006.07.10), включающий формирование U-образного кишечного резервуара низкого давления из трансплантата терминального отдела подвздошной кишки и канала для отведения мочи, отличающийся тем, что для формирования резервуара кишечный трансплантат рассекают по противобрыжеечному краю, получая прямоугольник, имеющий два коротких и два длинных плеча. На одном из длинных плечей посередине выделяют точку, вокруг которой длинное плечо перегибают, края совмещают и со стороны слизистой непрерывным сквозным, обвивным швом ушивают. Далее совмещают противоположные длинные стороны так, что получают трубчатый резервуар U-образной формы, сопоставляют и ушивают на протяжении 4-5 см края колен трансплантата, анастомозируют мочеточники с формируемым резервуаром с антирефлюксной защитой на мочеточниковых наружных стентах, затем формируют уретральную трубку, для чего перемещают в сторону уретры нижнюю губу трансплантата, соединяют верхнюю губу и две точки нижней губы трансплантата треугольным швом так, что образуется лоскут, посредством сшивания краев которого однорядным узловым швом образуют уретральную трубку длиной 5 см. Затем слизистую дистального конца трубки выворачивают наружу и фиксируют отдельными швами к серозной оболочке трансплантата. Через уретру и сформированную уретральную трубку в трансплантат проводят трехходовой катетер Фоли, в обратном направлении выводят наружные мочеточниковые стенты, анастомозируют уретральную трубку с уретрой 6-ю лигатурами на 2; 4; 6; 8; 10 и 12 часах условного циферблата. Сопоставляют края трансплантата до треугольного шва, учитывая, что нижняя губа оказывается короче верхней, сопоставление производят узловыми адаптирующими L-образными швами и затем фиксируют переднюю стенку кишечного резервуара к культям лонно-пузырных, лонно-простатических связок или к надкостнице лонных костей.
Недостатком данного метода является необходимость выполнения достаточно сложной технически реконструкции с необходимостью формирования на концах U-образного резервуара поочередно двух уретерорезервуароанастомозов по антирефлюксной методике, с последующим этапом формирования уретральной трубки, что значительно увеличивает время выполнения операции. Кроме того, предлагаемый вариант формирования «уретральной трубки», по сути, создает лучшие условия для наложения швов при анастомозе с уретрой. Однако это не уменьшает степени натяжения тканей в анастомозе, а необходимость наложения множественных швов в этой зоне потенциально чревато ишемизацией тканей в анастомозе, что увеличивает риск несостоятельности и последующей обструкции, что продемонстрировано самими авторами в клинических наблюдениях.
Известен способ гетеротопической кишечной пластики мочевого пузыря (Патент РФ №2286098, 2006.10.27), включающий радикальную цистэктомию и лимфаденэктомию, мобилизацию подвздошной кишки с последующим формированием из нее мочевого резервуара, механизма отведения мочи и моделирования накожной стомы, причем для формирования мочевого резервуара мобилизуют подвздошную кишку на протяжении 55-60 см, отступя на 20 см от илеоцекального угла, формируют межкишечный анастомоз, затем выполняют детубуляризацию 50 см участка трансплантата, поворачивают его на 180° вокруг брыжейки таким образом, чтобы детубуляризированный участок располагался в сторону правой подвздошной области. Затем детубуляризованный участок подвергают вначале продольной, затем поперечной реконфигурации, формируя при этом резервуар низкого давления, мочеточники анастомозируют с резервуаром по его задней стенке на моделирующих катетерах по методике Несбит. Оставшуюся часть трансплантата суживают путем наложения шва Ламбера на расстоянии 0,5 см друг от друга, после чего моделирующие катетеры и сформированную трубку для отведения мочи выводят через отдельный разрез передней брюшной стенки, после формирования стомы место выхода катетеров отграничивают от брюшной полости несколькими швами между передней стенкой резервуара и париетальной брюшиной передней брюшной стенки.
Однако данный метод применим лишь для гетеротопической деривации мочи, что в сравнении с ортотопической реконструкцией, на сегодняшний день, не соответствует принципу максимального обеспечения качества жизни пациента. Больной вынужден постоянно пользоваться катетером для эвакуации мочи. Это резко понижает качество психосоциальной реабилитации пациентов ввиду сниженной самооценки и нарушенной социальной адаптации.
Описан способ гетеротопической кишечной пластики мочевого пузыря (www. UroBel.UroWeb.ru, 20.07.2007 г., С.А.Красный, О.Г.Суконко, С.Л.Поляков, А.Н.Волков Первый опыт применения нового метода формирования континентного гетеротопического резервуара после цистэктомии).
Согласно данному способу на первом этапе производится радикальная цистэктомия с тазовой лимфодиссекцией, при поражении мочеиспускательного канала производится уретрэктомия.
Для формирования резервуара используется изолированный сегмент подвздошной кишки 60-65 см. Во избежание последующих серьезных нарушений пищеварения и обмена веществ сохраняется терминальный отдел тонкого кишечника (20-25 см). Отступя 20-25 см от илеоцекального угла рассекается брыжейка тонкой кишки на протяжении 10-15 см с сохранением A. Ileocolica. Проксимальный разрез брыжейки более короткий (5-8 см), так, чтобы оставить интактными минимум 2 сосудистые аркады, питающие изолированный сегмент кишки. С целью облегчения обнаружения кишечных сосудов используется проходящий боковой свет.
По линии разрезов брыжейки между мягкими кишечными жомами или с использованием сшивающих аппаратов рассекается тонкая кишка. Непрерывность кишечника восстанавливается наложением тонко-тонкокишечного анастомоза по типу "конец-в-конец", для чего используется одно- или двухрядный шов нитями Vicryl или Polysorb 3-0 или 4-0, может применяться также аппаратный шов. Отверстие в брыжейке ушивается с обеих сторон. Изолированный участок тонкой кишки отмывается от содержимого, после чего производится операция формирования резервуара.
Изолированный сегмент кишки на брыжейке рассекается вдоль по противобрыжеечному краю с оставлением неизмененными концевыми отрезками (по 10 см длиной). Детубуляризированный (рассеченный) сегмент кишки укладывается в виде буквы W, прилежащие края разрезов сшиваются между собой непрерывными обвивными швами с перехлестом нитью Vicryl или Polysorb 3-0. Затем ушивается передняя стенка резервуара. Мочеточники анастомозируются с дистальным концом изолированной кишки, проксимальный конец используется для формирования клапана и стомы.
Применение указанной методики, такой же как описана выше, не приводит к восстановлению самостоятельного мочеиспускания.
В наибольшей степени близки к заявляемому способу инвертирующей ортотопической илеоцистопластики ортотопические илеоцистопластики по Camey II, Hemi-Kock и по методике Studer.
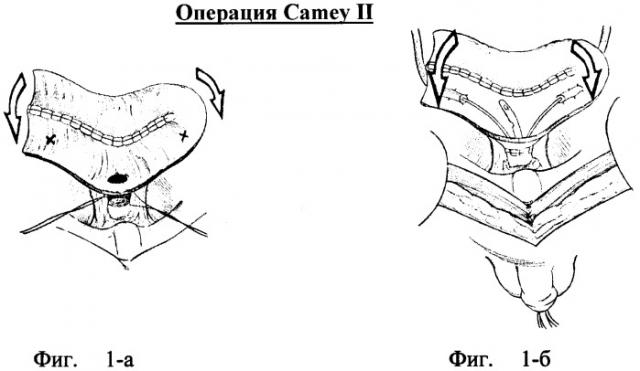
Ортотопическая илеоцистопластика по «Camey II»
Первоначально удержание мочи и функция мочеиспускания при этой операции были проблематичны: от 20 до 80% пациентов имели дневное и от 20 до 100% - ночное недержание - неудержание мочи (Roehrbom CG, Teigland CM, Sagalowsky AI. Functional characteristics of the Camey ileal bladder. J Urol 1987; 138: 739-42). Верхние мочевые пути оставались интактными у 95% пациентов, а рефлюкс отсутствовал у 85% больных.
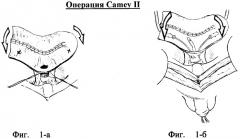
Важной последующей модификацией в операции «Camey II» была детубуляризация и реконфигурация кишечного сегмента, что привело к снижению перистальтической сократимости стенок резервуара и снижению давления в его просвете. Для этого по противобрыжеечному краю подвздошный сегмент (длиной 65 см) рассекался и складывался U-образно. Внутренние края сшивались между собой. Мочеточники имплантировались в края резервуара (у вершины и снования U) по методике Le Duc-Camey (Le Due A, Camey M, Teillac P. An original antireflux ureteroileal implantation technique: long-term follow up.J Urol 1987; 137: 1156-8). Самая нижняя точка средней части подвздошного сегмента анастомозировалась с уретрой (фиг.№1-а - подвздошная кишка сложена U-образно, задняя стенка ушита непрерывным обвивным швом через все слои, посередине длинного плеча сформировано отверстие для анастомоза с уретрой; метками обозначены места будущей имплантации мочеточников;
Фиг.№1-б - мочеточники имплантированы в стенку резервуара по методике Le Due, завершено формирование уретро-резервуароанастомоза; стрелками указано направление завершающего складывания стенок резервуара перед его окончательным ушиванием).
Дневное удержание мочи после данной операции составляет 96% и только 22% пациентов имеют ночное недержание (Camey M, Botto H, Richard Е. Complications of the Camey procedure. Urol Clin North Am. 1988; 15: 249-55.; Ramon J, Leandri P, Rossignol G, Botto H. Orthotopic bladder replacement using ileum: techniques and results. In Webster GD, Kirby R, King LR, Goldwasser В (eds). Reconstructive Urology. Oxford: Blackwell Scientific Publications, 1993; 445-57.). Адекватный контроль над мочеиспусканием достигается в сроки 4-6 месяцев. Частота рефлюкса в верхние мочевые пути примерно одинаковы.
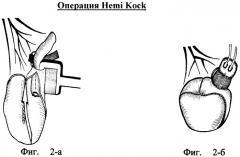
Ортотопическая илеоцистопластика по Hemi-Kock
Ортотопический резервуар Kock(a) называют операцией «Hemi-Kock pouch», которая является модификацией оригинального континентного резервуара с кожной стомой по Kock(y), имеющего приводящий и отводящий инвагинационные клапаны (Skinner DG, Lieskovsky G, Boyd S. Continent urinary diversion. J Urol 1989; 141: 1323-7.; Kock NG, Ghoneim MA, Lycke KG, Mahran MR. Replacement of the bladder by the urethral Kock pouch: functional results, urodynamics and radiological features. J Urol 1989; 141: 1111-16.). При ортотопической пластике по Kock(y) с анастомозом к уретре отпала необходимость в отводящем клапане. Единственный приводящий инвагинационный клапан действует как механизм антирефлюксной защиты верхних мочевых путей.
Для ортотопического неоциста Kock резецируют 60 см подвздошной кишки. Проксимальные 16 см используют для типичного формирования инвагинационного клапана. Дистальные 44 см вскрывают по противобрыжеечному краю, укладывают U-образно и сшивают прилежащие края, формируя заднюю стенку резервуара. Затем дистальный край подвздошной пластины сворачивают на себя и кверху. Дистальный край по линии шва в самой нижней точке резервуара оставляют открытым для наложения анастомоза с уретрой. Мочеточники анастомозируют с приводящей петлей выше инвагинационного клапана по рефлюксной методике (фиг.№2-а - окончательная фиксация инвагинационного клапана к стенке резервуара путем прошивания аппаратом ТА-55; проленовая сетка для последующей стабилизации клапана продета в сформированное брыжеечное окно Deaver(a); стрелкой указано направление поперечного складывания резервуара перед его окончательным ушиванием;
Фиг.№2-б - окончательный вид резервуара Hemi Kock: мочеточники имплантированы в приводящий тубулярный сегмент выше уровня инвагинационного клапана; клапан стабилизирован с помощью циркулярно фиксированной проленовой сетки; резервуар окончательно ушит в поперечном направлении.
Недостатками этой операции являются необходимость отделения брыжейки от стенки кишки на протяжении 7 см, использование синтетического материала и сшивающих аппаратов при формировании клапана, что может нарушать питание кишки с последующим нарушением удерживающего механизма. Для формирования одного клапана используется сшивающий аппарат с четырьмя кассетами. Миграция металлических скрепок в просвет резервуара может приводить к образованию конкрементов.
Количество ранних и поздних п/операционных осложнений - 12 и 24% соответственно. Как и для других методик ортотопических илеоцистопластик, характерными осложнениями являются несостоятельность резервуаров и резервуаро-уретральных анастомозов, пиелонефрит и стриктура резервуаро-уретрального анастомоза. Поздние осложнения в операции Hemi-Kock связаны в основном с приводящим инвагинационным клапаном. По данным Skinner D.J. у 4,1% больных из 295 сформировались камни в неоцисте, в то время как 2,4% имели стеноз приводящего клапана. Дезинвагинация клапана приводит к рефлюксу в верхние мочевые пути и удлинению приводящего сегмента кишки.
Ночное удержание было достигнуто у 75-86% пациентов. Рефлюкс отмечается у 17% пациентов.
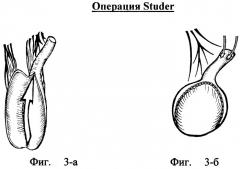
Ортотопическая илеоцистопластика по Studer
В 1988 году Studer предложил ортотопическое замещение мочевого пузыря тонкокишечным резервуаром низкого давления, который является упрощенным вариантом ортотопической цистопластики по Hemi Kock (Studer UE, Ackermann D, Casanova GA, Zingg EJ. Three years' experience with an ileal low pressure bladder substitute. Br J Urol 1989; 63: 43-52; Studer UE, Danuser H, Thalmann GN, Springer J, Turner H. Antireflux nipples or afferent tubular segments in 70 patients with ileal low pressure bladder substitutes: Long term results of a prospective randomized trial. J Urol 1996; 156: 1913-17.). Суть принципиального отличия состоит в том, что не формируется инвагинационный клапан Kock(a) в приводящем тонкокишечном сегменте неоциста. Новизна обусловлена тем, что инвагинационный клапан Kock(a) заменен на недетубуляризированный приводящий подвздошный сегмент длиной 20 см, который предотвращает рефлюкс в верхние мочевые пути.
Методика выполнения операции по Studer
После цистэктомии выполняется типичная резекция подвздошной кишки длиной 60-65 см, отступя 20-25 см от илеоцекального угла. Осуществляют рассечение брыжейки у дистальной и проксимальной границ резекции электроножом в бессосудистых промежутках от края подвздошной кишки в направлении корня брыжейки, на 1/2-2/3 этого расстояния (в зависимости от длины и мобильности брыжейки). Восстанавливают целостность ЖКТ путем наложения концевого двухрядного тонко-тонкокишечного анастомоза. Ушивают проксимальный конец резецированного сегмента подвздошной кишки наглухо.
Осуществляют рассечение кишечного сегмента со стороны дистального конца по противобрыжеечному краю на протяжении 40-45 см с сохранением тубулярной структуры проксимального сегмента - 20 см. Осуществляют симметричное U-образное складывание детубуляризированной части кишки (вершина U направлена каудально) с ушиванием задней стенки резервуара (однорядный обвивной непрерывный серозно-мышечно-подслизистый шов). Складывают в поперечном направлении U-образно сформированную заднюю стенку резервуара (дистальный край подвздошной пластины сворачивают на себя и кверху) и ушивают переднюю стенку резервуара однорядным непрерывным обвивным серозно-мышечно-подслизистым швом (фиг.№3-а - детубуляризированная часть подвздошной кишки сложена U-образно, приводящий сегмент длиной 20 см сохранен для использования в качестве антирефлюксного механизма; стрелкой указано направление поперечного складывания резервуара перед окончательным его ушиванием.
Фиг.№3-б - окончательный вид резервуара Studer: мочеточники имплантированы в приводящий тубулярный сегмент; резервуар окончательно ушит в поперечном направлении. Осуществляют низведение резервуара в малый таз и ротацию его таким образом, чтобы приводящее колено достигло забрюшинного пространства справа, а положение нижней стенки резервуара, прилежащего к уретре, обеспечивало выполнение уретро-подвздошного анастомоза без натяжения.
Проведение стентированных мочеточников в брюшную полость на уровне проксимального конца приводящего сегмента и выполнение анастомозов с приводящим кишечным сегментом конец-в-бок без антирефлюксной защиты.
Мочеточниковые дренажи вводят через приводящий кишечный сегмент в просвет резервуара и далее выводят через переднюю стенку резервуара на переднюю брюшную стенку. Выполнение в стенке кишки, прилежащей к уретре, отверстия, пропускающего кончик указательного пальца, для наложения анастомоза с уретрой. Выполняется анастомоз с уретрой. Введение в полость неоциста по уретре катетера Foley Ch №22. Дополнительно в полость неоциста устанавливается резервуаростома, которая выводится вместе с мочеточниковыми катетерами на заключительном этапе операции на переднюю брюшную стенку.
Через 1 год после операции дневное удержание - 92%, через 2 года ночное удержание - 80%. Метод лишен риска камнеобразования на сшивающих скобках, поскольку не формируется тонкокишечный инвагинат как при операции Hemi-Kock.
В настоящее время стало возможным и чрезвычайно важным выбрать именно тот метод деривации мочи, который позволит выполнить операцию с наименьшим числом как ближайших, так и отдаленных осложнений и обеспечит наилучшее качество жизни больного после операции (Hautmann R.E. Urinary diversion: ileal conduit to neobladder // J. Urol. - Vol.169, 2003. - P. 834-842). Следует отметить, что за последнее десятилетие предпочтения в выборе варианта ортотопической илеоцистопластики большинство хирургов отдают операции по Studer и популярность ее продолжает расти. Однако результаты этой методики значительно ухудшаются, если интраоперационно выявляется наличие короткой брыжейки тонкой кишки, которая обусловливает натяжение тканей по линии уретро-кишечного анастомоза. Такая ситуация по-прежнему является противопоказанием к операции по Studer, что вынуждает хирурга прибегать к альтернативным вариантам цистопластики.
Т.о., к одному из недостатков тонкой кишки относят ограниченные возможности применительно к ортотопической пластике ввиду того, что у ряда пациентов оказываются короткими сосуды брыжейки для беспрепятственного низведения сегмента подвздошной кишки в малый таз и наложения анастомоза между кишечным мочевым пузырем и уретрой без натяжения (Zinman L.N., Ill W. Bihrle // Bladder Reconstruction and Continent Urinary Diversion / Eds L.R. King, A.R. Stone, G.D. Webster - 2nd Ed. - St. Louis, 1991. - P. 68-87.).
Для решения этой же проблемы при ортотопической илеоцистопластике другими авторами предлагается дополнительное формирование из стенки резервуара «уретральной трубки» (способ ортотопической кишечной пластики мочевого пузыря по патенту РФ №2279254, 11.10.2004). Таким образом, возникающее по причине недостаточной длины брыжейки тонкой кишки даже минимальное натяжение в зоне анастомоза между кишечным резервуаром и уретрой остается серьезной проблемой и является основной причиной несостоятельности анастомоза с формированием мочевых затеков, перитонита, сепсиса, кишечной непроходимости, мочевых свищей с необходимостью повторных операций, повышенным риском летальности. Это заставляет хирурга, в случае имеющегося натяжения в анастомозе, менять интраоперационно план операции, отказываться от ортотопической реконструкции, выполнять дополнительные резекции кишечника, использовать дополнительные сшивающие аппараты, прибегать к другим, более сложным вариантам деривации мочи (гетеротопической, кондуитной, отведение в непрерывный кишечник и др.), которые оказываются заведомо хуже в сравнении с ортотопической деривацией. Это неоправданно затягивает время операции, увеличивает ее стоимость, увеличивает объем хирургической травмы, п/операционный к/день, риск осложнений и летальности.
Вышеперечисленные недостатки устраняются в заявляемом изобретении.
Непосредственным прототипом предлагаемой операции мы считаем операцию по Studer. Мы усовершенствовали ее для случаев, когда интраоперационно выявляется недостаточная длина брыжейки подвздошной кишки для беспрепятственного низведения ее в малый таз и наложения резервуаро-уретрального анастомоза без натяжения.
Задачей изобретения является создание простого, не требующего дополнительных затрат, не увеличивающего времени операции и объема хирургической травмы метода, позволяющего безопасно выполнить ортотопическую тонкокишечную реконструкцию мочевого пузыря, как наиболее предпочтительную, в условиях недостаточной длины брыжейки тонкой кишки.
Поставленная задача решается тем, что способ инвертирующей ортотопической илеоцистопластики при недостаточной длине сосудов брыжейки тонкой кишки, после выполнения цистэктомии, включает типичную резекцию подвздошной кишки 55 см на расстоянии 20-25 см от илеоцекального угла, рассечение ее по противобрыжеечному краю на протяжении 40 см, приводящий сегмент сохраняют на протяжении 15 см, восстановление целостности ЖКТ путем наложения (ручного или аппаратного) межкишечного анастомоза, формирование артифициального ортотопического резервуара низкого давления, наложение уретеронео- и уретроцистонеоанастомозов, кроме того, для этого выполняют продольную U-образную детубуляризирующую илеоцистопластику с продольным сшиванием стенок резервуара и сохранением тубулярного приводящего сегмента, при этом детубуляризированную часть складывают симметрично U-образно так, что вершина U направлена каудально, с последующим инвертирующим позиционированием резервуара в малом тазу, которое обеспечивает максимальное приближение стенки резервуара к культе уретры, наложением уретро-резервуарного анастомоза без натяжения.
Новый технический результат - снижение риска осложнений, повышение качества жизни пациентов за счет более выраженного (в сравнении с аналогичными методиками) низведения нижней точки резервуара в малый таз и обеспечения беспрепятственного наложения уретро-резервуарного анастомоза. Кроме этого, обеспечивается антирефлюксная защита. Операция не требует выполнения дополнительных сложных, более трудоемких, более длительных, с избыточной хирургической травмой реконструктивных приемов (дополнительная резекция тонкой кишки, дополнительная мобилизация брыжеек с риском нарушения адекватного кровоснабжения, формирование специальных «уретральных трубок» из стенки резервуара и т.п.). Таким образом не увеличивается время операции и объем хирургической травмы.
Предлагаемая методика не требует дополнительных затрат на сшивающие аппараты, шовный материал, инструменты, длительное анестезиологическое пособие и т.п., т.е. операция не ведет к увеличению себестоимости хирургического лечения.
Операция предполагает минимальную по протяженности резекцию тонкой кишки (не более 55 см).
Заявляемая методика позволяет хирургу не менять вынужденно план операции и способ кишечной пластики мочевого пузыря, а следовательно, позволяет предотвратить неоправданно высокие дополнительные затраты на ее выполнение. Таким образом операция не только не ведет к увеличению себестоимости хирургического лечения, но и значительно его удешевляет при наличии коротких сосудов брыжейки подвздошной кишки, позволяя избежать конверсии.
Операция предполагает исключительно трансуретральное дренирование неоциста. В отличие от аналогичных операций с установкой цистостомического дренажа, больной избавлен от необходимости повторной госпитализации для его удаления, что исключает дополнительные затраты на реабилитацию пациента и максимально сокращает сроки самой реабилитации
Операция позволяет восстановить самостоятельное мочеиспускание в максимально ранние сроки, что является чрезвычайно важным для последующего увеличения емкости ортотопического неоциста.
Существенное отличие заявляемого метода от прототипа состоит в том, что предотвращение натяжения тканей в зоне резервуаро-уретрального анастомоза достигается путем продольного, а не поперечного сшивания резервуара и его инвертирующего позиционирования в малом тазу для максимального приближения стенки резервуара к культе уретры и наложения уретро-резервуарного анастомоза без натяжения. Предлагаемая операция позволит не отказываться от самого эффективного варианта цистопластики - ортотопического по причине недостаточной длины брыжейки тонкой кишки.
Способ осуществляют следующим образом:
До этапа ушивания резервуара методика принципиально не отличается от операции по Studer за исключением некоторых моментов:
- резецируют не 60-65 см подвздошной кишки, а 55 см.
- детубуляризацию дистального конца резецированного сегмента выполняют на протяжении 40 см, а проксимальный тубулярный конец сохраняют на протяжении 15 см, а не 20 см.
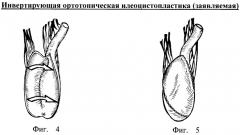
Детубуляризированную часть кишечного трансплантата складывают симметрично U-образно (вершина U направлена каудально), прилежащие края сшивают однорядным обвивным непрерывным швом через все слои со стороны слизистой (Полисорб 3/0), формируя заднюю стенку резервуара. Затем резервуар складывают не в поперечном, а в продольном направлении путем совмещения противоположных длинных сторон так, что получают трубчатый резервуар U-образной формы (фиг.№4 - детубуляризированная часть подвздошной кишки сложена U-образно, приводящий сегмент длиной 15 см сохранен для использования в качестве антирефлюксного механизма; стрелками указано направление продольного складывания резервуара перед окончательным его ушиванием), который ушивают наглухо однорядным обвивным непрерывным серозно-мышечно-подслизистым швом со стороны серозной оболочки кишки (фиг.№5 - вид резервуара после окончательного его ушивания в продольном направлении). Продольное сшивание U-образного резервуара обеспечивает более близкое прилежание нижней точки резервуара к культе уретры (на 3-4 см) в сравнении с поперечным складыванием при методике Studer. Однако в большинстве случаев, при короткой брыжейке, это не обеспечивает отсутствие натяжения в анастомозе с уретрой. Для еще большего низведения нижней стенки резервуара в малый таз выполняют инвертирующее позиционирование сформированного резервуара в малом тазу. Для этого осуществляют «выворачивание» сформированного U-образного резервуара между листками брыжейки кверху, начиная от вершины «U» (фиг.№6 - начало инвертирующего позиционирования сформированного резервуара в малом тазу путем «выворачивания» между листками брыжейки кверху, начиная от вершины «U»). После завершения полного выворачивающего позиционирования (фиг.№7 - продолжение «выворачивания» между листками брыжейки, стрелкой указано направление продолжения инвертирующего движения) и ротации резервуара вместе с приводящим тубуляризированным сегментом (фиг.№8 - завершающий этап инвертирующего позиционирования резервуара: происходит ротация резервуара вместе с приводящим тубуляризированным сегментом (указано стрелками), задняя стенка резервуара, свободная от брыжейки, оказывается расположенной кпереди и еще более свободно низводится в малый таз, сокращая расстояние до культи уретры еще на 3-4 см (фиг.№9 - вид резервуара после завершения инвертирующего позиционирования: задняя стенка резервуара, свободная от брыжейки, расположена кпереди и свободно низводится в малый таз; в самой нижней точке резервуара, прилежащей к уретре, сформировано отверстие, пропускающее кончик указательного пальца). При этом не происходит перегиба брыжейки, она свободно ретируется под резервуаром. А сам резервуар не оказывается «перетянутым» сосудами брыжейки в сагиттальной плоскости как при поперечном его складывании. Этот момент является весьма важным для последующего беспрепятственного расправления резервуара (увеличения его емкости) в послеоперационном периоде.
Далее в самой нижней точке резервуара, прилежащей к уретре, формируют отверстие, пропускающее кончик указательного пальца, накладывают анастомоз с уретрой узловыми швами через все слои, Полисорб 2/0, на 2, 4, 6, 8, 10 и 12 часах условного циферблата. По уретре в полость неоциста устанавливают катетер Foley Ch №20-22. Стентированные мочеточники проводят забрюшинно и через разрез париетальной брюшины вводят в брюшную полость на уровне верхнего края приводящего тубуляризированного сегмента. По методике Wallace (анастомоз Y-типа) мочеточники анастомозируют с открытым концом кишки приводящего сегмента резервуара. До полного ушивания анастомоза мочеточниковые стенты выводят по уретре наружу.
1. Для этого к концу катетера Foley Сп№20-22, введенного по уретре в кишечный неоцист и проведенный через приводящий кишечный сегмент, фиксируют мочеточниковые дренажи Ch №6-7 (таким образом, что концы их оказываются введенными в просвет катетера Foley, что предотвращает травму резервуара и зоны уретро-резервуароанастомоза при проведении) и временный проводник (полихлорвиниловая трубка Ch №7), которые выводят наружу по уретре вслед за извлекаемым катетером Foley.
2. Мочеточниковые дренажи отсоединяют от катетера Foley и удерживают, а катетер Foley проводят по уретре в резервуар в обратном направлении путем тракции за временный проводник. Временный проводник удаляют, баллон катетера Foley раздувают на 10,0-15,0 мл, под визуальным и мануальным контролем окончательно позиционируют дренажи в резервуаре.
3. К катетеру Foley у меатуса фиксируют мочеточниковые стенты.
4. Катетер Foley фиксируют к уздечке penis (либо к большой половой губе) (Перепечай В.А. Обоснование ортотопической сигмоцистопластики для восстановления мочевого пузыря: Дис… канд. мед. наук. - Ростов-на-Дону, 2000.; Коган М.И., Перепечай В.А. Современная диагностика и хирургия рака мочевого пузыря. - Ростов-н/Д, 2002. - 242 с.). Окончательно ушивают мочеточниково-резервуарный анастомоз.
5. Дополнительный цистостомический дренаж не устанавливают. Таким образом резервуар ушивается наглухо и дренируется исключительно трансуретрально (фиг.№10 - окончательный вид завершенной инвертирующей ортотопической илеоцистопластики: выполнен анастомоз с уретрой; по уретре в полость неоциста установлен катетер Foley; мочеточники анастомозированы с приводящим сегментом по методике Wallace (анастомоз Y-типа); мочеточниковые стенты выведены по уретре), что максимально сокращает сроки восстановления самостоятельного мочеиспускания в п/операционном периоде.
В послеоперационном периоде выполняют отмывание слизи по катетеру Foley - 3 р/сутки. Мочеточниковые дренажи удаляют на 8-12 сутки. На 10-14 сутки удаляют уретральный катетер, восстанавливается самостоятельное мочеиспускание, после чего через сутки - двое больных выписываются из стационара.
Работоспособность заявляемого способа подтверждается клиническими примерами.
Пример 1.
Больной П-ин, 38 л