Способ функциональной реабилитации больных, перенесших операции по поводу местнораспространенных опухолей дна полости рта и нижней челюсти
Иллюстрации
Показать всеИзобретение относится к стоматологии и может быть применимо для функциональной реабилитации больных, перенесших операции по поводу местнораспространенных опухолей дна полости рта и нижней челюсти при поэтапном проведении лечения. При определении границ будущей резекции челюсти на гипсовой модели находят точки, идентичные точкам, для которых рассчитывалось с помощью компьютерного моделирования смещение поверхности на трехмерной модели «3D-модели». Производят засверловку гипсовой модели в найденных точках строго перпендикулярно поверхности. Обтачивают поверхность гипсовой модели челюсти в соответствии с распечатками трехмерной модели «3D-модели», подготавливая ложе для будущего иммедиат-протеза. Изготавливают иммедиат-протез. Размещают его на протезное поле для формирования оптимального протезного ложа непосредственно после операции в течение 14-21 дня. Способ позволяет уменьшить риск рецидива опухоли, сократить срок реабилитации. 21 ил.
Реферат
Изобретение относится к медицине, в частности к онкологии и стоматологии, и может быть использовано для функциональной реабилитации больных с местнораспространенными формами рака нижней челюсти и дна полости рта.
Данные литературы говорят о целесообразности раннего изготовления замещающих протезов после резекции челюстей с целью предотвращения грубых необратимых рубцовых изменений, которые значительно затрудняют послеоперационное протезирование (Могилевский В.В., 1997 г.) (см. журнал «Маэстро стоматологии» №4 2002 г. стр.4-7).
Известны способы лечения больных с местно распространенными формами рака нижней челюсти с помощью различных металлических конструкций, замещающий удаленный фрагмент челюсти. Но, как правило, они малоэффективны в связи с развитием остеомиелита и отторжением имплантата.
Результаты отсроченной костной пластики нижней челюсти также не всегда удовлетворяют, так как приводят к удлинению сроков реабилитации до 1,5-2 лет. Хороший эстетический эффект при этом не обеспечивает восстановления полноценного жевания в связи с невозможностью создания «удобного протеза» (Пачес А.И., 1988 г). (См., книгу автора Е.Н.Жулева: «Частичные съемные протезы», Н.Новгород: НГМА стр.26-27.)
Использование костно-кожного трансплантата с применением микрососудистой техники для реконструкции нижней челюсти после ее резекции достаточно сложно, требует дорогостоящего оборудования, дальнейшего изучения и доработки.
Наиболее близким способом функциональной реабилитации больных, перенесших операции по поводу местнораспространенных опухолей дна полости рта и нижней челюсти, является метод лечения путем изготовления постоянного зубного протеза с установкой на протезное ложе с грубыми рубцовыми изменениями (см., книгу авторов Г.И.Оскольского с соавторами «Челюстно-лицевая ортопедия», Хабаровск 2001 стр.88, 97. В.Ю.Курляндского «Ортодонтия, травматология, челюстно-лицевое протезирование». Москва 1970 г., стр.366).
Недостатком указанного способа является то, что изготовление протезов производится после проведения оперативного вмешательства, когда произошло формирование протезного ложа. В результате чего увеличение сроков последующего протезирования вследствие мышечной контрактуры ограничивает доступ к будущему протезному ложу и затрудняет снятие оттисков, определение центральной окклюзии, введение протеза и в последующем его фиксацию и стабилизацию. Образовавшиеся рубцы изменяют положение органов зубочелюстной системы, что вызывает нарушение функции дыхания, глотания, жевания, речи и стойкому обезображиванию лица. В результате чего возникают сложности в реабилитации и социальной адаптации больных.
В основу полезной модели положена задача создания более рационального способа ортопедического лечения онкологических больных и более эффективной функциональной реабилитации больных, перенесших операции по поводу местнораспространенных опухолей дна полости рта и нижней челюсти. Предлагаемый способ позволяет сократить сроки реабилитации и социальной адаптации, способствует снижению частоты местных рецидивов и улучшению качества жизни больных.
Поставленная задача решается тем, что в способе функциональной реабилитации больных, перенесших операции по поводу местнораспространенных опухолей дна полости рта и нижней челюсти при поэтапном проведении лечения, включающем предоперационную диагностику, формирование протезного ложа, изготовление постоянного протеза с установкой на протезное ложе и реабилитационный этап, согласно изобретению при предоперационной диагностике проводят магнитно-резонансную и компьютерную томографию, компьютерное моделирование для определения границ будущей резекции челюсти на гипсовой модели и изготовление до операции съемного формирующего зубного протеза. Затем на протезное поле накладывают данный иммедиат-протез. После окончания процесса заживления и формирования протезного ложа (3-4 недели) изготавливают протез для постоянного ношения.
Для пояснения сущности изобретения представлено 23 чертежа. На фиг.1 представлена фотография пациента до операции. Фиг.2:
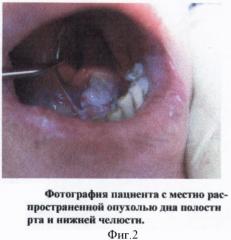
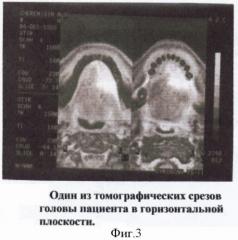
фотография пациента с местно распространенной опухолью дна полости рта и нижней челюсти. Фиг.3: один из томографических срезов головы пациента в горизонтальной плоскости. Фиг.4: один из томографических срезов головы пациента в сагиттальной плоскости. Фиг. 5, 6: магниторезонансная томография пациента в горизонтальной плоскости. Фиг. 7:
пример автоматического оконтурирования томографии горизонтальных срезов: с заведомо высоким пороговым уровнем. Фиг. 8: пример автоматического оконтурирования томографии горизонтальных срезов: контур с наиболее оптимальным пороговым уровнем. Фиг. 9: пример автоматического оконтурирования томографии горизонтальных срезов: сглаженный контур сечения новообразования с удаленными шумовыми областями. Фиг. 10: контур опухоли, полученный в программе Corel Draw путем преобразования эллипса в набор из четырех кривых, где 10.1 - острые узлы; 10.2 - гладкие узлы; 10.3 - касательные узлы. Фиг. 11: предполагаемые границы удаляемых тканей в результате предстоящей операции при помощи компьютерного моделирования: 1 - поперечное сечение челюсти до операции; 2 - то же сечение после операции. Фиг. 12: расчет ортогональных смещений протезного ложа; d1, d2, d3, d4 - значения смещений поверхности, определенные для четырех точек. Фиг. 13: гипсовая модель нижней челюсти с расчерченными границами, полученными путем компьютерного моделирования, по которой будет производиться засверловка на вычисленную глубину. Фиг. 14: гипсовая модель нижней челюсти с границами резекции, полученными в соответствии с расчетами 3D-модели. Фиг. 15: фотография пациента на операционном столе, после проведения горизонтально-плоскостной резекции нижней челюсти с гемиглоссэктомией. Фиг. 16: фотография пациента на операционном столе. В полости рта формирующий иммедиат-протез. Фиг. 17,18: фотографии пациента на третий день после операции. В полости рта формирующий иммедиат-протез с нанесенной на его базис стоматологической терапевтической системой. Фиг. 19: фотография пациента через неделю после операции. Фиг. 20: гипсовая модель нижней челюсти с сформированным протезным ложем. Модель изготовлена через 4 недели после операции. Фиг. 21: фотография пациента с частичным съемным пластиночным протезом для постоянного ношения в полости рта.
Авторы предлагают новый эффективный способ функциональной реабилитации больных с местнораспространенными формами опухолей нижней челюсти и дна полости рта (фиг.2), заключающийся в поэтапном проведении лечения: предоперационная подготовка, непосредственное, послеоперационное и отдаленное протезирование (через 3-4 недели) после проведения оперативного вмешательства.
Положительным результатом заявленного способа является повышение эффективности лечения за счет улучшения первичной и отсроченной функциональной реабилитации больных.
Положительный результат достигается тем, что на первом этапе комбинированного лечения до проведения оперативного вмешательства проводят магниторезонансную томографию (МРТ) для планирования объема мягкотканевого дефекта; компьютерную томографию (КТ) для определения объема костного дефекта.
По полученным данным (КТ, МРТ) проводят компьютерное моделирование, получают границы и рельеф будущей резекции челюсти и зубного ряда.
На основе полученных данных на гипсовых моделях челюстей, полученных до операции, планируют объем, границы и рельеф удаляемых тканей. Производят специальную обработку гипсовых моделей: челюсть и зубы, подлежащие удалению, срезают по заданному рельефу.
На полученной модели изготавливают формирующий иммедиат-протез, который накладывают в полости рта на операционном столе.
Затем через 3-4 недели после оперативного вмешательства снимают оттиски сформированного протезного ложа и изготавливают более точный протез нижней челюсти, восполняющий дефект.
Предлагаемый способ осуществляется следующим образом:
Лечение проводят поэтапно:
I этап - предоперационный - больному проводят:
1. МРТ - объем планируемого мягкотканевого дефекта;
2. КТ - объем костного дефекта;
3. Компьютерное моделирование - определение границы и рельефа будущей резекции нижней челюсти и зубного ряда;
4. Изготовление формирующего иммедиат-протеза.
II этап - послеоперационный:
1. Одномоментное наложение формирующего иммедиат-протеза в полости рта;
2. Применение стоматологической терапевтической системы (СТС);
3. Через 3-4 недели - получение индивидуального оттиска и изготовление протеза для постоянного ношения.
I (предоперационный) этап включает в себя: проведение магниторезонансной томографии для определения объема планируемого мягкотканевого дефекта; компьютерной томографии для определения объема костного дефекта. Затем на основе полученных снимков проводят компьютерное моделирование, определяют границы и рельеф будущей резекции нижней челюсти и зубного ряда.
Если результаты проведенных томографических исследований представлены в виде твердых бумажных копий либо в виде негативных фотоматериалов, то до начала моделирования такие копии преобразуются в электронный вид и представляются в виде файлов изображений. Пример фрагментов используемого для компьютерного моделирования исходного материала показан в приложении на чертежах, где фиг.3 - один из томографических срезов головы пациента в вертикальной плоскости, фиг.4 - то же, в горизонтальной плоскости; фиг.5, 6 - срезы в горизонтальной плоскости, полученные на ЯМР - томографе.
Суть такого моделирования заключается в следующем.
1. Выделение контуров. На каждом имеющемся томографическом срезе автоматически по указанию врача - оператора выделяются контуры основных моделируемых объектов: опухоли, мягких и твердых тканей. При компьютерном моделировании такие линии удобно выделять цветом (например, опухоль - красный контур, костные ткани - синий контур и т.д.). Однако учитывая, что в процессе выполнения моделирования может потребоваться получение твердых копий его отдельных этапов, удобнее для оконтуривания применять просто линии различных типов и толщины. Поскольку выделяемых объектов всего три и, кроме того, в дальнейшем потребуется отображать линию границы вырезаемых тканей, воспользуемся следующими обозначениями: толстая сплошная линия - граница кости, тонкая - граница мягких тканей, толстая пунктирная линия - граница вырезаемых тканей и тонкая пунктирная линия - граница злокачественного образования.
Для выполнения автоматического оконтуривания можно использовать самые различные принципы обработки изображений. Однако проще всего проводить контур по эквидистантной линии, то есть линии одинаковой плотности рентгеновского снимка, или, что в данном случае то же самое, линии одинаковой яркости. В качестве порогового уровня такой яркости чаще всего применяют уровень, равный половине полного перепада яркости на изображении, либо же половине локального перепада яркости на участке, ограниченным контуром, проведенным по линии, образованной совокупностью точек моделируемой поверхности, в которых градиент описывающей поверхность функции равен нулю. В основу другого подхода к проведению контурных линий можно предложить, например, алгоритм, основанный на выделении линий, проходящих через точки изображения, в которых вторая производная от градиента функции моделируемой поверхности обращается в нуль.
Поскольку контуры объектов, построенные по вышеописанным алгоритмам, могут носить слишком извилистый характер и даже иметь разрывы первого рода из-за наличия артефактов, естественных шумов изображения и наличия реальных резких локальных неоднородностей, процесс автоматического выделения контуров контролируемых объектов логично завершить выполнением операции их сглаживания. В основу такого сглаживания можно положить аппроксимацию полученных кривых сплайн-интерполирующими функциями. Практика показывает, что хороший сглаживающий эффект достигается тогда, когда в качестве базовых узлов интерполяции выбираются точки, в которых происходит смена направления тренда некоторого контура, полученного из исходного путем применения к нему морфологической операции эрозии с радиусом, равным 0.1…0.2 от максимального линейного размера объекта. При этом общее число узлов интерполяции может в k раз превышать число базовых узлов, где k=(1…2)·mod(R'max/R'min); R'max и R'min - соответственно максимум и минимум производной, взятой в полярных координатах от функции сглаженного контура R(φ). Если используется кусочная аппроксимация, то значение коэффициентов k может для различных интервалов принимать различные значения. На этапе сглаживания решается и задача сведения связности выделенной при автоматическом оконтуривании области к единице. При этом в качестве критерия отсева дополнительных выделенных контуром областей удобнее всего выбрать площадь этих областей. Пример автоматического оконтуривания томограмм горизонтальных срезов показан также в приложении на чертежах, где фиг.7 - контур с заведомо высоким пороговым уровнем, фиг.8 - контур с наиболее оптимальным пороговым уровнем, и фиг.9 - сглаженный контур сечения новообразования с удаленными шумовыми областями. Аналогичным образом выполняется оконтуривание костных и мягких тканей. К сожалению, используемые томографические методы исследований не обеспечивают должной локализации границ мягких тканей, поэтому для качественного выделения таких границ алгоритмы обработки должны использовать априорную информацию о положении контуров твердых тканей и о значении ординаты томографического среза, дополненную данными соответствующих антропологических признаков.
2. Интерактивная адаптация контуров. Как видно на фиг. 7, 8, 9, методы автоматического оконтуривания объектов достаточно грубы и даже после сглаживания содержат избыточную детализированную информацию о точной конфигурации объектов. Более того, из-за неточностей фотометрирования и специфических биологических особенностей тканей конкретного организма такие контуры могут недостаточно объективно отражать реальную ситуацию. Поэтому представляется целесообразным дополнить процесс оконтуривания интерактивными средствами, позволяющими врачу - оператору вносить соответствующие коррективы в получаемый результат. Простейшим способом такого интерактивного вмешательства является возможность корректировки параметра или набора параметров, задающих используемый для оконтуривания порог компарирования изображения, что хорошо иллюстрируется фиг. 7 и 8. Изменение данных параметров позволяет легко и просто изменить общую площадь и размеры фигуры, однако в отдельных случаях может приводить к появлению многочисленных протяженных участков вплоть до полной инверсии наблюдаемой картины. Поэтому для окончания формирования контурных линий можно воспользоваться идеями, воплощенными в графических редакторах с векторной графикой, например в графическом пакете Corel Draw. В соответствии с представлениями векторной графики любое изображение представляет собой суперпозицию простейших геометрических 7 фигур, называемых графическими примитивами.
В соответствии с такими принципами эллипс является графическим примитивом, характеризуемым наряду с координатами его центра такими параметрами, как величины полуосей, угол наклона, толщина и цвет контура и т.п. Сложный же контур можно представить как объединение таких графических примитивов, как полиномиальные кривые. Так, на фиг. 10 показан такой контур, полученный в программе Corel Draw путем преобразования эллипса в набор из четырех кривых. Точки соединения таких кривых называются узлами. Как видно на фиг. 10, направления касательных в узле для различных кривых могут как совпадать по направлению, так и различаться, в соответствии с чем узлы подразделяются на острые (фиг.10.1) и гладкие (фиг.10.2). При этом длина направленного вдоль касательной вектора (фиг.10.3) обратно пропорциональна степени кривизны кривой вблизи узла и определяется значением коэффициентов описывающего кривую полинома. Используя описанные принципы, несложно обеспечить интерактивную поддержку операции, позволяющей редактировать форму полученного на первом этапе контура. В частности, с ее помощью можно удалить избыточные узлы и тем самым сократить число описывающих контур интерполирующих участков, сделав форму моделируемого объекта еще более гладкой. Кроме того, преобразуя гладкие узлы в острые, нетрудно получить на контуре острые углы, что особенно важно при моделировании участков, ограниченных форматом кадра, а в дальнейшем - и при моделировании границ вырезания тканей. Пример восстановленных по вышеописанному алгоритму контуров новообразований, костных мягких тканей показан на фиг. 11.
Создание 3D-модели. Если операции 1-2 последовательно применить ко всем горизонтальным томографическим срезам и отобразить полученные контуры в пространстве с соблюдением расстояний между срезами, дополнив полученную картину меридианными линиями, получится элементарная 3D-модель фрагмента, относящегося к операции челюстно-лицевой области, воспроизводящей рельеф костных и мягких тканей и новообразования. Однако практическое применение такой модели достаточно затруднено в силу невозможности отображения в двумерной плоскости экрана монитора всех трех объектов сразу даже при использовании контурных линий различного вида, цвета и толщины. Другим ограничивающим фактором непосредственного применения модели является наличие у нее существенного шума, обусловленного субъективным фактором, а именно неточностью указания оператором границ контуров в процессе их интерактивной адаптации. Все это в сочетании с ограниченным числом горизонтальных срезов приводит к довольно значительным смещениям контуров различных слоев. Поэтому для прорисовки меридианных контуров необходимо обязательное применение статистических методов. В частности, очень неплохие результаты дает применение для этих целей классического метода наименьших квадратов (МНК), адаптированного для решения задач построения двумерного замкнутого сплайна. Пример реальных смещений горизонтальных контуров костных тканей в процессе моделирования, а также меридианного контура, построенного с применением МНК, показан на фиг. 11.
Проведение границы вырезки тканей. После завершения 3D-моделирования для всех трех объектов можно приступать к процедуре проведения границы вырезки тканей. Как и во всех предыдущих случаях, такая процедура будет сводиться к формированию набора контуров горизонтальных срезов границы, сначала в автоматическом режиме, а затем с последующей корректировкой границы в интерактивном режиме. При этом в основу автоматического построения контура границы можно взять контур, образованный линией пересечения плоскости среза с поверхностью, равноудаленной от поверхности новообразования на некоторую фиксированную величину d0, где значение d0 определяется исходя из соображений достаточной надежности проведения операции, а также величиной абсолютной погрешности выделения контура новообразования, которую можно принять равной 1…3 мм. Можно применять и более сложные алгоритмы, когда величина d0 является функцией плотности окружающей ткани и ее типа (кость или мышечная). Однако такое усложнение вряд ли оправдано, поскольку приводит к увеличению времени обработки, но не исключает необходимости корректировки линии границы с учетом интуиции врача - оператора. К тому же при такой коррекции врач может учесть результаты томографического анализа (фиг.12), показывающего глубину проникновения новообразования в окружающие ткани путем соответствующего увеличения величины d0. После завершения корректировки границы удаления тканей представляется целесообразным просмотреть в целом полученные результаты в 3D-виде. При этом вместо прорисовки объема с помощью меридианных и широтных линий для большей наглядности использовать прорисовку поверхностей и объемов тел в различных цветах с применением искусственной подсветки, а также локальные квадрантные вырезы с подчеркиванием форм сечений в двух ортогональных плоскостях. Если полученные результаты по каким-либо причинам не устраивают оператора, всегда можно повторить вышеприведенные операции, начиная с требуемого этапа моделирования. На этом этапе первичную обработку исходной графической информации можно считать законченной.
3. Моделирование послеоперационного рельефа. Данный этап является наиболее ответственным из всех этапов компьютерного моделирования, поскольку именно от заложенных в нем алгоритмов будет зависеть конечный результат моделирования. Суть данного этапа составляет перемещение поверхности мягких тканей ротовой полости на место удаленного в процессе операции новообразования в соответствии с проведенной на этапе 4 границей. Схематически процесс перемещения тканей в результате выполненной операции показан на фиг. 11, где 1 - поперечное сечение челюсти до оперативного вмешательства, а 2 - то же сечение после завершения операции. Поскольку в процессе перемещения происходит определенная деформация мягких тканей, точно смоделировать данный процесс практически невозможно, поскольку известно, что помимо анизотропии эластичные свойства ткани могут варьироваться в достаточно широких пределах в зависимости от возраста, пола и других, менее выраженных индивидуальных показателях конкретного индивидуума. В данном случае в основу моделирования был положен принцип несжимаемости мягких тканей, что характерно для любых жидких сред, а также принцип сохранения гладкости внешних операбельных поверхностей после их деформации. При этом накладывалось дополнительное ограничение, заключающееся в том, что смещение любой точки внутри перемещаемых тканей смещается не более чем 5% от их начального положения относительно границ внешней или внутренней поверхности. При этом абсолютная погрешность расчета положения послеоперабельной поверхности мягких тканей на модели лежала в пределах 1-3 мм. Очевидно, повысить точность вычислений можно путем более точного учета эластичности тканей, а также введения в модель возможности учета изменения толщины тканей, вызванных перемещением тканей при резекции.
4. Расчет ортогональных смещений рельефа протеза. Именно на данном этапе проявляется практическая значимость созданной на предыдущих этапах 3D-модели и ее преобразований. Суть данного этапа заключается в расчете величин смещения поверхности мягких, а возможно и костных, тканей в результате проведения операции и иллюстрируется фиг. 12, где d1…d4 - значения смещений поверхности, определенные для четырех точек. С точки зрения аналитической геометрии данная задача является достаточно простой. Гораздо сложнее решается задача рационального наложения сетки на раневую поверхность, поскольку именно от правильности выбора положения точек и расстояния между ними зависит адекватность создаваемого зубного протеза. С одной стороны, точки, в которых определяется глубина смещения поверхности, можно определить по методу П-тау сеток, широко применяемому при решении оптимизационных многокритериальных задач. С другой стороны, гораздо проще и более эффективно применение интерактивных методов, когда врач - оператор в присутствии техника выбирает наиболее характерные участки, которые, с одной стороны, можно достаточно точно идентифицировать как на гипсовой модели, так и на протезе челюсти (фиг. 12,13,14). С другой стороны, результат вычислений минимально зависит от погрешности засверловки гипсовой модели челюсти. Так, как видно из фиг. 12, размеры d2 и d3 мало зависят от отклонения линии от вертикали, тогда как для размеров d1 и d4 даже небольшой наклон линии может существенно изменить результат.
5. Обработка гипсовой модели. Полученные на предыдущем этапе результаты используются изготавливающим протез техником следующим образом.
5.1. На гипсовой модели челюсти находятся точки, идентичные точкам, для которых рассчитывалось смещение поверхности на 3D-модели;
5.2. В параллелометре строго перпендикулярно поверхности, производится засверловка гипсовой модели в найденных точках на вычисленную величину (фиг.13).
5.3. Поверхность протеза обтачивается по форме в соответствии с распечатками 3D-модели. При этом точность размеров обточки контролируется в лунках, получившихся в результате сверления.
5.4. После завершения модификации формы и рельефа гипсовой модели челюсти она готова к изготовлению формирующего иммедиат-протеза.
До операции больному снимают оттиски с верхней и нижней челюстей. Отливают гипсовые модели (фиг.13), определяют центральную окклюзию или центральное соотношение челюстей. Модели гипсуют в среднеанатомический артикулятор.
На основе полученных данных компьютерного моделирования на гипсовых моделях определяют и формируют границы, рельеф удаляемой нижней челюсти и зубного ряда (фиг.13, 14). Затем на гипсовой модели, в положении зафиксированной центральной окклюзии производят моделирование базиса протеза воском, осуществляют постановку искусственных зубов. Методом литьевого прессования заменяют воск на пластмассу и производят шлифовку и полировку протеза.
II этап
По завершению оперативного вмешательства (фиг.15), после предварительного замачивания в 0,05% растворе хлоргекседина, изготовленный формирующий иммедиат-протез накладывают на протезное поле (фиг.16).
Фиксация протеза осуществляется кламмерами за ограничивающие дефект зубы.
Предлагаемая методика позволяет предотвратить образование грубых рубцовых изменений, сформировать протезное ложе и преддверие полости рта. Это очень важно для осуществления дальнейшего определения плана лечения, протезирования и реабилитации больных, перенесших операции по поводу опухолей дна полости рта и нижней челюсти.
Акт глотания восстанавливается на 2-е сутки, речевая функция на 7-е сутки и способность пережевывать пищу в полной мере через 2-3 недели.
На этапе реабилитации больного в виду того, что во всех случаях протез опирается на раневую поверхность и на измененные, в следствии лучевой терапии, ткани протезного поля применялась разработанная нами стоматологическая терапевтическая система (СТС), которая состоит из лекарственных средств с заданным фармакологическим действием и полимерной основы. Полимерная основа - носитель, обеспечивающий «мягкую прокладку» и высвобождение действующих веществ в определенном участке полости рта (фиг.17, 18). Этим достигается локальность действия лекарственных средств, пролонгированность эффекта, удобство использования.
В качестве лекарственных средств использовано растительное сырье Алтайского края (бадан толстолистый, экстракт лопуха, облепиха крушевидная, мята перечная).
Представленная СТС обладает адгезивным, противовоспалительным, антимикробным, фунгицидным, экранирующим и дезодорирующим действиями. Заживление раневой поверхности происходило в короткие сроки, что позволило улучшить адаптацию и реабилитацию больных (фиг.18).
По истечении 4-х недельного срока у больного формируется протезное ложе, происходят изменения в окружающих тканях. В результате пользования формирующим иммедиат-протезом происходит осаживание подлежащих тканей в области оперативного вмешательства. Возникает несоответствие базиса протеза и тканей протезного ложа, что делает невозможным использование иммедиат-протеза для дальнейшей реабилитации больных (фиг.19).
В связи с этим возникает необходимость в изготовлении более точной конструкции съемного зубного протеза.
Непосредственно со сформированного протезного ложа снимают индивидуальный оттиск. Отливают гипсовую модель (фиг.20). По методике Гельфонда-Катца определяют центральное соотношение челюстей. Модели гипсуют в среднеанатомический артикулятор, после чего производят моделирование воском базиса протеза, осуществляют постановку искусственных зубов. Затем следует этап примерки восковой репродукции в полости рта больного. После чего производят замену воска на пластмассу, шлифовку, полировку протеза и наложение его на сформированное протезное ложе в полости рта (фиг.21).
В последующем больной пользуется этим частичным съемным пластиночным протезом постоянно либо, при хорошем прогнозе, через 1,5-2 года можно ставить вопрос о реконструктивной пластике нижней челюсти аутотрансплантатом или имплантатом.
Предлагаемый способ позволяет сократить сроки реабилитации и социальной адаптации, способствует снижению частоты местных рецидивов и улучшению качества жизни больных. Способ прост в реализации, обладает высокой эффективностью и может быть использован в специализированных онкологических учреждениях, занимающихся комплексным лечением больных с опухолями полости рта и ротового отдела глотки.
Способ функциональной реабилитации больных, перенесших операции по поводу местнораспространенных опухолей дна полости рта и нижней челюсти при поэтапном проведении лечения, включающий предоперационную диагностику, состоящую из определения границ будущей резекции челюсти с применением магниторезонансной и компьютерной томографии, формирование протезного ложа, изготовление постоянного протеза с установкой на протезное ложе и реабилитационный этап, отличающийся тем, что в процессе предоперационной диагностики при определении границ будущей резекции челюсти на гипсовой модели находят точки, идентичные точкам, для которых рассчитывалось с помощью компьютерного моделирования смещение поверхности на трехмерной модели «3D-модели», производят засверловку гипсовой модели в найденных точках строго перпендикулярно поверхности, после чего поверхность гипсовой модели челюсти обтачивают по форме в соответствии с распечатками трехмерной модели «3D-модели», подготавливая ложе для будущего иммедиат-протеза, затем изготавливают иммедиат-протез и размещают его на протезное поле для формирования оптимального протезного ложа непосредственно после операции в течение 14-21 дня в зависимости от объема проведенной операции.