Оксазолидинон-хинолонгибридные антибиотики
Иллюстрации
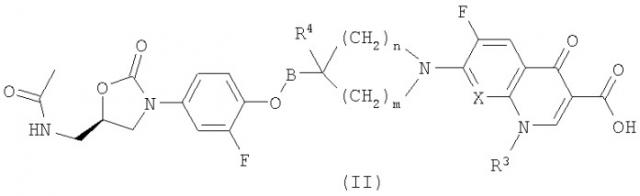
Показать всеИзобретение относится к соединениям формулы I, к их фармакологически приемлемой соли, сольвату, гидрату.
где А означает алкиленовую группу, алкениленовую группу, алкиниленовую группу, гетероалкиленовую группу, циклоалкиленовую группу, гетероциклоалкиленовую группу, ариленовую группу или гетероариленовую группу, причем каждая из указанных групп может быть замещена, Q означает CR4, X означает CR7 или N, Y означает CR6 или N, n равно 1, 2 или 3, m равно 1, 2 или 3, R1 означает Н, F, Cl, Br, I, ОН, NH2, алкильную группу или гетероалкильную группу, R2 означает Н, F или Cl, R3 означает Н, алкильную группу, алкенильную группу, алкинильную группу, гетероалкильную группу, циклоалкильную группу, гетероциклоалкильную группу, арильную группу, гетероарильную группу, алкиларильную группу или гетероарилалкильную группу, причем каждая из указанных групп может быть замещена одним, двумя или более атомами галогена или аминогруппами, R4 означает гидрокси, группу формулы OPO3R9 2 или OSO3R10 или гетероалкильную группу, содержащую по меньшей мере одну ОН, NH2, SO3R10, PO3R9 2 или СООН группу или сложноэфирную группу природной аминокислоты или ее производного, где группы R9 независимо друг от друга означают Н, алкил, циклоалкил, арил или аралкил, a R10 означает Н, алкил, циклоалкил, арил или аралкил, и далее значения для R5, R6,
R7 и R8, такие, как указаны в формуле изобретения, к фармацевтическим композициям, обладающим антимикробной активностью, содержащим вышеописанные соединения, а также к применению соединений формулы (I) и фармацевтической композиции для лечения бактериальной инфекции. Технический результат: получены и описаны новые соединения, которые могут использоваться в качестве антимикробных агентов и которые являются эффективными в отношении множества мультирезистентных бактерий. 4 н. и 14 з.п. ф-лы.
Реферат
В настоящем изобретении описаны новые соединения, в которых фармакофоры, хинолон и оксазолидинон, связаны линкерной группой, стабильной в физиологических условиях, и фармацевтическая антибактериальная композиция, содержащая указанные соединения. Эти соединения двойного действия могут использоваться в качестве антимикробных агентов, эффективных в отношении множества известных в медицине и ветеринарии патогенов, включающих грамположительные аэробные бактерии, такие, как полирезистентные стафилококки, стрептококки и энтерококки, а также грамотрицательные бактерии, такие, как Moraxella catarrhalis и Haemophilus influenzae, и анаэробные организмы, такие, как различные виды Bacteroides spp. и Clostridia spp., и кислотоустойчивые организмы, такие, как Mycobacterium tuberculosis, Mycobacterium avium spp.
Оксазолидинон-хинолон-гибридные антибиотики описаны в литературе (см. WO 02059116, WO 03002560, WO 03031443, WO 03032962). Главным недостатком соединений, известных из уровня техники, является плохая растворимость в воде, что затрудняет получение соответствующих составов.
В настоящем изобретении предлагаются новые соединения формулы (I), которые используются в качестве антимикробных агентов и являются эффективными в отношении множества полирезистентных бактерий
где А означает алкиленовую группу, алкениленовую группу, алкиниленовую группу, гетероалкиленовую группу, циклоалкиленовую группу, гетероциклоалкиленовую группу, ариленовую группу или гетероариленовую группу, причем каждая из указанных групп может быть замещена,
Q означает CR4 или N (особенно CR4),
Х означает CR7 или N,
Y означает CR6 или N,
n равно 1, 2 или 3,
m равно 1, 2 или 3,
R1 означает Н, F, Cl, Br, I, ОН, NH2, алкильную группу или гетероалкильную группу,
R2 означает Н, F или Cl,
R3 означает Н, алкильную группу, алкенильную группу, алкинильную группу, гетероалкильную группу, циклоалкильную группу, гетероциклоалкильную группу, арильную группу или гетероарильную группу, алкиларильную группу или гетероарилалкильную группу, причем каждая из указанных групп может быть замещена одним, двумя или более атомами галогена, такого, как F или C1, или аминогруппами,
R4 означает гидрокси, группу формулы ОРО3R9 2 или ОSО3R10 или гетероалкильную группу, содержащую по меньшей мере одну группу ОН, NH2, SО3R10, РО2R9 2 или СООН или сложноэфирную группу природной аминокислоты или ее производного, где группы R9 независимо друг от друга означают Н, алкил, циклоалкил, арил или аралкил, а R10 означает H, алкил, циклоалкил, арил или аралкил,
R5 выбирают из следующих групп:
R6 означает Н, F, Cl или ОМе,
R7 означает Н, F, Cl, ОН, NH2, замещенную или незамещенную алкильную группу, или замещенную или незамещенную гетероалкильную группу, или R3 и R7 могут быть связаны через алкиленовую, алкениленовую или гетероалкиленовую группу, или будут частью циклоалкиленовой или гетероциклоалкиленовой группы, если R3 не означает Н и R7 не означает Н, F, ОН, NH2 или Cl, а
R8 означает C1-С6гетероалкильную, гетероарилалкильную, гетероалкиларильную или гетероалкилгетероарильную группу,
или их фармакологически приемлемая соль, сольват, гидрат или состав.
Подразумевается, что некоторые соединения формулы (I) или (II), указанные в описании заявки, могут существовать в виде таутомерных форм, из которых только одна конкретно упомянута и отображена в описании, различных геометрических изомеров (которые обычно обозначаются как цис/транс изомеры или чаще всего (Е) и (Z) изомеры) или различных оптических изомеров, благодаря присутствию в структуре одного или более хиральных атомов углерода (которые обычно обозначаются в соответствии с правилами Кана-Ингольда-Прелога или как R/S система). Кроме того, некоторые соединения могут существовать в полиморфных формах. Изобретение включает все такие таутомерные формы, геометрические или оптические изомеры (а также рацематы и диастереомеры) и полиморфные формы.
Термин «алкил» означает насыщенную алкильную группу с прямой или разветвленной цепью, содержащую от одного до десяти, предпочтительно от одного до шести, атомов углерода, например группы метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, н-гексил, 2,2-диметилбутил, н-октил или н-пентил. Любая указанная алкильная группа замещена одним, двумя или более заместителями, например группами F, Cl, Br, I, NH2, ОН, SH или NO2.
Термины алкенил и алкинил означают ненасыщенную алкильную группу с прямой или разветвленной цепью, содержащую одну, две или более двойных и/или тройных связей, причем алкенил предпочтительно содержит одну или две двойные связи, а алкинил предпочтительно содержит одну или две тройные связи, предпочтительно содержащую от двух до десяти, предпочтительно от двух до шести, атомов углерода, например группы этенил (винил), пропенил (аллил), изопропенил, н-пентенил, бутенил, изопренил или гекса-2-енил, этинил, пропинил или бутинил. Любая указанная алкенильная или алкинильная группа замещена одним, двумя или более заместителями, например группами F, Cl, Br, I, NH2, ОН, SH или NO2.
Термин гетероалкил означает группу алкил, алкенил или алкинил, указанную выше, в которой один или более атомов углерода заменены на атом кислорода, азота, фосфора или серы, например группу алкокси, такую, как метокси, этокси, пропокси, изопропокси, бутокси или трет-бутокси, группу алкоксиалкил, такую, как метоксиметил, этоксиметил, 1-метоксиэтил, 1-этоксиэтил, 2-метоксиэтил или 2-этоксиэтил, алкиламиногруппу, такую, как метиламино, этиламино, пропиламино, изопропиламино, диметиламино или диэтиламино, алкилтиогруппу, такую, как метилтио, этилтио или изопропилтио, или цианогруппу. Кроме того, гетероалкил может означать одну из вышеуказанных групп, содержащую кетогруппу. Термин гетероалкил означает также группу, производную от карбокси или карбоксамидогруппы, такую, как ацетил, пропионил, ацетилокси, пропионилокси, ацетиламино или пропиониламино, карбоксиалкильную группу, такую, как карбоксиметил, карбоксиэтил или карбоксипропил, карбоксиалкильный эфир, алкилтиокарбоксиаминогруппу, алкоксииминогруппу, алкиламинотиокарбоксиаминогруппу или алкоксикарбониламиногруппу. Любая гетероалкильная группа, указанная выше, может содержать один, два или более заместителей, например F, Cl, Br, I, NH2, ОН, SH или NO2.
Термин циклоалкил означает насыщенную или частично ненасыщенную (содержащую одну, две или более двойных и/или тройных связей) циклическую группу, включающую один, два или более циклов и от 3 до 14 атомов углерода в цикле, предпочтительно от 5-6 до десяти атомов углерода в цикле, например группу циклопропил, циклобутил, циклопентил, циклогексил, тетралин, циклопентенил или циклогекс-2-енил. Любая циклоалкильная группа, указанная выше, может содержать один, два или более заместителей, например F, Cl, Br, I, ОН, NH2, SH, N3, NO2, алкильные группы, такие, как метил или этил, гетероалкильные группы, такие, как метокси, метиламино, диметиламино или циано.
Термин гетероциклоалкил означает циклоалкильную группу, указанную выше, в которой один, два или более атомов углерода в цикле заменены на один, два или более атомов кислорода, азота, фосфора или серы или на группы S(O)1-2, например группы пиперидино, морфолино или пиперазино.
Термин арил означает ароматическую циклическую группу, включающую один, два или более циклов и от 5 до 14 атомов углерода в цикле, предпочтительно от 5-6 до десяти атомов углерода в цикле, например группу фенил или нафтил. Любая арильная группа, указанная выше, может содержать один, два или более заместителей, например F, Cl, Br, I, ОН, NH2, SH, N3, NO2, алкильные группы, такие, как метил или этил, гетероалкильные группы, такие, как метокси, метиламино, диметиламино или циано.
Термин гетероарил означает арильную группу, указанную выше, в которой один, два или более атомов углерода в цикле заменены на атом кислорода, азота, бора, фосфора или серы, например группы пиридил, имидазолил, пиразолил, хинолинил, изохинолинил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, 1,2,3-триазолил, 1,2,4-триазолил, оксадиазолил, тиадиазолил, индолил, индазолил, тетразолил, пиразинил, пиримидинил и пиридазинил.
Термин аралкил (или арилалкил или алкиларил) означает группы, которые включают как арильную, так и алкильную и/или циклоалкильную группы.
Термин гетероарилалкил (или гетероалкиларил или гетероалкилгетероарил и т.п.) означает аралкильную группу, указанную выше, в которой один, два, три или более атомов углерода заменены на один, два, три или более атомов кислорода, азота, фосфора или серы или на группы S(O)1-2.
Любая алкильная, алкенильная, алкинильная, гетероалкильная, циклоалкильная, гетероциклоалкильная, арильная, гетероарильная, аралкильная или гетероарилалкильная группы, указанные выше, замещены одним или более атомами галогена, группами NH2, SH, NO2 или ОН, или незамещенными группами алкил, гетероалкил, арил, аралкил, аралкилокси, гетероарил, циклоалкил или гетероциклоалкил, указанными выше.
Термин "необязательно замещенный" или "замещенный" означает группы, в которых один или более атомов водорода заменены на атом галогена, на группу NH2, SH, NO2 или ОН, на группу незамещенный алкил, гетероалкил, арил, аралкил, аралкилокси, гетероарил, циклоалкил или гетероциклоалкил, указанную выше.
Предпочтительными и/или преимущественными вариантами осуществления изобретения являются объекты пунктов формулы изобретения.
Предпочтительны соединения формулы (I), в которых R1 означает Н.
Кроме того, предпочтительны соединения формулы (I), в которых R2 означает F или Н.
Более предпочтительны соединения формулы (I), в которых R3 означает этил, 2-пропил, С3-С6циклоалкил (т.е. циклопропил, циклобутил, циклопентил или циклогексил), фенил или пиридил. Все указанные группы замещены одним, двумя, тремя или более атомами фтора или аминогруппами.
Более предпочтительны соединения формулы (I), в которых R3 означает циклопропильную группу.
Кроме того, предпочтительны соединения формулы (I), в которых R7 и R3 вместе образуют мостиковую группу формулы -O-CH2-N(Me)- или -О-СН2-CH(Ме)-, причем в конечном соединении хиральный центр находится в (S)-конфигурации.
Более предпочтительны соединения формулы (I), в которых R4 означает гидрокси или группу формулы OSO3H, ОРО3Н2, ОСН2ОРО3Н2, ОСОСН2СН2СООН или сложный эфир природной аминокислоты или ее производного (т.е. группу формулы -OCOCHR′NH2 или ее производное, такое, как сложный эфир, амид или алкиламин, где R' означает боковую цепь природной аминокислоты, такой, как аспарагиновая кислота, глутаровая кислота, лизин и т.п., например диметиламиноглицин, OCOCH2N(СН3)2).
Кроме того, предпочтительны соединения формулы (I), в которых R8 означает группу формулы -CH2NHCOCH=CHAryl, -СН2О-гетероарил (особенно -окса-3-оксазол), -CH2NHSO2Me, -CH2NHCOOMe, -CH2NHCOMe, -CH2NHCS2Me, -CH2NHCSMe, -CH2NHCSNH2, -CH2NHCSOMe или -NHCOMe, особенно -CH2NHCSMe или -CH2NHCOMe.
Предпочтительны прежде всего соединения формулы (I), в которых R5 означает структуру
Более предпочтительны соединения формулы (I), в которых R7 означает Н, F, Cl или метоксигруппу, замещенную одним, двумя или тремя атомами фтора.
Кроме того, предпочтительны соединения формулы (I), в которых Х означает N или СН.
Более предпочтительны соединения формулы (I), в которых Y означает СН или N.
Кроме того, предпочтительны соединения формулы (I), в которых А означает C1-С6алкилен, С2-С6алкенилен, С2-С6алкинилен, C1-С6гетероалкилен, циклопропилен, эпоксид, азиридин, тиоэпоксид, лактам или лактон, причем каждая группа может быть замещена.
Более предпочтительны соединения формулы (I), в которых А означает группу формулы -О-В-, где В означает С1-С4алкиленовую группу, С2-С4алкениленовую группу, С2-С4алкиниленовую группу или C1-С4гетероалкиленовую группу, причем каждая группа может быть замещена одной, двумя или более гидрокси- или аминогруппами.
Предпочтительны прежде всего соединения формулы (I), в которых А означает группу формулы -СН2СН2-, -ОСН2-, -ОСН2СН2-, -SCH2-, -SCH2CH2-, -СН=СН-, , -СН(ОН)СН(ОН)- или -CH(NH2)CH(OH)-.
Предпочтительны прежде всего соединения формулы (I), в которых В означает СН2 или СН2СН2.
Предпочтительны прежде всего соединения формулы (II)
где остатки имеют значения, указанные выше. В предпочтительном варианте В означает СН2 или СН2СН2, Х означает СН, N или С-ОМе, а R3 означает циклопропил или Х означает CR7, а R7 и R3 вместе образуют мостиковую группу формулы -О-СН2-CH(Ме)-, где в конечном соединении предпочтительной конфигурацией хирального центра является (S)-конфигурация, n равно 1, 2 или 3, m равно 1, 2 или 3, а R4 означает гидрокси или группу формулы OSO3H, ОРО3Н2, ОСН2ОРО3Н2, ОСОСН2СН2СООН или сложный эфир природной аминокислоты или ее производного.
Более предпочтительны моно-, ди- и тринатриевые соли (наиболее предпочтительны мононатриевые соли) соединений формулы (I) или (II) или их смеси. Предпочтительны прежде всего моно-, ди- или тринатриевые соли (наиболее предпочтительны мононатриевые соли) соединений формулы (I) или (II), в которых R4 означает ОРО3Н2 или OSO3H, или их смеси.
Предпочтительна прежде всего натриевая соль соединения формулы (II), в котором R3 означает циклопропильную группу, Х означает CH или N, n равно 2, m равно 2, R4 означает ОРО3Н2, а В означает СН2.
Настоящее изобретение также относится к фармакологически приемлемым солям, или сольватам и гидратам, соответственно, и к композициям и составам соединений формулы (I) или (II). В настоящем изобретении описаны методики получения фармацевтически приемлемых агентов, которые содержат указанные соединения, а также применение указанных соединений для получения фармацевтически приемлемых агентов.
Фармацевтические композиции по настоящему изобретению содержат по меньшей мере одно соединение формулы (I) или (II) в качестве активного агента и необязательно носители и/или разбавители и/или адъюванты. Кроме того, фармацевтические композиции по настоящему изобретению необязательно содержат дополнительные известные антибиотики.
Примерами фармакологически приемлемых солей оснований формулы (I) или (II) являются соли физиологически приемлемых минеральных кислот, таких, как хлористоводородная кислота, бромистоводородная кислота, серная и фосфорная кислота, или органических кислот, таких, как метансульфоновая, пара-толуолсульфоновая, молочная, уксусная, трифторуксусная, лимонная, янтарная, фумаровая, малеиновая и салициловая кислота. Кроме того, кислотное соединение формулы (I) или (II) может образовывать соли с щелочными или щелочно-земельными металлами, например, соли натрия, калия, лития, кальция или магния, соли аммония или соли органических оснований, например соли метиламина, диметиламина, триметиламина, триэтиламина, этилендиамина, этаноламина, гидроксида холина, меглумина, пиперидина, морфолина, трис(2-гидроксиэтил)амина, лизина или аргинина. Соединения формулы (I) или (II) могут образовывать сольваты, особенно гидраты. Гидратирование может происходить в процессе получения или из-за гигроскопичности первоначально безводного соединения формулы (I) или (II). Соединения формулы (I) или (II) могут содержать асимметрические атомы углерода и могут присутствовать в форме ахиральных соединений, смесей диастереомеров, смесей энантиомеров или в форме оптически чистых соединений.
Кроме того, настоящее изобретение относится к пролекарствам, которые включают соединение формулы (I) или (II) и по меньшей мере одну фармакологически приемлемую защитную группу, которая отщепляется в физиологических условиях, такую, как алкокси-, аралкокси-, ацил-, SO3H, РО3Н2, ацилоксиметильная группа (например, пивалоилоксиметил), 2-алкил-, 2-арил- или 2-аралкилоксикарбонил-2-алкилиденэтильная группа или ацилоксигруппа, указанная выше, например этокси, бензилокси, ацетил или ацетилокси. Предпочтительны прежде всего пролекарства, представляющие собой соединение формулы (I) или (II), где R4 означает ОН, модифицированное по гидроксигруппе.
Как указано выше, терапевтические агенты, которые содержат соединения формулы (I) или (II), их сольваты, соли или составы, также включены в объем настоящего изобретения. В общем случае соединения формулы (I) или (II) вводят известными и приемлемыми способами, известными в уровне техники, отдельно или в комбинации с любым другим терапевтическим агентом. Такие терапевтические агенты можно вводить одним из следующих способов: пероральным способом, например, в форме таблеток, драже, таблеток в оболочке, пилюлей, полутвердых препаратов, мягких или твердых капсул, например мягких или твердых желатиновых капсул, водных или масляных растворов, эмульсий, суспензий или сиропов; парентеральным способом, включающим внутривенную, внутримышечную и подкожную инъекцию, например, в форме инъекционного раствора или суспензии; ректальным способом в форме суппозитория; ингаляцией или вдуванием, например, порошкообразного состава в форме микрокристаллов или спрея (например, жидкого аэрозоля); чрескожным способом, например, с использованием системы чрескожной доставки (TDS), такой, как пластырь, содержащий активный ингредиент, или интраназальным способом. При получении таких таблеток, драже, пилюлей, полутвердых препаратов, таблеток в оболочке, драже и твердых, например, желатиновых, капсул, терапевтически эффективный продукт смешивают с фармацевтически инертными неорганическими или органическими эксципипентами, такими, например, как лактоза, сахароза, глюкоза, желатин, солод, силикагель, крахмал или его производные, тальк, стеариновая кислота или ее соли, сухое обезжиренное молоко и т.п. При получении мягких капсул в качестве эксципиентов используются, например, растительные, минеральные, животные или синтетические масла, воски, жиры, полиолы. При получении жидких растворов, эмульсий или суспензий или сиропов в качестве эксципипентов используются, например, вода, спирты, солевой раствор, водная декстроза, полиолы, глицерин, липиды, фосфолипиды, циклодекстрины, растительные, минеральные, животные или синтетические масла.
Предпочтительны прежде всего липиды и более предпочтительны фосфолипиды (предпочтительно природного происхождения; особенно с размерами частиц от 300 до 350 нм), предпочтительно в солевом фосфатном буферном растворе (рН 7-8, предпочтительно 7,4). При получении суппозиториев в качестве эксципиентов можно использовать, например, растительные, минеральные, животные или синтетические масла, воск, жиры и полиолы. В аэрозольных составах используются пригодные для этих целей сжатые газы, например кислород, азот и диоксид углерода. Фармацевтически пригодные агенты могут также содержать дополнительные компоненты, такие, как консерванты, стабилизаторы, например, УФ-защитные средства, эмульгаторы, подсластители, ароматизаторы, соли для изменения осмотического давления, буферные вещества, компоненты оболочки и антиоксиданты.
Для специалиста в данной области представляется очевидной суточная доза для одного пациента от приблизительно 1 мг до приблизительно 4000 мг, особенно от приблизительно 50 мг до приблизительно 3 г, причем подразумевается, что доза зависит от возраста и состояния пациента (млекопитающего) и типа заболевания, которое подлежит излечению или профилактике. Суточную дозу можно вводить в виде разовой дозы или раздельными дозами. Средняя разовая доза может составлять приблизительно 50 мг, 100 мг, 250 мг, 500 мг, 1000 мг и 2000 мг.
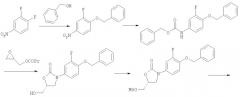
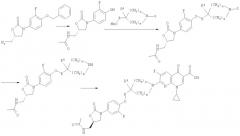
Соединения формулы (I) и (II) можно синтезировать, как показано на следующей схеме:
Условия реакции
Стадия 1: CH2Cl2, КОН (50%), 3 ч, КТ, 97%.
Стадия 2: Н2, Pt/C, 20 ч, КТ, затем Z-Cl (Cbz-Cl), ацетон/вода, NaHCO3, 12 ч, КТ, 98%.
Стадия 3: н-BuLi, -60°С, 24 ч, 80%.
Стадия 4: MsCl, триэтиламин, CH2Cl2, 100%.
Стадия 5: NaN3 в ДМФА, 90°С, катализатор Bu4NI, 5 ч, 90%.
Стадия 6: Н2, Pd(OH)2, ТГФ, МеОН, 24 ч, затем АсОН, Ac2O, КТ, 2 ч, 70%.
Стадия 7: ДМФА, NaH, 70°C, 12 ч, 75%.
Стадия 8: H2, Pd(OH)2, МеОН, ТГФ, 24 ч, КТ, 100%.
Стадия 9: N-метилпирролидинон, 1-циклопропил-7-хлор-6-фтор-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота (коммерческий препарат), TMS-Cl, основание Хюнига или К2СО3, 80°С, 5 ч, 80%.
Примеры
Пример 1
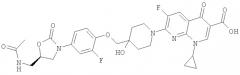
7-(4-{4-[(5S)-5-(Ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-гидроксипиперидин-1-ил)-1-циклопропил-6-фтор-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоновая кислота
Стадия 1
Бензиловый эфир (4-бензилокси-3-фторфенил)карбаминовой кислоты
Раствор 34,9 г 1-бензилокси-2-фтор-4-нитробензола (WO 03064413) (MM: 247,28, 141 ммоль) и 340 мг 5% платины на активированном угле в 350 мл этилацетата перемешивали в атмосфере водорода при КТ и нормальном давлении. По результатам анализа методом ЖХВР реакция завершалась через 20 ч. Катализатор отделяли фильтрованием через стекловолоконный фильтр и фильтрат упаривали при пониженном давлении досуха. Маслообразный остаток растворяли в 500 мл ацетона, добавляли 250 мл насыщенного раствора бикарбоната натрия и 17,5 г бикарбоната натрия (ММ: 84,01, 208 ммолей). Смесь охлаждали до 5°С и добавляли по каплям 26,08 г бензилхлорформиата (ММ: 170,59, 152 ммоля) и смесь перемешивали при комнатной температуре в течение 2 ч, контролируя ход реакции методом ТСХ (элюент: гексан/этилацетат, 3:1). Ацетон выпаривали, остаток разбавляли добавлением 500 мл воды и твердое вещество отделяли фильтрованием. Кристаллы промывали 500 мл воды и высушивали. Выход: 48,05 г, 95,8%. МС (ESI+): 352,5 (M+H)+, MC (ESI-): 350,8, (M-H)+.
Стадия 2
(5R)-3-(4-Бензилокси-3-фторфенил)-5-гидроксиметилоксазолидин-2-он
Раствор 17,5 г бензилового эфира (4-бензилокси-3-фторфенил)карбаминовой кислоты (ММ: 351,38, 50 ммолей) в 30 мл сухого тетрагидрофурана перемешивали при охлаждении до -78°С на бане с сухим льдом/ацетоном. Затем в смесь добавляли по каплям 22,8 мл 2,3 М раствора н-бутиллития (52,5 ммоля) в н-гексане и реакционную смесь перемешивали при -78°С в течение 15 мин. Затем в смесь добавляли 7,92 г R(-)-глицидилбутирата (ММ: 144,17, 60 ммолей) и реакционную смесь нагревали до комнатной температуры. Реакцию контролировали методом ЖХВР, останавливали добавлением насыщенного раствора хлорида аммония и смесь разбавляли добавлением 100 мл этилацетата. Органический слой промывали 200 мл воды и 200 мл солевого раствора. Органический слой сушили над сульфатом магния, фильтровали и фильтрат упаривали при пониженном давлении. Остаток кристаллизовали из 200 мл смеси этилацетат/гексан, 1:1. Твердое вещество отделяли фильтрованием и перекристаллизовывали из 150 мл смеси этилацетат/дихлорметан, 9:1. Бесцветные кристаллы отделяли фильтрованием и высушивали. Выход: 10,4 г, 65,5%. МС (ESI+): 318,1 (М+Н)+.
Стадия 3
(5S)-5-Азидометил-3-(4-бензилокси-3-фторфенил)оксазолидин-2-он
В раствор 10 г (5R)-3-(4-бензилокси-3-фторфенил)-5-гидроксиметилоксазолидин-2-она (ММ: 317,32, 31,51 ммоля) и 4,78 г триэтиламина (ММ: 101,19, 47,26 ммоля) в 300 мл дихлорметана при перемешивании при 10°С добавляли 4,32 г метансульфонилхлорида (ММ: 114,55, 37,82 ммоля). Смесь перемешивали при комнатной температуре в течение 1 ч, контролируя ход реакции методом ТСХ (элюент: этилацетат/гексан, 1:1). Реакцию останавливали добавлением 100 мл воды, органический слой промывали 100 мл солевого раствора, сушили над сульфатом магния, фильтровали и фильтрат упаривали при пониженном давлении. Остаток растворяли в 100 мл диметилформамида, добавляли 5,12 г азида натрия (ММ: 65,01, 78,7 ммоля) и каталитическое количество иодида тетрабутиламмония. Суспензию перемешивали при 90°С в течение ночи, контролируя ход реакции методом ЖХВР. Диметилформамид выпаривали при пониженном давлении, остаток растворяли в 200 мл дихлорметана и органический слой последовательно промывали 100 мл воды и 100 мл солевого раствора. Раствор в дихлорметане сушили над сульфатом магния, фильтровали и фильтрат упаривали при пониженном давлении. Остаток кристаллизовали из 150 мл смеси этилацетат/гексан, 1:1. Кристаллы отделяли фильтрованием, при этом получали твердое вещество грязно-белого цвета. Выход: 10,4 г, 97%. MS (ESI+): 343,1 (M+H)+-.
Стадия 4
N-[(5S)-{3-(3-Фтор-4-гидроксифенил)}-2-оксооксазолидин-5-илметил]ацетамид
Суспензию 10,4 г (5S)-5-азидометил-3-(4-бензилокси-3-фторфенил)оксазолидин-2-она (ММ: 342,33, 30,38 ммоля) и 1,5 г 10% палладия на активированном угле в 400 мл смеси метанол/этилацетат, 1:1, перемешивали при комнатной температуре в атмосфере водорода в течение 2 сут. Катализатор отделяли фильтрованием через стекловолоконный фильтр и фильтрат упаривали при пониженном давлении. Остаток растворяли в 100 мл уксусной кислоты и добавляли 3,72 г уксусного ангидрида (ММ: 102,09, 36,45 ммоля). Растворитель упаривали при пониженном давлении, остаток кристаллизовали из смеси этилацетат/гексан, 1:1, при этом получали твердое вещество грязно-белого цвета. Выход: 6,76 г, 83%. MS (ESI+): 269,4 (M+H)+, MC (ESI-): 267,3
(M-H)-.
Стадия 5
Бензиловый эфир 4-{4-[(5S)-5-(ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-гидроксипиперидин-1-карбоновой кислоты
Суспензию 22,72 г бензилового эфира 1-окса-6-азаспиро[2.5]октан-6-карбоновой ктслоты (WO 9803507) (MM: 247,29, 92 ммоля), 21,45 г N-[(5S)-{3-(3-фтор-4-гидроксифенил)}-2-оксооксазолидин-5-илметил]ацетамида (MM: 268,246, 80 ммолей) и 16,58 г карбоната калия (ММ: 138,20, 120 ммолей) в 150 мл диметилформамида перемешивали при 100°С в течение 7 ч, контролируя ход реакции методом ТСХ (элюент: дихлорметан/метанол, 9:1). Диметилформамид выпаривали при пониженном давлении и остаток растворяли в 600 мл смеси дихлорметан/метанол, 9:1. Органический слой последовательно промывали 400 мл воды и 400 мл солевого раствора. Органический слой сушили над сульфатом магния, фильтровали и фильтрат разбавляли добавлением 250 мл этилацетата. Смесь концентрировали при пониженном давлении до конечного объема 400 мл. Суспензию перемешивали при комнатной температуре в течение ночи. Кристаллы отделяли фильтрованием и последовательно промывали 150 мл этилацетата и 100 мл пентана. Выход: 31,65 г, 76,7%. MS (ESI+): 516,8 (М+Н)+.
Стадия 6
N-[{(5S)-3-[3-Фтор-4-(4-гидроксипиперидин-4-илметокси)фенил]-2-оксооксазолидин-5-илметил}]ацетамид
Суспензию 31 г бензилового эфира 4-{4-[(5S)-5-(ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-гидроксипиперидин-1-карбоновой кислоты (ММ: 515,54, 60,13 ммоля) и 2,5 г 10% палладия на активированном угле в 310 мл метанола и 150 мл этилацетата перемешивали в атмосфере водорода в течение 4 ч, контролируя ход реакции методом ТСХ (элюент: этилацетат). Суспензию разбавляли 300 мл метанола, нагревали до 40°С и катализатор отделяли фильтрованием через стекловолоконный фильтр. Фильтрат концентрировали до 150 мл, разбавляли добавлением 300 мл этилацетата и повторно концентировали до 200 мл. Затем добавляли 200 мл диэтилового эфира и суспензию перемешивали при охлаждении до 0°С. Твердое вещество отделяли фильтрованием и высушивали. Выход: 21,6 г, 94,3%. МС (ESI+): 382,6 (М+Н)+.
Стадия 7
7-(4-{4-[(5S)-5-(Ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-гидроксипиперидин-1-ил)-1-циклопропил-6-фтор-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоновая кислота
Суспензию 71 мг 7-хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксо[1,8]нафтиридин-3-карбоновой кислоты (ММ: 282,66, 0,25 ммоля), 95 мг N-[{(5S)-3-[3-фтор-4-(4-гидроксипиперидин-4-илметокси)фенил]-2-оксооксазолидин-5-илметил}]ацетамида (ММ: 381,40, 0,25 ммоля), 102 мг триэтиламина (ММ: 101,19, 1,0 ммоль) и 81 мг триметилхлорсилана (ММ: 108,64, 0,75 ммоля) в 1 мл N-метилпирролидин-2-она перемешивали при нагревании при 80°С в течение 5 ч, контролируя ход реакции методом ТСХ (элюент: дихлорметан/метанол, 9:1). N-Метилпирролидин-2-он выпаривали, остаток растворяли в 20 мл смеси дихлорметан/метанол, 9:1, и раствор последовательно промывали 10 мл 0,1 н. соляной кислоты и 20 мл солевого раствора. Органический слой сушили над сульфатом магния, фильтровали и фильтрат упаривали. Остаток растворяли в 10 мл смеси дихлорметан/метанол, 9:1, и разбавляли добавлением 20 мл этилацетата. Выпавший осадок отделяли фильтрованием, при этом получали твердое вещество грязно-белого цвета. Вторую порцию получали при концентировании маточного раствора при пониженном давлении. Выход: 100 мг, 64%. МС (ESI+): 628,8 (М+Н)+, МС (ESI-): 626,8 (М-Н)-.
Пример 2
7-(4-{4-[(5S)-5-(Ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-фосфонооксипиперидин-1-ил)-1-циклопропил-6-фтор-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоновая кислота
Стадия 1
7-[4-{4-[(5S)-5-(Ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-(бис-бензилоксифосфорилокси)пиперидин-1-ил]-1-циклопропил-6-фтор-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоновая кислота
В суспензию 125 мг 7-(4-{4-[(5S)-5-(ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-гидроксипиперидин-1-ил)-1-циклопропил-6-фтор-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоновой кислоты (ММ: 627,60, 0,2 ммоля) и 42 мг тетразола (ММ: 70,05, 0,6 ммоля) в 1 мл дихлорметана добавляли 138 мг дибензил-N,N-диизопропилфосфорамидита (ММ: 345,42, 0,4 ммоля), при этом наблюдалось медленное превращение исходной суспензии в прозрачный раствор. Раствор перемешивали при комнатной температуре в течение 2 ч, контролируя ход реакции методом ТСХ (элюент: дихлорметан/метанол, 9:1). Реакционную смесь охлаждали до 0°С и добавляли 0,6 мл 0,5 М раствора мета-хлорбензойной кислоты в дихлорметане. Смесь перемешивали при комнатной температуре в течение 2 ч и разбавляли добавлением 20 мл дихлорметана. Органический слой последовательно промывали 20 мл насыщенного раствора бикарбоната натрия, 20 мл солевого раствора и сушили над сульфатом магния. Суспензию фильтровали и фильтрат упаривали при пониженном давлении. Остаток очищали хроматографией на силикагеле (элюент: дихлорметан/метанол, 9:1), при этом получали твердое вещество грязно-белого цвета. Выход: 158 мг, 89%. MS (ESI+): 889,3 (M+H)+, MC (ESI-): 887,0 (M-H)-.
Стадия 2
7-(4-{4-[(5S)-5-(Ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-фосфонооксипиперидин-1-ил)-1-циклопропил-6-фтор-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоновая кислота
Суспензию 158 мг 7-[4-{4-[(5S)-5-(Ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-(бис-бензилоксифосфорилокси)пиперидин-1-ил]-1-циклопропил-6-фтор-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоновой кислоты (ММ: 887,84, 0,177 ммоля) и 20 мг 20% гидроксида палладия на активированном угле в 20 мл смеси дихлорметан/метанол/вода, 6:3:1, перемешивали при комнатной температуре в атмосфере водорода в течение 3 ч. Катализатор отделяли фильтрованием через стекловолоконный фильтр, растворители упаривали при пониженном давлении и остаток растворяли в 10 мл метанола. Раствор разбавляли добавлением 20 мл воды, при этом наблюдалось образование осадка белого цвета. Твердое вещество отделяли фильтрованием и высушивали. Выход: 85 мг, 68%. МС (ESI+): 709,0 (М+Н)+, МС
(ESI-): 706,5 (М-Н)-.
Пример 3
7-[4-{4-[(5S)-5-(Ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-(2,6-диаминогексаноилокси)пиперидин-1-ил]-1-циклопропил-6-фтор-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоновая кислота
Стадия 1
трет-Бутиловый эфир 4-{4-[(5S)-5-(ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-гидроксипиперидин-1-карбоновой кислоты
Указанное соединение получали при взаимодействии 3,83 г трет-бутилового эфира 1-окса-6-азаспиро[2.5]октан-6-карбоновой кислоты (WO 0204462) (MM: 213,28, 18 ммолей) и 4,02 г N-[(5S)-{3-(3-фтор-4-гидроксифенил)}-2-оксооксазолидин-5-илметил]ацетамида (MM: 268,246, 15 ммолей) в присутствии 3,1 г карбоната калия (ММ: 138,20, 22,5 ммоля) в 30 мл диметилформамида, аналогично тому, как описано в примере 1, стадия 5. Выход: 4,89 г, 67%. МС (ESI+): 482,6 (М+Н)+.
Стадия 2
трет-Бутиловый эфир 4-{4-[(5S)-5-(ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-(2,6-бис-бензилоксикарбониламиногексаноилокси)пиперидин-1-карбоновой кислоты
В суспензию 96 мг трет-бутилового эфира 4-{4-[5-(5S)-(ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-гидроксипиперидин-1-карбоновой кислоты (ММ: 481,52, 0,2 ммоля), 195 мг Z-Lys(Z)-OH (MM: 414,46, 0,4 ммоля) и 49 мг 4-диметиламинопиридина (MM: 122,17, 0,4 ммоля) в 2 мл дихлорметана при перемешивании при комнатной температуре добавляли 115 мг гидрохлорида N-(3-диметиламинопропил)-N′-этилкарбодиимида (ММ: 191,70, 0,6 ммоля) и реакционную смесь перемешивали в течение ночи. Смесь разбавляли добавлением 20 мл этилацетата, органический слой последовательно промывали 10 мл 1 н. соляной кислоты, 20 мл воды и 20 мл солевого раствора, сушили над сульфатом магния, фильтровали и фильтрат упаривали досуха. Остаток очищали хроматографией на силикагеле (элюент: дихлорметан/метанол, 9:1), при этом получали бесцветное вязкое масло. Выход: 150 мг, 88%. МС (ESI+): 878,8 (М+Н)+.
Стадия 3
Гидрохлорид 4-{4-[(5S)-5-(ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}пиперидин-4-илового эфира 2,6-бис-бензилоксикарбониламиногексановой кислоты
200 мг трет-бутилового эфира 4-{4-[5-(5S)-(ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-(2,6-бис-бензилоксикарбониламиногексаноилокси)пиперидин-1-карбоновой кислоты (ММ: 977,97, 0,22 ммоля) растворяли в 4 мл 1,25 М раствора сухого HCl в метаноле. Реакционную смесь перемешивали при 40°С в течение 2 ч, растворитель удаляли перегонкой при пониженном давлении, при этом получали твердое вещество грязно-белого цвета. Выход: 178 мг, колич. МС (ESI+): 778,8 (М+Н)+.
Стадия 4
7-[4-{4-[(5S)-5-(Ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-(2,6-бис-бензилоксикарбониламиногексаноилокси)пиперидин-1-ил]-1-циклопропил-6-фтор-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоновая кислота
Указанное соединение получали при взаимодействии 62 мг 7-хлор-1-циклопропил-6-фтор-1,4-дигидро-4-оксо[1,8]нафтиридин-3-карбоновой кислоты (ММ: 282,66, 0,25 ммоля), 178 мг гидрохлорида 4-{4-[5-(5S)-(ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}пиперидин-4-илового эфира 2,6-бис-бензилоксикарбониламиногексановой кислоты (ММ: 814,31, 0,22 ммоля) и 48 мг триметилхлорсилана (ММ: 108,64, 0,44 ммоля) в присутствии 90 мг триэтиламина (ММ: 101,19, 0,88 ммоля) в 1 мл N-метилпирролидин-2-она аналогично тому, как описано в примере 1, стадия 7. Выход: 94 мг, 42%. МС (ESI+): 1025,3 (М+Н)+.
Стадия 5
7-[4-{4-[(5S)-5-(Ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-(2,6-диаминогексаноилокси)пиперидин-1-ил]-1-циклопропил-6-фтор-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоновая кислота
Суспензию 94 мг 7-[4-{4-[(5S)-5-(ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-4-(2,6-бис-бензилоксикарбониламиногексаноилокси)пиперидин-1-ил]-1-циклопропил-6-фтор-4-оксо-1,4-дигидро[1,8]нафтиридин-3-карбоновой кислоты (ММ: 1024,05, 0,091 ммоля) и 20 мг 20% гидроксида палладия на активированном угле в 20 мл смеси дихлорметан/метанол/вода, 6:3:1, перемешивали при комнатной температуре в атмосфере водорода в течение 4 ч. Катализатор отделяли фильтрованием через стекловолоконный фильтр, растворители упаривали при пониженном давлении и остаток растворяли в 10 мл метанола. Раствор разбавляли добавлением 20 мл воды, при этом наблюдалось образование осадка белого цвета. Твердое вещество отделяли фильтрованием и высушивали. Выход: 29 мг, 43%. МС (ESI+): 757,0 (М+Н)+, МС
(ESI-): 755,2.
Пример 4
Моно-[4-{4-[(5S)-5-(ацетиламинометил)-2-оксооксазолидин-3-ил]-2-фторфеноксиметил}-1-(6-карбокси-8-циклопропи