Анализ сахаридных вакцин без взаимовлияния
Иллюстрации
Показать всеИзобретение относится к области медицины и биотехнологии и касается способа анализа сахаридных вакцин без взаимовлияния. Сущность изобретения основана на способах, позволяющих анализировать смешанные менингококковые сахариды различных серогрупп, в частности при комбинации сахаридов серогрупп С, W135 и Y по изобретению анализируют содержание сиаловой кислоты, глюкозы и галактозы. Результаты для глюкозы и галактозы используют непосредственно для количественного определения сахаридов серогрупп Y и W135, соответственно, а объединенное содержание глюкозы и галактозы вычитают из содержания сиаловой кислоты для количественного определения сахаридов серогруппы С и содержания свободных сахаридов в конъюгированных вакцинах. Преимущество изобретения заключается в упрощении контроля качества вакцин, содержащих капсульные сахариды различных серогрупп. 3 н. 9 з.п. ф-лы, 4 табл., 19 ил.
Реферат
Все процитированные документы включены в настоящее описание в своей полноте посредством ссылки.
Область техники
Настоящее изобретение относится к области анализа и контроля качества вакцин, содержащих бактериальные капсульные сахариды, и в особенности - вакцин, в которых сахариды конъюгированы с носителем.
Предшествующий уровень техники
Иммуногены, содержащие капсульные сахаридные антигены, конъюгированные с белками-носителями, хорошо известны в данной области техники. Конъюгирование превращает Т-независимые антигены в Т-зависимые, таким образом, усиливая вторичный иммунный ответ и позволяя развиться протективному иммунитету; прототипом конъюгированных вакцин была вакцин против Haemophilus influenzae типа b (Hib) [см., например, главу 14 ссылки I]. С момента создания вакцины Hib были созданы также вакцины против Neisseria meningitidis (менингококк) и против Streptococcus pneumoniae (пневмококк). Также представляет интерес создание вакцин к другим организмам, например, Streptococcus agalactiae (стрептококк группы В) [2], Pseudomonas aeruginosa [3] и Staphylococcus aureus [4] (золотистый стафилококк).
Для применения у человека одобрены конъюгированные вакцины к N. meningitidis, ceрогруппе С, к ним относятся Menjugate™, Meningitec™ и NeisVac-C™. Сообщалось о смесях конъюгатов из каждой из серогрупп А, С, W135 и Y [см., например, ссылки 6-9], включая продукт Menactra™. К другим смесям конъюгированных антигенов относятся: (i) менингококковые смеси А/С [10, 11]; (ii) продукт PrevNar [12], содержащий семь пневмококковых конъюгатов; (iii) смешанные конъюгаты менингококка и Hib [13, 14]; и (iv) комбинированные конъюгаты менингококка, пневмококка и Hib [15].
При применении конъюгированных вакцин возникают проблемы стабильности и однородности от партии к партии. Например, для вакцин к Hib сообщалось о каталитической деполимеризации сахарида [16], а конъюгаты капсул менингококка серогруппы А легко гидролизуются [17]. Нестабильность конъюгатов приводит к нежелательному снижению эффективной дозы иммуногенного конъюгата с течением времени, вариабельности между партиями и повышению уровня неохарактеризованных продуктов распада. В ссылках 18 и 19 обсуждаются проблемы, касающиеся тестирования стабильности конъюгированных вакцин.
Количественный анализ гликоконъюгатов обычно включает первый этап гидролиза сахарида, причем затем анализ основывается на высвобожденных моносахаридах. Хотя такой анализ является относительно прямым для единичных конъюгатов (например, анионообменные хроматографические методы использовались для анализа гидролизированных конъюгатов Hib [20] и менингококков серогруппы А [21]), для комбинированных вакцин ситуация является более сложной, особенно если различные сахариды содержат одинаковые моносахаридные единицы. Например, капсульные сахариды менингококков серогрупп С, W135 и Y все содержат сиаловую кислоту, поэтому любой метод, основанный на анализе высвобожденной сиаловой кислоты, не будет способен различить три серогруппы.
Задачей изобретения является обеспечение усовершенствования количественной оценки сахаридов в конъюгированных вакцинах для оценки стабильности и целостности. В частности, задачей изобретения являются способы, которые могут использоваться для измерения единичных конъюгатов в рамках комбинированных менингококковых конъюгированных вакцин, и таким образом обеспечивают улучшение контроля качества и стабильности вакцин.
Раскрытие изобретения
Изобретение основано на способах, которые позволяют анализировать смешанные менингококковые сахариды различных серологических групп, даже если сахариды содержат одинаковые моносахаридные единицы. Изобретение, таким образом, обеспечивает способ анализа содержания сахаридов в композиции, причем:
(a) композиция содержит капсульный сахарид серологической группы С Neisseria meningitidis и один или оба из следующих: (i) капсульный сахарид серологической группы W135 Neisseria meningitidis; и/или (ii) капсульный сахарид серологической группы Y Neisseria meningitidis;
(b) способ включает этап анализа содержания сиаловой кислоты в композиции, и: (i) если композиция включает сахарид серологической группы W135, этап анализа содержания галактозы в композиции; (И) если композиция включает сахарид серологической группы Y, этап анализа содержания глюкозы в композиции;
(c) если композиция содержит сахарид серологической группы W135, содержание сахарида серологической группы W135 в композиции определяют по результатам анализа галактозы на этапе (b);
(d) если композиция содержит сахарид серологической группы Y, содержание сахарида серологической группы Y в композиции определяют по результатам анализа глюкозы на этапе (b);
(e) содержание сахарида серологической группы С в композиции определяют при сравнении результатов анализа сиаловой кислоты с: (i) если композиция включает сахарид серологической группы W135, но не серологической группы Y, с результатами анализа галактозы на этапе (b); (ii) если композиция включает сахарид серологической группы Y, но не серологической группы W135, с результатами анализа глюкозы на этапе (b); или (Hi), если композиция включает и сахарид серологической группы W135, и сахарид серологической группы Y, с объединенными результатами анализов глюкозы и галактозы на этапе (b).
Таким образом, при комбинации сахаридов серологических групп С, W135 и Y, по изобретению анализируют содержание сиаловой кислоты, глюкозы и галактозы. Результаты анализа глюкозы и галактозы используют для непосредственного количественного определения сахаридов серологических групп Y и W135, соответственно, а объединенное содержание глюкозы и галактозы вычитают из содержания сиаловой кислоты, чтобы количественно определить сахариды серологической группы С. Эти три серологических группы можно таким образом проанализировать даже притом, что их моносахаридный состав перекрывается. Изобретатели обнаружили, что исследования трех различных моносахаридов можно выполнять на одном и том же материале, без взаимовлияния между моносахаридами и без взаимовлияния любых других сахаридных материалов в композиции (например, стабилизаторов лиофилизации). Способ может использоваться для анализа общего содержания сахаридов и свободных сахаридов в конъюгированных вакцинах, он упрощает контроль качества вакцин, содержащих капсульные сахариды нескольких серологических групп.
В работе [22] описан способ анализа смесей альдозы, гексозамина и сиаловой кислоты без взаимного влияния (interference), но этот метод основан на ферментной обработке и получении химических производных. Напротив, способ по изобретению не требует таких этапов и, таким образом, является более быстрым и легким в применении. Более того, на ситуацию, описанную в [22], не влияет присущая ей проблема необходимости различения разных сахаридов, содержащих одинаковые моносахаридные единицы.
Изобретение обеспечивает также компьютерное устройство, адаптированное для выполнения способа по изобретению. В частности, изобретение обеспечивает компьютерную программу для анализа содержания сахаридов в композиции, как определено выше, включая программные модули для: (а) получения данных по содержанию сиаловой кислоты и по содержанию глюкозы и/или галактозы в образце; (b) вычисление по этим данным содержания капсульного сахарида серогруппы С и серогруппы W135 и/или Y. Изобретение также обеспечивает компьютерный программный продукт, включающий среду для хранения информации для считывания компьютером с содержащейся на ней компьютерной программой по изобретению.
Капсульные сахариды серологических групп С, W135 и Y
Способы изобретения предназначены для анализа смесей менингококковых капсульных сахаридов. Эти смеси включают капсульные сахариды (i) серологической группы С и (ii) любой или обеих из серологических групп W135 и Y, то есть C+W135, C+Y, или C+W135+Y. Также могут присутствовать дополнительные сахариды.
Капсульный сахарид серологической группы С представляет собой гомополимер (α29)-связанной сиаловой кислоты (N-ацетил нейраминовой кислоты, или 'NeuNAc'). Большинство штаммов серологической группы С имеет O-ацетильные группы в положении С-7 и/или С-8 остатков сиаловой кислоты, но приблизительно в 15% клинических изолятов эти O-ацетильные группы отсутствуют [23, 24]. По-видимому, ацетилирование не влияет на эффективность защиты (например, в отличие от продукта Menjugate™, в продукте NeisVac-C™ использован де-O-ацетилированный сахарид, но обе вакцины эффективны). Структура сахарида приведена на Фиг.13 и обозначается на письме следующим образом: →9)-Neu p NAc 7/8 ОАс-(а2→.
Сахарид серогрупы W135 представляет собой полимер дисахаридных единиц сиаловой кислоты - галактозы. Подобно сахариду серогруппы С он характеризуется вариабельным O-ацетилированием, но в положениях 7 и 9 сиаловой кислоты [25]. Структура приведена на Фиг.14 и обозначается на письме следующим образом: →4)-D-Neup NAc (7/90Ac)-α-(2→6)-D-Gal-α-(1→.
Сахарид серологической группы Y подобен сахариду серогруппы W135, за исключением того, что повторяющаяся дисахаридная единица содержит глюкозу вместо галактозы (см. Фиг.16). Подобно сахариду серогруппы W135 он характеризуется вариабельным O-ацетилированием в положениях 7 и 9 сиаловой кислоты [25]. Структура сахарида серогруппы Y приведена на Фиг.15 и обозначается на письме следующим образом: →4)-D-Neup5Ac(7/90Ac)-α-(2→6)-D-Glc-α-(1→.
Таким образом, в композиции, включающей капсульные сахариды серогрупп С, W135 и Y, содержатся три различных составляющих мономера (глюкоза, галактоза и сиаловая кислота), и эти три мономера присутствуют в смеси после гидролиза. Количество мономеров глюкозы в такой смеси прямо связано с количеством сахарида серогруппы Y в исходной композиции, а количество мономеров галактозы прямо связано с количеством сахарида W135. Однако для серогруппы С ситуация более сложная: сиаловая кислота является единственным мономером, доступным для количественного определения сахарида серогруппы С, но любое измерение количества сиаловой кислоты в смеси будет включать мономеры, полученные из сахаридов серогрупп W135 и Y. Изобретение позволяет преодолеть сложность такого анализа путем измерения содержания в смеси галактозы, глюкозы и сиаловой кислоты (по отдельности и/или одновременно), а затем: (а) использования содержания галактозы для количественного определения содержания серогруппы W135 до гидролиза; (b) использования содержания глюкозы для количественного определения содержания серогруппы Y до гидролиза; (с) использования разницы между содержанием сиаловой кислоты и общим содержанием глюкозы и галактозы для количественного определения содержания серогруппы С до гидролиза, т.е. молярное количество серогруппы С, вычисляют как молярное количество сиаловой кислоты минус молярное количество (глюкозы+галактозы). Вычитание молярного содержания глюкозы и галактозы из молярного содержания сиаловой кислоты корректирует взаимовлияние серогрупп W135 и Y и оставляет только сиаловую кислоту серогруппы С.
Изобретение может использоваться для анализа капсульных сахаридов различных длин. Например, Menjugate™ и Meningitec™ включают подобранные по размеру фрагменты (олигосахариды) полноразмерного сахарида серологической группы С, тогда как в Neis-Vac-C™ использован полноразмерный полисахарид. Изобретение может использоваться с олигосахаридами и/или с полноразмерными полисахаридами. Олигосахариды характеризуются степенью полимеризации (DP) меньшей, чем у нативных капсульных полисахаридов, присутствующих в бактериях, DP может в среднем составлять <30, например, от 10 до 25. DP можно легко измерить ионообменной хроматографией или колориметрическими анализами [26].
Анализ содержания моносахарида
Способ по изобретению включает этап анализа содержания сиаловой кислоты, галактозы (если присутствует серогруппа W135) и глюкозы (если присутствует серологическая группа Y). Если способ применяют для отслеживания наличия моносахаридных единиц в композиции (например, просто для отслеживания остаточных моносахаридов с ранних этапов производства, или для отслеживания возможного гидролитического высвобождения мономеров из конъюгата), тогда этот способ можно применять непосредственно к композиции. Как правило, однако, способ используется для того, чтобы измерить общее содержание сахаридов в композиции, так что перед анализом композицию гидролизуют до моносахаридов. Таким образом, способ по изобретению обычно включает этап обработки композиции с целью деполимеризации капсульных сахаридов для высвобождения составляющих их моносахаридов. Затем на деполимеризованной смеси высвободившихся моносахаридов можно проводить анализ содержания сиаловой кислоты и содержания галактозы и/или глюкозы.
Условия деполимеризации капсульных сахаридов до их составных моносахаридов известны в данной области техники. Например, сахарид серологической группы С можно гидролизовать для анализа общего содержания сахаридов обработкой 100 мМ НСl при 80°С в течение 2 часов [27]. Кислотный гидролиз с использованием трифторуксусной кислоты (ТФУ) может использоваться для гидролиза всех серологических групп С, W 135 и Y, причем для группы С предпочтительна немного более низкая температура инкубации, чтобы избежать разложения сиаловой кислоты (90°С, а не 100°С). Типичная обработка ТФУ включает добавление ТФУ до конечной концентрации 2М, с последующим нагревом до 90-100°С в течение 90 минут. После деполимеризации продукты гидролиза сахарида могут быть высушены, например, в вакуумной сушилке.
После деполимеризации композиция содержит смешанные моносахариды, полученные из серологических групп С и W135 и/или Y. Количества этих моносахаридов в смеси прямо связаны с количествами сахаридов в первоначальной композиции перед гидролизом, и, таким образом, количества исходных сахаридов можно определить, как описано выше. Количества можно определить в терминах количеств (например, молей) молекул, масс, отношений или концентраций. Обычно используют моли, поскольку сиаловая кислота имеет молекулярную массу, отличную от молекулярной массы глюкозы/галактозы, но можно использовать любую из этих единиц измерения взаимозаменяемо для оценки содержания сахаридов в смеси. Для количественного измерения аналитические результаты можно сравнивать со стандартом с известным содержанием конкретного сахарида.
Деполимеризованная смесь предпочтительно полностью гидролизуется до моносахаридов. Изобретатели обнаружили, что иногда происходит неполный гидролиз, приводящий к появлению смесей, в которых присутствуют дисахаридные фрагменты (т.е. Gal-NeuNAc для MenW135, и Glc-NeuNAc для MenY). Однако моносахариды высвобождаются с правильным теоретическим соотношением, и дисахариды не влияют на анализ моносахаридов, так что их наличие не вызывает сложностей.
Ход деполимеризации (например, для определения полного гидролиза до моносахаридов по сравнению с частичным гидролизом до олигосахаридов) можно отслеживать путем измерения степени полимеризации (DP) в смеси, используя известные методы, например ЯМР, масс-спектрометрию и т.д.
Методы количественного определения моносахаридов глюкозы, галактозы и сиаловой кислоты хорошо известны в данной области техники. Методы могут быть прямыми или косвенными (например, они могут включать получение производных моносахаридов, с последующим анализом, который коррелирует с первоначальным содержанием моносахаридов). Методы могут включить разделение двух/трех различных моносахаридов друг от друга, с последующим отдельным анализом, и в таком случае собственно измерение содержания моносахарида может быть одинаковым в каждом случае, со специфичностью, являющейся результатом разделения. Однако предпочтительно использовать методы, позволяющие анализировать сахариды в присутствии друг друга так, чтобы не требовалось их разделение перед анализом. Кроме того, для конъюгированных сахаридов можно использовать методы, в которых после деконъюгации носитель и сахарид не требуется разделять. Один из предпочтительных методов - это анионная хроматография, и особенно - высокоэффективная анионообменная хроматография (НРАЕС), обычно с импульсной амперометрической детекцией (PAD) [28, 29]. Системы HPAEC-PAD производятся компанией Dionex™ Corporation (Sunnyvale, CA), например, система BioLC™, использующая колонку типа РА1 [диаметр 10 мкм, полистироловый субстрат, 2% сшитый с дивинилбензолом, агломерированный с 500 нм бусинами MicroBead из латекса, функционализированного четвертичным аммонием (5% сшитого)] или РА10 [диаметр 10 мкм, этилвинилбензоловый субстрат, 55% сшитый с дивинилбензолом, агломерированный с 460 нм бусинами MicroBead с бифункциональным ионом четверичного аммония (5%
сшитым)]. Эти системы позволяют количественно анализировать индивидуальные сахариды в смесях без необходимости в получении производных или в разделении перед анализом. Для анализа сахарида может быть желательно отфильтровать другие соединения перед нанесением на колонку, и компания Dionex™ производит предколоночные уловители и фильтры (guards) для этой цели, например, амино-уловитель для отделения аминокислот, боратный уловитель и т.д.
Альтернативным способом для количественного определения моносахаридов глюкозы, галактозы и сиаловой кислоты в деполимеризованной смеси является ядерный магнитный резонанс (ЯМР). Однако исходя из простоты использования и высокой чувствительности предпочтительными являются хроматографические методы по изобретению.
После определения содержания сиаловой кислоты и содержания глюкозы и/или галактозы становится просто сравнить мольные количества каждого моносахарида в смеси, и таким образом вычислить количество капсульных сахаридов в исходной композиции.
Способ по изобретению обычно является деструктивным. Поэтому вместо того, чтобы проводить способ на всей композиции, более типично взять пробу интересующей композиции и провести анализ на этом образце.
Конъюгаты
Изобретение может применяться для анализа содержания сахаридов в вакцинах, и в особенности в вакцинах, содержащих конъюгированный сахарид. Ковалентное конъюгирование используется для усиления иммуногенности сахаридов путем преобразования их из Т-независимых в Т-зависимые антигены, что позволяет примирование для иммунологической памяти. Конъюгирование особенно применимо для педиатрических вакцин и является хорошо известным методом [например, описанным в ссылках с 30 по 39]. Сахариды могут быть связаны с носителями прямо [40, 41], но обычно используют линкер или спейсер, например, адипиновую кислоту, β-пропионамидо [42], нитрофенил-этиламин [43], галоацилгалиды [44], гликозидные связи [45], 6-аминокапро новую кислоту [46], ADH (алко-гольдегидрогеназа) [47], С4-С12 фрагменты [48], и т.д.
Типичными белками-носителями в конъюгатах являются бактериальные токсины или токсоиды, такие как токсоид дифтерии или токсоид столбняка. Производное дифтерийного токсина CRM197 [49-51] является белком-носителем в Menjugate™ и Meningitec™, тогда как токсоид столбняка используется в NeisVac™. Токсоид дифтерии используется в качестве носителя в Menactra™. К другим известным белкам-носителям относятся белок наружной мембраны N.meningitidis [52], синтетические пептиды [53, 54], белки теплового шока [55, 56], белки коклюша [57, 58], цитокины [59], лимфокины [59], гормоны [59], факторы роста [59], искусственные белки, включающие множественные эпитопы Т-клеток CD4+ человека из различных антигенов, полученных из патогенов [60], белок D из H.mfluenzae [61, 62], пневмококковый поверхностный белок PspA [63], белки поглощения железа [64], токсин А или В из C.difficile [65] и т.д. В композиции могут использоваться более одного белка-носителя, например, для снижения риска подавления носителя, а один белок-носитель может нести более одного сахаридного антигена [66]. Конъюгаты обычно характеризуются соотношением сахарид: белок (мас./мас.) от 1:5 (т.е. избыток белка) до 5:1 (т.е. избыток сахарида). Композиции могут содержать свободный белок-носитель в дополнение к конъюгатам [67].
В общем при использовании изобретения композиции, содержащие конъюгированные сахариды, можно анализировать двумя способами. В первом можно измерить общую концентрацию сахаридов для каждой серологической группы в композиции, например, перед выпуском вакцины (с регуляторной целью или с целью контроля качества), или для проверки концентраций после смешивания конъюгатов. Во втором способе можно измерить свободный неконъюгированный сахарид в композиции, например, для контроля неполного конъюгирования или контроля гидролиза конъюгата путем отслеживания увеличения концентрации свободного сахарида с течением времени. При выполнении обоих типов анализов для каждой серогруппы можно оценивать соотношение свободного сахарида и общего содержания сахаридов, что можно использовать для регуляторных целей или для целей контроля качества. В общем, желательно гарантировать, что вакцина содержит <25% (например, <20%, <15%, <10% и т.д.) каждого сахарида в свободной форме. Высокое содержание свободных сахаридов означает более низкую иммуногенную дозу конъюгата.
таким образом, изобретение обеспечивает способ анализа композиции, в котором:
(a) композиция включает конъюгат капсульного сахарида серологической группы с neisseria meningitidis и один или оба из следующих: (i) конъюгат капсульного сахарида серологической группы W135 neisseria meningitidis; и/или (ii) конъюгат капсульного сахарида серологической группы Y neisseria meningitidis;
(b) композиция может включать капсульные сахариды в неконъюгированной форме;
(c) содержание любых неконъюгированных капсульных сахаридов определяют способом по изобретению, как описано выше;
(d) содержание конъюгированных капсульных сахаридов определяют способом по изобретению, как описано выше;
и, при необходимости:
(e) отношение конъюгированный: неконъюгированный сахарид рассчитывают для одного или более капсульных сахаридов.
Этапы (с) и (d) можно осуществлять или в любом порядке, или одновременно.
Для отдельной оценки конъюгированных и неконъюгированных сахаридов их нужно разделить. Свободный (то есть неконъюгированный) сахарид в водной композиции можно отделить от конъюгированного сахарида различными способами, реакция конъюгирования изменяет различные химические и физические параметры сахарида, и отличия можно использовать для разделения. Например, для разделения свободного и конъюгированного сахарида можно применять сортировку по размерам, так как конъюгированный материал имеет более высокую массу благодаря белку-носителю. Предпочтительным методом сортировки по размерам является ультрафильтрация, и свободный сахарид может проходить через мембрану ультрафильтрации с соответствующим ограничением (например, 30 кда для носителя crm197), тогда как конъюгат будет задержан. Альтернативный метод состоит в применении твердофазной экстракции (spe), с использованием колонки или мембраны, задерживающей конъюгат, но позволяющей свободному сахариду проходить в виде элюата. Метод твердо-фазной экстракции является более быстрым и состоятельным, но сортировка по размерам применима более универсально. Как еще одна альтернатива, если конъюгаты были адсорбированы с адъювантом, то центрифугированием можно отделить адсорбированный конъюгат (осадок) от свободного сахарида (супернатант), высвобождающегося после гидролиза.
Таким образом, свободный сахарид можно отделить от общего сахарида и проанализировать отдельно, что позволяет определить количество неконъюгированного материала в композиции. Сравнение количества свободного сахарида с общим количеством сахарида легче, чем отдельный анализ двух пулов после разделения, особенно если конъюгированный материал остается на подложке во время разделения.
Дополнительные капсульные сахариды
Изобретение позволяет анализировать композиции, содержащие капсульные сахариды серологических групп C и W135 и/или Y n.meningitidis. Он может также применяться для анализа композиций, содержащих другие капсульные сахариды, например, капсульный сахарид серологической группы а n. meningitidis, капсульный сахарид н. influenzae b, и т.д.
Капсульный сахарид серологической группы а менингококка является гомополимером (α1→6)-связанного n-ацетил-d-маннозамин-1-фосфата, с частичным o-ацетилированием в положениях с3 и с4 (фиг.17). Ацетильные группы могут быть замещены блокирующими группами для предотвращения гидролиза [17], и такие модифицированные сахариды все равно являются сахаридами серологической группы а в терминах настоящего изобретения. Известны условия деполимеризации для капсульного сахарида серологической группы а [21], например, гидролиз тфу (трифторуксусной кислотой) при 100°с, как описано выше для других серологических групп. Альтернативный метод включает обработку dowex 50 н+, с последующим нагреванием в течение 1 часа при 100°с [68]. Высвобожденные мономеры маннозамин фосфата можно анализировать параллельно с глюкозой, галактозой и сиаловой кислотой, например, методом hpaec-pad (высокоэффективная анионообменная хроматография с импульсной амперометрической детекцией) [21].
Капсульный сахарид hib представляет собой полимер рибозы, рибита и фосфата. Сахарид известен как "prp" (поли-3-β-d-рибоза-(1,1)-d-рибитол-5-фосфат) и показан на фиг.18. Известны методы деполимеризации prp до моносахаридов для анализа hpaec-pad или 3р-ямр, например, инкубация с naoh при комнатной температуре в течение ночи [20]. Высвобожденные рибозу и рибит можно анализировать параллельно с глюкозой, галактозой и сиаловой кислотой.
Капсульный полисахарид серологической группы с представляет собой гомополимер α2→9~-связанных сиаловых кислот (также известен как коломиновая кислота). Предпочтительно, чтобы композиция, анализируемая по изобретению, не содержала каких-либо других гомополимеров сиаловой кислоты, например, капсульного сахарида серологической группы в менингококка (α2→8-связанные сиаловые кислоты), или капсульного сахарида e.coli k12 (со связями α2→8 и α2→9). В более общем смысле, если композиция, которая будет проанализирована, содержит капсульный сахарид, включающий мономер глюкозы, галактозы или сиаловой кислоты, то предпочтительно, чтобы этот капсульный сахарид дополнительно включал мономер или мономеры, являющиеся уникальными (в пределах смеси), для этого сахарида для облегчения смешанного анализа. Даже если мономеры одинаковы для сахаридов, наличие уникального мономера позволяет анализировать различные сахариды параллельно при использовании тех же принципов, что описаны для разделения менингококковых серогрупп C, W135 и Y.
Некапсульные сахаридные компоненты
если изобретение основано на анализе моносахарида в смеси, полученной из анализируемой композиции, предпочтительно, чтобы композиция не включала этот моносахарид в свободной форме (отличный от любых фоновых моносахаридов, полученных при гидролизе капсульного сахарида). Например, включение свободной сиаловой кислоты в анализируемую композицию может привести к завышенной оценке содержания серогруппы C. Тот же принцип применяется, если включены дисахариды и т.д., и затем они гидролизуются, например, присутствие сахарозы (глюкоза + фруктоза), или мальтозы или трегалозы (обе диглюкозы) может привести к завышенной оценке содержания серологической группы Y, а присутствие лактозы (глюкоза + галактоза) может привести к завышенной оценке содержания W135 и Y (и недооценке содержания серологической группы C).
Однако такие сахариды часто используются в составе вакцины (например, в качестве стабилизаторов [69,70], и есть два общих пути, которыми можно минимизировать и/или избежать этих проблем взаимовлияния. Согласно первому способу можно измерить исходные уровни этих соединений и затем вычесть из уровней в деполимеризованной смеси. Согласно второму эти компоненты можно удалить из композиции перед анализом, например, фильтрацией или диализом. Для удаления низкомолекулярных компонентов можно использовать мембраны ультрафильтрации, например, мембрану ik для удаления сахарозы (mw (молекулярная масса): 360).
Наличие моносахаридов, которые не содержатся в анализируемых капсульных сахаридах, обычно не приводит к проблемам взаимовлияния. Например, сахарные спирты могут быть включены в вакцину в качестве стабилизатора лиофилизации [71], но методом нраес-aed можно различить простой моносахарид и соответствующий моносахарид многоатомного спирта, например, моносахариды маннозу (обнаруживаемую в капсуле aerobacter aerogenes [72]) и маннит (стабилизатор), или рибозу и рибит [73].
Анализ несахаридных компонентов
наряду с анализом содержания сахаридов в композиции способ может включать анализ других компонентов или свойств, например, осмоляльности, рн, степени полимеризации для индивидуальных сахаридов или конъюгатов, содержание белка (особенно для белков - носителей), содержания алюминия, содержание детергента, содержание консерванта и т.д.
Изобретение обеспечивает способ количественного определения сахаридов отдельных серологических групп в смеси капсульных сахаридов, по меньшей мере, двух различных менингококковых серогрупп, причем: (а) различные серологические группы включают серологическую группу C и одну или обе из следующих: (i) серологическая группа W135 и/или (ii) серологическая группа Y; (b) способ включает этап деполимеризации капсульных сахаридов в смеси, с получением деполимеризованной смеси; и (с) различные серологические группы количественно оценивают, сравнивая моносахаридный состав деполимеризованной смеси.
Общие понятия
Термин "включающий" охватывает "включающий", а также "состоящий", например композиция, "включающая" X, может состоять исключительно из X или может включать что-либо дополнительно, например Х+Y.
Термин "по существу" не исключает "полностью", например, композиция, которая является "по существу свободной" от Y, может быть полностью свободной от Y. Где необходимо, в определении изобретения слово "по существу" может быть опущено.
Термин "около" относительно числового значения X означает, например, X±10%.
Следует отметить, что кольца сахаров могут существовать в открытой и закрытой форме, и что хотя в структурных формулах здесь приведены закрытые формы, открытые формы также охватываются изобретением.
Краткое описание чертежей
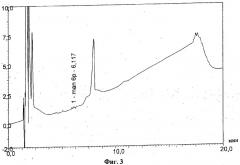
На фиг.1 и 2 приведен hpaec-pad анализ конъюгата менингококковой серологической группы а, лиофилизированного с применением стабилизатора маннита. Подобные анализы материала, где в качестве стабилизатора использовалась сахароза, приведены на фиг.3 и 4.
На фиг.5 и 6 приведены аналогичные анализы для конъюгата серологической группы Y, который не был лиофилизирован, а на фиг.7 и 8 приведен тот же анализ для конъюгата серологической группы W135.
На фиг.9-12 приведен hpaec-pad анализ смешанных конъюгатов серологических групп C, W135 и Y,
На фиг.13-15 приведены структурные формулы капсульных сахаридов менинго-кокковых серологических групп C (13), W135 (14), и Y (15). На фиг.16 показано различие между серологическими группами W135 и Y.
На фиг.17 приведена структурная формула капсульного сахарида серологической группы а менингококка.
На фиг.18 приведена структурная формула капсульного сахарида н. influenzae типа b.
На фиг.19 приведено изменение содержания свободного сахарида (%) в объединенных конъюгатах серологических групп C (♦), W135 (■) и Y (▲) в шести временных точках.
Варианты осуществления изобретения
Получение конъюгата и хроматографические методы
Получают антигены капсульных сахаридов серологических групп A, C, W135 и Y neisseria meningitidis и конъюгируют их с crm^?, как описано в ссылке 7.
Объединяют четыре конъюгата и получают водную композицию "menacwy".
В отдельной работе, конъюгат серологической группы а лиофилизируют в присутствии сахарозы или маннита, и получают смесь конъюгатов серологической группы C, W135 и Y ("mencwy").
Анализ содержания сахарида проводят в hpaec-pad хроматографической системе dionex™ согласно инструкциям изготовителя. Прибор оснащен модулем градиентного насоса (gp40 или gp50), импульсным амперометрическим детектором (ed40 или ed50) и автоматическим пробоотборником (as3500 или as50). Сахариды обнаруживают измерением электрического тока, генерируемого при их окислении на поверхности золотого рабочего электрода (электрод сравнения ag/agcl). Применяют трехпотенциальный сигнал (triple-potential waveform), используя следующие установки: е1=0,05 v; t1=400 мс; е2=0,75 v; t2=200 мс; е3=-0,15 v; t3=400 мс. Интеграция происходит от 200 до 400 мс при применении е1. Хроматографические данные объединяют и обрабатывают при использовании программного обеспечения peaknet 6.4.
Серологическая группа а
Лиофилизированный с маннитом состав сахарида серологической группы а исследуют методом hpaec-pad после хранения при 4°с в течение 3 месяцев. Композиции, содержащие конъюгат, отделяют от свободного сахарида при использовании колонки для твердофазной экстракции (spe) C4. Раствор, содержащий свободный сахарид, подвергают кислотному гидролизу тфу при 100°с в течение 2 часов. Затем смесь наносят на колонку dionex™ carbopac pa1, используя ра1 guard, градиентное элюирование и импульсную амперометрическую детекцию (pad детекцию), для обнаружения маннозамин-6-фосфата. Результаты приведены на фиг, 1.
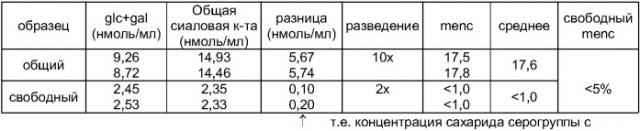
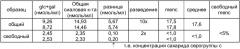
Проводят такой же анализ, но без отделения свободного сахарида твердофазной экстракцией. Результаты этого анализа приведены на фиг.2. При сравнении фиг.1 и 2, с учетом того, что в анализе на фиг.1 использовано разведение 1:2, а в анализе на фиг.2 использовано разведение 1:5, видно, что пик маннозамин-6-фосфата значительно ниже на фиг.1, что указывает на низкий уровень свободного сахарида в композиции. Количественный анализ показывает 10,7 мкг общего сахарида на флакон, причем содержание свободного сахарида 3,7%.
Лиофилизированный с сахарозой материал анализируют тем же самым способом, после восстановления в 600 мкл воды на флакон, с последующим объединением образцов для получения 2-3 мл на анализ. Перед нанесением на колонку spe C4 композицию подвергают ультрафильтрации с использованием мембраны 1 к (промывка 2 мл воды, загрузка 2 мл раствора образца, 3 цикла промывки по 2 мл воды, восстановление ультраконцентрата и доведение объема до 1 мл, разведение 1:1 до конечной концентрации nacl 0,9% для загрузки на spe). На фиг.3 показано, что наличие свободного сахарида в композиции незначительно, а конъюгированному материалу соответствует большой пик (фиг.4).
Серологические группы W135 и Y
До комбинирования с другими конъюгатами исходный конъюгат серологической группы Y подвергают анализу. Конъюгат отделяют от свободного сахарида, используя 30 кда мембрану для ультрафильтрации. Анализируемый материал гидролизуют тфу при 100°C, с последующим количественным анализом глюкозы в системе dionex™ при использовании колонки carbopac pa1, ловушки aminotrap, изократического элюирования и этапа регенерации, и детекции pad, согласно инструкциям изготовителя. Перед нанесением гидролизата на колонку нет необходимости в удалении носителя crm197. Неконъюгированный материал обнаруживается (фиг.5), но в меньшем количестве, чем общая глюкоза (фиг.6). Учитывая разные разведения, анализ этих фигур дает фракцию свободного сахарида 1,8%.
Исходный материал серологической группы W135 обрабатывают и анализируют тем же способом, но с детекцией галактозы, а не глюкозы (фиг.7 и 8). С учетом разных разведении при анализе этих чертежей получают фракцию свободного сахарида 6%.
Комбинированные конъюгаты
Конъюгаты серологических групп A, C, W135 и Y комбинируют с адъювантом - фосфатом алюминия, как описано в ссылке 7. Комбинацию конъюгата mencwy, которую хранили в течение 2 недель при 4°C, используют для восстановления лиофилизированного конъюгата меnа и спустя 48 часов проводят анализ, с центрифугированием для отделения адъюванта от конъюгатов. Комбинированные конъюгаты отделяют от свободных сахаридов двумя циклами ультрафильтрации при использовании 30 кда мембраны. Второй цикл уменьшает загрязнение гликоконъюгатом, который иногда проходит в растворенное вещество первого цикла. Сахариды анализируют до и после ультрафильтрации путем кислотного гидролиза с тфу при 90°с/100°с, с последующими двумя отдельными анализами hpaec-pad на колонке dionex™ carbopac pa1.
Для анализа серологической группы с колонку оборудуют carbopac pa1 guard и используют градиентное поэтапное элюирование. Эту колонку используют в режиме, при котором глюкоза и галактоза не разделяются, поскольку этот способ более быстрый. Результаты приведены на фиг.9 и 10. Для серологических групп W135 и Y колонку оборудуют ловушкой amino trap и используют из