Новые нитрофенилипритные и нитрофенилазиридиновые спирты и их соответствующие фосфаты и их применение в качестве нацеленных цитотоксических средств
Иллюстрации
Показать всеНастоящее изобретение относится к новым фосфатам нитрофенилипритных и нитрофенилазиридиновых спиртов общей формулы (I): где Х представляет в любом доступном положении кольца -CONH-; R представляет низший C1-6алкил; Y представляет в любом доступном положении кольца -N-азиридинил, -N(CH2CH2W)2 или
-N(CH2CHMeW)2, где каждый W независимо выбран из галогена или -ОSО2Ме; Z представляет в любом доступном положении кольца -NO2 или -SO2Me; и его фармацевтически приемлемым солям. Кроме того, изобретение относится к способу получения фосфатов формулы (I) и формул (Ia), (Ib) и (Iс) (частные случаи формулы (I)), к способу противоракового лечения и к способу уничтожения гипоксических клеток с использованием соединений формулы (I), а также к фармацевтической композиции на основе соединений формулы (I). Технический результат: получены новые соединения, которые могут быть применимы в качестве нацеленных цитотоксических средств. 12 н. и 2 з.п. ф-лы, 5 табл.
Реферат
Настоящее изобретение относится к новым нитрофенилипритным и нитрофенилазиридиновым спиртам, к их соответствующим фосфатам, к их применению в качестве нацеленных цитотоксических средств; в качестве биовосстановительных препаратов при гипоксических опухолях и к их применению при деструкции клеток, включая направленную на гены ферментно-пролекарственную терапию (GDEPT) и направленную на антитела ферментно-пролекарственную терапию (ADEPT) в сочетании с нитроредуктазными ферментами.
Применение селективных к опухолям пролекарств (относительно неактивных соединений, которые могут быть селективно превращены в более активные соединения in vivo) представляет собой ценную концепцию при терапии рака (см., например, Denny, Eur. J. Med. Chem. (2001) 36, 577).
Например, пролекарство может быть превращено в противоопухолевое средство под влиянием фермента, который может соединяться с моноклональным антителом, которое будет связываться с антигеном, ассоциированным с опухолью. Комбинация такого пролекраства с таким ферментом и конъюгатом моноклонального антитела представляет очень активное клиническое средство. Этот подход к терапии рака, часто именуемый как «направленная на антитела ферментно-пролекарственная терапия» (ADEPT), раскрыт в WO88/07378.
Еще один терапевтический подход, называемый «направленная на вирус ферментно-пролекарственная терапия» (VDEPT), был предложен в качестве способа обработки опухолевых клеток у пациентов, используя пролекарства. Опухолевые клетки нацеливаются вирусным вектором, несущим ген, кодирующий фермент, способный активировать пролекарство. Ген может быть транскрипционно регулируемым тканеспецифическими промоторными или усилительными последовательностями. Вирусный вектор входит в опухолевые клетки и экспрессирует фермент, чтобы пролекарство превратилось в активный препарат внутри опухолевых клеток (Huber et al., Proc. Natl. Acad. Sci. USA (1991) 88, 8039). Альтернативно, использовались невирусные способы доставки генов. Такие способы включают совместное осаждение фосфата кальция, микроинъекцию, липосомы, прямой захват ДНК и опосредованный рецепторами перенос ДНК. Их обзор представлен в публикации Morgan & French, Annu. Rev. Biochem., 1993, 62; 191. Термин «GDEPT» (направленная на гены ферментно-пролекарственная терапия) используется для включения как вирусных, так и невирусных систем доставки (Denny et al. US 6310237).
4-Нитроароматические соединения восстанавливаются флавопротеидными ферментами как млекопитающих, так и бактерий, которые воздействуют на ступенчатое добавление электронов в количестве до 6. Основной ферментный метаболит представляет собой обычно 4-электронный восстановленный вид (гидроксиламин).
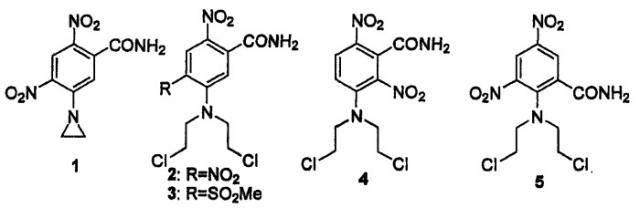
Сообщалось о ряде нитрофенилипритов и нитрофенилазиридинов в качестве пролекарств для применения при направленной на гены ферментно-пролекарственной терапии (GDEPT) в сочетании с ферментами нитроредуктазы. В частности, сообщается, что CB 1954 [5-(азиридин-1-ил)-2,4-динитробензамид] (1) [показано ниже] представляет собой субстрат для аэробной нитроредуктазы NTR (продукт гена nfsB), выделенный из E.coli B (Boland et al., Biochem. Pharmacol. 1991, 41, 867-875; Anlezark et al., Biochem. Pharmacol, 1992, 44, 2289-2295; Parkinson et al., J. Med. Chem. 2000, 43, 3624). Это соединение применялось в качестве пролекарства, применяемого как при ADEPT (Knox et al., Biochem. Pharmacol., 1995, 49, 1641-1647), так и при GDEPT (Bridgewater et al.,. Eur. J. Cancer, 1995, 31A, 2362-2370; Bailey et al., Gene Ther., 1996, 3, 1143-1150; Bailey and Hart, Gene Ther., 1997, 4,80-81; Green et al., Cancer Gene Ther., 1997, 4, 229-238), включая клиническое испытание (Chung-Faye et al., Clin. Cancer Res., 2001, 7, 2662-2668).
Аналогичным образом, динитрофенилиприт SN 23862 (2) представляет собой также субстрат для NTR и проявляет селективную токсичность в отношении линий клеток, которые эксперссируют фермент. Он активируется восстановлением нитрогруппы (Palmer et al., J. Med. Chem., 1995, 38, 1229; Kestell et al., Cancer Chemother. Pharmacol., 2000, 46, 365-374). Производное 4-SO2Me (3) также представляло собой субстрат (Atwell et al., Anti-Cancer Drug Des., 1996, 11, 553), как и региоизомеры (4) и (5) (Friedlos et al., J. Med. Chem., 1997, 40, 1270).
Однако соединения этого типа не были очень эффективными в качестве биовосстановительных пролекарств, когда эти соединения активировались в гипоксической опухолевой ткани ферментами эндогенной редуктазы, проявляющими соотношения активности 2-5 в гипоксических условиях относительно гипоксических условий в линии клеток дикого типа АА8, используя клоногенный анализ (Palmer et al., J. Med. Chem. 1996, 39, 2518-2528).
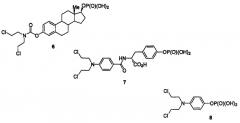
Были описаны некоторые фосфатные аналоги ипритов, предназначенные для солюбилизации соединений. Самым известным является эстрамустинфосфат (эстрацит; 6), который, как было показано, связывается с доменами, связывающими тубулин, на различных белках, связанных с микротрубочками (Moraga et al., Biochem. Biophys. Acta, 1992, 1121, 97-103), и которые, как было показано, активны при запущенном раке молочной железы (Keren-Rosenberg et al., Semin. Oncol., 1997, 24 (Suppl. 3), 26-29), но, как было показано, активируется NTR или гипоксией. Другое исследование также показало, что эстрамустинфосфат является сенсибилизатором к облучению (Kim et al., Int. J. Radiat. Oncol. Biol. Phys., 1994, 29, 555-557). Аналог фенолипритфосфата 7 представляет собой субстрат карбоксипептидазы, которая не активируется в гипоксических условиях (Matsui et al., патент Японии 07082280 А2, 1995), и солюбилизированный иприт 8 был описан в качестве ингибитора фосфатазы, но не было показано, что он активируется в гипоксических условиях (Workman, Chem.-Biol. Interact., 1978, 20, 103-112).
Целью настоящего изобретения является предоставление специфического класса нитрофенилипритов и азиридинов, несущих короткоцепочечные спирты и их соответствующих фосфатов для применения в качестве нацеливаемых цитотоксических средств или биовосстановительных пролекарств, или, по меньшей мере, предоставление общественности полезной альтернативы.
В первом аспекте настоящее изобретение предоставляет новые фосфатные соединения формулы I
где
Х представляет в любом доступном положении кольца -CONH-, -SO2NH-, -O-, -CH2-, -NHCO- или -NHSO2-;
R представляет низший С1-6алкил, необязательно замещенный одной или несколькими группами, включая гидрокси, амино и их N-оксиды или диалкиламино и их N-оксиды;
Y представляет в любом доступном положении кольца -N-азиридинил,
-N(CH2CH2W)2 или -N(CH2CHMeW)2, где каждый W независимо выбран из галогена или -OSO2Me;
Z представляет в любом доступном положении кольца -NO2, галоген, -CN, -CF3 или -SO2Me;
и их фармацевтически приемлемые соли и производные.
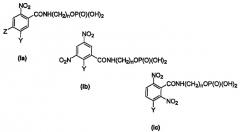
В предпочтительном варианте осуществления фосфатное соединение формулы (I) выбрано из соединения, представленного формулами (Ia), (Ib) или (Ic)
где Y может представлять
и где
n равен 1-6
Z представляет -NO2, галоген, -CN, -CF3 или -SO2Me; и
где каждый W независимо выбран из галогена или -OSO2Me;
и его фармацевтически приемлемых солей и производных.
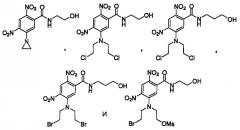
Предпочтительно, фосфатное соединение формулы (I) выбрано из группы, включающей:
2-[[2-[бис(2-бромэтил)амино]-3,5-динитробензоил]амино]этилдигидрофосфат;
3-[[5-[бис(2-хлорэтил)амино]-2,4-динитробензоил]амино]пропилдигидрофосфат;
3-[[5-[бис(2-бромэтил)амино]-2,4-динитробензоил]амино]пропилдигидрофосфат;
2-[[2-[бис(2-хлорэтил)амино]-3,5-динитробензоил]амино]этилдигидрофосфат;
2-[(2-хлорэтил)-2,4-динитро-6-[[[2-(2-фосфоноокси)этил]амино]карбонил]анилино]этилметансульфонат;
2-({2-[бис(2-бромпропил)амино]-3,5-динитробензоил}амино)этилдигидрофосфат;
2-[(2-бромэтил)-2,4-динитро-6-[[[2-(фосфоноокси)этил]амино]карбонил]анилино]этилметансульфонат;
2-[[2-[бис(2-йодэтил)амино]-3,5-динитробензоил]амино]этилдигидрофосфат;
2-[(2-йодэтил)-2,4-динитро-6-({[2-(фосфоноокси)этил]амино]карбонил)анилино]этилметансульфонат;
2-[(2-хлорэтил)-2,4-динитро-3-[[[3-(фосфоноокси)пропил]амино]карбонил]анилино]этилметансульфонат;
3-({3-[бис(2-бромэтил)амино]-2,6-динитробензоил}амино)пропилдигидрофосфат;
2-[(2-бромэтил)-2,4-динитро-3-[[[2-(фосфоноокси)этил]амино]карбонил]анилино]этилметансульфонат;
2-[(2-бромэтил)-2,4-динитро-3-[[[3-(фосфоноокси)пропил]амино]карбонил]анилино]этилметансульфонат и
2-[(2-йодэтил)-2,4-динитро-3-[[[3-(фосфоноокси)пропил]амино]карбонил]анилино]этилметансульфонат.
Во втором аспекте настоящее изобретение предоставляет спиртовые соединения формулы (II)
где
Х представляет в любом доступном положении кольца -CONH-, -SO2NH-, -O-, -CH2-, -NHCO- или -NHSO2-;
Y представляет в любом доступном положении кольца -N-азиридинил,
-N(CH2CH2W)2 или -N(CH2CHMeW)2, где каждый W независимо выбран из галогена или -OSO2Me;
Z представляет в любом доступном положении кольца -NO2, галоген, -CN, -CF3 или -SO2Me;
R представляет низший С1-6алкил, необязательно замещенный одной или несколькими группами, включая гидрокси, амино и их N-оксиды или диалкиламино и их N-оксиды; и их фармацевтически приемлемые соли и производные, при условии, что когда Z представляет NO2 и Y представляет -N(CH2CH2Cl)2, X и R вместе не могут представлять -CONHCH2(CHOH)CH2-, и, кроме того, при условии, что следующие соединения
исключаются.
В предпочтительном варианте осуществления соединение, содержащее спиртовую группу, формулы (II) выбрано из соединения, представленного формулами (IIa), (IIb) или (IIc)
где Y может представлять
и где
n равен 1-6
Z представляет -NO2, галоген, -CN, -CF3 или -SO2Me; и
где каждый W независимо выбран из галогена или -OSO2Me;
и их фармацевтически приемлемые соли и производные, при условии, что когда Z представляет -NO2 и Y представляет -N(CH2CH2Cl)2, X и R вместе не могут представлять -CONHCH2(CHOH)CH2-, и, кроме того, при условии, что следующие соединения
исключаются.
Предпочтительно, соединение формулы (II) выбрано из группы, включающей:
N-(2-гидроксиэтил)-5-[бис(2-бромэтил)амино]-2,4-динитробензамид;
N-(4-гидроксибутил)-5-[бис(2-бромэтил)амино]-2,4-динитробензамид;
N-(5-гидроксипентил)-5-[бис(2-бромэтил)амино]-2,4-динитробензамид;
N-(6-гидроксигексил)-5-[бис(2-бромэтил)амино]-2,4-динитробензамид;
5-[бис(2-бромэтил)амино]-N-(2-гидроксиэтил)-4-(метилсульфонил)-2-нитробензамид;
2-[(2-бромэтил)-5-[[(3-гидроксипропил)амино]карбонил]-2,4-динитроанилино]этилметансульфонат;
5-[бис(2-йодэтил)амино]-N-(2-гидроксиэтил)-2,4-динитробензамид;
2-[бис(2-хлорэтил)амино]-N-(2-гидроксиэтил)-3,5-динитробензамид;
2-[бис(2-бромэтил)амино]-N-(2-гидроксиэтил)-3,5-динитробензамид;
2-[бис(2-хлорэтил)амино]-N-(3-гидроксипропил)-3,5-динитробензамид;
2-[бис(2-бромэтил)амино]-N-(3-гидроксипропил)-3,5-динитробензамид;
2-[бис(2-хлорэтил)амино]-N-(4-гидроксибутил)-3,5-динитробензамид;
2-[бис(2-бромэтил)амино]-N-(4-гидроксибутил)-3,5-динитробензамид;
2-[бис(2-хлорэтил)амино]-N-(5-гидроксипентил)-3,5-динитробензамид;
2-[бис(2-бромэтил)амино]-N-(5-гидроксипентил)-3,5-динитробензамид;
2-[бис(2-хлорэтил)амино]-N-(6-гидроксигексил)-3,5-динитробензамид;
2-[бис(2-бромэтил)амино]-N-(6-гидроксигексил)-3,5-динитробензамид;
2-[бис(2-бромпропил)амино]-N-(2-гидроксиэтил)-3,5-динитробензамид;
2-((2-бромэтил)-2-{[(2-гидроксипропил)амино]карбонил}-4,6-динитроанилино)этилметансульфонат;
2-((2-бромэтил)-2-{[(2-гидроксипропил)амино]карбонил}-4,6-динитроанилино)этилметансульфонат;
2-((2-хлорэтил)-2-{[(2-гидроксиэтил)амино]карбонил}-4,6-динитроанилино)этилметансульфонат;
2-[бис(2-йодэтил)амино]-N-(2-гидроксиэтил)-3,5-динитробензамид;
2-((2-йодэтил)-2-{[(2-гидроксиэтил)амино]карбонил}-4,6-динитроанилино)этилметансульфонат;
2-[бис(2-бромэтил)амино]-N-(2-гидроксиэтил)-2,6-динитробензамид;
2-((2-бромэтил)-3-{[(2-гидроксиэтил)амино]карбонил}-2,4-динитроанилино)этилметансульфонат;
3-[бис(2-бромэтил)амино]-N-(3-гидроксипропил)-2,6-динитробензамид;
2-((2-бромэтил)-3-{[(3-гидроксипропил)амино]карбонил}-2,4-динитроанилино)этилметансульфонат;
3-[бис(2-бромэтил)амино]-N-(4-гидроксибутил)-2,6-динитробензамид;
2-((2-бромэтил)-3-{[(4-гидроксибутил)амино]карбонил}-2,4-динитроанилино)этилметансульфонат;
2-((2-хлорэтил)-3-{[(3-гидроксипропил)амино]карбонил}-2,4-динитроанилино)этилметансульфонат и
2-((2-йодэтил)-3-{[(3-гидроксипропил)амино]карбонил}-2,4-динитроанилино)этилметансульфонат.
В третьем аспекте изобретения предоставляется способ получения фосфатов, представленных общей формулы (I)
где
Х представляет в любом доступном положении кольца -CONH-, -SO2NH-, -O-, -CH2-, -NHCO- или -NHSO2-;
R представляет низший С1-6алкил, необязательно замещенный одной или несколькими группами, включая гидрокси, амино и их N-оксиды или диалкиламино и их N-оксиды;
Y представляет в любом доступном положении кольца -N-азиридинил или -N(CH2CH2W)2, где каждый W независимо выбран из галогена или -OSO2Me;
Z представляет в любом доступном положении кольца -NO2, галоген, -CN, -CF3 или -SO2Me;
и их фармацевтически приемлемых солей и производных;
включающий стадии
(i) фосфорилирования соединения формулы (II)
где
Х представляет в любом доступном положении кольца -CONH-, -SO2NH-, -O-, -CH2-, -NHCO- или -NHSO2-;
Y представляет в любом доступном положении кольца -N-азиридинил,
-N(CH2CH2W)2 или -N(CH2CHMeW)2, где каждый W независимо выбран из галогена или -OSO2Me;
Z представляет в любом доступном положении кольца -NO2, галоген, -CN, -CF3 или -SO2Me; и
R представляет низший С1-6алкил, необязательно замещенный одной или несколькими группами, включая гидрокси, амино и их N-оксиды или диалкиламино и их N-оксиды.
В четвертом аспекте предоставляется способ получения соединений формул (IIa), (IIb) или (IIc)
где Y может представлять
и где
n равен 1-6
Z представляет -NO2, галоген, -CN, -CF3 или -SO2Me; и
где W1 представляет собой галоген, и W2 представляет собой -OSO2Me;
и их фармацевтически приемлемых солей и производных;
включающий стадию
взаимодействия соединения формул (IIa'), (IIb') или (IIc'), необязательно при нагревании
где Y может представлять
где каждый W'1 и W'2 представляет собой галоген;
с эффективным количеством метансульфоната серебра (AgOMs) в растворителе с получением определенного выше соединения формул (IIa), (IIb) или (IIc).
Следует понимать, что в способе, определенном непосредственно выше, где W'1 и
W'2 представляют собой или йод, и/или бром, указанный йод и/или бром может быть частично или полностью замещен -ОSO2Me. В ситуации, где каждый или оба из W'1 и W'2 представляют собой хлор, указанный хлор является инертным и не может быть замещен -ОSO2Me.
Предпочтительно, растворитель выбирают из MeCN или другого полярного апротонного растворителя.
В пятом аспекте предоставляется способ получения соединения формул (Ia), (Ib) или (Ic)
где Y может представлять
и где
n равен 1-6
Z представляет -NO2, галоген, -CN, -CF3 или -SO2Me; и
где каждый W независимо выбран из галогена или -OSO2Me;
и его фармацевтически приемлемых солей и производных,
включающий стадию
фосфорилирования соединения, представленного формулами (IIa), (IIb) или (IIc)
где Y представляет
и где
n равен 1-6
Z представляет -NO2, галоген, -CN, -CF3 или -SO2Me; и
где W независимо выбран из галогена или -OSO2Me;
и его фармацевтически приемлемых солей и производных.
В шестом аспекте предоставляется соединение формулы (I), формулы (Ia), (Ib) или (Ic) или формулы (IIa), (IIb) или (IIc), полученное любым из определенных выше способов получения.
В седьмом аспекте настоящее изобретение предоставляет способ применения в качестве пролекарств, подходящих для
(i) GDEPT (направленной на гены ферментно-пролекарственной терапии) или ADEPT (направленной на антитела ферментно-пролекарственной терапии) в сочетании, по меньшей мере, с одним нитроредуктазным ферментом; или
(ii) применения в качестве одного или нескольких селективных для гипоксии цитотоксинов,
включающий стадию введения соединения формулы (I), как определено выше, или соединения формулы (II)
где
Х представляет в любом доступном положении кольца -CONH-, -SO2NH-, -O-, -CH2-, -NHCO- или -NHSO2-;
Y представляет в любом доступном положении кольца -N-азиридинил,
-N(CH2CH2W)2 или -N(CH2CHMeW)2, где каждый W независимо выбран из галогена или -OSO2Me;
Z представляет в любом доступном положении кольца -NO2, галоген, -CN, -CF3 или -SO2Me;
R представляет низший С1-6алкил, необязательно замещенный одной или несколькими группами, включая гидрокси, амино и их N-оксиды или диалкиламино и их N-оксиды; и их фармацевтически приемлемых солей и производных;
или их смесь в терапевтически эффективном количестве для нацеливания на опухолевые клетки у субъекта.
Предпочтительно, нитроредуктазный фермент кодируется геном nfsB или E.coli, или ортологичными генами у вида Clostridia.
Предпочтительно, способ включает дополнительную стадию облучения опухолевых клеток.
В восьмом аспекте настоящее изобретение предоставляет способ применения в качестве пролекарств, подходящих для GDEPT (направленной на гены ферментно-пролекарственной терапии) или ADEPT (направленной на антитела ферментно-пролекарственной терапии) в сочетании, по меньшей мере, с одним нитроредуктазным ферментом, в качестве противоракового средства, включающий стадию введения соединения формулы (I), как определено выше, или соединения формулы (II)
где
Х представляет в любом доступном положении кольца -CONH-, -SO2NH-, -O-, -CH2-, -NHCO- или -NHSO2-;
Y представляет в любом доступном положении кольца -N-азиридинил,
-N(CH2CH2W)2 или -N(CH2CHMeW)2, где каждый W независимо выбран из галогена или -OSO2Me;
Z представляет в любом доступном положении кольца -NO2, галоген, -CN, -CF3 или -SO2Me;
R представляет низший С1-6алкил, необязательно замещенный одной или несколькими группами, включая гидрокси, амино и их N-оксиды или диалкиламино и их N-оксиды; и их фармацевтически приемлемых солей и производных;
или их смесь в терапевтически эффективном количестве для нацеливания на опухолевые клетки у субъекта.
Предпочтительно, нитроредуктазный фермент кодируется геном nfsB или E.coli, или ортологичными генами у вида Clostridia.
Предпочтительно, способ включает дополнительную стадию облучения опухолевых клеток.
Следует понимать, что при ADEPT может быть необходимой подача восстанавливающего ко-фактора, поскольку они могут не присутствовать в значительных концентрациях снаружи клеток. Предусматривается, что синтетический ко-фактор можно использовать для стимуляции активации пролекарства аналогами внутриклеточного фермента. Аналогичная проблема не возникает при GDEPT, потому что в значительных концентрациях имеется несколько внутриклеточных восстанавливающих ко-факторов, таких как аналоги NADH и NADPH.
В девятом аспекте настоящее изобретение предоставляет способ обеспечения противоракового лечения, где соединение формулы (I), как определено выше, вводят в эффективном количестве субъекту.
Предпочтительно, количество указанного соединения составляет примерно от 20% до 100% от максимально переносимой дозы для указанного субъекта.
Предпочтительно, способ включает еще одну стадию воздействия на опухолевые клетки облучением или химиотерапевтическими средствами.
В десятом аспекте настоящего изобретения предоставляется способ деструкции клеток с использованием, по меньшей мере, одного нитроредуктазного фермента, включающий стадию введения соединения формулы (I), как определено выше, или соединения формулы (II)
где
Х представляет в любом доступном положении кольца -CONH-, -SO2NH-, -O-, -CH2-, -NHCO- или -NHSO2-;
Y представляет в любом доступном положении кольца -N-азиридинил,
-N(CH2CH2W)2 или -N(CH2CHMeW)2, где каждый W независимо выбран из галогена или -OSO2Me;
Z представляет в любом доступном положении кольца -NO2, галоген, -CN, -CF3 или -SO2Me;
R представляет низший С1-6алкил, необязательно замещенный одной или несколькими группами, включая гидрокси, амино и их N-оксиды или диалкиламино и их N-оксиды; и их фармацевтически приемлемых солей и производных; или их смесь в количестве, эффективном для разрушения клеток, где указанные клетки экспрессируют, по меньшей мере, один нитроредуктазный фермент.
Предпочтительно, клетки, которые являются мишенью для деструкции, являются опухолевыми клетками в ткани у субъекта.
Предпочтительно, способ деструкции клеток с использованием, по меньшей мере, одного нитроредуктазного фермента обеспечивается технологией ADEPT или GDEPT.
В одиннадцатом аспекте настоящего изобретения предоставляется фармацевтическая композиция, включающая терапевтически эффективное количество соединения формулы (I) или соединения формулы (II)
где
Х представляет в любом доступном положении кольца -CONH-, -SO2NH-, -O-, -CH2-, -NHCO- или -NHSO2-;
Y представляет в любом доступном положении кольца -N-азиридинил,
-N(CH2CH2W)2 или -N(CH2CHMeW)2, где каждый W независимо выбран из галогена или -OSO2Me;
Z представляет в любом доступном положении кольца -NO2, галоген, -CN, -CF3 или -SO2Me;
R представляет низший С1-6алкил, необязательно замещенный одной или несколькими группами, включая гидрокси, амино и их N-оксиды или диалкиламино и их N-оксиды; и их фармацевтически приемлемых солей и производных, или их смеси и фармацевтически приемлемый эксципиент, адъювант, носитель, буфер или стабилизатор.
Фармацевтически приемлемый эксципиент, адъювант, носитель, буфер или стабилизатор должен быть предпочтительно нетоксичным и не должен мешать эффективности активности ингредиента. Точная природа носителя или другого вещества будет зависеть от пути введения, который может быть пероральным или путем инъекции, такой как кожная, подкожная или внутривенная. Следует понимать, что эти факторы могут быть легко определены специалистом в данной области без ненужного экспериментирования.
Фармацевтические композиции для перорального введения могут быть в форме таблетки, капсулы, порошка или жидкости. Таблетка может включать твердый носитель или адъювант. Жидкие фармацевтические композиции в целом включают жидкий носитель, такой как воду, вазелиновое масло, животные или растительные масла, минеральное масло или синтетическое масло. Могут быть включены физиологический солевой раствор, декстроза или другой раствор сахарида или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль. Капсула может включать твердый носитель, такой как желатин.
Для внутривенной, кожной или подкожной инъекции активный ингредиент должен быть в форме парентерально приемлемого водного раствора, который свободен от пирогенов и имеет подходящие рН, изотоничность и устойчивость. Специалисты в данной области вполне способны получить соответствующие растворы, используя, например, изотонические носители, такие как раствор хлорида натрия для инъекций, раствор Рингера для инъекций, молочнокислый раствор Рингера для инъекций. При необходимости могут быть включены консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки.
В двенадцатом аспекте настоящего изобретения предоставляется применение при изготовлении лекарственного средства эффективного количества соединения формулы (I), как определено выше, или соединения формулы (II)
где
Х представляет в любом доступном положении кольца -CONH-, -SO2NH-, -O-, -CH2-, -NHCO- или -NHSO2-;
Y представляет в любом доступном положении кольца -N-азиридинил,
-N(CH2CH2W)2 или -N(CH2CHMeW)2, где каждый W независимо выбран из галогена или -OSO2Me;
Z представляет в любом доступном положении кольца -NO2, галоген, -CN, -CF3 или -SO2Me;
R представляет низший С1-6алкил, необязательно замещенный одной или несколькими группами, включая гидрокси, амино и их N-оксиды или диалкиламино и их N-оксиды; и их фармацевтически приемлемых солей и производных, или их смеси для применения при (i) GDEPT или (ii) ADEPT в качестве селективного для гипоксии цитотоксина для нацеливания на раковые клетки у нуждающегося в этом субъекта.
В тринадцатом аспекте настоящего изобретения предоставляется применение при изготовлении лекарственного средства эффективного количества соединения формулы (I), как определено выше, или соединения формулы (II)
где
Х представляет в любом доступном положении кольца -CONH-, -SO2NH-, -O-, -CH2-, -NHCO- или -NHSO2-;
Y представляет в любом доступном положении кольца -N-азиридинил,
-N(CH2CH2W)2 или -N(CH2CHMeW)2, где каждый W независимо выбран из галогена или -OSO2Me;
Z представляет в любом доступном положении кольца -NO2, галоген, -CN, -CF3 или -SO2Me;
R представляет низший С1-6алкил, необязательно замещенный одной или несколькими группами, включая гидрокси, амино и их N-оксиды или диалкиламино и их N-оксиды; и их фармацевтически приемлемых солей и производных, или их смеси для применения при терапии для деструкции клеток для нацеливания на раковые клетки у нуждающегося в этом субъекта.
Хотя соединения настоящего изобретения обычно используются для нацеливания на опухолевые клетки или опухолевые ткани у людей, их можно применять для нацеливания на опухолевые клетки или ткани у других субъектов теплокровных животных, таких как другие приматы, сельскохозяйственные животные, такие как крупный рогатый скот, спортивные животные и домашние животные, такие как лошади, собаки и кошки.
Используемый во всем описании термин «терапевтически эффективное количество» следует понимать как количество соединения формулы (I) или формулы (II), как определено выше, или любого из соединений Ia-Ic или IIa-IIc, как определено выше, или их смеси, которое достаточно для проявления благоприятного эффекта на субъект с раковыми клетками. Действительное количество, частота и динамика введения будут зависеть от природы и тяжести подвергаемого лечению заболевания. Назначение лечения находится в сфере ответственности врачей общей практики и других врачей.
Используемый во всем описании термин «галоген» включает хлор, бром или йод.
Следует понимать, что соединения изобретения, определенные выше, можно вводить отдельно или в комбинации с другими видами лечения, в частности, лучевой терапией и цитотоксическими химиотерапевтическими препаратами, или одновременно, или последовательно, в зависимости от подлежащего лечению состояния.
Используемый во всем описании термин «их фармацевтически приемлемые производные и соли» включают соли, производные кислот, образованные из хлористоводородной, серной, фосфорной, уксусной, лимонной, щавелевой, малоновой, салициловой, яблочной, фумаровой, янтарной, аскорбиновой, малеиновой, метансульфоновой, изетионовой кислот и им подобных, и соли, производные оснований, образованные из карбоната натрия и калия, гидроксида натрия и калия, аммиака, триэтиламина, триэтаноламина и им подобных.
Используемый во всем описании термин «деструкция клеток» следует понимать как уничтожение клеток, которые были подвергнуты генной инженерии для экспрессии фермента, такого как нитроредуктаза, введением пролекарства, которое активировано этим ферментом. В результате, деструкцию клеток можно использовать для селективной деструкции определенных клеток или тканей-мишеней посредством, например, специфической ферментативной экспрессии нитроредуктазы, которая специфически экспрессирована тканью и которую затем можно использовать для активации пролекарства в активный метаболит для деструкции определенных клеток или тканей-мишеней (Gusterson et al. Endocrine Related Cancer, 1997, 4, 67-74).
Выражение «по существу минимальный побочный эффект» следует понимать как означающий, что уничтожение примыкающих, не являющихся мишенью клеток является минимальным из-за наличия небольшой или отсутствия диффузии между клетками, являющимися и не являющимися мишенью активированного метаболита, который возникает в результате ферментативной активации соединения формулы (I) или формулы (II), определенного выше, или любого из соединений Ia-Ic или IIa-IIc, определенных выше, или их смеси.
Фармацевтически приемлемые соли формулы (I) включают основные или кислотные соединения формулы (I), которые образуют фармацевтически приемлемые соли и с органическими, и с неорганическими кислотами и/или органическими и неорганическими основаниями. Примерами подходящих кислот для образования солей являются хлористоводородная, серная, фосфорная, уксусная, лимонная, щавелевая, малоновая, салициловая, яблочноая, фумаровая, янтарная, аскорбиновая, малеиновая, метансульфоновая, изетионовая кислоты и им подобные. Примерами подходящих оснований для образования соли являются карбонат натрия и калия, гидроксид натрия и калия, аммиак, триэтиламин, триэтаноламин и им подобные.
Дальнейшие аспекты настоящего изобретения станут очевидными из следующего описания, представленного только в виде примера и со ссылкой на сопровождающие схемы синтеза.
Примеры соединений формулы (I), где Х представляет собой -CONH-, можно получить способами, приведенными на схеме 1, где Z является таким, как определено выше для формулы (I).
В следующих таблицах 1а и 2а представлены физические данные для соединений общей формулы (I) и (II), представляющих их и способных быть полученными способами изобретения.
где Y может представлять
| Таблица 1а Репрезентативные примеры исходных спиртов | |||||||
| No | Z | Y | Y (W 1 ,W 2 ) | n | Т.пл. | Формула или ссылка | Анализы |
| IIa-1 | NO2 | азиридины | 2 | 192-193 | Ссылка 1 | C,H,N | |
| IIa-2 | NO2 | - | Cl,Cl | 2 | Ссылка 2 | ||
| IIa-3 | NO2 | - | Cl,Cl | 3 | 90-91 | Ссылка 4 | C,H,N,Cl |
| IIa-7 | NO2 | - | Br,Br | 2 | 151-152 | C13H16Br2N4O6 | C,H,N,Br |
| IIa-7s | SO2Me | - | Br,Br | 2 | 126-127 | C14H19Br2N3O6S | C,H,N |
| IIa-8 | NO2 | - | Br,Br | 3 | 85-86 | Ссылка 4 | C,H,N,Br |
| IIa-9 | NO2 | - | Br,Br | 4 | 123-124 | C15H20Br2N4O6 | C,H,N,Br |
| IIa-10 | NO2 | - | Br,Br | 5 | смола | C15H22Br2N4O6 | HRMS |
| IIa-11 | NO2 | - | Br,Br | 6 | смола | C17H24Br2N4O6 | HRMS |
| IIa-12 | NO2 | - | Br,OMs | 2 | Ссылка 2 | ||
| IIa-13 | NO2 | - | Br,OMs | 3 | смола | C16H21BrN4O9S | HRMS |
| IIa=l4 | NO2 | - | I,I | 2 | 142-143 | C13H16I2N4O6 | C,H,N,I |
| IIb-1 | азиридины | 6 | 189-192 | C15H20N4O6 | C,H,N | ||
| IIb-2 | - | Cl,Cl | 2 | 109-111 | Cl3H16Cl2N4O6 | C,H,N | |
| IIb-3 | - | - | Cl,Cl | 3 | 89-91 | Cl4Hl8Cl2N4O6 | C,H,N,C1 |
| IIb-4 | - | - | Cl,Cl | 4 | смола | C15H20Cl2N4O6 | HRMS |
| IIb-5 | - | - | Cl,Cl | 5 | смола | C16H22Cl2N4O6 | HRMS |
| IIb-6 | - | - | Cl,Cl | 6 | смола | C17H24Cl2N4O6 | HRMS |
| IIb-2m | Cl,OMs | 2 | смола | C14H19ClN4O9S | HRMS | ||
| IIb-7 | - | - | Br,Br | 2 | 105-108 | C13H16Br2N4O6 | C,H,N,Br |
| IIb-7a | - | - | Br,BrA | 2 | 127-130 | C15H20Br2N406 | C,H,N |
| IIb-8 | - | - | Br,Br | 3 | 89-94 | C14H18Br2N4O6 | C,H,N,Br |
| IIb-9 | - | - | Br,Br | 4 | смола | C15H20Br2N406 | HRMS |
| IIb-10 | - | - | Br,Br | 5 | смола | C16H22Br2N4O6 | HRMS |
| IIb-11 | - | - | Br,Br | 6 | смола | C17H24Br2N4O6 | HRMS |
| IIb-12 | - | - | Br,OMs | 2 | Ссылка3 | ||
| IIb-13 | - | - | Br,OMs | 3 | смола | C15H21BrN4O9S | HRMS |
| IIb-14 | - | - | I,I | 2 | 129-131 | C13H16I2N4O6 | C,H,N |
| IIb-15 | - | - | I,OMs | 2 | смола | C14H19IN4O9S | HRMS |
| IIc-6 | Cl,OMs | 3 | 104-109 | C15H21ClN4O9S | C,H,N | ||
| IIc-7 | - | - | Br,Br | 2 | смола | C13H16Br2N4O6 | HRMS |
| IIc-8 | - | - | Br,Br | 3 | смола | C14H18Br2N4O6 | HRMS |
| IIc-9 | - | - | Br,Br | 4 | смола | C15H20Br2N4O6 | HRMS |
| IIc-12 | - | - | Br,OMs | 2 | 94-97 | C14H18BrN4O9S | C,H,N |
| IIc-13 | - | - | Br,OMs | 3 | 115-117 | Ссылка3 | C,H,N |
| IIc-14 | - | - | Br,OMs | 4 | 114-117 | C16H23BrN4O9S | C,H,N |
| IIc-15 | I,OMs | 3 | 100-103 | C15H21IN4O9S | C,H,N | ||
| Aα-метилиприт |
Примечания
Ссылки на известные соединения.
1. Khan AH, Ross WC J. Tumor-growth inhibitory nitrophenylaziridines and related compounds. Structure-activity relations. II. Chem.-Biol. Int., 1971, 4, 11-22.
2. NZ Patent No.240785.
3. Co-pending NZ Application No. 521851.
4. Wilson WR, Pullen SM, Hogg A, Helsby NA, Hicks KO, Denny WA. Quantitation of bystander effects in nitroreductase suicide gene therapy using three-dimensional cell. Cancer Res., 2002, 62, 1425-1432.
Соединения таблицы 1а можно получить общими способами, представленными на схемах 2а-2k и проиллюстрированными ниже в примерах 1-20.
где Y может представлять
| Таблица 1b Примеры фосфатов формул Ia-Ic | ||||||
| No | Z | Y (Wi,W 2 ) | n | Т.пл. | Формула | Анализы |
| Ia-3P | NO2 | Cl,Cl | 3 | 195-200 | C14H19Cl2N4O9P | HRMS |
| Ia-8P | NO2 | Br,Br | 3 | 170-174 | C14H19Br2N4O9P | HRMS |
| Ib-2P | - | Cl,Cl | 2 | пена | C13H17Cl2N4O9P | HRMS |
| Ib-2mP |