Полипептид с антивирусной активностью, его получение и применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, в частности к генной инженерии, и может быть использовано в медикобиологической промышленности для получения активных препаратов интерлейкина-29 (IL-29). Предложены мутантные формы IL-29 (SEQ ID NO: 27, 29, 40, 41, 149 и 159) с заменой цистеинового остатка в положении, соответствующем положению 171 аминокислотной последовательности зрелого белка дикого типа, которые характеризуются корректным образованием внутримолекулярных дисульфидных связей и, соответственно, обеспечивают при экспрессии в гетерологичной системе получение полипептидов с антивирусной активностью в виде гомогенных препаратов. Описаны векторные конструкции и трансформированные этими конструкциями клетки-хозяева для экспрессии новых вариантов IL-29. 7 с. и 8 з.п. ф-лы, 37 табл.
Реферат
Цитокины играют важную роль в регулировании кроветворения и иммунных ответов, а также могут влиять на развитие лимфоцитов. Семейство цитокинов человека класса II включает субтипы интерферона-α (IFN-α), интерферон-β (IFN-β), интерферон-γ (IFN-γ), IL-10, IL-19 (патент США № 5985614), MDA-7 (Jiang et al., Oncogene 11, 2477-2486 (1995)), IL-20 (Jiang et al., Oncogene 11, 2477-2486 (1995)), IL-22 (Xie et al., J. Biol. Chem. 275, 31335-31339 (2000)) и AK-155 (Knappe et al., J. Virol. 74, 3881-3887 (2000)). Большинство цитокинов связывают и передают сигналы посредством цитокиновых рецепторов класса I или класса II. Члены семейства рецепторов цитокинов человека класса II включают интерферон-αR1 (IFN-αR1), интерферон-γ-R2 (IFN-γ-R2), интерферон-γ R1 (IFN-γ R1), интерферон-γR2 (IFN-γR2), IL-10R (Liu et al., J. Immunol. 152, 1821-1829 (1994)), CRF2-4 (Lutfalla et al., Genomics 16, 366-373 (1993)), IL-20Rβ (Blumberg et al., Cell 104, 9-19 (2001) (известен также как zcytor7 (патент США № 5945511) и CFR2-8 (Kotenko et al., Oncogene 19, 2557-2565 (2000)), IL-20Rβ (Blumberg et al., там же, (2001)) (известен также как DIRS1 (PCT WO 99/46379)), IL-22RA1 (рецептор-α1 для IL-22, сообщение направлено в HUGO на экспертизу) (известен также как IL-22R (Xie et al., J. Biol. Chem. 275, 31335-31339 (2000)), zcytor11 (патент США № 5965704) и CRF2-9 (Kotenko et al., Oncogene 19, 2557-2565 (2000)) и тканевый фактор.
Рецепторы цитокинов класса II обычно представляют собой димеры, образованные двумя отдельными цепями рецептора, субъединицами α и β рецептора (Stahl et al., Cell 74, 587-590 (1993)). В общем случае субъединицы α являются основными белками, связывающимися с цитокинами, а субъединицы β требуются для образования высоко аффинных участков для связывания, а также для передачи сигнала. Исключение составляет рецептор IL-20, в котором обе субъединицы необходимы для связывания с IL-20 (Blumberg et al., там же, (2001)).
Рецепторы цитокинов класса II идентифицируют по консервативной области связывания цитокина, размером приблизительно в 200 аминокислот (D200), расположенной во внеклеточной части рецептора. Указанная область связывания цитокина включает два домена фибронектина типа III (FnIII), каждый размером приблизительно 100 аминокислот (Bazan J.F., Proc. Natl. Acad. Sci. USA 87, 6934-6938 (1990); Thoreau et al., FEBS Lett., 282, 16-31 (1991)). Каждый домен FnIII содержит консервативные остатки Cys, Pro и Trp, которые определяют складчатую структуру семи β-цепей аналогично константной области иммуноглобулинов (Uze et al., J. Interferon Cytokine Res. 15, 3-26 (1995)). Консервативные структурные элементы семейства рецепторов цитокинов класса II позволяют идентифицировать новые члены указанного семейства на основании степени гомологичности первичной последовательности аминокислот.
Интерлейкины представляют собой семейство цитокинов, которые опосредуют иммунологические ответы, в том числе, воспалительные реакции. Центральное место в формировании иммунного ответа принадлежит Т-клетке, которая продуцирует многие цитокины и формирует приобретенный иммунитет к антигенам. Цитокины, продуцируемые Т-клеткой, подразделяют на тип 1 и тип 2 (Kelso, A. Immun. Cell Biol. 76: 300-317 (1998). Цитокины типа 1 включают IL-2, интерферон-гамма (IFN-γ), LT-α и участвуют в воспалительных ответах, в формировании иммунитета к вирусам, иммунитета к внутриклеточным паразитам и принимают участие в реакции отторжения трансплантата. Цитокины типа 2 включают IL-4, Il-5, IL-6, IL-10 и IL-13 и участвуют в гуморальных ответах, в формировании иммунитета к гельминтам и в аллергических ответных реакциях. Цитокины, которые имеют сходство так с типом 1, так и с типом 2, включают IL-3, GM-CSF и TNF-α. Ряд сведений позволяет предположить, что популяции Т-клеток, продуцирующих цитокины типа 1 и 2, предпочтительно мигрируют в различные типы воспаленной ткани.
С терапевтической точки зрения особый интерес представляют интерфероны (обзоры по интерферонам см. De Maeyer and De Maeyer-Guignard, “Interferons” в The Cytokine Handbook, 3 rd Edition, Thompson (ed.), pages 491-516 (Academic Press Ltd. 1998) и Walsh, Biopharmaceuticals: Biochemistry and Biotechnology, pages 158-188 (John Wiley & Sons 1998)). Интерфероны проявляют самую разнообразную биологическую активность и могут применяться для лечения некоторых аутоиммунных заболеваний, в частности, рака, а также для усиления иммунного ответа против инфекционных агентов, в том числе вирусов, бактерий, грибов и простейших. В настоящее время идентифицированы шесть форм интерферона, которые делят на две большие группы. Так называемые интерфероны “типа I” включают IFN-α, IFN-β, IFN-ω, IFN-δ и интерферон-τ. В настоящее время IFN-γ и один субкласс IFN-α являются единственными интерферонами типа II.
Интерфероны типа I, которые, как полагают, происходят от одного родительского гена, сохранили достаточно сходную структуру и способны осуществлять свое действие посредством одного и того же рецептора на поверхности. α-Цепь рецептора IFN-α/β человека содержит внеклеточную N-концевую область, которая обладает свойствами рецептора цитокина класса II. IFN-γ не обладает значительной степенью гомологии с IFN типа I или с IFN-α-субтипом типа II, однако, обладает рядом биологических активностей, сходных с IFN типа I.
Практикующие врачи используют преимущества, предоставляемые множественностью активности интерферонов, для лечения широкого круга состояний. Например, одна из форм IFN-α разрешена к применению в более чем 50 странах для лечения таких болезненных состояний как лейкемия “волосатых” клеток, почечная карцинома, карционома базальных клеток, злокачественная меланома, СПИД-ассоциированная саркома Капоши, множественная миелома, хроническая миелогенная лейкемия, не-ходжкинская лимфома, папилломатоз гортани, грибовидный микоз, остроконечная кондилома, хронический гепатит В, гепатит С, хронический гепатит D, и хронический не вирусный гепатит А, гепатит не-В/С. Администрация США по контролю за продуктами питания и лекарственными средствами одобрила применение IFN-β для лечения рассеянного склероза, хронических заболеваний нервной системы. IFN-γ применяют для лечения хронических гранулематозных заболеваний, при этом интерферон усиливает иммунный ответ пациента, чтобы разрушить инфекцию, вызванную бактериями, грибками, патогенными простейшими. Клинические исследования показывают также, что IFN-γ может применяться при лечении СПИДа, лейшманиоза и лепроматозной лепры.
IL-28, IL-28B и IL-29 составляют недавно открытое новое семейство белков, последовательность которых гомологичная последовательности интерферонов типа I и которые обладают геномной гомологией по отношению к IL-10. Указанное новое семейство описано в совместной патентной заявке РСТ WO 02/086087 и Sheppard et al., Nature Immunol. 4:63-68, 2003); оба документа включены в настоящее описание посредством ссылки. По своим способностям индуцировать антивирусное состояние в клетках IL-28 и IL-29 функционально напоминают интерфероны типа I, однако, в отличие от интерферонов типа I они не проявляют антипролиферативную активность против некоторых линий В-клеток.
Известно, что IL-28 и IL-29 имеют нечетное количество цистеинов (заявка РСТ WO 02/086087 и Sheppard et al., выше). Экспрессия рекомбинантных IL-28 и IL-29 может привести к гетерогенной смеси белков, образованной внутримолекулярными дисульфидными связями во многих конформациях. Разделение указанных форм может быть сложным и трудоемким. Поэтому желательно предоставить молекулы IL-28 и IL-29, которые после экспрессии дают один тип формирования внутримолекулярных дисульфидных связей, а также разработать способы формирования складчатой структуры и очистки указанных препаратов, с целью сохранения их гомогенности. Таким образом, в настоящем изобретении предлагаются композиции и способы получения гомогенных препаратов IL-28 и IL-29.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
В настоящем описании широко используют ряд терминов. С целью облегчения понимания изобретения приводятся следующие определения.
Если не указано иное, определения в единственном числе, “по крайней мере, один” обозначает один или более одного.
Термин “аффинная метка” применяется в настоящем описании для обозначения полипептидного сегмента, который может быть присоединен ко второму полипептиду, с целью очистки или детектирования второго пептида или же с целью создания участка для присоединения второго пептида к субстрату. В принципе, в качестве аффинной метки может применяться пептид или белок, для которого существует антитело или другой специфический связывающий агент. Аффинные метки включают полигистидиновую метку, белок А (Nilsson et al., EMBO J. 4: 1075, 1985; Nilsson et al., Methods Enzymol. 198: 3, 1991), глутатион-S-трансферазу (Smith and Johnson, Gene 67: 31, 1988), аффинную метку Glu-Glu (Grusenmeyer et al., Proc. Natl. Acad. Sci. USA 82: 7952-4, 1985), вещество Р, пептид Flag™ (Hopp et al., Biotechnology 6: 1204-10, 1988), пептид связывания стрептавидина или другой антигенный эпитоп или домен связывания. См. общие сведения в Ford et al., Protein Expression and Purification 2: 95-107, 1991. ДНК, кодирующие аффинные метки, доступны от коммерческих поставщиков (в частности, от компании Pharmacia Biotech, Пискатауэй, Нью-Джерси).
Термин “аллельный вариант” используется в настоящем описании для обозначения любой из двух или нескольких альтернативных форм гена, занимающих тот же самый хромосомный локус. Аллельный вариант обычно возникает в результате мутации и может привести к фенотипному полимофизму внутри популяции. Генная мутация может быть молчащей мутацией (изменений в кодируемом полипептиде не происходит) или может кодировать полипептиды, которые имеют измененную последовательность аминокислот. Термин аллельный вариант используется в настоящем описании также для обозначения белка, кодируемого аллельным вариантом гена.
Термины “аминоконцевой” и “карбоксиконцевой” используются в настоящем описании для обозначения положений в полипептидах. В соответствии с контекстом указанные термины применяют со ссылкой на конкретную последовательность или часть полипептида для обозначения близости или относительного положения. Например, некоторая последовательность, размещенная карбокситерминально относительно сравниваемой последовательности в полипептиде, располагается проксимально к карбоксильному концу сравниваемой последовательности, но не обязательно у карбоксильного конца полипептида полной длины.
Термин “пара комплемент/антикомплемент” обозначает неидентичные фрагменты которые в определенных условиях образуют не ковалентно связанную устойчивую пару. Например, биотин и авидин (или стрептавидин) являются прототипными членами пары комплемент/антикомплемент. Другими примерами пар комплемент/антикомплемент являются пары антитело/антиген (или гаптен или эпитоп), смысловая/антисмысловая полипептидные пары и т.п. В том случае, когда желательна последующая диссоциация пары комплемент/антикомплемент, сродство связывания пары комплемент/антикомплемент должно составлять <109 М-1.
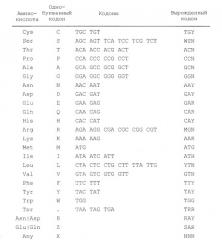
Термин “вырожденная нуклеотидная последовательность” обозначает последовательность нуклеотидов, которая включает один или несколько вырожденных кодонов (по отношению к сравниваемой молекуле полинуклеотида, кодирующего полипептид). Вырожденные кодоны содержат различные триплеты нуклеотидов, но кодируют один и тот же остаток аминокислоты (например, триплеты GAU и GAC каждый кодируют Asp).
Термин “экспрессирующий вектор” применяют для обозначения молекулы ДНК, линейной или циклической, включающей фрагмент, который кодирует представляющий интерес полипептид, операбельно присоединенный к дополнительным сегментам, обеспечивающим его транскрипцию. Подобные дополнительные сегменты включают последовательности промотора и терминатора транскрипции, а также могут включать одну или несколько точек начала репликации, один или несколько селектируемых маркеров, энхансер, сигнал полиаденилирования и т.д. Экспрессирующие векторы обычно получают из плазмидных или вирусных ДНК или же они могут содержать элементы и тех и других.
Термин “изолированный” применительно к полинуклеотидам обозначает полинуклеотид, который выделен из его естественной генной среды и таким образом освобожден от других посторонних или нежелательных кодирующих последовательностей и существует в форме, которая подходит для использования в системе продуцирования белка, полученной методами генной инженерии. Подобные изолированные молекулы представляют собой такие молекулы, которые выделены из естественной среды и включают кДНК и геномные клоны. Изолированные молекулы ДНК по настоящему изобретению свободны от других генов, с которыми они обычно связаны, но могут включать нативные 5' и 3' не транслируемые участки, такие как промоторы и терминаторы транскрипции. Идентификация ассоциированных участков должна быть понятна для специалистов в данной области техники (см., например, Dynan and Tijan, Nature 316: 774-78, 1985).
“Изолированный” (или “выделенный”) полипептид или белок представляет собой полипептид или белок, который находится в условиях, отличных от условий его естественного окружения, т.е. не в крови или в ткани животного. В предпочтительной форме изолированный полипептид практически не содержит других полипептидов, в особенности других полипептидов животного происхождения. Полипептиды предпочтительно предоставляют в высоко чистой форме, т.е. с чистотой более 95%, более предпочтительно, с чистотой более 99%. При использовании в этом контексте, термин “изолированный” не исключает присутствие того же самого полипептида в альтернативных физических формах, таких как димеры или иным образом гликозилированные или функционализованные формы.
При использовании термина “уровень” по отношению к иммунным клеткам, таким как NK-клетки, Т-клетки, в частности цитотоксические Т-клетки, В-клетки и т.п., повышенный уровень обозначает либо увеличенное количество клеток, либо повышенную активность функций клеток.
Термин “уровень” по отношению к вирусным инфекциям относится к изменению уровня вирусной инфекции и включает, но этим не ограничиваясь, изменение уровня CTLs или NK-клеток (как указано выше), уменьшенную вирусную нагрузку, повышенный титр антивирусного антитела, пониженные серологические уровни аланинаминотрансферазы или улучшение, которое определяют гистологическим анализом ткани-мишени или органа-мишени. Установление того, являются ли указанные изменения уровня значимой разницей или значимыми изменениями, легко может быть установлено специалистом в данной области техники.
Термин “операбельно связан” по отношению к сегментам ДНК обозначает, что сегменты расположены таким образом, что они согласованно выполняют предназначенную им функцию, например, транскрипция начинается у промотора и протекает далее через кодирующий сегмент к терминации транскрипции.
Термин “ортолог” обозначает полипептид или белок, полученный из одного вида, который является функциональным двойником полипептида или белка, выделенного из других видов. Различия в ортологах являются результатом видообразования.
“Паралоги” являются различимыми, но структурно родственными белками, производимыми организмом. Полагают, что паралоги возникают вследствие дубликации генов. Например, α-глобин, β-глобин и миоглобин являются паралогами по отношению друг к другу.
“Полинуклеотид” представляет собой одноцепочечный или двухцепочечный полимер, составленный из дезоксирибонуклеотидных или рибонуклеотидных оснований, которые читаются от 5'-конца к 3'-концу. Полинуклеотиды включают РНК и ДНК и могут быть выделены из природных источников, синтезированы in vitro или получены комбинированием природных или синтетических молекул. Размеры полинуклеотидов выражают в парах оснований (сокращенно “п.о.”), нуклеотидах (“н”) или тысячах оснований (“т.о.”). Если позволяет контекст, то последние два термина могут описывать полинуклеотиды, которые являются одноцепочечными или двухцепочечными. Если термин применяют по отношению к двухцепочечным молекулам, то его используют для обозначения полной длины и в этом случае следует понимать, что он эквивалентен термину “пары оснований”. Для специалиста должно быть очевидным, что две цепочки двухцепочечного полинуклеотида могут слегка различаться по своей длине, и их концы могут иметь уступы как результат ферментативного расщепления; таким образом, не все нуклеотиды внутри двухцепочечного полинуклеотида могут быть парными.
“Полипептид” представляет собой полимер, составленный остатками аминокислот, которые соединены пептидными связями независимо от того, продуцируются они в природе или получаются синтетически. Полипептид, содержащий меньше приблизительно 10 аминокислотных остатков, обычно называют “пептидом”.
Термин “промотор” используют в настоящем описании по его известному из области техники значению для обозначения части гена, содержащего последовательности ДНК, которые обеспечивают связывание РНК-полимеразы и инициацию транскрипции. Последовательности промотора обычно, но не всегда, располагаются у 5'-конца некодирующих участков генов.
“Белок” представляет собой макромолекулу, составленную одной или несколькими полипептидными цепочками. Белок может также содержать непептидные компоненты, такие как углеводные группы. Углеводы и другие непептидные заместители могут быть добавлены к белку в клетке, в которой белок продуцируется, и различаются в зависимости от типа клетки. Белки определяют в настоящем описании в терминах структур аминокислотного скелета; заместители, такие как углеводные группы, обычно не указываются, но они, тем не менее, могут присутствовать.
Термин “рецептор” обозначает ассоциированный с клеткой белок, который связывается с биоактивной молекулой (в частности, с лигандом) и опосредует влияние лиганда на клетку. Соединенные с мембраной рецепторы характеризуются мультипептидной структурой, которая включает внеклеточный домен связывания лиганда и внутриклеточный домен эффектора, который обычно принимает участие в передаче сигнала. Связывание лиганда с рецептором приводит к конформационным изменениям в рецепторе, которые вызывают взаимодействие между доменом эффектора и другой молекулой или другими молекулами в клетке. Указанное взаимодействие, в свою очередь, приводит к изменению обмена веществ в клетке. Результаты обмена веществ, которые связаны с взаимодействием рецептора и лиганда, включают транскрипцию гена, фосфорилирование, дефосфорилирование, усиление продукции циклических АМФ, мобилизацию клеточного кальция, мобилизацию мембранных липидов, адгезию клеток, гидролиз липидов инозитола и гидролиз фосфолипидов. В общем случае, рецепторы могут быть рецепторами, связанными с мембраной, цитозольными или ядерными рецепторами; мономерными (например, рецептор тироидстимулирующего гормона, бета-адренергический рецептор) или мультимерными (в частности, рецептор для PDGF, рецептор гормона роста, рецептор IL-3, рецептор для GM-CSF, рецептор для G-CSF, рецептор эритропоэтина и рецептор IL-6) рецепторами.
Термин “секреторная сигнальная последовательность” обозначает последовательность ДНК, которая кодирует полипептид (“секреторный полипептид”), в качестве компонента большего по размеру полипептида, направляет больший по размеру полипептид по секреторному пути в клетке, в которой он синтезируется. Больший по размеру полипептид обычно отщепляют, чтобы удалить секреторный пептид при движении по секреторному пути.
Термин “вариант сплайсинга” используют в настоящем описании для обозначения альтернативных форм РНК, транскрибированных из гена. Вариация сплайсинга естественным образом возникает при использовании альтернативных участков сплайсинга внутри транскрибированной молекулы РНК или реже между раздельно транскрибированными молекулами РНК и может привести к нескольким молекулам мРНК, транскрибированным из одного и того же гена. Варианты сплайсинга могут кодировать полипептиды, имеющие измененную аминокислотную последовательность. Термин вариант сплайсинга используют в настоящем описании также для обозначения белка, кодируемого вариантом сплайсинга мРНК, транскрибированной из гена.
Следует понимать, что молекулярные массы и размеры полимеров, определяемых качественными аналитическими методами (в частности, электрофорезом), имеют приблизительные значения. В том случае, когда эти значения обозначают как “около” Х или “приблизительно” Х, то следует понимать, что указанное значение Х приведено с точностью ± 10%.
“zcyto20”, “zcyto21”, “zcyto22” являются прежде использовавшимися обозначениями для IL-28A человека, IL-29 человека и IL-28В человека, соответственно. Нуклеотидная и аминокислотная последовательность для IL-28A приведены в SEQ ID NO: 1 и SEQ ID NO: 2, соответственно. Нуклеотидная и аминокислотная последовательность для IL-29 приведены в SEQ ID NO: 3 и SEQ ID NO: 4, соответственно. Нуклеотидная и аминокислотная последовательность для IL-28В приведены в SEQ ID NO: 5 и SEQ ID NO: 6, соответственно. Указанные последовательности полностью описаны в РСТ заявке WO 02/086087, совместно поданной компанией ZymoGenetics, Inc., которая включена в настоящее описание посредством ссылки.
“zcyto24” и “zcyto25” являются прежде использовавшимися обозначениями для IL-28 мыши, и они приведены, соответственно, в SEQ ID NO: 7, 8, 9 и 10. Полинуклеотиды и пептиды полностью описаны в РСТ заявке WO 02/086087, совместно поданной компанией ZymoGenetics, Inc., которая включена в настоящее описание посредством ссылки.
“zcytor19” является прежде использовавшимся обозначением для α-субъединицы IL-28, и она приведена в SEQ ID NO: 11. Полинуклеотиды и пептиды приведены в РСТ заявке WO 02/20569, поданной компанией Schering, Inc., и заявке WO 02/44209, принадлежащей компании ZymoGenetics, Inc., которые включены в настоящее описание посредством ссылки. “Рецептор IL-28” обозначает α-субъединицу IL-28 и субъединицу CRF2-4, образующую гетеродимерный рецептор.
В настоящем изобретении предлагаются молекулы полинуклеотидов, включая молекулы ДНК и РНК, кодирующие мутантные IL-28 и IL-29, содержащие замены цистеина, которые приводят к экспрессии препарата рекомбинантных IL-28 и IL-29, который представляет собой гомогенный препарат. В соответствии с настоящим изобретением гомогенным препаратом IL-28 и IL-29 является препарат, в котором, по крайней мере, на 98% сохраняется единая внутримолекулярная структура дисульфидных связей в очищенном полипептиде. В других вариантах осуществления настоящего изобретения единая дисульфидная конформация в препарате очищенного полипептида на 99% является гомогенной. В общем случае, как указано в настоящем описании, указанные мутанты, содержащие замены цистеина, сохраняют некоторую биологическую активность, свойственную IL-28 и IL-29 дикого типа. Например, молекулы по настоящему изобретению могут связываться с рецептором IL-28 с определенной специфичностью. В общем случае, связывание лиганда с родственным рецептором является специфическим в том случае, когда значение KD составляет в интервале от 100 нМ до 100 пМ. Специфическое связывание в диапазоне значений KD от 100 мМ до 10 нМ соответствует связыванию с низкой аффинностью. Специфическое связывание в диапазоне значений KD от 2,5 пМ до 100 пМ соответствует связыванию с высокой аффинностью. В другом примере биологическая активность мутантных IL-28 и IL-29, содержащих замены цистеина, проявляется в том случае, когда молекулы способны проявлять определенный уровень антивирусной активности, связанной с IL-28 и IL-29 дикого типа. Определение уровня антивирусной активности подробно описывается в настоящем изобретении.
При ссылке на IL-28 указанный термин означает как IL-28А, так и IL-28В. Ранее IL-28А обозначали как zcyto20 (SEQ ID NO: 1 и 2), IL-29 обозначали как zcyto21 (SEQ ID NO: 3 и 4), а IL-28В обозначали как zcyto22 (SEQ ID NO: 5 и 6). (См. РСТ заявка WO 02/086087 и Sheppard et al., выше). Мышиные ортологи для IL-28 ранее обозначали как zcyto24 (SEQ ID NO: 7 и 8), zcyto25 (SEQ ID NO: 9 и 10).
Ген IL-28А дикого типа кодирует полипептид из 200 аминокислот, как показано в SEQ ID NO: 2. Сигнальную последовательность для IL-28А можно прогнозировать как составленную из аминокислотных остатков от -25 (Met) до аминокислотного остатка -1 (Ala) из SEQ ID NO: 2. Зрелый пептид для IL-28А начинается у аминокислотного остатка 1 (Val) из SEQ ID NO: 2. Спирали IL-28А прогнозируются следующим образом: спираль А определена аминокислотными остатками с 31 (Ala) по 45 (Leu); спираль В определена аминокислотными остатками с 58 (Thr) по 65 (Gln); спираль С определена аминокислотными остатками с 69 (Arg) по 86 (Ala); спираль D определена аминокислотными остатками с 95 (Val) по 114 (Ala); спираль Е определена аминокислотными остатками с 126 (Thr) по 142 (Lys); а спираль F определена аминокислотными остатками с 148 (Cys) по 169 (Ala); как показано в SEQ ID NO: 2.
Ген IL-29 дикого типа кодирует полипептид из 200 аминокислот, как показано в SEQ ID NO: 4. Сигнальную последовательность для IL-29 можно прогнозировать как составленную из аминокислотных остатков от -19 (Met) до аминокислотного остатка -1 (Ala) из SEQ ID NO: 4, SEQ ID NO: 119, SEQ ID NO: 121. Зрелый пептид для IL-29 начинается у аминокислотного остатка 1 (Gly) из SEQ ID NO: 4. IL-29 описан в РСТ заявке WO02/02627. Спирали IL-29 прогнозируются следующим образом: спираль А определена аминокислотными остатками с 30 (Ser) по 44 (Leu); спираль В определена аминокислотными остатками с 57 (Asn) по 65 (Val); спираль С определена аминокислотными остатками с 70 (Val) по 85 (Ala); спираль D определена аминокислотными остатками с 92 (Glu) по 111 (Gln); спираль Е определена аминокислотными остатками с 118 (Thr) по 139 (Lys); а спираль F определена аминокислотными остатками с 144 (Gly) по 170 (Leu); как показано в SEQ ID NO: 4.
Ген IL-28B дикого типа кодирует полипептид из 200 аминокислот, как показано в SEQ ID NO: 6. Сигнальную последовательность для IL-28B можно прогнозировать как составленную из аминокислотных остатков от -21 (Met) до аминокислотного остатка -1 (Ala) из SEQ ID NO: 6. Зрелый пептид для IL-28B начинается у аминокислотного остатка 1 (Val) из SEQ ID NO: 6. Спирали IL-28B прогнозируются следующим образом: спираль А определена аминокислотными остатками с 31 (Ala) по 45 (Leu); спираль В определена аминокислотными остатками с 58 (Thr) по 65 (Gln); спираль С определена аминокислотными остатками с 69 (Arg) по 86 (Ala); спираль D определена аминокислотными остатками с 95 (Gly) по 114 (Ala); спираль Е определена аминокислотными остатками с 126 (Thr) по 142 (Lys); а спираль F определена аминокислотными остатками с 148 (Cys) по 169 (Ala); как показано в SEQ ID NO: 6.
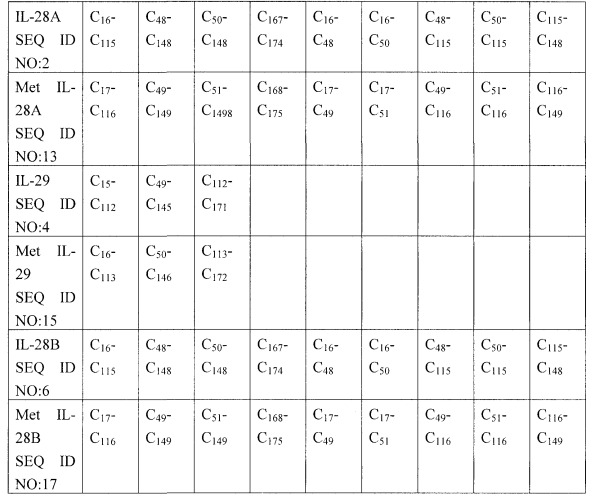
В настоящем изобретении предлагаются мутации в последовательностях IL-28 и IL-29 дикого типа, как показано в SEQ ID NO: 1, 2, 3, 4, 5 и 6, которые приводят к экспрессии индивидуальных форм молекул IL-28 или IL-29. Поскольку, как полагают, гетерогенность форм является результатом образования разнообразных комбинаций внутримолекулярных дисульфидных связей, то конкретные варианты осуществления настоящего изобретения включают мутации по остаткам цистеина в последовательностях IL-28 и IL-29 дикого типа. При экспрессии IL-28 и IL-29 в E. сoli присутствует N-концевой или аминоконцевой метионин. Например, в SEQ ID NO: 12-17 показаны нумерации нуклеотидных и аминокислотных последовательностей для IL-28А, IL-29 и IL-28В, когда присутствует N-концевой Met. В Таблице 1 приведены возможные комбинации пар цистеина, соединенных внутримолекулярными дисульфидными связями, для IL-28А, IL-28В и IL-29 дикого типа.
Таблица 1
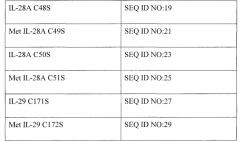
Молекулы полинуклеотидов и полипептидов по настоящему изобретению имеют мутации по одному или нескольким цистеинам, имеющимся в молекулах IL-28А, IL-29 и IL-28В дикого типа, и, тем не менее, они сохраняют биологическую активность, как указано в настоящем описании. В Таблице 2 приведены примеры мутаций с заменой цистеина, в частности, точечных мутаций с заменой цистеина (C) на серин (S).
Таблица 2
Было показано, что все члены рассматриваемого семейства связываются с одним и тем же цитокиновым рецептором класса II, IL-28R. α-Субъединицу IL-28 ранее обозначали как рецептор zcytor19. Не вдаваясь в теорию, можно считать, что указанные молекулы проявляются во всех сигналах, передающихся через рецептор IL-28 по одному и тому же пути. Рецептор IL-28 описан в совместно поданной РСТ патентной заявке WO 02/44209, которая включена в настоящее описание посредством ссылки; Sheppard et al., выше; Kotenko et al., Nature Immunol. 4: 69-77, 2003; и РСТ WO 03/040345. IL-28R является членом цитокиновых рецепторов класса II, которые характеризуются наличием в их внеклеточных доменах одного или нескольких рецепторных модулей цитокина (CRM). Другие цитокиновых рецепторы класса II включают zcytor11 (патент США № 5965704 совместного владения), CRF2-4 (номер доступа Z17227 в базе данных GenBank), IL-10R (номера доступа U00672 и NM_001558 в базе данных GenBank), DIRS1, zcytor7 (патент США № 5945511 совместного владения) и тканевый фактор. Рецептор IL-28, как и все известные рецепторы класса II, за исключением альфа-цепи рецептора к интерферону-альфа/бета, содержит в своем внеклеточном домене лишь CRM одного класса II.
Цитокины с пучками из четырех спиралей группируют также по длине составляющих их спиралей. Цитокины “динноцепочечной” формы обычно состоят из спиралей, содержащих 24-30 остатков, и они включают IL-6, цилиарный нейротрофический фактор (CNTF), фактор ингибирования лейкемии (LIF) и человеческий гормон роста (hGH). Цитокины “короткоцепочечной” формы обычно состоят из спиралей, содержащих 18-21 остатков, и они включают IL2, IL-4 и GM-CSF. Исследования с использованием CNTF и IL-6 показали, что спиралью из CNTF можно заменить эквивалентную спираль в IL-6, при этом химера приобретает способность связывать CNTF. Таким образом, оказывается, что функциональные домены четырехспиральных цитокинов определяются степенью структурной гомологии, независимо от идентичности последовательности, и могут сохранять функциональную целостность в химере (Kallen et al., J. Biol. Chem. 274: 11859-11867, 1999). Таким образом, мутантные полипептиды IL-28 и IL-29, содержащие замены цистеина, могут быть полезны для получения химерных слитых молекул, в частности, с другими интерферонами, с целью определения и модулирования специфичности связывания рецептора. Особый интерес представляют слитые белки, которые объединяют спиральные и петлевые области интерферонов и цитокинов, таких как TNF-α, IL-10 и человеческий гормон роста.
В настоящем изобретении предлагаются молекулы полинуклеотидов, включая молекулы ДНК и РНК, которые кодируют, например, мутантные полипептиды IL-28 или IL-29, содержащие замены цистеина. Например, в настоящем изобретении предлагаются вырожденные нуклеотидные последовательности, кодирующие приведенные в настоящем описании полипептиды IL-28A C48S, Met IL-28A C49S, IL-28A C50S, Met IL-28A C51S, IL-29 C171S и Met IL-29 C172S. Для специалистов должно быть понятно, что ввиду вырожденности генетического кода в указанных молекулах полинуклеотидов возможны значительные вариации в последовательностях. SEQ ID NO: 30, 31, 32, 33, 34 и 35 являются вырожденными последовательностями ДНК, которые охватывают все молекулы ДНК, кодирующие IL-28A C48S, Met IL-28A C49S, IL-28A C50S, Met IL-28A C51S, IL-29 C171S и Met IL-29 C172S, соответственно. Для специалистов должно быть понятно, что вырожденные последовательности SEQ ID NO: 30, 31, 32, 33, 34 и 35 обозначают также все последовательности РНК, кодирующие SEQ ID NO: 30, 31, 32, 33, 34 и 35, путем замены T на U и, таким образом, также рассматриваются в настоящем описании.
Полипептиды IL-28A по настоящему изобретению включают также мутации во втором цистеине, С2, зрелого полипептида. Например, С2 от N-конца или аминового конца в полипептиде с SEQ ID NO: 2 является цистеином в аминокислотном положении 48 или положении 49 (с дополнительным N-концевым Met), если полипептид экспрессируется в E. сoli (см., например, SEQ ID NO: 13). Указанный второй цистеин (которых имеется семь, как в IL-28B), или С2 в IL-28A, может быть мутирован, например, заменой на серин, аланин, треонин, валин или аспарагин. Мутантные молекулы IL-28A С2 по настоящему изобретению включают, например, молекулы полинуклеотидов, приведенные в SEQ ID NO: 20 и 22, в том числе молекулы ДНК и РНК, которые кодируют мутантные по С2 полипептиды IL-28A, как показано в SEQ ID NO: 21 и 23, соответственно. SEQ ID NO: 36 и 37 являются дополнительными полипептидами IL-28A С2 по настоящему изобретению.
Помимо мутантов IL-28A С2, настоящее изобретение включает также полипептиды IL-28A, содержащие мутации в положении третьего цистеина, С3, зрелого полипептида. Например, С3 от N-конца или аминового конца в полипептиде с SEQ ID NO: 2 является цистеином в положении 50 или положении 51 (с дополнительным N-концевым Met), если полипептид экспрессируется в E. сoli (см., например, SEQ ID NO: 13). Мутантные молекулы IL-28A С3 по настоящему изобретению включают, например, молекулы полинуклеотидов, приведенные в SEQ ID NO: 24 и 26, в том числе молекулы ДНК и РНК, которые кодируют мутантные полипептиды IL-28A С3, как показано в SEQ ID NO: 25 и 27, соответственно. SEQ ID NO: 38 и 39 являются дополнительными полипептидами IL-28A С3 по настоящему изобретению.
Полипептиды IL-28A по настоящему изобретению включают, например, SEQ ID NO: 2, 13, 19, 21, 23 и 25, которые кодируются молекулами полинуклеотидов IL-28A, приведенными в SEQ ID NO: 1, 12, 18, 20, 22 и 24, соответственно. Дополнительные полипептиды IL-28A по настоящему изобретению включают, например, SEQ ID NO: 36, 37, 38 и 39.
Полипептиды IL-28В по настоящему изобретению включают также мутации во втором цистеине, С2, зрелого полипептида. Например, С2 от N-конца или аминового конца в полипептиде с SEQ ID NO: 6 является цистеином в аминокислотном положении 48 или положении 49 (с дополнительным N-концевым Met), если полипептид экспрессируется в E. сoli (см., например, SEQ ID NO: 17). Указанный второй цистеин (которых имеется семь, как в IL-28А), или С2 в IL-28В, может быть мутирован, например, заменой на серин, аланин, треонин, валин или аспарагин. Мутантные молекулы IL-28В С2 по настоящему изобретению включают, например, молекулы полинуклеотидов, приведенные в SEQ ID NO: 122 и 124, в том числе молекулы ДНК и РНК, которые кодируют мутантные полипептиды IL-28В С2, как показано в SEQ ID NO: 123 и 125, соответственно. Дополнительные мутантные молекулы IL-28В С2 по настоящему изобретению включают молекулы полинуклеотидов, приведенные в SEQ ID NO: 130 и 132, в том числе молекулы ДНК и РНК, которые кодируют мутантные полипептиды IL-28В С2, приведенные в SEQ ID NO: 131 и 133, соответственно (публикация РСТ WO 03/066002 (Kotenko et al.)).
Помимо мутантов IL-28В С2, настоящее изобретение включает также полипептиды IL-28В, включающие мутации в положении третьего цистеина, С3, зрелого полипептида. Например, С3 от N-конца или аминового конца в полипептиде с SEQ ID NO: 6 является цистеином в положении 50 или положении 51 (с дополнительным N-концевым Met), если полипептид экспрессируется в E. сoli (см., например, SEQ ID NO: 17). Мутантные молекулы IL-28В С3 по настоящему изобретению включают, например, молекулы полинуклеотидов, приведенные в SEQ ID NO: 126 и 128, в том числе молекулы ДНК и РНК, которые кодируют мутантные полипептиды IL-28В С3, как показано в SEQ ID NO: 127 и 129, соответственно. Дополнительные мутантные молекулы IL-28В С3 по настоящему изобретению включают молекулы полинуклеотидов, приведенные в SEQ ID NO: 134 и 136, в том числе молекулы ДНК и РНК, которые кодируют мутантные полипептиды IL-28В С3, приведенные в SEQ ID NO: 135 и 137, соответственно (публикация РСТ WO 03/066002 (Kotenko et al.)).
Полипептиды IL-28В по настоящему изобретению включают, например, SEQ ID NO: 6, 17, 123, 125, 127, 129, 131, 133, 135 и 137, которые кодируются молекулами полинуклеотидов IL-28В, приведенными в SEQ ID NO: 5, 16, 122, 124, 126, 128, 130, 132, 134 и 136, соответственно.
Полипептиды IL-29 по настоящему изобретению включают также, например, мутации в пятом цистеине, С5, зрелого полипептида. Например, С5 от N-конца полипептида с SEQ ID NO: 4 является цистеином в положении 171 или положении 172 (с дополнительным N-концевым Met), если полипептид экспрессируется в E. сoli (см., например, SEQ ID NO: 15). Указанный пятый цистеин, или С5 из IL-29, может быть мутирован, например, заменой на серин, аланин, треонин, валин или аспарагин. Указанные мутантные полипептиды IL-29 С5 имеют структуру дисульфидных связей С1(Cys15 из SEQ ID NO: 4)/С3(Cys112 из SEQ ID NO: 4) и С2(Cys49 из SEQ ID NO: 4)/С4(Cys145 из SEQ ID NO: 4). Дополнительные мутантные молекулы IL-29 С5 по настоящему изобретению включают молекулы полинуклеотидов, приведенные в SEQ ID NO: 26, 28, 82, 84, 138, 140, 142, 144, 146, 148, 150, 152, 154, 156, 158 и 160, в том числе молекулы ДНК и РНК, которые кодируют мутантные полипептиды IL-29 С5, приведенные в SEQ ID NO: 27, 29, 83, 85, 139, 141, 143, 145, 147, 149, 151, 153, 155, 157, 159 и 161, соответственно. Дополнительные мутантные молекулы IL-29 С5 по настоящему изобретению включают молекулы полинуклеотидов, приведенные в SEQ ID NO: 86, 88, 94 и 96, в том числе молекулы ДНК и РНК, которые кодируют мутантные полипептиды IL-29 С5, приведенные в SEQ ID NO: 87, 89, 95 и 97, соответственно (публикация РСТ WO 03/066002 (Kotenko et al.)). Дополнительные мутантные молекулы IL-29 С5 по настоящему изобретению включают молекулы полинуклеотидов, приведенные в SEQ ID NO: 102, 104, 110 и 112, в том числе молекулы ДНК и РНК, которые кодируют мутантные полипептиды IL-29 С5, приведенные в SEQ ID NO: 103, 105, 111 и 113, соответствен