Способ автоматического определения размеров и положения сердца пациента по флюорографическим снимкам
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к компьютерным диагностическим системам (КДС), и может быть использовано в КДС для автоматического определения размеров и положения сердца по флюорографическим снимкам (ФОС) пациента при реконструкции трехмерной структуры сердца. Для реализации способа выполняют следующие действия. Регистрируются ФОС в прямой и левой боковой проекциях. На ФОС осуществляется выделение контура сердца путем анализа изображения, вычисления значений вероятности для точек изображения, показывающих, что данная точка изображения принадлежит к определенным участкам изображения, относящимся к сердцу, и получения контурной модели сердца. Затем создается массив контуров проекций компьютерной модели сердца, получаемых последовательными поворотами модели с заданным шагом угла по трем координатным осям, и осуществляется наложение и совмещение проекций модели сердца с изображением на ФОС. При этом выполняется последовательное сравнение контуров сердца на ФОС пациента и контуров различных проекций модели сердца из созданного массива. В результате проекции модели, соответствующие прямому и левому боковому флюорографическим снимкам и имеющие наименьшую площадь несовпадения после наложения изображений контуров друг на друга, наиболее точно соответствуют контурам сердца на ФОС пациента. При этом трехмерная модель сердца является подобной сердцу пациента. Это позволяет осуществить автоматизацию определения размеров и положения сердца пациента на флюорографическом снимке. 2 з.п. ф-лы, 12 ил.
Реферат
Предлагаемое изобретение относится к медицинской технике, в частности к компьютерным диагностическим системам (КДС), для оценки состояния сердечно-сосудистой системы (ССС). Предлагаемое изобретение предназначено для автоматического определения размеров и положения сердца по флюорографическим снимкам (ФОС) пациента и может быть использовано в КДС при массовых профилактических обследованиях (скрининге) ССС для реконструкции трехмерной структуры сердца. Учитывая то, что ежегодно флюорографическое обследование проходят миллионы граждан, проблема автоматического определения «геометрии» сердца пациента по ФОС является актуальной задачей.
Известен способ построения трехмерной модели сердца [1] при помощи ультразвуковой эхокардиографии, основанный на регистрации отраженных от лоцируемого объекта ультразвуковых волн и дающий возможность визуализации сердечных структур и построения модели поверхности сердца. Однако метод требует участия при диагностике высококвалифицированного специалиста, использования дорогостоящей аппаратуры и значительных затрат времени на проведение одного исследования. Широкое использование эхокардиографического метода при скрининге затруднено также из-за большого количества используемых методик и стандартных проекций, каждая из которых применяется для изучения определенных анатомических отделов сердца и диагностики определенных патологий, так как получаемые изображения сечений сердца зависят от положения датчика. Кроме того, при эхокардиографическом методе невозможно получить достоверную диагностическую информацию при ряде анатомических особенностей сердца пациента.
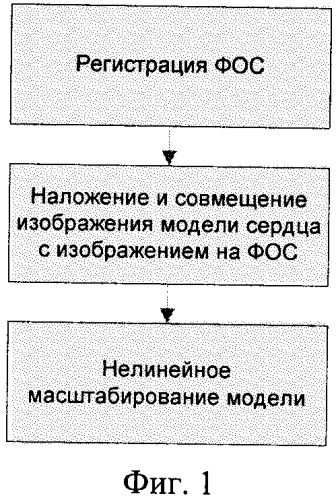
Известен выбранный в качестве прототипа способ определения основных функциональных показателей миогеодинамики сердца [2], заключающийся в том, что регистрируют прямой и левый боковой флюорографические снимки сердца пациента, определяют по снимкам геометрические параметры сердца пациента, осуществляют наложение на них компьютерной модели сердца, осуществляют совмещение и нелинейное масштабирование компьютерной модели сердца.
На фигуре 1 приведена схема алгоритма известного способа определения размеров и положения сердца по ФОС пациента.
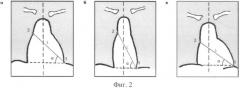
На фигуре 2 приведены варианты расположения сердца в грудной клетке [3]: а - у нормостеника, б - у астеника, в - у гиперстеника. На фигуре 2 приняты следующие обозначения: «1» - верхушка сердца, «2» - правый предсердно-сосудистый угол, L - длинный размер (диаметр) сердца, соединяющий правый предсердно-сосудистый угол с верхушкой.
На фигуре 3 приведена схема расположения грудной клетки при рентгенологическом исследовании пациента [3]: а - в прямой проекции, б - в правой передней косой проекции, в - в левой передней косой проекции и г - в левой боковой проекции. На фигуре 3 приняты следующие обозначения: ПЖ - правый желудочек; ЛЖ - левый желудочек.
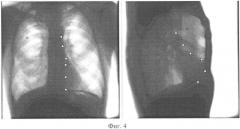
На фигуре 4 приведены ФОС в прямой и левой боковой проекциях с отмеченными на них опорными точками.
На фигуре 5 приведено изображение компьютерной модели сердца в процессе произвольной деформации.
На фигуре 6 приведены проекции трехмерного объекта на плоскости XOY и ZOY: а - проекции куба, б - проекции параллелепипеда, в - проекции куба, повернутого вокруг своей оси на 45°.
Из анализа формулы изобретения и схемы алгоритма известного способа следует, что определение геометрических параметров сердца осуществляется вручную. Врач-рентгенолог просматривает и анализирует ФОС на экране монитора, выявляет патологии и делает заключение, руководствуясь шаблоном описания и сохраняя информацию в базе данных.
Например, положение сердца в грудной клетке определяется углом наклона к горизонтали длинника сердечной тени («L»). Последний соединяет правый атриовазальный угол («2») с верхушкой сердца («1»). В прямой проекции различают три нормальных варианта положения сердца (см. фигуру 2). У нормостеников угол наклона длинника сердца составляет около 45° (косое положение сердца), у астеников - больше 45° (вертикальное положение), у гиперстеников - меньше 45° (горизонтальное положение) [3].
Недостатками «ручного» определения размеров и положения сердца по ФОС являются:
1. Отсутствие возможности автоматического определения «геометрии» сердца пациента по ФОС.
2. Низкая пропускная способность «ручной» обработки ФОС.
Известный способ включает следующие этапы.
Регистрация ФОС. Для регистрации ФОС используется специализированная рентгенографическая аппаратура, включающая люминесцентный экран, электронную камеру, оптическую систему, компьютер, планшет, светозащитный кожух и рентгенопрозрачный экран [4]. ФОС регистрируют в нескольких стандартных проекциях [3]. На фигуре 3а изображение представлено в прямой проекции, когда пациент обращен грудью к экрану. На фигуре 3б изображение представлено в правой передней косой проекции, когда больной располагается под углом 45° к экрану правым плечом вперед. На фигуре 3в изображение представлено в левой передней косой проекции, когда пациент располагается за экраном левым плечом вперед. На фигуре 3г изображение представлено в левой боковой проекции. В известном способе используются прямая и левая боковая проекции. На фигуре 4 приведены ФОС в прямой и левой боковой проекциях. ФОС грудной клетки пациента хранятся в цифровом виде в памяти компьютера.
Наложение и совмещение модели сердца на ФОС. Для определения размеров и положения сердца врач просматривает ФОС и определяет опорные точки. Опорными точками служат точки, для которых врачом однозначно определяются соответствующие позиции на обоих изображениях по характерным признакам (см. фигуру 4). В качестве характерных признаков выступают точки контуров, структурные или геометрические особенности сердца пациента на ФОС. Выбор и определение позиций опорных точек осуществляется врачом визуально, так как современные методы распознавания образов не обеспечивают полную автоматизацию данного процесса. Результатом работы врача при анализе ФОС является множество (N) согласованных пар точек, первая из которых принадлежит прямому, а вторая - левому боковому снимку, причем известно, что эта пара точек на двухмерных проекциях является изображением одной и той же точки трехмерного пространства. Для выявления опорных точек врачу необходимо представить себе проекцию оси пересечения сечений на прямом и левом боковом ФОС сердца пациента. Очевидно, что для выполнения указанных действий врач должен обладать соответствующей квалификацией и опытом.
Основной проблемой при этом является отбраковка ложных точек, которые были идентифицированы как согласованные, но на самом деле являются двухмерными изображениями различных точек трехмерного пространства.
Трехмерные координаты опорной точки определяются при условии, если известно положение снимков в некоторой системе координат (СК) и установлено соответствие между изображением заданной точки на одном снимке с ее изображениями на остальных снимках.
Нелинейное масштабирование модели сердца. На данном этапе осуществляется совмещение координат опорных точек модели сердца пациента с координатами их изображений на ФОС. Для этого применяют нелинейное масштабирование трехмерной модели сердца. На фигуре 5 приведено изображение модели сердца в процессе произвольной деформации с помощью аппарата FFD-box [5], позволяющего производить деформацию трехмерного объекта путем смещения управляющих точек (в данном случае используется 27 управляющих точек). После достижения соответствия опорных точек модели сердца их проекциям на ФОС делается заключение о соответствии трехмерной модели сердца сердцу пациента. В результате на основе геометрических параметров модели сердца определяют геометрические размер и положение сердца пациента.
Сердце является геометрическим объектом сложной формы, его размеры и расположение у каждого пациента являются индивидуальными. Известно, что вращение сердца вокруг его продольной оси составляет ±30°, относительно поперечной оси составляет от +45° до -90°, относительно сагиттальной оси составляет ±30° [6]. Поэтому невозможно точно определить размеры и положение сердца по ФОС пациента, используя только совмещение и нелинейное масштабирование.
К примеру, изменение угла поворота сердца вокруг какой-либо оси СК может привести к сжатию или растяжению его проекции на снимке. Применение нелинейного масштабирования модели позволяет осуществлять совмещение модели объекта с проекцией только за счет изменения размеров модели, т.е. ее растяжения или сжатия. Так как угол поворота объекта также влияет на размеры его проекции, при совмещении необходимо учитывать и угол поворота модели. Фигура 6 иллюстрирует зависимость размера проекции от размера и угла поворота проецируемого объекта, ортогонального куба с длиной ребра h, проецируется в квадрат с длиной стороны h на плоскости XOY и ZOY (см. фигуру 6а). На фигуре 6.в приведены проекции в виде прямоугольника с длинами большей и меньшей сторон и h соответственно. Следуя известному способу, для совмещения исходного объекта (ортогонального куба) с данной проекцией модель объекта необходимо растянуть относительно оси ОХ с коэффициентом масштабирования Таким образом, исходный куб трансформируется в параллелепипед с длинами ребер h, h, (см. фигуру 6б). Совмещение исходного объекта (ортогонального куба) с приведенной проекцией может быть достигнуто и другим способом, а именно - поворотом модели объекта вокруг своей оси (параллельной оси OY) на 45° без искажения его геометрических размеров (см. фигуру 6в). Следовательно, параметры модели сердца в известном способе, использующем только деформацию трехмерной модели сердца, могут быть определены неверно.
Таким образом, в известном способе размеры и положение сердца пациента определяются врачом визуально на экране монитора путем наложения на ФОС грудной клетки пациента, совмещения и нелинейного масштабирования компьютерной модели сердца. При реализации известного способа квалификация и опыт врача-рентгенолога являются решающими факторами. При этом проблема автоматического определения размеров и положения сердца пациента по ФОС является нерешенной.
Изобретение направлено на повышение степени автоматизации и достоверности определения геометрических параметров сердца пациента на основе анализа ФОС.
Это достигается тем, что в способ автоматического определения размеров и положения сердца пациента по флюорографическим снимкам, заключающийся в том, что регистрируют прямой и левый боковой флюорографические снимки сердца пациента, определяют по снимкам геометрические параметры сердца пациента, осуществляют наложение на них компьютерной модели сердца, осуществляют совмещение и нелинейное масштабирование компьютерной модели сердца, введены действия, с помощью которых на прямом и левом боковом флюорографических снимках пациента выделяют контуры сердца, получают множество проекций трехмерной модели сердца путем последовательного поворота на заданные углы α, β, γ относительно осей X, Y, Z, осуществляют совмещение контура проекции модели с контуром сердца на флюорографическом снимке пациента путем аффинных преобразований, осуществляют сравнение контуров сердца пациента на прямом и левом боковом флюорографических снимках с контурами соответствующих проекций трехмерной модели сердца, вычисляют площадь несовпадения контуров SF для прямого флюорографического снимка сердца пациента и SL для левого бокового флюорографического снимка сердца пациента, в результате углы поворота α, β, γ относительно осей X, Y, Z и коэффициенты масштабирования Kx, Ky, Kz соответствующих проекций трехмерной модели сердца, имеющих наименьшую сумму площадей S=SF+SL, определяют размеры и положение сердца пациента.
При этом выделение контура сердца на прямом и левом боковом флюорографических снимках пациента осуществляется путем анализа изображения на прямом и левом боковом флюорографических снимках, вычисления значений вероятностей для точек изображения, показывающих, что данная точка изображения принадлежит определенному участку изображения, относящемуся к сердцу, и получения контурной модели сердца.
При этом вычисление площади несовпадения контуров для прямого флюорографического снимка сердца пациента и для левого бокового флюорографического снимка сердца пациента осуществляется для каждого флюорографического снимка путем первого наложения контура соответствующей проекции модели сердца на выделенный на флюорографическом снимке контур сердца пациента, вычисления площади несовпадения первого наложения, второго наложения выделенного на флюорографическом снимке контура сердца пациента на контур соответствующей проекции модели сердца, вычисления площади несовпадения второго наложения и суммирования площадей несовпадения первого и второго наложения.
Введенные действия с их связями проявляют новые свойства, которые позволяют автоматизировать процесс определения параметров сердца по ФОС.
На фигуре 7 приведена схема алгоритма предлагаемого способа определения размеров и положения сердца по ФОС пациента.
На фигуре 8 приведена схема алгоритма сравнения и выбора проекций с наименьшим несовпадением контуров. На фигуре 8 приняты следующие обозначения: SFi,j,k - площадь несовпадения прямой проекции модели, полученной на шаге (i,j,k) с соответствующим ФОС пациента, SLi,j,k - площадь несовпадения левой боковой проекции модели, полученной на шаге (i,j,k) с соответствующим ФОС пациента, i,j,k - индексы массива проекций модели сердца, соответствующие поворотам модели вокруг осей X, Y, Z соответственно.
На фигуре 9 приведено изображение ФОС пациента с выделенным на нем контуром сердца.
На фигуре 10 приведено изображение трехмерной модели сердца, совмещенного с передним и левым боковым ФОС пациента.
На фигуре 11 приведена схема алгоритма вычисления площади несовпадения контуров сердца.
На фигуре 12 приведены изображения контуров сердца для вычисления площади несовпадения.
Предлагаемый способ автоматического определения размеров и положения сердца пациента по флюорографическим снимкам включает следующие этапы (см. фигуру 7).
Выделение контура сердца на ФОС. После регистрации прямого и левого бокового ФОС пациента в цифровом формате осуществляется обработка ФОС для выделения на них контуров сердца. Для этого согласно способу обработки изображения и системе, включающей шаги выделения контура [7], осуществляется анализ изображения, вычисление значений вероятности для точек изображения, показывающих, что данная точка изображения принадлежит к определенным участкам изображения, относящимся к объекту, и получение контурной модели объекта. Данный способ позволяет выделить контур сердца на ФОС, как показано на фигуре 9.
Синтез проекций модели сердца заключается в получении проекций трехмерной модели сердца на плоскости, соответствующих прямой и левой боковой проекциям сердца при флюорографическом обследовании. Создается массив контуров проекций компьютерной модели сердца, получаемых последовательными поворотами модели с заданным шагом угла по трем координатным осям. Угол поворота модели на каждом шаге составляет не более 5°. Таким образом, угол поворота вокруг оси может принимать 13 значений (-30°, -25°, -20°, -15°, -10°, -5°, 0°, 5°, 10°, 15°, 20°, 25°, 30°). С учетом сочетания поворотов вокруг каждой из трех осей координат общее количество проекций модели сердца на каждую плоскость равно 2197 (133).
Наложение и совмещение проекций модели сердца с изображением на ФОС заключается в наложении изображения проекции модели сердца на изображение контура сердца, выделенного на ФОС, определении геометрического центра контурного изображения сердца, совмещении геометрического центра проекции модели сердца с геометрическим центром контурного изображения сердца с помощью операции сдвига вдоль координатных осей. Данная операция реализуется средствами компьютерной графики.
Сравнение и выбор проекций с наименьшим несовпадением контуров. Выполняется последовательное сравнение контуров сердца на ФОС пациента и контуров различных проекций модели сердца из созданного массива (см. фигуру 8). При этом перебираются все возможные сочетания углов поворота вокруг координатных осей.
Прямой и левый боковой ФОС пациента одновременно сравниваются с контурами соответствующих проекций модели.
Для определения площади несовпадения контуров используется следующий алгоритм (см. фигуру II): выделенный на ФОС контур (контур 1) закрашивается серым цветом и помещается на белый фон (см. фигуру 12а), контур проекции модели сердца (контур 2) закрашивается черным цветом и также помещается на белый фон (см. фигуру 12б). Затем на контур 2 накладывается контур 1 (см. фигуру 12в), после чего большая часть контура 1 становится закрытой контуром 2. Для вычисления площади «первого» несовпадения достаточно вычислить площадь изображения, закрашенную серым цветом (цветом контура 1). Далее производится наложение контура 1 на контур 2 (см. фигуру 12г) и аналогично рассчитывается площадь изображения, закрашенная черным цветом (цветом контура 2), - площадь «второго» несовпадения. Сумма площадей «первого» и «второго» несовпадений является общей площадью несовпадения контуров.
где S - площадь несовпадения контуров;
S1 - площадь несовпадения после наложения контура 2 на контур 1;
S2 - площадь несовпадения после наложения контура 1 на контур 2.
Для реализации данного алгоритма используются средства компьютерной графики, при этом вычисление площади участка изображения сводится к подсчету пикселей соответствующего цвета (черного или серого) в буфере изображения.
Операция сравнения контуров повторяется для каждой прямой и левой боковой проекции модели сердца, повернутой на определенные углы относительно координатных осей (см. фигуру 8). В результате пара проекций модели, имеющая наименьшую площадь несовпадения после наложения изображений контуров друг на друга, будет наиболее точно соответствовать контурам сердца на ФОС пациента.
Нелинейное масштабирование модели сердца. В зависимости от отношения площадей изображения сердца на ФОС и проекции модели сердца, повернутой на соответствующий угол, вычисляются коэффициенты масштабирования модели сердца вдоль каждой из координатных осей:
где Kx, Ky, Kz - коэффициенты масштабирования вдоль осей X, Y, Z соответственно;
SF1 - площадь сердца на ФОС в прямой проекции;
SF2 - площадь прямой проекции модели сердца;
SL1 - площадь сердца на ФОС в левой боковой проекции;
SL2 - площадь левой боковой проекции модели сердца.
После определения углов поворота сердца пациента производится нелинейное масштабирование изображений контуров модели сердца таким образом, чтобы они более точно соответствовали изображениям контуров сердца на ФОС пациента. Масштабирование модели сердца осуществляется с помощью аффинных преобразований. Аффинное преобразование представляет собой линейное преобразование с последующим преобразованием сдвига, оно может быть представлено в следующем виде:
где Т - аффинное преобразование;
x - вектор координат точки в пространстве;
А - матрица линейного преобразования координат;
b - вектор сдвига.
То же преобразование часто записывают в матричной форме:
где T - аффинное преобразование;
x, y, z - координаты точки в пространстве;
a1…a3 - коэффициенты линейного преобразования координат;
b1…b3 - коэффициенты сдвига.
Полученные коэффициенты масштабирования используются при построении трехмерной модели сердца.
Так как углы поворота модели сердца при построении массива контуров проекций определены заранее, а коэффициенты масштабирования вычислены при сравнении изображений контуров, то все необходимые данные для определения размеров и положения сердца пациента известны.
Вывод параметров модели сердца. Заключительным этапом является представление параметров сердца врачу. После определения углов поворота и коэффициентов масштабирования трехмерная модель сердца находится в состоянии подобия сердцу пациента. Таким образом, врачу представляются вычисленные размеры и положение трехмерной модели сердца, соответствующей прямой и левой боковой проекциям ФОС, которые сохраняются в базе данных. На экране монитора отображается трехмерная модель сердца, совмещенная с ФОС в прямой и левой боковой проекциях (см. фигуру 10). Данная операция осуществляется средствами компьютерной графики для контроля правильности автоматического определения размеров и положения сердца.
Технический результат, достигаемый при реализации предлагаемого способа, заключается в автоматизации определения размеров и положения сердца пациента по ФОС.
Литература
1. Automatic delineation of heart borders and surfaces from images / Richard K. Johnson / John Alan McDonald / Florence H. Sheehan // US 2003038802 от 27.02.2003.
2. Способ определения основных показателей миогемодинамики сердца / Бодин О.Н. / Бурукина И.П. / Митин А.А. / Огоньков В.В. / Митрошин А.Н. / Бондаренко Л.А. / Рудакова Л.Е. // Патент РФ №2264786, МПК А61В 5/0402, 6/00.
3. Ройтберг Г.Е., Струтынский А.В. Лабораторная и инструментальная диагностика заболеваний внутренних органов. М.: ООО "Медицина", 2003.
4. Аппарат для получения компьютерных рентгеновских изображений и способ получения таких изображений / Арапов Н.А. / Корнев А.Н. / Кулаков В.И. / Никонов И.А. / Санталов Б.Ф. / Устинин М.Н. / Фокин В.А. / Яшин В.А. // Патент РФ №2134450, МПК 6 G06T 1/00, G03B 42/02, H05G 1/00, А61В 6/00, G06F 19/00, G06F 159:00.
5. Мэрдок, Келли, Л. 3D Studio MAX R3. Библия пользователя: Пер. с англ.: М.: Издательский дом «Вильяме», 2001, 1040 с.
6. Кечкер М.И. Руководство по клинической электрокардиографии. - М.: 2000, 395 с.
7. Image processing method and system involving contour detection steps / Oliver Gerard / Sherif Makram-Ebeid // US Patent No: US 6,366,684 B1 от 14.10.1999.
1. Способ автоматического определения размеров и положения сердца пациента по флюорографическим снимкам, заключающийся в том, что регистрируют прямой и левый боковой флюорографические снимки сердца пациента, определяют по снимкам геометрические параметры сердца пациента, осуществляют наложение на них компьютерной модели сердца, осуществляют совмещение и нелинейное масштабирование компьютерной модели сердца, отличающийся тем, что на прямом и левом боковом флюорографических снимках пациента выделяют контуры сердца, получают множество проекций трехмерной модели сердца путем последовательного поворота на заданные углы α, β, γ относительно осей X, Y, Z, осуществляют совмещение контура проекции модели с контуром сердца на флюорографическом снимке пациента путем аффинных преобразований, осуществляют сравнение контуров сердца пациента на прямом и левом боковом флюорографических снимках с контурами соответствующих проекций трехмерной модели сердца, вычисляют площадь несовпадения контуров SF для прямого флюорографического снимка сердца пациента и SL для левого бокового флюорографического снимка сердца пациента и коэффициенты масштабирования Kx, Ky, Kz размеров модели сердца вдоль соответствующих осей трехмерной модели сердца, в результате по углам поворота α, β, γ, относительно осей X, Y, Z и коэффициентам масштабирования Kx, Ky, Kz модели сердца, проекции которой имеют наименьшую площадь (S) несовпадения контуров проекций модели сердца и контуров сердца пациента на прямом (SF) и левом боковом (SL) флюорографических снимках S=SF+SL с контурами сердца пациента, выделенными на прямом и левом боковом флюорографических снимках, определяют размеры и положение сердца пациента.
2. Способ по п.1, отличающийся тем, что выделение контура сердца на прямом и левом боковом флюорографических снимках пациента осуществляется путем анализа изображения на прямом и левом боковом флюорографических снимках, вычисления значений вероятностей для точек изображения, показывающих, что данная точка изображения принадлежит определенному участку изображения, относящемуся к сердцу, и получения контурной модели сердца.
3. Способ по любому из пп.1 и 2, отличающийся тем, что вычисление площади несовпадения контуров для прямого флюорографического снимка сердца пациента и для левого бокового флюорографического снимка сердца пациента осуществляется для каждого флюорографического снимка путем первого наложения контура соответствующей проекции модели сердца на выделенный на флюорографическом снимке контур сердца пациента, вычисления площади несовпадения первого наложения, второго наложения выделенного на флюорографическом снимке контура сердца пациента на контур соответствующей проекции модели сердца, вычисления площади несовпадения второго наложения и суммирования площадей несовпадения первого и второго наложений.