Способ лечения нефроангиопатии при аллоксановом диабете у экспериментальных животных
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к эндокринологии и нефрологии, и касается лечения нефроангиопатии при экспериментальном аллоксановом диабете. Для моделирования диабета животным однократно внутрибрюшинно вводят 5% водный раствор аллоксана в дозе 15 мг на кг веса животного. Через 2 недели подкожно вводят L-карнитин в дозе 25 мг на 100 г веса животного ежедневно 1 раз в сутки в течение 4 недель. Способ обеспечивает эффективное лечение нефроангиопатии в специфических условиях эксперимента за счет снижения перекисного окисления липидов в клеточных мембранах сосудов почки и улучшения почечного кровотока. 6 табл., 10 ил.
Реферат
Изобретение относится к медицине и может быть использовано при лечении нефроангиопатии при аллоксановом диабете.
Диабетическая нефропатия - одно из наиболее тяжелых последствий сахарного диабета, снижающее качество и продолжительность жизни больных (Дедов И.И., Шестакова В., 2000; Бондарь И.А., Климонтов В.В., Королева Е.А. и др., 2003; Бондарь И.А., Климонтов В.В., 2005) и занимающее первое место среди других ангиопатий. Каждый второй больной СД типа 1 и каждый четвертый больной СД типа 2 умирает от острой или хронической почечной недостаточности (Дедов И.И., Сунцов Ю.И., Кудрякова С.В. и др., 1998; Дедов И.И., 2003). При СД нарушения внутрипочечной гемодинамики могут наблюдаться при отсутствии клинико-лабораторных признаков поражения почек, что провоцируется гормонально-метаболическими нарушениями (Кутырина И.М., Тареева И.Е., Шестакова М.В., Зверев К.В., 1995).
В условиях гипергликемии глюкоза беспрепятственно проникает в эндотелиальные клетки сосудов, вызывая в них патологические биохимические реакции. Эндотелий уязвим для воздействия как системной, так и внутриорганной или тканевой гипертензии, развивающейся в микроциркуляторном русле. Все перечисленные факторы (гипергликемия, системная и внутрикапиллярная гипертензия, цитокины) могут вызывать глубокие повреждения эндотелиальных клеток сосудов при СД, провоцируя секрецию вазоактивных и гормональноактивных веществ, способных ускорять процессы диабетической ангиопатии (Шестакова М.В., Северина И.С., Дедов И.И. и др., 1995; Григорян О.Р., 2005; Григорян О.Р., Гродницкая Е.Э., 2005; Pfab T, Thone-Reineke С, Theilig F et al., 2006).
Одним из многочисленных факторов, играющих роль в развитии диабетической нефропатии, является дисбаланс окислительно-восстановительных процессов и усиление неконтролируемых свободно-радикальных реакций (СРО), называемые окислительным стрессом (Baynes JW, 1991; Tesfamariam В, 1994; Van Damn PC, Van Asbeck BS, Erkelens, 1995).
Учитывая важную роль в развитии диабетических ангиопатий окислительного стресса, необходимой составляющей патогенетической терапии является применение антиоксидантов (АО) (Кулагин О.Л., 2000; Кокорева Е.В., 2002; Yin X, Zhang Y, Yu J et al., 2006). Исследование ангиопротекторных эффектов препаратов антиоксидантов у больных с диабетическими ангиопатиями свидетельствует о перспективности данного направления (Бобырева Л.Е., 1997, 1998; Машков Ю.И., 2001; Янькова В.И., Иванова И.Л., Федореев С.А., Кулеш Н.И., 2002; Чугунова Л.А., Шамхалова И.Ш., Шестакова М.В., 2004) и о повышении факторов антиоксидантной защиты и угнетении процессов перекисного окисления липидов.
Наряду с приведенными данными литературы следует отметить, что в доступной литературе отсутствуют данные о комплексных исследованиях, посвященных изучению патофизиологических и биохимических особенностей нарушений взаимосвязанных систем свободно-радикального окисления и антиоксидантной защиты клеток, обуславливающих развитие диабетической нефропатии.
В качестве аналога изобретения нами взят способ лечения нефропатии при аллоксановом диабете у крыс с использованием мексидола, димефосфона, где в качестве сравнения был выбран альфа-токоферол (Машков Ю.И. Изучение нефропротекторных свойств мексидола, димефосфона и альфа-токоферола при острой интоксикации четыреххлористым углеродом, гентамицином и аллоксановым диабете, 2001 г., диссертация на соискание ученой степени кандидата медицинских наук), заключающийся во введении аллоксана в дозе 135 мг/кг массы внутрибрюшинно однократно. Через 2 недели после аллоксана вводили 12 дней мексидол в дозе 25 мг/кг в/м, димефосфон 50 мг/кг и 12 дней альфа-токоферол 25 мг/кг подкожно 1 раз в сутки.
Недостатком данного способа является то, что для оценки функционального состояния почек на фоне лечения изучались только минутный диурез, клубочковая фильтрация, канальцевая реабсорбция воды на фоне водной нагрузки, вызванной внутривенным введением 0,45% раствора NaCl в дозе 30 мг/кг массы тела и перекисное окисление липидов в эритроцитах и почечной ткани. В отличие от этого, мы изучали влияние препарата L-карнитин не только на водовыделительную функцию почек на фоне спонтанного 6-часового диуреза, но и электролитовыделительную функцию почек: определяли экскрецию натрия и калия, фильтрационный заряд натрия и калия, канальцевую реабсорбцию натрия, а также активность Na+, K+-АТФ-азы в гомогенатах слоев почечной ткани и микросомальной и митохондриальной фракциях почечной ткани, что позволило провести более глубокий анализ показателей нефропатии при экспериментальном сахарном диабете и влияние препарата L-карнитина на них и макро- и микрогемодинамики в сравнении с α-токоферолом.
У заявляемого изобретения имеются следующие существенные признаки: для коррекции нарушений процессов перекисного окисления липидов, антиоксидантной системы, показателей функционального состояния почек подкожно вводили крысам с экспериментальным сахарным диабетом в течение месяца L-карнитин в расчете 25 мг/100 г массы тела. По истечении периода введения исследовали показатели перекисного окисления липидов, антиоксидантной системы, показатели функционального состояния почек. Влияние L-карнитина оказалось эффективным. L-карнитин конкурентно угнетает окисление жирных кислот, улучшает окисление глюкозы, способствует нормализации энергообразования. На фоне курсового введения L-карнитина в дозе 0,5 мл (25 мг/100 г массы тела) крысам с экспериментальным сахарным диабетом обнаружено достоверное снижение активности процессов перекисного окисления липидов по данным содержания малонового диальдегида в крови (р<0,001), не отмечается различий с уровнем контроля. Активность каталазы снижается статистически достоверно (р<0,001), но не достигает контрольного уровня, супероксиддисмутаза (СОД) активируется (р<0,001) и ее активность не отличается от контрольного уровня.
Заявляемое изобретение направлено на решение задачи, заключающейся в предложении способа лечения нефроангиопатии при аллоксановом диабете у экспериментальных животных.
Решение этой задачи позволяет расширить представление о патофизиологических механизмах развития нефроангиопатии при хроническом аллоксановом диабете, предложить способ лечения нефроангиопатии при аллоксановом диабете у экспериментальных животных, повышающий воспроизводимость, удобный для проведения эксперимента на животных.
Для достижения этого технического результата заявляемое изобретение «Способ лечения нефроангиопатии при аллоксановом диабете у экспериментальных животных» включает следующие существенные признаки: для коррекции нарушений процессов перекисного окисления липидов (ПОЛ), антиоксидантной системы (АОС), показателей микрогемодинамики, функционального состояния почек вводили крысам с экспериментальным сахарным диабетом в течение месяца L-карнитин. По истечении периода введения исследовали показатели перекисного окисления липидов, антиоксидантной системы, состояние микро- и макрогемодинамики, функционального состояния почек. На фоне курсового введения L-карнитина в дозе 0,5 мл (25 мг/100 г массы тела) крысам с экспериментальным сахарным диабетом обнаружено достоверное снижение активности процессов перекисного окисления липидов по данным содержания малонового диальдегида в крови (р<0,001), не отмечается различий с уровнем контроля. Активность каталазы снижается статистически достоверно (р<0,001), СОД активируется (р<0,001) и ее активность не отличается от контрольного уровня.
У заявляемого способа имеются следующие преимущества: доступное, безопасное, воспроизводимое, относительно недорогое.
Между признаками заявляемого изобретения и техническим результатом существует следующая причинно-следственная связь: на фоне курсового введения L-карнитина в дозе 0,5 мл (25 мг/100 г массы тела) крысам с экспериментальным сахарным диабетом обнаружено достоверное снижение активности процессов перекисного окисления липидов по данным содержания малонового диальдегида в крови (р<0,001), не отмечается различий с уровнем контроля. Активность каталазы снижается статистически достоверно (р<0,001), СОД активируется (р<0,001) и ее активность не отличается от контрольного уровня.
По имеющимся у авторов сведениям совокупность существенных признаков, характеризующих сущность заявляемого изобретения, неизвестна, что позволяет сделать вывод о соответствии изобретения критерию «новизна».
По мнению авторов, сущность заявляемого изобретения не следует для специалистов явным образом из известного уровня медицины, так как из него не выявляется вышеуказанная возможность получения способа лечения нефроангиопатии при сахарном диабете, что позволяет сделать вывод о соответствии критерию «изобретательский уровень».
Совокупность существенных признаков, характеризующих сущность изобретения, в принципе может быть использована в медицине с получением результата, заключающегося в более высоком уровне лечения нефроангиопатии при сахарном диабете, что позволяет сделать вывод о соответствии изобретения критерию «промышленная применимость».
Способ осуществлялся следующим образом.
Для поражения инсулиногенных β-клеток островков Лангерганса (Лазарис Я.А., 1947) экспериментальный сахарный диабет (аллоксановый) вызывали путем внутрибрюшинного введения 5% водного раствора аллоксана (синтезированного в лаборатории кафедры биохимии СОГМА) в дозе 15 мг/кг веса животного натощак, на фоне 24-48 часового голодания при свободном доступе к воде. Через 48-72 часа натощак забирали кровь из хвоста (микроколичество) и определяли уровень глюкозы глюкозооксидазным методом (тест наборы). Модель считали состоявшейся при повышении сахара крови и диуреза в 2 раза. Для коррекции нарушений ПОЛ, АОС, показателей диабетической нефропатии (ДН) в течение месяца крысам с экспериментальным сахарным диабетом подкожно вводили L-карнитин в дозе 25 мг/100 г массы тела.
По истечении срока эксперимента изучали перфузию в различных точках локации тканей (жидкостный обмен) прозвучиванием датчиком 10 МГц, работающим по принципу «слепого» допплера у наркотизированных животных. Затем крысы забивались под тиопенталовым наркозом; забирали кровь из сердца с использованием в качестве антикоагулянта 2,8% раствора ЭДТА для определения концентрации малонового диальдегида (МДА) и сыворотку для определения активности каталазы и СОД, определяли концентрацию креатинина для расчета основных процессов мочеобразования.
Пример 1. Исследования проводили на крысах-самцах линии Вистар массой 200-220 грамм, находящихся на стандартном пищевом рационе со свободным доступом к воде и естественным световым режимом в зимний сезон года. Экспериментальный сахарный диабет, характеризующийся инсулиновой недостаточностью, вызывали путем внутрибрюшинного введения 5% водного раствора аллоксана в дозе 15 мг/кг массы тела. Для коррекции нарушений ПОЛ, АОС, показателей диабетической нефропатии (ДН), микрогемодинамики вводили крысам с экспериментальным сахарным диабетом в течение месяца подкожно L-карнитин в дозе 25 мг/100 г массы тела.
По истечении периода введения исследовали показатели ДН, микрогемодинамики ПОЛ, АОС, активность Na+, К+-АТФ-азы почечной ткани.
Сущность заявляемого способа подтверждена графически, где изображено:
Фиг.1 - динамика показателей перфузии тканей (жидкостного обмена) в норме и при экспериментальном сахарном диабете;
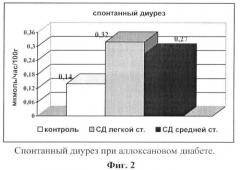
Фиг.2 - спонтанный диурез при аллоксановом диабете;
Фиг.3 - скорость клубочковой фильтрации при аллоксановом диабете;
Фиг.4 - канальцевая реабсорбция воды при аллоксановом диабете;
Фиг.5 - экскреция натрия при аллоксановом диабете;
Фиг.6 - фильтрационный заряд натрия при аллоксановом диабете;
Фиг.7 - канальцевая реабсорбция натрия при аллоксановом диабете;
Фиг.8 - активность каталазы при аллоксановом диабете;
Фиг.9 - активность супероксиддисмутазы при аллоксановом диабете;
Фиг.10 - активность Na+, К+-АТФ-азы почечной ткани у крыс с экспериментальным сахарным диабетом на фоне корригирующей терапии L-карнитином.
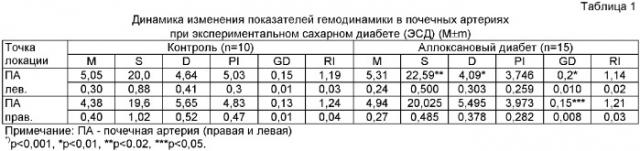
При анализе перфузии тканей во всех точках локации выявлено снижение средней скорости кровотока (М) (в среднем - на 20%) преимущественно за счет снижения систолической скорости кровотока (S) - на 15%, при повышении диастолической скорости кровотока (D) на 10%. Реографические показатели характеризуются повышением Индекса Гослинга, отражающего повышение упругоэластических свойств (плотности) сосудистой стенки, и снижением градиента давления в сосудах микроциркуляторного русла. Индекс Пурселло (реографический индекс - RI), который отражает общее периферическое сосудистое сопротивление, повышается (фиг.1).
Поскольку ангиопатии носят органоспецифический характер, и наиболее тяжелым последствием сосудистых осложнений является диабетическая нефропатия, мы исследовали гемодинамику в почечных артериях и изменения электролитовыделительной функции почек, включая Na-транспортирующий энзим.
Данные показали повышение средней (М), систолической (S) и диастолической скоростей кровотока (табл.1).
Это и способствовало поддержанию неизменного или несколько сниженного уровня клубочковой фильтрации при экспериментальном сахарном диабете разной степени тяжести (фиг.3). Однако имело место достоверное угнетение трансканальцевого транспорта воды (фиг.4) и электролитов (фиг.7), что и приводило к диуретическому (фиг.2) и натрийуретическому эффектам (фиг.5).
Канальцевый транспорт натрия является активным процессом и зависит от состояния натриевого насоса, основным компонентом которого является Na+, K+-АТФ-аза. Поэтому мы исследовали активность энзима в гомогенатах, коркового и мозгового веществ почечной ткани.
Данные показали снижение активности Na+, K+-АТФ-азы в гомогенатах обоих слоев почечной ткани, наиболее значительно в мозговом веществе (табл.2). Так, в корковом веществе активность фермента снизилась с 4,39±0,18 мкмоль Рн/мг белка/час до 3,18±0,22 мкмоль Рн/мг белка/час (р<0,001), то есть на 27,3% по сравнению с контрольной группой; а в мозговом веществе на 35,6%, то есть с 6,62±0,17 мкмоль Рн/мг белка/час в контрольной группе до 4,28±0,13 мкмоль Рн/мг белка/час в опытной (р<0,002).
| Таблица 2Показатели активности Na+, K+-АТФазы гомогенатов коркового и мозгового вещества почечной ткани при аллоксановом диабете | ||
| Группы животных | Активность Na+, K+-АТФ-азы в гомогенатах почечной ткани. мкмоль РН/мг белка/час | |
| В корковом веществе | В мозговом веществе | |
| Контрольная группа | М=4,39 | М=6,62 |
| m=±0,18 | m=±0,35 | |
| n=25 | n=25 | |
| Группа с аллоксановым диабетом | М=3,18 | М=4,38 |
| m=±0,22 | m=±0,13 | |
| n=25 | n=25 | |
| ρ=≤0,001 | ρ=<0,002 | |
| Примечание: ρ - достоверность результатов в опытной группе сравнительно с данными контрольной группы. |
Для исследования механизмов выявленных нарушений гемодинамики и показателей нефропатии мы исследовали на молекулярно-клеточном уровне патобиохимические аспекты патологического процесса. Анализ результатов показал, что на фоне стойкой гипергликемии происходит увеличение концентрации МДА в корковом и мозговом веществах почечной ткани у крыс с аллоксановым диабетом средней степени тяжести (табл.3.)
| Таблица 3Концентрация малонового диальдегида в эритроцитах и интерстиции почечной ткани при аллоксановом диабете | ||||
| Группы животных | Концентрация МДА в эритроцитах (нмоль/клетку) | Концентрация МДА в мозговом веществе почечной ткани (нмоль/мг белка) | Концентрация МДА в корковом веществе почечной ткани (нмоль/мг белка) | |
| Контрольная группа | М | 6,87 | 4,28 | 3,18 |
| ±m | 0,45 | 0,13 | 0,22 | |
| n | 10 | 16 | 16 | |
| Аллоксановый диабет | М | 8,65 | 6,62 | 4,39 |
| ±m | 0,47 | 0,17 | 0,18 | |
| n | 10 | 12 | 12 | |
| ρ | <0,01 | <0,001 | <0,001 | |
| Примечание: ρ - достоверность результатов по сравнению с контролем. |
Интенсификация ПОЛ при экспериментальном сахарном диабете обусловлена не только увеличением количества инициаторов ПОЛ, но и снижением активности ферментов антиокислительной защиты, которые разрушают или предупреждают образование активных форм кислорода.
Наши данные выявили повышение активности каталазы в сыворотке крови во всех группах животных с экспериментальным сахарным диабетом (фиг.8). Активность же СОД снижалась на фоне высокого уровня сахара крови (фиг.9).
Для коррекции нарушений ПОЛ, АОС, показателей ДН, макро- и микрогемодинамики вводили крысам с экспериментальным сахарным диабетом в течение месяца L-карнитин 0,5 мл (25 мг/кг массы тела).
Полученные данные показали, что на фоне курсового введения L-карнитина происходит достоверное снижение активности ПОЛ по данным МДА в крови, не отмечается различий с уровнем контроля. Активность каталазы снижается статистически достоверно (р<0,001), СОД активируется и ее активность не отличается от контрольного уровня (табл.4).
| Таблица 4 | ||||
| Изменение активности ПОЛ и АО С крови у крыс с аллоксановым диабетом на фоне введения L-карнитина | ||||
| Группы животных | МДА | СОД | Каталаза | |
| Контроль | М | 6,87 | 2,55 | 225,56 |
| ±m | 0,45 | 0,46 | 29,09 | |
| n | 15 | 15 | 15 | |
| СД | М | 8,65 | 1,45 | 345,33 |
| ±m | 0,47 | 0,044 | 3,32 | |
| n | 15 | 8 | 11 | |
| ρ | <0,001 | <0,01 | <0,001 | |
| СД+элькар | М | 4,28 | 1,942 | 302,63 |
| ±m | 0,156 | 0,031 | 1,237 | |
| n | 10 | 10 | 10 | |
| ρ* | >0,05 | >0,05 | <0,01 | |
| ρ** | <0,001 | <0,001 | <0,001 | |
| ρ* - по сравнению с СД; ρ** - по сравнению с контролем. |
Для выявления эффективности действия антиоксидантов на интенсивность перекисного окисления липидов и активность ферментов АОЗ проведен корреляционный анализ между концентрацией МДА, активностью СОД и каталазы. Данные показали наличие обратной корреляционной связи между концентрацией МДА и активностью СОД на фоне введения L-карнитина (r=0,59), что подтверждает его эффективность.
В другом варианте опытов было изучено влияние L-карнитина на активность
Na+, K+-АТФ-азы коркового и мозгового вещества почечной ткани. Данные показали эффективность препарата на состояние Na, K-транспортирующего энзима в мозговом веществе почек, в то время как активность фермента в корковом веществе обнаружила тенденцию к повышению, но изменения были недостоверны (фиг.10).
При исследовании характера кровотока в магистральных артериальных сосудах - почечных артериях (ПА пр. и ПА лев.) при СД отмечаются однонаправленные изменения гемодинамики, характеризующиеся снижением средней скорости кровотока (М) за счет снижения систолической скорости кровотока (S) при одновременном повышении диастолической скорости кровотока (D). В наибольшей степени повышение диастолической скорости кровотока (D) отмечается в почечных артериях. Реографические показатели характеризуются повышением индекса Гослинга, отражающего повышение упругоэластических свойств (плотности сосудистой стенки), и снижением градиента давления в сосудах микроциркуляторного русла. Индекс Пурселло (реографический индекс - RI), который отражает регионарное периферическое сосудистое сопротивление, снижается (табл.5).
| Таблица 5Изменение показателей почечного кровотока у крыс с СД и на фоне антиоксидантной терапии L-карнитином | |||||||
| Показатели | Статистика | ПА левая | ПА правая | ||||
| контроль | СД | L-карнитин | контроль | СД | L-карнитин | ||
| М | М | 5,052 | 5,308 | 4,83 | 4,377 | 4,946 | 5,18 |
| ±m | 0,304 | 0,245 | 0,47 | 0,402 | 0,276 | 0,41 | |
| S | М | 20,019 | 22,59** | 17,57*†††† | 19,599 | 20,025 | 18,38 |
| ±m | 0,880 | 0,500 | 0,71 | 1,020 | 0,485 | 0,77 | |
| D | М | 4,638 | 4,09 | 3,92 | 5,651 | 5,495 | 3,49 |
| ±m | 0,415 | 0,303 | 0,53 | 0,521 | 0,378 | 0,5 | |
| Pi | М | 5,036 | 3,746*** | 4,74 | 4,830 | 3,973 | 4,14 |
| ±m | 0,297 | 0,259 | 0,55 | 0,467 | 0,282 | 0,26 | |
| GD | М | 0,148 | 0,2*** | 0,12†††† | 0,127 | 0,15 | 0,13 |
| ±m | 0,012 | 0,010 | 0,01 | 0,011 | 0,008 | 0,01 | |
| RI | М | 1.191 | 1,145 | 0,76 | 1.24 | 1,207 | 0,80 |
| ±m | 0,029 | 0,021 | 0,03 | 0,044 | 0,029 | 0,03 | |
| n | 15 | 24 | 18 | 15 | 24 | 18 | |
| **** - p<0,001 *** - p<0,01 ** - p<0,02 * - p<0,05 достоверность относительно нормы. | |||||||
| †††† - p<0,001 ††† - p<0,01 †† - p<0,02 † - p<0,05 достоверность относительно диабета. |
Данные микроциркуляции (МЦ) показывают повышение средней скорости кровотока (М) при ЭСД за счет преимущественного повышения систолической скорости (S); плотность стенок микроциркуляторных сосудов (Pi) и их тонус (реографический индекс - RI) снижаются (табл.6).
| Таблица 6Изменения показателей жидкостного обмена у крыс с экспериментальным сахарным диабетом при различных вариантах антиоксидантной терапии | ||||
| Показатели | Статистика | Контроль | СД | L-карнитин |
| М | М | 2,52 | 2,14 | 2,25 |
| ±m | 0,076 | 0,064 | 0,15 | |
| S | М | 11,34 | 10,48 | 10,78 |
| ±m | 0,264 | 0,165 | 0,17 | |
| D | М | 6,34 | 6,25 | 5,84 |
| ±m | 0,168 | 0,220 | 0,23 | |
| Pi | М | 7,67 | 9,504 | 9,85 |
| ±m | 0.25 | 0,231 | 0,12 | |
| GD | М | 0,042 | 0,04 | 0,04 |
| ±m | 0,001 | 0,001 | 0,001 | |
| RI | М | 1,49 | 1,572 | 0,45 |
| ±m | 0,036 | 0,03 | 0.02 | |
| n | 10 | 58 | 36 |
Эта эффективность L-карнитина согласно наших данных связана с одной стороны с угнетением липопероксидации, приводящей к нормализации состояния фосфолипидов эндотелия сосудов, что и позволило уменьшить плотность сосудистой стенки, это подтверждается существованием отрицательной корреляционной связи между концентрацией МДА и скоростью кровотока (r=-0,69). С другой стороны, L-карнитин, улучшая метаболические окислительные процессы в эпителиальных клетках сосудов и кардиомиоцитах, улучшает макро- и микрогемодинамику.
Мембранотропный препарат L-карнитин угнетает процессы ПОЛ клеточных мембран в структурах нефрона и периферических сосудов, одновременно стимулирует АОЗ клеток, что характеризует его влияние на основное патогенетическое звено развивающейся нефро- и ангиопатии.
Способ лечения нефроангиопатии при аллоксановом диабете у экспериментальных животных, отличающийся тем, что животным первоначально однократно внутрибрюшинно вводят 5%-ный водный раствор аллоксана в дозе 15 мг/кг массы тела, а затем через 2 недели вводят подкожно ежедневно 1 раз в сутки L-карнитин в дозе 25 мг/100 г веса животного продолжительностью 4 недели.