Ингалятор предварительно дозированного сухого порошка для лекарств, чувствительных к влаге
Иллюстрации
Показать всеИзобретение относится к медицинской технике, а именно к ингаляторам предварительно дозированного сухого порошка. Ингалятор содержит дозу сухого порошкового лекарства и контейнер. Доза сухого порошкового лекарства загружена в контейнер и содержит частицы тиотропия и частицы по меньшей мере одного сухого эксципиента. Контейнер имеет средства сухой герметизации с высокими барьерными свойствами, содержащие алюминий, что предотвращает проникновение влаги. Доза сухого порошкового лекарства в контейнере сформирована либо волюметрическими, либо электрополевыми способами формирования доз. Использование изобретения позволяет повысить стабильность порошка тиотропия при его использовании для лечения астмы и других респираторных расстройств. 2 н. и 16 з.п. ф-лы, 5 ил.
Реферат
Настоящее изобретение относится к ингалятору сухого порошка (DPI), доставляющему высокую и стабильную дозу мелкодисперсных частиц. В этом ингаляторе используется высоконепроницаемый герметичный контейнер, заполненный по меньшей мере одной отмеренной дозой препарата, содержащего по меньшей мере один эксципиент и лекарственное средство тиотропий.
Дополнительные преимущества и другие признаки настоящего изобретения частично будут изложены в нижеследующем описании, а частично станут очевидными обычному специалисту при ознакомлении с нижеследующим или могут быть поняты из практического осуществления настоящего изобретения. Преимущества настоящего изобретения могут быть реализованы и получены, как конкретно указано в прилагаемой формуле изобретения. Следует понимать, что настоящее изобретение может иметь другие и иные воплощения, и некоторые его частности могут быть модифицированы в различных очевидных отношениях без отклонения от настоящего изобретения. Данное описание следует считать иллюстративным, а не ограничивающим по характеру.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Ингаляторы сухого порошка (DPI) становятся все более популярными по причине простоты их применения и их медицинской эффективности. DPI можно разделить на две основных категории: устройства для нефасованного средства и с предварительным отмериванием. Устройства с предварительным отмериванием завоевывают все большую часть рынка из-за возможности контролировать продукт и процесс отмеривания правильной дозы пользователю. DPI с предварительно отмеренными дозами являются, по этой причине, более надежными, чем ингаляторы для нефасованного средства, которые отмеряют дозу порошка внутри ингалятора. DPI с предварительным отмериванием перемещают критическую стадию отмеривания дозы в фармацевтический производственный процесс.
Астма и хроническое обструктивное легочное заболевание (COPD) поражают более чем 30 миллионов человек в США. Каждый год на эти состояния приходится более 100000 смертей. Обструкция потока воздуха через легкие является характерным признаком каждого из этих заболеваний дыхательных путей, и лекарства, используемые при лечении, часто подобны.
Хроническое обструктивное легочное заболевание (COPD) является широко распространенным хроническим легочным нарушением, включающим в себя хронический бронхит и эмфизему. Причины COPD не вполне понятны. Опыт показывает, что наиболее важной причиной хронического бронхита и эмфиземы является курение сигарет. Также могут играть роль загрязнение воздуха и воздействия, связанные с характером работы, особенно в сочетании с курением сигарет. Наследственность также является причиной некоторых случаев эмфиземы, вследствие недостаточности альфа-1-антитрипсина.
Введение противоастматических лекарственных средств путем пероральной ингаляции находится в настоящее время в центре внимания из-за создаваемых им преимуществ, таких как быстрое и предсказуемое начало действия, экономическая эффективность и высокий уровень комфорта для пользователя. Ингаляторы для сухого порошка (DPI) особенно интересны в качестве инструмента введения, по сравнению с другими ингаляторами, благодаря обеспечиваемой ими гибкости с точки зрения интервала номинальных доз, то есть количества активной субстанции, которое можно ввести в одной ингаляции.
Тиотропий, и особенно его бромидные соли, является эффективным бронходилататором. Тиотропий имеет относительно быстрое начало и большую продолжительность действия, которое может длиться 24 часа или более. Тиотропий снижает вагусный холинергический тонус гладкой мышцы, который является основным обратимым компонентом COPD. Было показано, что при клиническом тестировании тиотропий вызывает довольно незначительные побочные эффекты, из которых сухость во рту и запор являются, наверное, самыми обычными симптомами. Так как часто очень трудно диагностировать астму и COPD правильно, и поскольку оба нарушения могут сосуществовать, полезно лечить больных, страдающих преходящей или постоянной бронхиальной обструкцией, приводящей к одышке, малой, но эффективной, дозой длительно действующего антихолинергического агента, предпочтительно бромида тиотропия, благодаря быстрому началу, большой продолжительности и незначительным побочным эффектам его действия. В настоящее время бронходилатирующее лекарственное средство, подобное тиотропию, часто прописывают вместе и вводят в комбинации с другими противоастматическими лекарствами, для того чтобы обеспечить комбинированную терапию, например комбинируя бронходилатирующее и противовоспалительное лечение.
Эффективность дозы в значительной степени зависит от доставки стабильной и высокой дозы мелкодисперсных частиц (FPD) из ингалятора сухого порошка. FPD представляет собой массу дозы, вдыхаемой из ингалятора сухого порошка, с аэродинамическим размером частиц менее 5 мкм. Таким образом, при вдыхании дозы любого типа сухого лекарственного порошка важно получить во вдыхаемом воздухе высокую массовую фракцию мелкодисперсных частиц (FPF) с аэродинамическим размером предпочтительно менее чем 5 мкм. Большинство более крупных частиц (>5 мкм) не следует за потоком воздуха в многочисленные разветвления дыхательных путей, а прилипает к гортани и верхним дыхательным путям, при этом лекарство не осуществляет предполагаемое действие, а вместо этого может быть вредным для пользователя. Также важно, как можно более точно поддерживать дозу для пользователя и сохранять стабильную эффективность в течение времени, а также чтобы лекарственная доза не разрушалась в процессе нормального хранения. Например, Boehringer Ingelheim KG (BI) продает бромид тиотропия под патентованным названием Spiriva®, авторы изобретения обнаружили, что система Spiriva®/HandHailer® от BI для ингаляционного введения доз, содержащихся в желатиновых капсулах, демонстрирует плохие характеристики и имеет кратковременную стабильность при использовании.
Существует несколько способов из предшествующего уровня техники, применимых к тиотропию, для изготовления лекарственных препаратов, пригодных для ингаляции посредством ингаляторного устройства для сухого порошка. В одном таком способе тиотропий и эксципиент суспендируют в жидкости и затем перемешивают, и после получения смеси жидкость выпаривают. Смешивание веществ с частицами разного размера представляет собой другой способ, который показывает, как получить однородную порошковую смесь при помощи специальной процедуры смешивания. Еще один способ показывает, как осуществить непрерывное дозирование в смеситель для получения однородного порошкового препарата. Другие способы, которые можно использовать для получения однородного порошкового препарата эксципиента или эксципиентов и субстанции тиотропий, включают использование воздуха или какого-либо другого фармацевтически приемлемого газа в качестве суспендирующей среды в периодическом или непрерывном процессе смешивания для получения однородного смешивания частиц эксципиента(ов) и тиотропия и возможно одного или более дополнительных фармацевтически активных ингредиентов (API).
Получение препарата тиотропия и эксципиента, в котором количество тиотропия очень мало (например, менее 1:100 от количества эксципиента), чрезвычайно важно для FPD. Некоторые способы из предшествующего уровня техники направлены на улучшенную подготовку эксципиентов с целью улучшения FPD активного ингредиента, например нанесением оболочки на эксципиент, чтобы присутствовала фторированная поверхность частиц. Для улучшения FPD характеристик препарата возможно использовать другие модификации поверхности и другие способы обработки поверхности.
В предшествующем уровне техники не является необычным введение осушителя в материал контейнера, или в устройство, или во внешнюю упаковку устройства. Количество осушителя в конструкциях такого типа обычно очень мало, и требования к герметичности контейнера с целью защиты лекарственного порошка остаются теми же, если не предполагается, что осушитель должен быть нейтрализован перед открыванием продукта.
Способы образования дозы препаратов тиотропия включают обычное массовое, гравиметрическое или объемное отмеривание, а также устройства и механическое оборудование для заполнения, например, блистерных упаковок, хорошо известные в фармацевтической промышленности. Примеры из предшествующего уровня техники по объемным и/или массовым способам и устройствам для получения доз лекарств в порошковой форме смотрите также в WO 03/27617 А1, WO 03/66437 А1, WO 03/66436 A1, WO 03/26965 A1, WO 02/44669 A1 и DE 10046127 A1, DE 2020956 U1. Также можно использовать электростатические способы дозообразования, например, как раскрыто в US 6007630 и US 5699649.
В наиболее подходящем способе внесения микрограммовых и миллиграммовых количеств сухих порошков использована технология электрического поля (ELFID), как раскрыто в принадлежащем авторам изобретения патенте США №6592930 В2, который во всей своей полноте включен в данное описание изобретения посредством ссылки. В этом способе текучесть порошка является несущественной, так как частицы порошка перемещают из нефасованного источника на подложку для дозы на стадии образования дозы, опираясь не на силу тяжести, а используя главным образом технологию электрических и электростатических сил для внесения отмеренного количества порошка, то есть дозы, на подложку для дозы, которая может представлять собой блистер, капсулу или высоконепроницаемый контейнер, как раскрыто в настоящем изобретении. Преимуществом такого электрополевого способа образования дозы является то, что нет необходимости добавлять крупные частицы эксципиента к лекарственному порошку, потому что хорошая текучесть порошка не является существенной. Эксципиенты добавляют к активному агенту, в частности тиотропию, для разбавления лекарственного средства, чтобы иметь в ингаляторе предварительно отмеренную дозу, превышающую 100 мкг. Преимущественно эксципиент мелко измельчен, так чтобы средний массовый аэродинамический диаметр (MMAD) составлял менее 10 мкм. Тесты подтверждают, что доза мелкодисперсных частиц (FPD) из дозы, образованной электрополевым способом, значительно лучше, чем FPD из аналогичной дозы, образованной другими способами, обычными для предшествующего уровня техники. Электрополевой способ также очень подходит для комбинированных доз, например тиотропия, смешанного с API, или для раздельного формирования и внесения отмеренных количеств активных лекарств в одном и том же контейнере.
Из предшествующего уровня техники известны ингаляторы сухого порошка, использующие легкоотслаивающуюся фольгу для защиты дозы при использовании. Легкоотслаивающаяся закрывающая фольга сделана из слоистого материала с термогерметизирующим лаком (HSL), прилипающим к PVC (полихлорвиниловому) слою основного слоистого материала после того, как формованная полость в основном слоистом материала заполнена порошком. Процесс заполнения очень важен, потому что любой порошок, оставшийся на термогерметизируемых поверхностях, крайне отрицательно влияет на качество герметизации. Легкоотслаивающийся HSL всегда гораздо более чувствителен и сложен для герметизации по сравнению с общепринятой герметизирующей фольгой. Часто необходимо иметь внешнюю высоконепроницаемую упаковку для сохранения ингалятора в течение периода хранения и иметь легкоотслаивающийся HSL для защиты порошка только во время использования. В таком типе ингалятора из предшествующего уровня техники доза порошка открывается до того, как ингалятор готов для ингаляции, и поэтому доза подвергается воздействию окружающей среды и возможного выдыхаемого пользователем влажного воздуха.
Целью настоящего изобретения является сохранение и доставка высокой дозы мелкодисперсных частиц (FPD) тиотропия DPI продуктом, содержащим отмеренную дозу лекарственного средства тиотропия, адаптированную для ингаляции, упакованную в сухой и непроницаемый контейнер, так что в течение периода хранения этого медицинского продукта при доставке на FPD не влияют нормальные вариации условий окружающей среды при манипуляциях, хранении и доставке с использованием DPI продукта. Как станет очевидным из нижеследующего, авторы изобретения достигли этой цели и даже более.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении раскрыт DPI продукт, который предпочтительно адаптирован для применения в лечении респираторных расстройств и содержит предварительно отмеренное сухое порошковое лекарственное средство, включающее по меньшей мере один эксципиент и возможно по меньшей мере один дополнительный активный фармацевтический ингредиент (API). Кроме того, дозу в DPI непосредственно отмеряют, загружают и герметично закрывают во влагонепроницаемом сухом контейнере, действующем как сухой высоконепроницаемый герметизирующий в отношении влаги слой. Предпочтительным сухим порошковым лекарством является тиотропий, и в описании ниже он является типичным веществом.
DPI по данному изобретению содержит предварительно отмеренную дозу сухого порошка, имеющую высокую FPD, и делает возможным выбор подходящих пригодных эксципиентов для хороших свойств с точки зрения влажности и образования доз с достижением высоких FPD (например, с точки зрения как электрополевой технологии дозировки, так и общепринятых способов объемного заполнения).
В другом аспекте данного изобретения один или более чем один эксципиент включен в выбранных соотношениях с тиотропием в сухой порошковый препарат, так что функции эксципиента или эксципиентов состоят, среди прочего в том, чтобы разбавлять сильнодействующий ингредиент тиотропий, и/или сделать текучесть сухого порошкового препарата приемлемой для процесса образования дозы, и/или оптимизировать FPD отмеренной дозы.
В еще одном аспекте данного изобретения раскрыт тип ингалятора, в который можно вводить по меньшей мере один герметичный влагонепроницаемый сухой контейнер, содержащий отмеренную дозу тиотропия, и который может доставлять указанную дозу с постоянной FPD на протяжении ожидаемого времени хранения продукта.
В дополнительном аспекте изобретения тиотропий смешан или приготовлен в виде препарата с одним или более дополнительным(и) фармакологически активным(и) ингредиентом(ами) (API), таким образом лекарственное средство тиотропий скомбинировано с другим(и) лекарством(ами) для использования в лечении респираторных расстройств. Настоящее изобретение включает такое применение тиотропия в комбинированной дозе лекарственных средств в стабильных препаратах, которые непосредственно отмерены и помещены в герметичный влагонепроницаемый сухой контейнер для введения в DPI, причем комбинированная доза адаптирована для ингаляции пользователем.
Кроме того, в этом изобретении раскрыт способ предотвращения попадания увлажненного воздуха от пользователя к порошку в дозе перед ингаляцией, а также способ получения дозы, пригодной для аэрозолизации в тот момент, когда нарушается герметизация контейнера, включающего в себя эту дозу.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Данное изобретение вместе с его дополнительными аспектами и преимуществами можно лучше всего понять при обращении к нижеследующему подробному описанию, взятому вместе с прилагаемыми чертежами, в которых:
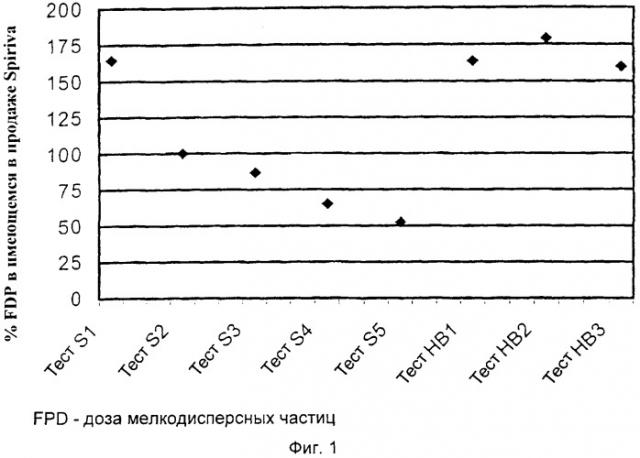
на Фиг.1 графически показаны результаты тестов S1-S5 и HBS1-HBS3;
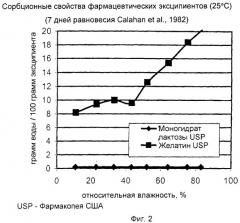
на Фиг.2 показаны сорбционные свойства фармацевтических эксципиентов;
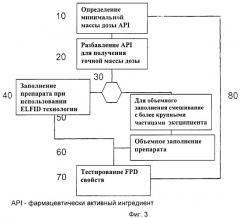
на Фиг.3 на блок-схеме показан способ разработки фармацевтической композиции с высокой FPD;
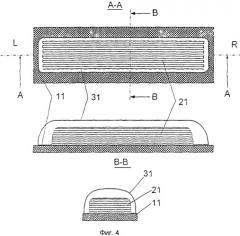
на Фиг.4 показаны виды сверху и сбоку первого воплощения дозы, внесенной на лоток для дозы, и высоконепроницаемого герметизирующего слоя; и
на Фиг.5 показаны виды сверху и сбоку второго воплощения дозы на подложке для дозы и высоконепроницаемого герметизирующего слоя.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВОПЛОЩЕНИЙ
Настоящее изобретение относится к DPI с загруженным(и) чувствительным(и) к влаге лекарственным(и) средством(ами), предпочтительно содержащим тиотропий, и описывает дозы и доставку доз для достижения высоких показателей доставленной FPD. Предпочтительно DPI является предварительно отмеренным. Кроме того, данное изобретение решает проблему того, как такие чувствительные лекарственные средства можно защитить от влаги с момента образования и герметизации доз до момента ингаляции выбранной дозы пользователем на всех стадиях хранения, транспортировки, распределения, опять хранения и, наконец, использования дозы. Кроме того, раскрыты подходящие ингаляторы сухого порошка для дозировок, чувствительных к влаге.
В настоящем изобретении раскрыт сухой, влагонепроницаемый, непосредственно нагружаемый и герметичный контейнер, включающий отмеренную дозу тиотропия в препарате с высокой FPD, содержащем по меньшей мере один эксципиент. Термин "тиотропий" является общим термином для всех его активных форм, включая фармацевтически приемлемые соли (особенно бромид), производные, энантиомеры, рацематы, гидраты, сольваты или их смеси. Отмеренная доза обычно включает по меньшей мере один эксципиент. В контейнере используются сухие высоконепроницаемые герметизирующие слои, непроницаемые для влаги и другого постороннего вещества, и он адаптирован для введения в устройство, представляющее собой ингалятор сухого порошка, или этот контейнер может быть адаптирован для того, чтобы представлять собой часть ингаляционного устройства.
"Сухой" означает, что стенки контейнера выполнены из выбранных материалов так, что эти стенки, особенно внутренняя стенка контейнера, не могут высвобождать воду, которая может оказать влияние на порошок антихолинергического лекарственного средства в дозе таким образом, что снижается FPD. Логическим следствием является то, что конструкции и материалы контейнера не следует выбирать из способов, предложенных в немецкой публикации DE 10126924 А1. Например, желатин не является сухим материалом, и даже после специального процесса сушки желатин все еще содержит воду.
"Высоконепроницаемый герметизирующий слой" означает сухую упаковочную конструкцию, или материал, или комбинацию материалов. Высоконепроницаемый герметизирующий слой характеризуется тем, что он представляет собой высокоэффективный барьер для влаги, и что сам герметизирующий слой является "сухим", то есть не может отдавать измеряемые количества воды загруженному порошку. Высоконепроницаемый герметизирующий слой может быть, например, сделан из одного или более слоев материалов, то есть технических полимеров, алюминия или других металлов, стекла, оксидов кремния и т.д., которые вместе образуют высоконепроницаемый герметизирующий слой. Если высоконепроницаемый герметизирующий слой представляет собой фольгу, фармацевтическая фольга PCTFE/PVC 50 мкм является минимально необходимой высоконепроницаемой фольгой, если требуется достичь двухнедельной стабильности при использовании. Для более продолжительной стабильности при использовании можно использовать металлическую фольгу, такую как алюминиевая фольга от Alcan Singen.
"Высоконепроницаемый контейнер" представляет собой механическую конструкцию, сделанную для вмещения и заключения в нее дозы, например, тиотропия. Высоконепроницаемый контейнер выполнен с использованием высоконепроницаемых герметизирующих слоев, составляющих стенки контейнера.
"Непосредственно помещаемый" означает, что отмеренную дозу помещают непосредственно в высоконепроницаемый контейнер, то есть без первоначального помещения этой дозы, например, в желатиновую капсулу, и затем заключают один или более чем один первичный контейнер (капсулы) во вторичную упаковку, сделанную из высоконепроницаемого герметизирующего материала.
Тиотропий является превосходным бронходилатирующим лекарственным средством, так как он имеет быстрое начало действия и действует в течение длительного времени, даже более 24 часа, что делает его идеальным для многих астматиков. Он является сильнодействующим лекарственным средством, и одноразовое ежедневное введение посредством ингаляции достаточно для того, чтобы справляться с астмой. Если пользователь страдает острыми приступами астмы, то дополнительное введение тиотропия снова позволит контролировать приступ астмы. Однако тиотропий чрезвычайно чувствителен к влаге. Этот факт, например, подтвержден в докладе "COLLEGE TER BEOORDELING VAN GENEESMIDDELEN MEDICINES EVALUATION BOARD; PUBLIC ASSESSMENT REPORT; Spiriva 18µg, inhalation powder in hard capsules: RVG 26191' (2002-05-21), где на стр.6/28 в разделе "Product development and finished product" сообщается об очень кратковременной стабильности при использовании продукта Spiriva®® (9 суток), и о ломкости капсулы в блистерной упаковке, и об очень низкой FPD: "около 3 мкг". Капсулы упакованы в блистер, сделанный из поливинилхлорида и защитного алюминиевого слоя. Один блистерный лист состоит из двух блистеров с 5 углублениями, соединенных вдоль перфорированной линии. Алюминиевая снимаемая фольга закрывает эти углубления. Блистер позволяет брать одну капсулу за один раз, так что другие капсулы остаются защищенными от влажного воздуха. Очевидно, что такая поливинилхлоридная пленка не является достаточной для защиты капсул SPIRIVA® в течение более 9 суток в ситуации использования.
Подробные сведения об ингаляционном наборе, содержащем ингалируемый порошок тиотропия, и о применении ингалятора для введения тиотропия также можно получить в международной публикации WO 03/084502 А1. Подробные сведения о тиотропиевых соединениях, о лекарствах на основе таких соединений, о применении этих соединений и о способах получения соединений можно получить из заявки на европейский патент 0418716 B1.
В свете вышеупомянутой информации, приведенной в указанном докладе, была организована программа тестирования стабильности продукта Spiriva® в соответствии с рекомендациями Администрации по контролю за продуктами питания и лекарствами (Food and Drug Administration, FDA).
Spiriva® вводят при помощи DPI HandiHaler®. Spiriva® представляет собой препарат тиотропия и тонкоизмельченного эксципиента и более крупного эксципиента для объемного заполнения в желатиновую капсулу, которую высушивают после заполнения и затем упаковывают в блистер тропического типа, сделанный из ПВХ пленки. Затем этот блистер покрывают алюминиевой фольгой. В течение времени использования после открывания первой капсулы только ПВХ пленка защищает остальные 4 капсулы в блистере.
Была организована и проведена трехнедельная программа тестирования в условиях ускоренного старения (40±2°С/75±5 RH (относительная влажность)) укупорки контейнера продукта Spiriva®, в данном случае капсулы и блистерной упаковки, и влияния капсулы и блистерной упаковки на FPD.
Проведение тестов
Нефасованный порошковый препарат Spiriva® и капсулы Spiriva® из местной аптеки авторов изобретения направляли в лабораторию вместе с HandiHaler®. Лаборатория была подготовлена для проведения in vitro тестов в соответствии с Европейской фармакопеей (ЕР) и Фармакопеей США (USP) при использовании двух каскадных импакторов Андерсена. Затем была выполнена вся аналитическая работа в соответствии со стандартизированными методами Физических Тестов и Определений для Аэрозолей, ингаляторов отмеренной дозы и ингаляторов сухого порошка, описанными в фармакопеях (например, USP 2002 <601>) при использовании современной системы высокоэффективной жидкостной хроматографии (ВЭЖХ).
Тесты Spiriva®
Тест S1
Аэродинамическая мелкодисперсная фракция частиц отмеренной и доставляемой дозы из HandiHaler® при использовании препарата Spiriva® из нефасованного порошка, помещенного в капсулы производителя при относительной влажности ниже 10%. Тест выполняли при перепаде давления 4 кПа в HandiHaler® при комнатной температуре и в условиях окружающей среды лаборатории.
Тест S2
Аэродинамическая мелкодисперсная фракция частиц отмеренной и доставляемой дозы из HandiHaler® при использовании имеющихся в продаже капсул Spiriva®, приобретенных в местной аптеке авторов изобретения. Тест выполняли при перепаде давления 4 кПа в HandiHaler® при комнатной температуре и в условиях окружающей среды лаборатории.
Тест S3
Тест на стабильность при использовании аэродинамической мелкодисперсной фракции частиц отмеренной и доставленной дозы из HandiHaler® с использованием имеющихся в продаже капсул Spiriva®, приобретенных в местной аптеке авторов изобретения. Из блистера, содержащего 5 капсул, одну капсулу извлекали, а остальные 4 капсулы помещали на 4 суток в условия 40°С и 75%-ной относительной влажности. Затем, перед выполнения тестов, блистер, содержащий 4 капсулы, помещали в эксикатор на 2 часа. Тест выполняли при перепаде давления 4 кПа в HandiHaler® при комнатной температуре и в условиях окружающей среды лаборатории.
Тест S4
Тест на стабильность при использовании аэродинамической мелкодисперсной фракции частиц отмеренной и доставленной дозы из HandiHaler® с использованием имеющихся в продаже капсул Spiriva®, приобретенных в местной аптеке авторов изобретения. Из блистера, содержащего 5 капсул, одну капсулу извлекали, а остальные 4 капсулы помещали на 13 суток в условия 40°С и 75%-ной относительной влажности. Затем, перед выполнения тестов, блистер, содержащий 4 капсулы, помещали в эксикатор на 2 часа. Тест выполняли при перепаде давления 4 кПа в HandiHaler® при комнатной температуре и в условиях окружающей среды лаборатории.
Тест S5
Тест на стабильность при использовании аэродинамической мелкодисперсной фракции частиц отмеренной и доставленной дозы из HandiHaler® с использованием имеющихся в продаже капсул Spiriva®, приобретенных в местной аптеке авторов изобретения. Из блистера, содержащего 5 капсул, одну капсулу извлекали, а остальные 4 капсулы помещали на 21 сутки в условия 40°С и 75%-ной относительной влажности. Затем, перед выполнения тестов, блистер, содержащий 4 капсулы, помещали в эксикатор на 2 часа. Тест выполняли при перепаде давления 4 кПа в HandiHaler® при комнатной температуре и в условиях окружающей среды лаборатории.
Испытания высоконепроницаемого герметизирующего слоя
Тест HSB1
Тест на стабильность при использовании аэродинамической мелкодисперсной фракции частиц отмеренной и доставленной дозы из HandiHaler® с использованием препарата Spiriva® из нефасованного порошка, помещенного при относительной влажности ниже 10% в контейнеры, выполненные так, чтобы выступать в качестве высоконепроницаемого герметизирующего слоя, в данном случае из алюминиевой фольги от Alcan Singen Germany, и затем герметично закрытые до абсолютной герметичности. Алюминиевые контейнеры помещали в эксикатор на 2 часа перед загрузкой порошкового препарата Spiriva® из алюминиевых контейнеров в капсулы производителя при относительной влажности ниже 10%. Тест выполняли при перепаде давления 4 кПа в HandiHaler® при комнатной температуре и в условиях окружающей среды лаборатории.
Тест HSB2
Тест на стабильность при использовании аэродинамической мелкодисперсной фракции частиц отмеренной и доставленной дозы из HandiHaler® с использованием препарата Spiriva® из нефасованного порошка, помещенного при относительной влажности ниже 10% в контейнеры, выполненные так, чтобы действовать в качестве высоконепроницаемого герметизирующего слоя, в данном случае из алюминиевой фольги от Alcan Singen Germany, и затем герметично закрытые до абсолютной герметичности. Герметично закрытые алюминиевые контейнеры помещали в климатическую камеру на 7 суток при 40°С и 75%-ной относительной влажности. Алюминиевые контейнеры помещали в эксикатор на 2 часа перед загрузкой порошкового препарата Spiriva® из алюминиевых контейнеров в капсулы производителя при относительной влажности ниже 10%. Тест выполняли при перепаде давления 4 кПа в HandiHaler® при комнатной температуре и в условиях окружающей среды лаборатории.
Тест HSB3
Тест на стабильность при использовании аэродинамической мелкодисперсной фракции частиц отмеренной и доставленной дозы из HandiHaler® с использованием препарата Spiriva® из нефасованного порошка, помещенного при относительной влажности ниже 10% в контейнеры, выполненные так, чтобы выступать в качестве высоконепроницаемого герметизирующего слоя, в данном случае из алюминиевой фольги от Alcan Singen Germany, и затем герметично закрытые до абсолютной герметичности. Герметично закрытые алюминиевые контейнеры помещали на 14 суток в климатические камеры при 40°С и 75%-ной относительной влажности. Алюминиевые контейнеры затем помещали в эксикатор на 2 часа перед загрузкой порошкового препарата Spiriva® из алюминиевых контейнеров в капсулы изобретателя при относительной влажности ниже 10%. Тест выполняли при перепаде давления 4 кПа в HandiHaler® при комнатной температуре и в условиях окружающей среды лаборатории.
Тесты DPI C-haler
Для оценки патентованного ингалятора авторов изобретения для предварительно отмеренного сухого порошка, так называемого C-haler, по сравнению с HandiHaler® выполняли тест вне программы тестирования стабильности. В картридже C-haler использовали высоконепроницаемые герметизирующие слои, сделанные из алюминиевой фольги от Alcan Singen Germany, и контейнеры объемно заполняли 5 мг нефасованного порошкового препарата Spiriva®. Тест выполняли при перепаде давления 4 кПа в HandiHaler® при комнатной температуре и в условиях окружающей среды лаборатории. Результаты тестов с импактором Андерсена рассчитывали для фракции мелких частиц на основании доставленной дозы, а также отмеренной дозы и переводили в FPD. Результаты приведены ниже в табл.1.
Результаты тестов S1-5 и HBS1-3 графически представлены на Фиг.1. По оси Y указан "% FPD имеющегося в продаже препарата Spiriva®". Это соответствует FPD из HandiHaler®, где 100% представляют собой FPD из свежей пробы из аптеки.
| Табл.1. | ||
| Ингалируемая доза мелкодисперсных частиц (FPD) <5 мкм в % | ||
| Вычисления основаны на | Spiriva® в HandiHaler®, имеющийся в продаже образец, FPD | Spiriva® в C-haler, FPD |
| Отмеренной дозе | 18% | 47% |
| Доставленной дозе | 36% | 56% |
Выводы по тестам, выполненным на Spiriva®
Неожиданно авторы изобретения в своих тестах обнаружили и сделали заключение, что предварительно отмеренные дозы Spiriva® чрезвычайно чувствительны к влаге и что обычная упаковка в желатиновые капсулы, используемая в настоящее время для ингаляционных продуктов и особенно респираторных продуктов, будет значительно влиять на FPD. Результаты показывают, что существует необходимость в сухом, влагонепроницаемом, высоконепроницаемом герметизирующем слое для предварительно отмеренной дозы, окружающей препарат тиотропия, для сохранения первоначальной мелкодисперсной фракции частиц, а также то, что желатин не является подходящим эксципиентом или материалом для использования вместе с препаратом Spiriva® внутри высоконепроницаемого герметичного контейнера. В свете этих результатов не так удивительно то, что авторы изобретения также обнаружили то, что препарат тиотропия должен быть должным образом защищен также в процессе использования, если надо избежать дальнейшего снижения FPD.
Проведенные тесты показывают, что влагосодержание желатиновой капсулы уменьшает FPD вне Handihaler® на приблизительно 50%, с момента помещения дозы в капсулу до момента выхода продукта на рынок. При загрузке доз Spiriva® в сухие контейнеры, сделанные из материалов, обладающих высоконепроницаемыми герметизирующими свойствами, и затем при хранении нагруженных контейнеров при 40°С и 75%-ной относительной влажности перед перемещением доз Spiriva® в капсулы производителя и выполнением тех же тестов с использованием Handihaler®, как ранее, нельзя обнаружить никаких изменений в дозе мелкодисперсных частиц (FPD) даже после длительных периодов времени. Однако FPD Spiriva® в желатиновых капсулах продолжает уменьшаться во время использования продукта, и, как показано в тесте на стабильность при использовании, FPD снижается на еще 20% после 5 суток хранения при 40°С и 75%-ной относительной влажности из-за нарушения влагоизолирующего барьера блистерной упаковки. В Таблице 1 показано, что C-haler авторов изобретения, в котором используются высоконепроницаемые контейнеры, демонстрирует по сравнению с Handihaler® в 2,6 раза лучшие характеристики в отношении FPD на основании отмеренной дозы.
Уровень техники
В настоящее время отмеренные дозы порошкового препарата Spiriva® на месте производства производителя помещают в желатиновые капсулы. Желатиновая капсула обычно содержит 13-14 мас.% воды на стадии образования дозы, и после загрузки капсул их сушат в специальном процессе, чтобы минимизировать содержание воды. Некоторое количество высушенных капсул затем помещают в общую блистерную упаковку. Подробные сведения о подходящих материалах для капсул и производственных процессах из уровня техники можно получить из заявки на немецкий патент DE 10126924 A1. Оставшееся после сушки небольшое количество воды в материале капсулы, таким образом, помещено в блистерную упаковку. Равновесие между захваченным воздухом, находящимся внутри упаковки, и желатиновой капсулой будет создавать внутри блистерной упаковки относительную влажность, которая будет отрицательно влиять на FPD порошка тиотропия вне ингалятора сухого порошка.
Интересно отметить, что большинство сухих порошковых препаратов разных типов лекарств не подвержено значительному влиянию влаги, заключенной в материале капсул, или отклонений в относительной влажности окружающего воздуха при нормальном хранении. Примерами веществ, которые гораздо более стабильны в отношении влажности, являются ингалируемые стероиды, например будесонид и флутиказон. Неожиданно исследования авторов изобретения показали значительные отличия для тиотропия. Вследствие некоторых до сих пор неизвестных механизмов, при воздействии очень малых количеств воды FPD со временем уменьшается. Поскольку капсулы используют только в качестве удобных механических носителей, среди прочего доз Spiriva®, частичное решение проблемы влажности может состоять в том, чтобы вообще не использовать капсулы, а вместо этого непосредственно помещать дозы в контейнеры, сделанные из сухого упаковочного материала с высоконепроницаемыми герметизирующими свойствами, в условиях сухой окружающей среды, предпочтительно при относительной влажности ниже 15%.
Влагонепроницаемые высоконепроницаемые контейнеры по настоящему изобретению, которые загружают отмеренными дозами тиотропия, предпочтительно следует делать из алюминиевой фольги, разрешенной для непосредственного контакта с фармацевтическими продуктами. Алюминиевая фольга, которая работает должным образом в данных аспектах, обычно состоит из технических полимеров, ламинированных алюминиевой фольгой для придания фольге надлежащих механических свойств, чтобы избежать растрескивания алюминия при формовке. Герметизацию образовавшихся контейнеров обычно осуществляют путем использования более тонкой покровной фольги из чистого алюминия или ламинированного алюминия и полимера. Контейнер и покровную фольгу затем герметизируют вместе, используя по меньшей мере один из нескольких возможных способов, например:
используя термосклеивающий лак, посредством давления и нагревания;
используя нагревание и давление для соединения материалов вместе плавлением;
ультразвуковую сварку контактирующих материалов.
Тиотропий в чистом виде является очень сильнодействующим лекарственным средством, и поэтому перед стадией образования дозы его разбавляют путем смешивания с приемлемыми эксципиентами, например лактозой, в выбранном(ых) соотношении(ях) в соответствии с предпочтительным способом образования и загрузки доз. Подробные сведения об ингаляционных порошках, содержащих тиотропий в смесях с эксципиентами, о способах изготовления порошков, о применении порошка и капсул для порошка можно получить, например, в международной заявке WO 02/30389 А1, Bechtold-Peters et al. Изготовление препарата очень малого количества, например, тиотропия с гораздо большим количеством эксципиента требует специальных мер предосторожностей, которые надо принять для получения конечного стабильного и надежного способа изготовления.
В соответствии с настоящим изобретением, доставляемая доза мелкодисперсных частиц (FPD) чистого тиотропия, вводимая путем ингаляции, в описании изобретения не ограничена и в общем случае может находитьс