Комплексообразующие бензосодержащие гетероциклические соединения, содержащие -дикарбонильный заместитель с фторированными радикалами
Иллюстрации
Показать всеИзобретение относится к области синтеза новых аналитических реагентов комплексообразующего типа, пригодных для допирования наночастиц и использования в области люминесцентно-спектрального анализа, технологии биочипов, а также в качестве экстрагентов ионов тяжелых и редкоземельных металлов. Описываются комплексообразующие бензосодержащие гетероциклические соединения, содержащие β-дикарбонильный заместитель с фторированными радикалами формулы: HetAr-С(O)СН2С(O)CF3, где HetAr=
образующие люминесцирующие комплексы с ионами Eu3+. Предложенные соединения по длительности люминесценции и эффективности связывания находятся на уровне ближайших по структуре соединений, однако при этом являются легкодоступными в отношении технологии получения и обладают повышенной растворимостью в воде, составляющей >10-4 моль/л, в связи с чем могут быть использованы для создания принципиально новых схем биочипов с временной, пространственной и спектральной селекцией сигнала. 5 ил., 1 табл.
Реферат
Изобретение относится к области синтеза новых аналитических реагентов комплексообразующего типа и может быть использовано в области люминесцентного анализа, в частности для клинической диагностики объектов биогенного происхождения, а также в областях науки и техники, связанных с процессами комплексообразования ионов тяжелых металлов и применения наноразмерных аналитических реагентов.
Известен способ флуоресцентно-спектроскопического определения биологически активных веществ, при осуществлении которого используются маркеры на основе комплексов лантаноидов, связанных с определяемыми веществами посредством полиаминополикарбоновых кислот типа диэтилентриаминопентауксусной кислоты (ДТПА), обладающих высокими константами связывания с ионом лантаноидов (>1018 л/моль) (США, патент №4808541, НКИ 436/501). Недостатком этих соединений является то, что они не обладают люминесцентными свойствами.
Для детектирования связанных ионов лантаноидов в этом способе приходится перекомплексовывать их в другой хелат с люминесцирующим β-дикетоном (например, нафтоилтрифторацетоном (НТА). Метод, известный под названием DELFIA, осуществляется в среде так называемого усиливающего раствора (УР), состоящего из буфера рН≤3,5, синергического агента триоктилфосфиноксида (ТОФО) и мицеллобразователя Тритона Х-100. Недостатком НТА является то, что он обладает константой связывания с ионом европия (Eu3+) порядка 107 л/моль и не может быть использован для прямого мечения биологических структур. Для надежного выявления малых концентраций аналита (10-13 - 10-8 моль/л по Eu3+) НТА в УР используется в большом избытке (1,5.10-5 моль/л). Недостатком этого комплексообразователя является также и то, что максимум возбуждения люминесценции комплекса НТА - Eu3+ находится при ~340 нм, что требует применения дорогостоящих источников возбуждения типа лазера или импульсных газонаполненных ламп, а также кварцевой оптики в канале возбуждения.
Известны бифункциональные соединения на основе 2,6-дизамещенных пиридинов, образующие комплексы с ионами лантаноидов, и их использование в качестве ковалентных маркеров в анализах биоспецифических взаимодействий (США, патент №6127529, НКИ 534/10). Эти комплексы обладают большей стабильностью по сравнению с комплексами на основе полиаминополикарбоновых кислот и могут быть использованы при повышенных температурах, в электрофоретических условиях, в присутствии дополнительных комплексообразователей и т.п. Они обладают люминесцентными свойствами и могут быть применены для анализа in situ (например, при гомогенном иммуноанализе). Вместе с тем из-за низкой квантовой эффективности этих маркеров чувствительность определения невысока (~10-4 моль/л аналита в реакционной среде). В основном эти соединения применяются для прямого мечения биологических объектов ионом европия с последующим перекомплексованием их в УР (см., например, Clin.Chem., v.46, 2000, р.р.658-666). Максимум возбуждения их комплексов с Eu3+ также не превышает 330 нм.
Известны флуоресцентные комплексы ионов лантаноидов на основе производных терпиридинов, обладающих высокими константами связывания (США, патент №5457186, НКИ 534/15). В отличие от комплексов на основе пиридиновых производных они обладают несколько улучшенными значениями квантовой эффективности, но таким же коротковолновым возбуждением (≤340 нм). Кроме того, стоимость этих реагентов достаточно высока, так как для достижения наибольшего эффекта используются дейтерированные производные.
Известны реагенты для мечения на основе комплексов ионов лантаноидов с бис-β-дикарбонильными структурами, содержащими также хромофорную (ароматическую) и электроноакцепторную (фторзамещенные алкильные группы) части (США, патент №6166251, НКИ 562/828). Эти комплексы обладают достаточной интенсивностью флуоресценции, более чем в 10 раз превышающую интенсивность флуоресценции реагентов известных систем (LKB). Недостатком указанных соединений является то, что максимум длины волны возбуждения комплексов также не превышает 340 нм.
Близкими к заявляемым соединениям по технической сущности являются дибензосодержащие пятичленные циклические соединения, содержащие два симметричных β-дикарбонильных заместителя с фторированными радикалами (RU, патент №2296756, МКИ C07D 307/91). Так, некоторые из заявляемых соединений образуют стабильные (константы связывания ≥1011 л/моль) длительно люминесцирующие (времена жизни люминесценции τ порядка 600÷900 мкс) комплексы с ионами Eu3+ и имеют максимумы возбуждения в области ≥360 нм. Однако вещества этого типа недостаточно хорошо растворимы в воде (<10-4 моль/л), могут участвовать в неспецифических (гидрофобных) взаимодействиях с материалами твердой фазы и, как следствие, снижать чувствительность иммуноанализа при мечении ими биологических макромолекул. Таким образом, эти соединения не могут использоваться в ряде задач иммуноанализа, в том числе для создания допированных наночастиц, получаемых водоэмульсионной полимеризацией. Кроме того, эти соединения достаточно сложны при очистке и выделении, обладают остаточной "фоновой" люминесценцией и не позволяют выявлять ионы европия в концентрациях ниже 10-13 М.
Задачей является создание соединений, растворимых в воде и органических растворителях и характеризующихся оптимальным набором люминесцентно-спектральных свойств при комплексообразовании, в частности, с ионами Eu3+ (времена жизни люминесценции τ порядка 300÷600 мкс при возбуждении в области ≈340-360 нм), синтез которых может быть легко осуществлен и легко воспроизводиться и при этом не требуется высокой квалификации исполнителей, а их очистка может быть осуществлена с минимальными затратами.
Техническим результатом, достигаемым при использовании заявляемых соединений, являются их оптимальные люминесцентно-спектральные характеристики при образовании комплексов с ионами тяжелых металлов и растворимость в воде в концентрациях >10-4 моль/л, что позволяет проводить чувствительное обнаружение как самих ионов, так и других аналитов, допированных наночастицами.
Технический результат достигается предлагаемыми соединениями, представляющими собой комплексообразующие бензосодержащие гетероциклические соединения, образующие люминесцирующие комплексы с ионами Eu3+ содержащие β-дикарбонильный заместитель с фторированными радикалами, общей формулы: HetAr-С(O)СН2С(O)CF3,
где HetAr=
Авторам не известны растворимые в воде и органических растворителях комплексообразующие бензосодержащие гетероциклические соединения, содержащие β-дикарбонильный заместитель с фторированными радикалами. Кроме того, авторам не известны комплексы фторированных β-дикарбонильных соединений с ионами лантаноидов, которые при использовании, например, в условиях проведения анализа биоспецифического связывания обеспечивают указанный выше технический результат. Следовательно, заявляемое техническое решение удовлетворяет критерию «Новизна».
Известны технические решения, в которых использованы соединения, содержащие β-дикарбонильные заместители и различные ароматические хромофоры. Соединение, описанное в патенте США №6166251, НКИ 562/828, обеспечивает получение комплексов, обладающих достаточно высокими константами связывания Eu3+, но коротковолновым (≤340 нм) возбуждением. Заявляемые соединения позволяют получать комплексы Eu3+ с приемлемыми для допирования наночастиц константами связывания (~107 М-1) и интенсивной длительной люминесценцией при возбуждении в области длин волн ≥340 нм. Следовательно, предлагаемое техническое решение соответствует критерию "Уровень техники".
Заявляемые соединения и их комплексы с ионами лантаноидов могут найти применение в качестве маркеров и усилителей в различных способах анализа с использованием флуориметрии с временным разрешением люминесценции и особенно для допирования наночастиц. В области клинической диагностики они могут быть использованы для определения белков, гормонов, токсинов, нуклеиновых кислот и других объектов биогенного происхождения (например, микроорганизмов и вирусов), являющихся участниками биоспецифических взаимодействий. В области аналитической химии заявляемые реагенты могут быть применены для обнаружения редкоземельных элементов, их концентрирования и выделения, в том числе в хроматографии. В области техники они могут быть применены в качестве экстрагентов ионов тяжелых и редкоземельных металлов с целью их извлечения и/или очистки от их примесей сточных и контурных вод. Наиболее перспективно их применение в целях производства биочипов. Следовательно, заявляемое техническое решение соответствуют критерию «Промышленная применимость».
В общем случае заявляемые β-дикарбонильные соединения получаются конденсацией Кляйзена (схема 1), хотя созданию каждого типа гетероароматических соединений соответствуют свои оптимальные параметры: конденсирующий агент, щелочной реагент, условия реакции, стехиометрия компонентов и т.п.
В качестве конденсирующего агента можно использовать сложные эфиры и ангидриды, галогенангидриды алифатических кислот, предпочтительно, однако, применять алкиловые эфиры трифторуксусной кислоты.
В качестве щелочных реагентов можно применять этилат натрия, метилат натрия, металлический натрий, амид натрия, гидриды натрия и лития. Если β-дикарбонильные соединения получаются в присутствии алкоголятов натрия с удовлетворительными выходами, то следует использовать именно эти реагенты, так как они менее опасны в обращении, чем металлический натрий или гидриды и менее способны к образованию побочных продуктов, чем металлический натрий или амид натрия. Предпочтительно применять в качестве реагентов метиловый эфир трифторуксусной кислоты и метилат натрия.
В качестве растворителей при осуществлении конденсации Кляйзена используются любые инертные растворители, не меняющиеся в условиях реакции. К ним, в частности, принадлежат: ациклические и циклические простые эфиры, ациклические и циклические углеводороды, апротонные биполярные растворители. Предпочтение отдается одному из вышеперечисленных растворителей в зависимости от конкретно взятого исходного ацетильного соединения.
При проведении реакции предпочтительным оказалось соотношение компонентов: ацетильное соединение - конденсирующий агент - щелочной реагент как 1:1,2:1,2, хотя оно может изменяться в каждом конкретном случае.
Температура реакции может колебаться от -5°С до температуры кипения растворителя, однако предпочтительно от -5°С до +40°С.
Реакцию можно проводить как при атмосферном, так и при повышенном или пониженном давлении, однако обычно работают при атмосферном давлении.
Заявляемые бензосодержащие гетероциклические соединения, имеющие β-дикарбонильный заместитель с трифторметильной группой приведенной выше общей формулы, представляют собой индивидуальные химические соединения ряда β-дикетонов, в которых в качестве хромофорного фрагмента выступают гетероароматические циклы. В каждом из них присутствует β-дикарбонильная группировка (в положении 3 у индола, бензотиофена и фенотиазина и положении 2 у бензофурана и хинолина), ковалентно связанная с фторсодержащими фрагментами, которые обеспечивают сдвиг кето-енольного равновесия в сторону енола и за счет этого облегчают образование координационной связи с ионами редкоземельных элементов. Максимум возбуждения люминесценции комплексов предлагаемых соединений с Eu3+ варьирует в зависимости от структуры в интервале 340÷360 нм.
На фигуре 1 приведена структурная формула соединения 1-(1-бензотиофен-3-ил)-4,4,4-трифтор-1,3-бутандиона;
на фигуре 2 - 4,4,4-трифтор-1-(1H-индол-3-ил)-1,3-бутандиона;
на фигуре 3 - 1-(1-бензофуран-2-ил)-4,4,4-трифтор-1,3-бутандиона;
на фигуре 4 - 4,4,4-трифтор-1-(10H-фенотиазин-3-ил)-1,3-бутандиона;
на фигуре 5 - 4,4,4-трифтор-1-(2-хинолинил)-1,3-бутандиона.
Примеры синтеза заявляемых соединений
Пример 1
Синтез 1-(1-бензотиофен-3-ил)-4,4,4-трифтор-1,3-бутандиона
К суспензии гидрида лития (25 ммоль) в сухом диэтиловом эфире (40 мл) прибавляли раствор метилового эфира трифторуксусной кислоты (5,6 ммоль) в этиловом эфире (5 мл) и раствор 3-бензотиофенилметилкетона (5,6 ммоль) в этиловом эфире (10 мл). Реакционную массу кипятили 24 часа, охлаждали до комнатной температуры, обрабатывали раствором продажной концентрированной серной кислоты (3,7 г) в дистиллированной воде (20 мл). Органический слой отделяли и промывали дистиллированной водой (3×7 мл), выдерживали при остаточном давлении 15 Торр в течение 1 часа при 80°С. Сухой остаток перекристаллизовывали из гептана (20 мл), промывали гексаном (3×5 мл) и получали β-дикетон, который представляет собой кристаллическое вещество с Тпл=57°С. Выход целевого продукта 0,98 ммоль (6,0%).
1Н-ЯМР: 6.6 (с, 1Н,=СН); 7.5 (м, 2Н, 2=СН); 7.9 (д, 1Н, =СН, J=7); 8.4 (с, 1Н,=СН); 8.65 (д, 1Н, =СН); 15.2 (ушс, 1Н, ОН);
19F-ЯМР: 0.4 (с, 3F, CF3);
МВ=272,2; C12H7F3O2S.
Элементный анализ: найдено С - 52,75%, Н - 2,34%, вычислено С - 52,94%, Н - 2,59%.
Пример 2
Синтез 4,4,4-трифтор-1-(1H-индол-3-ил)-1,3-бутандиона
Металлический натрий (12 ммоль) растворяли в сухом метаноле (5 мл), затем реакционную массу концентрировали досуха при остаточном давлении 20 Торр в течение 1 часа при 90°С. Прибавляли сухой диэтиловый эфир (15 мл) и раствор метилового эфира трифторуксусной кислоты (12 ммоль) в этиловом эфире (5 мл), затем прибавляли 3-индолилметилкетон (5 ммоль). Полученную суспензию выдерживали при 50°С и перемешивании в замкнутом объеме в течение 15 часов, охлаждали до комнатной температуры, обрабатывали раствором продажной концентрированной уксусной кислоты (1,5 г) в дистиллированной воде (40 мл). Органический слой отделяли и промывали дистиллированной водой (3×10 мл), выдерживали при остаточном давлении 20 Торр в течение 1 часа при 85°С. Сухой остаток перекристаллизовывали из хлороформа (65 мл), промывали хлороформом (3×5 мл) и получали β-дикетон, представляющий кристаллическое вещество с Тпл=199°С. Выход целевого продукта 1,32 ммоль (25,0%).
1Н-ЯМР: 6.45 (с, 1Н, =СН); 7.2 (м, 2Н, 2=СН); 7.5 (м, 1Н, =СН); 8.2 (м, 1Н, =СН); 8.55 (с, 1Н, =СН); 12.35 (ушс, 1Н, NH);
19F-ЯМР: 3.3 (с, 3F, CF3);
МВ=255.2; C12H8F3NO2.
Элементный анализ: найдено С - 56,85%, Н - 3,24%, N 5,21%, вычислено С - 56,48%, Н - 3,16%, N 5,49%.
Пример 3
Синтез 1-(1-бензофуран-2-ил)-4,4,4-трифтор-1,3-бутандиона
Металлический натрий (25 ммоль) растворяли в сухом метаноле (7 мл), затем реакционную массу концентрировали досуха при остаточном давлении 15 Торр в течение 1 часа при 110°С. Прибавляли сухой диэтиловый эфир (20 мл) и в течение 15 минут метиловый эфир трифторуксусной кислоты (25 ммоль), затем раствор 2-бензофурилметилкетона (25 ммоль) в диэтиловом эфире (10 мл). Реакционную массу кипятили в течение 6,5 часов при перемешивании, охлаждали до комнатной температуры, обрабатывали раствором продажной концентрированной серной кислоты (7,5 г) в дистиллированной воде (40 мл). Органический слой отделяли и промывали дистиллированной водой (3×25 мл), выдерживали при остаточном давлении 20 Торр в течение 1 часа при 75°С, фракционировали и получали β-дикетон в виде кристаллического вещества с Тпл=74°С (Ткип=91 (2) °С). Выход целевого продукта 1,58 ммоль (8,0%).
1Н-ЯМР: 6.75 (с, 1Н, =СН); 7.35 (т, 2Н, 2=СН, J=6); 7.6 (д, 1Н, =СН, J=8); 7.75 (т, 1Н, =СН); 7.8 (д, 1Н, =СН); 7.95 (с, 1Н, =СН);
19F-ЯМР: 2.4 (с, 3F, CF3);
МВ=256,2; C12H7F3O3.
Элементный анализ: найдено С - 56,68%, Н - 2,50%, вычислено С - 56,26%, Н - 2,75%.
Пример 4
Синтез 4,4,4-трифтор-1-(10H-фенотиазин-3-ил)-1,3-бутандиона
Металлический натрий (15 ммоль) растворяли в сухом метаноле (6 мл), затем реакционную массу концентрировали досуха при остаточном давлении 22 Торр в течение 1 часа при 85°С. Прибавляли сухой диэтиловый эфир (20 мл) и в течение 15 минут раствор метилового эфира трифторуксусной кислоты (15 ммоль) в этиловом эфире (5 мл), затем прибавляли 3-тиазинилметилкетон (5 ммоль). Полученную суспензию кипятили при перемешивании в течение 2 часов, охлаждали до комнатной температуры, обрабатывали раствором продажной концентрированной серной кислоты (4,6 г) в дистиллированной воде (40 мл). Органический слой отделяли и промывали дистиллированной водой (3×15 мл), выдерживали при остаточном давлении 20 Торр в течение 3 часов при 85°С. Сухой остаток перекристаллизовывали из смеси (25 мл) хлороформ-гептан (8:1), промывали хлороформом (3×5 мл) и получали β-дикетон, в виде кристаллического вещества с Тпл=188°С. Выход целевого продукта 3,22 ммоль (24,8%).
1Н-ЯМР: 6.6 (д, 1Н, =СН, J=7); 6.65 (с, 1Н, =СН); 6.7 (м, Н, =СН); 6.8 (д, 1Н, =СН, J=8); 6.9 (м, 2Н, 2=СН); 7.2 (с, 1Н, =СН); 7.4 (д, 1Н, =СН, J=8); 8.65 (с, 1Н, NH);
19F-ЯМР: 5.1 (с, 3F, CF3);
MB=337,3; C16H10F3NO2S.
Элементный анализ: найдено С - 56,51%, Н - 2,59%; вычислено С - 56,97%, Н - 2,99%.
Пример 5
Синтез 4,4,4-трифтор-1-(2-хинолинил)-1,3-бутандиона
Металлический натрий 0,28 г (12,2 ммоль) растворяли в 10 мл сухого метанола, затем реакционную массу концентрировали досуха при остаточном давлении 22 Торр в течение 1 часа при 85°С. К полученному метилату натрия прибавляли 0,80 г (4,67 ммоль) ацетилхинолина в 15 мл сухого диэтилового эфира, раствор метилового эфира трифторуксусной кислоты 0,66 г (5,14 ммоль) в 5 мл сухого диэтилового эфира. Полученную суспензию кипятили при перемешивании 3 часа, охлаждали до комнатной температуры, обрабатывали раствором концентрированной серной кислоты 2 г в 5 мл дистиллированной воды. Органический слой отделяли, промывали дистиллированной водой (3×10 мл), водный слой экстрагировали эфиром (3×5), объединенные эфирные слои упаривали. Получали 4,4,4-трифторо-1-(2-хинолинил)-1,3-бутандион 0,34 ммоль (7,21%), грязно-желтое твердое вещество т. разл. 280-282°С. 1Н-ЯМР-спектр (δ, м. д.): 6,98 (с, 1Н, =СН); 7,62 (м, 1Н, =СН,); 7,77 (м, 1Н, =СН,); 7,95 (д, 1Н, =СН); 8,19 (м, 2Н, 2=СН); 8,38 (д, 1Н, =СН);
19F-ЯМР: 3.2 (с, 3F, CF3);
МВ=267,2; C13H8F3NO2.
Элементный анализ: найдено С - 58,18%, Н - 3,20%, N - 5,18% C20H11F6NO4, вычислено С - 58,43%, Н - 3,02%, N - 5,24%.
Пример 6
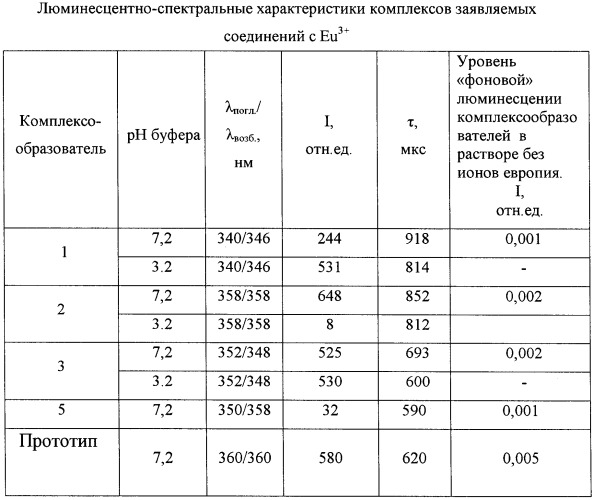
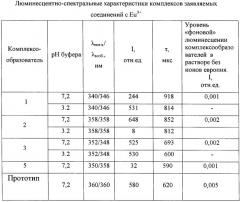
Люминесцентно-спектральные свойства комплексов заявляемых соединений с Eu3+
Регистрацию спектрально-люминесцентных характеристик комплексов осуществляли в диапазоне длин волн 230÷800 нм на флуориметре с временным разрешением люминесценции - модель Perkin-Elmer LS-5B, США. Соответствующие результаты приведены в таблице, где λпогл/λвозб - длина волны поглощения/возбуждения люминесценции комплекса при регистрации эмиссии на 615 нм, I - интенсивность люминесценции в максимуме возбуждения и регистрации в относительных единицах (время задержки регистрации эмиссии люминесценции td - 0,1 мс, время регистрации эмиссии люминесценции tg - 1 мс), τ - время жизни люминесценции.
Все характеристики получены в водных растворах, содержащих 5·10-5 моль/л ТОФО и 0,1% Тритона Х-100. Для нейтральной среды (0,05 моль/л Трис-буфер рН 7,2) приведены результаты, полученные от комплексов лиганд - Eu3+ стехиометрического состава 1:1 (концентрации лиганд: ион =10-8:5·10-6 моль/л), для кислой (среда УР рН 3,2) - состава 3:1 (концентрации лиганд: ион =1.5·10-5:10-8 моль/л).
Из данных, приведенных в таблице, следует, что заявляемые соединения образуют интенсивно и длительно люминесцирующие комплексы с Eu3+ в нейтральных средах. В кислой среде хорошие люминесцентные характеристики сохраняют соединения (1) и (3), что позволяет использовать их в качестве перекомплексообразователей в способе иммуноанализа на основе DELFIA.
Комплексообразующие бензосодержащие гетероциклические соединения, содержащие β-дикарбонильный заместитель с фторированными радикалами, общей формулыHetAr-С(O)СН2С(O)CF3,где HetAr= образующие люминесцирующие комплексы с ионами Eu3+.