Варианты домена gla фактора vii или viia
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению вариантов домена Gla фактора VII человека и фактора VIIa человека, и может быть использовано в медицине. Получают аминокислотную последовательность варианта FVII или FVIIa, которая отличается по 1-15 аминокислотным остаткам по отношению к аминокислотной последовательности фактора VII человека (hFVII) или фактору VIIa человека (hFVIIa), в которой отрицательно заряженный аминокислотный остаток введен путем замены в положение 36. Полученные варианты FVII или FVIIa используют в составе композиции для лечения млекопитающих, имеющих заболевание или нарушение, где желательным является образование сгустка крови. Изобретение позволяет получить варианты FVII или FVIIa с повышенной свертывающей активностью и/или повышенной активацией фактора X по сравнению с природной формой hFVIIa. 3 н. и 39 з.п. ф-лы, 3 ил., 5 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение касается новых полипептидных вариантов домена Gla фактора VII (FVII) или фактора VIIa (FVIIa), а также применения таких полипептидных вариантов в терапии, в частности, для лечения различных заболеваний, связанных с нарушением свертываемости крови.
Уровень техники
Свертывание крови представляет собой процесс, включающий сложное взаимодействие многочисленных компонентов (или факторов) крови, которое обычно приводит к образованию фибринового сгустка. Обычно факторы крови, которые участвуют в так называемом “каскаде свертывания”, представляют собой предшественники ферментов или зимогены, то есть энзиматически неактивные белки, которые превращаются в активную форму под действием определенного активатора. Одним из таких факторов свертывания крови является фактор FVII.
Фактор FVII является витамин К-зависимым белком плазмы крови, который синтезируется в печени и секретируется в кровь в виде одноцепочечного гликопротеина с молекулярной массой 53 кДа (Broze & Majerus, J. Biol Сhem. 1980; 255:1242-1247). Зимоген FVII превращается в активную форму (FVIIa) в результате протеолитического расщепления в единственном участке, R152-1153, что приводит к образованию двух полипептидных цепей, связанных между собой одним дисульфидным мостиком. Фактор FVIIa в комплексе с тканевым фактором (комплекс FVIIa) способен переводить два других фактора свертываемости крови, фактор IX (FIX) и фактор Х (FX), в их активные формы, что запускает реакции, приводящие к быстрому образованию тромбина и формированию фибринового сгустка (Osterud & Rapaport, Proc Natl Acad Sci USA 1977; 74:5260-5264).
Фактор FVII подвергается пост-трансляционным модификациям, включая витамин К-зависимое карбоксилирование, приводящее к образованию десяти остатков γ-карбоксиглутаминовой кислоты на N-концевом участке молекулы. Таким образом, остатки под номерами 6, 7, 14, 16, 19, 20, 25, 26, 29 и 35, показанные в SEQ ID NO:1, являются остатками γ-карбоксиглутаминовой кислоты в домене Gla, который важен для активности FVII. Другие пост-трансляционные модификации включают присоединение сахарного компонента к двум имеющимся природным участкам N-гликозилирования в положениях 145 и 322 соответственно и к двум природным участкам 0-гликозилирования в положениях 52 и 60 соответственно.
Установлено, что ген, кодирующий фактор FVII человека (hFVn), расположен в 13 хромосоме в локусе q34-qter 9 (de Grouchy et al., Hum Genet 1984; 66:230-233). Он содержит девять экзонов и занимает область размером 12,8 т.п.н. (O'Наrа et al., Proc Natl Acad Sci USA 1987; 84:5158-5162). Организация гена и структура молекулы белка FVII подобны другим витамин К-зависимым прокоагулянтным белкам, у которых экзоны 1а и 1b кодируют сигнальную последовательность; экзон 2 кодирует пропептид и домен Gla; экзон 3 кодирует короткий гидрофобный участок; экзоны 4 и 5 кодируют домен, подобный эпидермальному фактору роста; и экзоны от 6 до 8 кодируют каталитический домен сериновой протеазы (Yoshitake et al., Biochemistry 1985; 24:3736-3750).
В литературе имеются сообщения о трехмерной структуре hFVIIa (Pike et al., Natl Acad Sci USA 1999; 96:8925-8930 и Kemball-Cook et al., J. Syruct. Biol., 1999; 127:213-223) и о структуре комплекса hFVIIa с растворимым тканевым фактором, полученные методами рентгеновской кристаллографии (Banner et al., Nature, 1996; 380:41 и Zhang et al., J. Mol. Biol. 1999; 285:2089), а также о структуре небольших фрагментов hFVII (Мuranyi et al., Biochemistry, 1998; 37:10605 и Као et al., Biochemistry, 1999; 38:7097).
Имеется также несколько сообщений о вариантах FVII, полученных методами белковой инженерии (Dickmson & Ruf, J Biol Chem, 1997; 272:19875-19879; Kemball-Cook et al., J Biol Chem 1998; 273:8516-8521; Bharadwa; et al., J Biol Chem, 1996; 271:30685-30691; Rufet al., Biochemistruy, 1999; 38:1957-1966).
Имеются сообщения об экспрессии FVII в клетках ВНК или в других клетках млекопитающих (WO 92/15686, WO 91/11514 и WO 88/10295) и совместной экспрессии FVII и эндопротеазы kex2 в клетках эукариот (WO 00/28065).
Коммерческие препараты рекомбинантного FVIIa человека (rhFVIIa) продаются под торговой маркой NovoSeven®. NovoSeven® предназначен для лечения кровотечений у пациентов с гемофилией типа А и В. NovoSeven® является единственным препаратом rhFVIIa для эффективного и надежного лечения кровотечений, который доступен на рынке в настоящее время.
О неактивной форме FVII, в которой модифицированы аргинин 152 и/или изолейцин 153 (1153), сообщалось в WO 91/11514. Эти аминокислоты расположены в участке активации. В WO 96/12800 описана инактивация FVIIa ингибитором сериновых протеаз. Об инактивации FVIIa посредством карбамилирования ос-аминокислотной группы 1153 сообщалось в работе Petersen et al., Eur J Biochem, 1999; 261:124-129. Инактивированная форма способна конкурировать с факторами дикого типа FVII или FVIIa за связывание тканевого фактора и способна ингибировать свертывающую активность. Предполагается использовать инактивированную форму FVIIa для лечения пациентов, страдающих от заболеваний, связанных с повышенной свертываемостью крови, например, пациентов с сепсисом, риском инфаркта миокарда или страдающих образованием тромбов.
В связи с лечением неконтролируемых кровотечений, например, при травмах, предполагается, что FVIIa способен превращать FX в активный FXa без связывания тканевого фактора, и, как предполагается, эта реакция активации происходит, в первую очередь, на поверхности активированных тромбоцитов (Hedner et al. Blod Coagulfion & Fibrinolysis, 2000; 11:107-111). Однако hFVIIa или rhFVIIa в отсутствие тканевого фактора имеют низкую активность в отношении FX и, следовательно, предотвращение неконтролируемых кровотечений, например, у пациентов с травмами, требует неоднократного использования относительно высоких доз hFVIIa или rhFVIIa. Таким образом, для более эффективного лечения неконтролируемых кровотечений (для снижения потери крови) необходимо иметь усовершенствованные (improved) молекулы FVIIa, которые обладают высокой активностью по отношению к FX в отсутствие тканевого фактора. Такие усовершенствованные молекулы FVIIa должны демонстрировать пониженное время свертывания (более быстрое действие/повышенную свертывающую активность) по сравнению с rhFVIIa при применении в случаях неконтролируемых кровотечений.
Варианты домена Gla фактора FVII/FVIIa были раскрыты в WO 99/20767, US 6017882 и WO 00/66753, где некоторые остатки, расположенные в домене Gla, как было установлено, являются важными для связывания с фосфолипидными мембранами и, следовательно, для активации FX. В частности, было установлено, что остатки 10 и 32 являются критически важными и что повышенное сродство для связывания с фосфолипидными мембранами и, следовательно, повышенная активация FX может быть достигнута за счет мутаций P10Q [замена остатка пролина (Р) в положении 10 на остаток глутамина (Q)] и К32Е [замена остатка лизина (К) в положении 32 на остаток глутаминовой кислоты (Е)]. В частности, было установлено, что активация FX была усилена по сравнению с rhFVIIa при незначительных условиях для свертывания, таких как условия в присутствии низкого уровня тканевого фактора.
WO 01/58935 раскрывает новую стратегию получения молекул FVII или FVIIa, имеющих inter alia (ко всему прочему) увеличенное время полужизни за счет направленного гликозипирования или присоединения полиэтиленгликоля.
WO 03/093465 раскрывает варианты FVII или FVIIa, имеющие определенные модификации в домене Gla и имеющие один или более участков N-гликозилирования, введенные за пределами домена Gla.
WO 2004/029091 раскрывает варианты FVII или FVIIa, имеющие определенные модификации в участке связывания тканевого фактора.
В настоящем изобретении идентифицированы новые остатки в домене Gla, которые обеспечивают дальнейшее увеличение сродства при связывании фосфолипидных мембран и, следовательно, дальнейшее увеличение активации FX. Варианты FVII или FVIIa данного изобретения могут также демонстрировать пониженное сродство при связывании тканевого фактора.
Предметом настоящего изобретения является получение усовершенствованных молекул FVII или FVIIa (вариантов FVII или FVIIa), которые способны более эффективно активировать превращение FX в FXa, чем hFVIIa, rhFVIIa или [P10Q+K32E]rhFVIIa. В частности, предметом настоящего изобретения является получение усовершенствованных молекул FVII или FVIIa (вариантов FVII или FVIIa), которые способны более эффективно активировать превращение FX в FXa, чем hFVIIa, rhFVIIa или [P10Q+K32E]rhFVIIa в отсутствие тканевого фактора. Данные цели были поставлены при создании вариантов FVII или FVIIa, описываемых в данном изобретении.
Раскрытие изобретения
В своем первом аспекте настоящее изобретение касается полипептидного варианта фактора VII (FVII) или фактора Vila (FVIIa), имеющего аминокислотную последовательность, включающую 1-15 модификаций аминокислот по отношению к фактору VII человека (bFVII) или фактору Vila человека (hFVIIa) с аминокислотной последовательностью, показанной в SEQ ID NO:1, где в положение 34 посредством замены введен гидрофобный аминокислотный остаток.
В своем втором аспекте настоящее изобретение касается полипептидного варианта фактора VII (FVII) или фактора Vila (FVIIa), имеющего аминокислотную последовательность, включающую 1-15 модификаций аминокислот по отношению к фактору VII человека (hFVII) или фактору VIIa человека (hFVIIa) с аминокислотной последовательностью, показанной в SEQ ID NO:1, где аминокислотная последовательность включает замену аминокислоты в положении 36.
В своем третьем аспекте настоящее изобретение касается полипептидного варианта фактора VII (FVII) или фактора VIIa (FVIIa), имеющего аминокислотную последовательность, включающую 3-15 модификаций аминокислот по отношению к фактору VII человека (hFVII) или фактору VIIa человека (bFVIIa) с аминокислотной последовательностью, показанной в SEQ ID NO:1, где аминокислотная последовательность включает замены аминокислот в положениях 10 и 32 и, по меньшей мере, еще одну замену аминокислоты в положении, которое выбирают из группы, состоящей из положений 74, 77 и 116.
Следующие аспекты настоящего изобретения касаются нуклеотидной последовательности, кодирующей полипептидные варианты настоящего изобретения, экспрессионного вектора, включающего эту последовательность, и клетки-хозяина, включающей нуклеотидную последовательность или экспрессионный вектор.
Следующие аспекты настоящего изобретения касаются также фармацевтической композиции, включающей полипептидные варианты настоящего изобретения, использования полипептидных вариантов настоящего изобретения или фармацевтической композиции настоящего изобретения в качестве медикамента, а также способов лечения с использованием полипептидных вариантов или фармацевтических композиций настоящего изобретения.
Следующие аспекты настоящего изобретения станут понятными из приведенного ниже описания, а также из приведенной формулы изобретения.
Краткое описание фигур
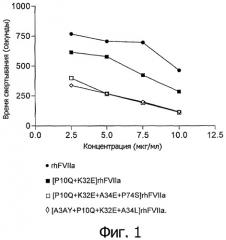
На Фигуре 1 показана зависимость времени свертывания крови от концентрации для вариантов настоящего изобретения в условиях, описанных в “Анализе цельной крови”.
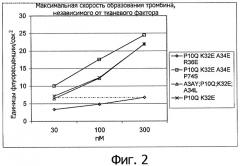
На Фигуре 2 показана максимальная скорость фактор-зависимого образования тромбина для вариантов настоящего изобретения в условиях, описанных в “Определении тромбограммы”.
На Фигуре 3 показана максимальная скорость фосфолипид-зависимого образования тромбина для вариантов настоящего изобретения в условиях, описанных в “Определении тромбограммы”.
Осуществление изобретения
Определения
В контексте настоящего описания и формулы изобретения применяются следующие определения.
Термин “FVII” или “полипептид FVII” обозначает молекулу FVII (facfor VII), представленную в форме одной полипептидной цепи. Примером полипептида FVII является FVII дикого типа человека. (hFVII), имеющий аминокислотную последовательность, показанную в SEQ ID NO:1. Необходимо, однако, понимать, что термин “полипептид FVII” также включает hFVII-подобные молекулы, такие как фрагменты или варианты в SEQ ID NO:1, в частности, варианты, в которых последовательность включает, по меньшей мере, одну или до 15, предпочтительно до 10 модификаций аминокислот по сравнению с SEQ ID NO:1.
Термин “FVIIa” или “полипептид FVIIa” обозначает молекулу FVII в ее активированном (FVII activate) двухцепочечном состоянии. В тех случаях, когда для описания аминокислотной последовательности FVIIa используется аминокислотная последовательность, представленная в SEQ ID NO:1, необходимо понимать, что пептидная связь между R152 и I153 одноцепочечной формы была расщеплена, и одна образовавшаяся цепь включает аминокислотные остатки 1-152, а другая цепь включает остатки 153-406.
Термины “rFVII” и “rFVIIa” обозначают полипептиды FVII и FVIIa, полученные с использованием техники получения рекомбинантных белков (recombinant FVII/FVIIa).
Термины “hFVII” и “hFVIIa” обозначают FVII и FVIIa дикого типа человека (Аммдм FVII/FVIIa), соответственно, с аминокислотной последовательностью, показанной в SEQ ID NO:1.
Термины “rhFVII” и “rhFVIIa” обозначают FVII и FVIIa дикого типа человека, имеющие аминокислотную последовательность, показанную в SEQ ID NO:1, полученные с помощью рекомбинантной техники. Примером rhFVIIa является NovoSeven®.
Термин “домен Gla” используется для обозначения аминокислотных остатков, занимающих область от 1 до 45 в SEQ ID NO:1.
Соответственно, термин “положение, находящееся за пределами домена Gla”, охватывает аминокислотные остатки в положениях 46-406 в SEQ ID NO:1.
Аббревиатуры “FX”, “TF” и “TFP%” обозначают фактор X, тканевой фактор (tissue factor) и ингибитор пути с участием тканевого фактора (tissue factor parhway inhibitor) соответственно.
Термин “протеазный домен” обозначает аминокислотные остатки в области 153-406, считая от N-конца.
Термин “каталитический центр” (catalytic site, каталитический участок) используется для обозначения обеспечивающей каталитическую активность триады аминокислот, состоящей из S344, D242 и HI 93 полипептидного варианта.
Термин “исходная(ый)” (рarent) используется для обозначения молекулы, которая будет модифицирована/усовершенствована согласно настоящему изобретению. Хотя исходный полипептид, который будет подвергнут модификации согласно настоящему изобретению, может быть любым полипептидом FVII или FVIIa и, следовательно, может иметь любое происхождение, например, может быть полипептидом не человека, а других млекопитающих, предпочтительно, чтобы исходный полипептид являлся hFVII или hFVIIa.
“Вариантом” является полипептид, который отличается одним или более аминокислотным остатком от исходного полипептида, обычно 1-15 аминокислотными остатками (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислотными остатками), в случае отличия 1-10 аминокислотными остатками, например, 1-8, 1-6, 1-5 или 1-3 аминокислотными остатками. Как правило, исходный полипептид является hFVII или hFVIIа.
Термин “конъюгат” (или взаимозаменяемо “конъюгированный полипептид”) применяется для обозначения гетерогенной (в смысле составной или химерной) молекулы, образованной при ковалентном присоединении одного или более полипептидов к одному или более не-полипептидным компонентам, таких как молекулы полимеров, липофильные соединения, остатки сахаров иди агенты органического происхождения. Предпочтительно, чтобы конъюгат был растворимым при используемых концентрациях и условиях, то есть был растворимым в физиологических жидкостях, таких как кровь. Примеры конъюгированных полйпептидов настоящего изобретения включают гликозилированные и/или связанные с полиэтиленгликолем (ПЭГ) полипептиды.
Термин “ковалентное присоединение” или “ковалентно присоединенный” обозначает, что полипептидный вариант и не-полипептидный компонент либо ковалентно связаны непосредственно друг с другом, либо ковалентно связаны друг с другом не напрямую, а, по меньшей мере, через один промежуточный компонент, такой как мостик, вставка или бифункциональный связывающий агент.
Термин “не-полипептидный компонент” используется для обозначения молекулы, отличной от пептидного полимера, построенного из аминокислотных мономеров, связанных друг с другом пептидными связями, молекула которого может быть связана с группой полипептидного варианта настоящего изобретения, способной к такому присоединению. Предпочтительные примеры таких молекул включают полимерные молекулы, остатки сахаров, липофильные компоненты или агенты органического происхождения. При использовании термина “конъюгированные варианты” в контексте настоящего изобретения необходимо понимать, что не-полипептидный компонент связан с полипептидной частью конъюгированного варианта через способную к присоединению группу полипептида. Как отмечалось выше, не-полипептидный компонент может быть ковалентно связан с группой для присоединения либо напрямую, либо через промежуточный компонент.
“Полимерная молекула” является молекулой, образованной за счет ковалентного соединения двух или более мономеров, из которых ни один мономер не является аминокислотным остатком, за исключением случаев, когда полимером является сывороточный альбумин человека или другой белок плазмы крови, присутствующий в ней в значительном количестве. Термин “полимер” может использоваться взаимозаменяемо с термином “полимерная молекула”. Данный термин также используется для обозначения молекул углеводов, присоединяемых in vitro в процессе гликозилирования, то есть при искусственном гликозилировании, обычно проводимом in vitro и заключающемся в ковалентном присоединении молекулы углевода к способной к присоединению группе полипептидного варианта, иногда с использованием бифункционального сшивающего агента.
Термин “сахарный компонент” используется для обозначения углевод-содержащей молекулы, включающей один или более моносахаридных остатков, которые могут быть присоединены к полипептидному варианту (для получения конъюгата полипептидного варианта в виде гликозилированного полипептидного варианта) посредством гликозилирования in vivo. Термин “гликозилирование in vivo” используется для обозначения присоединения любого сахарного компонента, происходящего in vivo, то есть в процессе посттрансляционного процессинга в обеспечивающих гликозилирование клетках, используемых для экспрессии полипептидного варианта, например, путем N-гликозилирования или O-гликозилирования. Точная структура присоединяемого олигосахарида в значительной степени зависит от организма, используемого для экспрессии и последующего гликозилирования.
“Участок N-гликозилирования” имеет последовательность N-X-S/T/C, где Х представляет собой любой аминокислотный остаток, кроме пролина, N является аспарагином, a S/T/C являются серином, треонином или цистеином, предпочтительно серином или треонином и наиболее предпочтительно треонином. Предпочтительно, чтобы аминокислотный остаток в положении +3 по отношению к аспарагину не являлся пролином.
“Участок O-гликозилирования” является ОН-группой серинового или треонинового остатка.
Термин “группа для присоединения” используется для обозначения функциональной группы полипептидного варианта, в частности группы аминокислотного остатка или углеводного компонента этого варианта, способной к присоединению не-полипептидного компонента, такого как молекула полимера, липофильная молекула, сахарный компонент или органический агент для получения производных. Подходящие группы для присоединения и соответствующие им не-полипептидные компоненты представлены в приведенной ниже таблице.
| Группа дли присоединения | Аминокислота | Примеры неполипептидного компонента | Метод конъюгации/ Активированный ПЭГ | Ссылка |
| -NH2 | N - концевая, Lys | Полимер, например ПЭГ, с амидной или иминной группой | мПЭГ-SPA Трезилированный мПЭГ | Nektar Therapeutics Delgado et al, Critical reviews in Therapeutic Drug Carrier Systems 9(3, 4):249-304 (1992) |
| -СООН | С - концевая, Asp, Glu | Полимер, например ПЭГ, с эфирной или амидной группой. Углеводный компонент | мПЭГ-Гц Связывание in vivo | Nektar Therapeutics |
| -SH | Cys | Полимер, например ПЭГ, с дисульфидной, малеимидной или винилсульфоновой группойУглеводный компонент | ПЭГ-винилсульфон ПЭГ-малеимид Связывание in vivo | Nektar Therapeutics Delgado et al, Critical reviews in Therapeutic Drug Carrier Systems 9(3, 4):249-304 (1992) |
| -ОН | Ser, Thr, Lys, OH- | Сахарный компонент. ПЭГ со сложным эфиром, эфиром, карбаматом, карбонатом | O-гликозидирование in vivo | |
| -CONH2 | Asn как часть участка N-гликозилирования | Сахарный компонентПолимер, например, ПЭГ | N-гликозилирование in vivo | * |
| Ароматический остаток | Phe, Тyr, Tip | Углеводный компонент | Связывание in vitro | |
| -CONH2 | Gin | Углеводный компонент | Связывание in vitro | Yan and Wold, Biochemistry, 1984, Jul 31; 23(16):3759-3765 |
| Альдегид Кетон | Окисленный олигосахарид | Полимер, например, ПЭГ Гидразид ПЭГ | Присоединение ПЭГ | Andresz et al., 1978, Macromol. Сhem. 179:301, WO 92/16555, WO 00/23114 |
| Гуанидин | Arg | Углеводный компонент | Связывание in vitro | Lundblad and Noyes, Chemical Reagents forProtein Modification, CRC Press Inc., Florida, USA |
| Имидазольное кольцо | His | Углеводный компонент | Связывание in vitro | Как для гуанидина |
При N-гликозилировании in vivo термин “группа для присоединения” используется в нетрадиционном значении для обозначения аминокислотных остатков, входящих в состав участка N-гликозилирования (с последовательностью N-X-S/T/C, как говорилось выше). Хотя остаток аспарагина в участке N-гликозилирования является тем остатком, к которому в процессе гликозилирования присоединяется сахарный компонент, это присоединение не может происходить, если отсутствуют другие аминокислотные остатки, входящие в состав участка N-гликозилирования.
Таким образом, когда не-полипептидный компонент является сахарным компонентом и его конъюгация происходит при гликозилировании in vivo, термин “аминокислотные остатки, составляющие группу для присоединения не-полипептидного компонента”, используемый в связи с изменениями в аминокислотной последовательности, необходимо понимать, что один или несколько аминокислотных остатков, составляющих участок N-гликозилирования in vivo, были изменены таким образом, чтобы ввести в аминокислотную последовательность функциональный участок N-гликозилирования in vivo.
В настоящей заявке названия аминокислот и обозначения атомов (например, СА, СВ, CD, CG, SG, NZ, N, О, С и т.д.) используются в соответствии с принятыми в Protein DataBank (PDB) (www.pdb.org) на основе номенклатуры IUPAC (IUPAC Nomenclature and Symbolism for Ammo Acids and Peptides (residue names, atom names, etc.), Еyr. J. Biochem., 138:9-37 (1984), с учетом изменений, внесенных в Еyr. J. Biochem., 152, 1 (1985).
Термин “аминокислотный остаток” используется для обозначения любого природного или синтетического аминокислотного остатка, в первую очередь для обозначения аминокислотных остатков, входящих в группу из 20 аминокислот, обычно встречающихся в природных белках, то есть остаток выбирают из группы, состоящей из остатков аланина (А1а или А), пистеина (Cys или С), аспарагиновой кислоты (Asp или D), глутаминовой кислоты (Glu или Е), фенилаланина (Phe или F), глицина (Gly или G), гистидина (His или Н), изолейцина (Ilе или I), лизина (Lys или К), лейцина (Leu или L), метионина (Met или М), аспарагина (Asn или N), пролина (Pro или Р), глутамина (Gin или Q), аргинина (Arg или R), серина (Ser или S), треонина (Тhr или Т), валина (Val или V), триптофана (Тrр или W) и тирозина (Туг или Y).
Терминология, используемая для обозначения положения аминокислоты, заключается в следующем: G124 означает, что в положении 124 аминокислотной последовательности, показанной в SEQ ID NO:1, расположен остаток глицина. G124R означает, что остаток глицина в положении 124 был заменен на остаток аргинина. Альтернативные замены обозначаются с помощью значка “/”, например, N145S/T означает аминокислотную последовательность, в которой остаток аспарагина в положении 145 заменен либо на серин, либо на треонин. Множественные замены обозначаются значком “+”, например, K143N+N145S/T означает аминокислотную последовательность, которая включает замену остатка лизина в положении 143 на остаток аспарагина и замену остатка аспарагина в положении 145 на остаток серина или треонина. Вставка дополнительного остатка аминокислоты, например, вставка остатка аланина после G124 обозначается как G124GA. Вставка двух дополнительных остатков аланина обозначается как G124GAA и так далее. Использование выражений “вставка в положение X” или “вставленный в положение X” означает, что аминокислотный остаток (остатки) вставлен (вставлены) между аминокислотными остатками Х и Х+1. Деления аминокислотного остатка обозначается звездочкой. Например, деления остатка глицина в положении 124 обозначается как G124*.
Если не указано иначе, нумерация аминокислотных остатков, приводимая в настоящем изобретении, соответствует нумерации аминокислотной последовательности полипептида hFVII/hFVIIa (SEQ ID NO:1).
Термин “отличается от…”, используемый в связи со специфическими мутациями, предназначен для обозначения дополнительных отличий помимо специфических различий в аминокислотной последовательности. Например, помимо модификаций, внесенных в Gla домен для увеличения активации FX, полипептид может иметь другие модификации, которые не обязательно имеют отношение к этому эффекту.
Таким образом, кроме модификаций аминокислот, раскрываемых в настоящем изобретении, необходимо понимать, что аминокислотная последовательность полипептидного варианта настоящего изобретения, если это необходимо, может содержать и другие изменения, то есть другие замены, вставки или делепии. Например, такие изменения могут включать укорачивание N- и/или С-конца на один или более аминокислотный остаток (например, на 1-10 аминокислотных остатков) или присоединение одного или более добавочных аминокислотных остатков к N- и/или С-концу, например, добавление остатка метионина к N-концу или введение остатка пистеина вблизи С-конца, а также “консервативные аминокислотные замены”, то есть замены, проводимые внутри групп аминокислот с близкими характеристиками, например, внутри групп аминокислот с маленьким радикалом, кислых аминокислот, полярных аминокислот, основных аминокислот, гидрофобных аминокислот и ароматических аминокислот.
Примеры таких консервативных замен показаны в приведенной ниже таблице.
| 1 | Аланин(А) | Глицин (G) | Серии (S) | Треонин (Т) |
| 2 | Аспарагиновая кислота (D) | Глутаминовая кислота (Е) | ||
| 3 | Аспарагин (N) | Глутамин (Q) | ||
| 4 | Аргинин (R) | Гистидин (Н) | Лизин (К) | |
| 5 | Изолейцин (I) | Лейцин (L) | Метионин (М) | Валин (V) |
| 6 | Фенилаланин (F) | Тирозин (Y) | Триптофан (W) |
Другие примеры дополнительных модификаций раскрываются в разделах “Модификации за пределами домена Gla” и “Другие модификации за пределами домена Gla”.
Термин “нуклеотидная последовательность” используется для обозначения непрерывного участка, состоящего из двух или более молекул нуклеотидов. Нуклеотидная последовательность по происхождению может быть геномной, кДНК, РНК, полусинтетической, синтетической или любой их комбинацией.
Термин “вектор” обозначает плазмиду или другие нуклеотидные последовательности, способные к репликации внутри клетки-хозяина или способные интегрироваться в геном клетки-хозяина и которые, таким образом, подходят для выполнения различных функций в соответствующей клетке-хозяине (система вектор-хозяин) для облегчения клонирования нуклеотидной последовательности, то есть для получения необходимых количеств последовательности, обеспечивающих экспрессию продукта гена, кодируемого данной последовательностью, и для интегрирования нуклеотидной последовательности в геном клетки-хозяина. Вектор может содержать различные компоненты в зависимости от тех функций, которые необходимо обеспечить.
“Клетка”, “клетка-хозяин”, “линия клеток” и “культура клеток” используются в настоящем изобретении взаимозаменяемо, и, как следует понимать, данные термины включают потомство, получаемое при выращивании или культивировании клеток.
Термины “трансформация” и “трансфекция” используются взаимозаменяемо для обозначения процесса введения ДНК в клетку.
Термин “функционально связанный” обозначает ковалентное соединение двух или более нуклеотидных последовательностей с помощью ферментативного лигирования или другим способом для получения такой конфигурации последовательностей относительно друг друга, которая обеспечивает нормальное функционирование всех последовательностей. Обычно “функционально связанный” означает, что нуклеотидные последовательности связаны непрерывно и, в случае наличия обеспечивающего секрецию лидера, располагаются рядом в пределах одной рамки считывания. Связывание обеспечивается с помощью лигирования по подходящим сайтам рестрикции. Если такие сайты отсутствуют, используются синтетические олигонуклеотидные адаптеры или линкеры с применением стандартных методов работы с рекомбинантными ДНК.
В контексте настоящего изобретения термин “модификация” или “модификация аминокислоты” используется для обозначения замены боковой цепи аминокислоты, замены аминокислотного остатка, делении аминокислотного остатка или вставки аминокислотного остатка.
Термин “ввести” обозначает введение аминокислотного остатка, в частности посредством замены существующего аминокислотного остатка, или, как альтернатива, посредством вставки дополнительного аминокислотного остатка.
Термин “удалить” обозначает удаление аминокислотного остатка, в частности посредством замены аминокислотного остатка, который необходимо удалить, другим аминокислотным остатком, или, как альтернатива, посредством делении (без замены) аминокислотного остатка, который необходимо удалить.
В контексте настоящего изобретения термин “активность” должен пониматься как соответствующая активность, измеренная в условиях, в которых эта активность действительно измеряется.
В соответствии с этим термин “амидолитическая активность” (aminodolytic activity) используется для обозначения активности, измеряемой в приведенном здесь “Измерении амидолитической активности”. Для проявления “амидолитической активности” вариант настоящего изобретения в своей активированной форме должен иметь, по меньшей мере, 10% от амидолитической активности rhFVIIa при измерении в условиях, описанных в приведенном здесь “Измерении амидолитической активности”. В предпочтительных воплощениях настоящего изобретения вариант, в своей активированной форме, имеет, по меньшей мере, 20% от амидолитической активности rhFVIIa, например, по меньшей мере 30% или, по меньшей мере, 40%, более предпочтительно, по меньшей мере, 50%, например 60%, или, по меньшей мере, 70%, даже более предпочтительно, по меньшей мере, 80%, например, по меньшей мере, 90% от амидолитической активности rhFVIIa при измерении в условиях, описанных в приведенном здесь “Измерении амидолитической активности”. В наиболее интересных воплощениях вариант, в своей активированной форме, имеет практически одинаковую с rhFVIIa амидолитическую активность, например, амидолитическую активность на уровне 75-125% от амидолитической активности rhFVIIa.
Термин “свертывающая активность” обозначает активность, измеряемую в описанном здесь “Анализе цельной крови”, то есть означает время, необходимое для образования сгустка. Таким образом, меньшее время свертывания соответствует более высокой свертывающей активности.
Термин “повышенная свертывающая активность” используется в том случае, когда время свертывания для полипептидного варианта статистически достоверно ниже по сравнению с таковым, полученным при использовании rhFVIIa или [P10Q+K32E]rhFVIIa, при его измерении в сравнимых условиях в соответствии с описанным здесь “Анализом цельной крови”
В контексте настоящего изобретения термин “активность” также используется в отношении способности вариантов активировать превращение FX в FXa. Эта активность также обозначается как “способность активировать FX” или “FXa-образующая активность” и может быть измерена, как описано ниже в “Анализе TF-независимой активации фактора Х”.
Термин “повышенная способность активировать FX” или “повышенная FXa-образующая активность” используется для обозначения того, что вариант настоящего изобретения, в своей активированной форме, имеет статистически достоверно увеличенную способность превращать FX в FXa по сравнению с молекулой сравнения, такой как rhFVIIa или [P10Q+K32E]rhFVIIa. To, до какой степени вариант настоящего изобретения (в своей активированной форме) может увеличивать скорость перехода FX в активное состояние, можно легко измерить, как описано ниже в “Анализе TF-независимой активации фактора Х”.
Термин “иммуногенность” используется в отношении используемого вещества для обозначения способности этого вещества индуцировать ответ иммунной системы. Иммунный ответ может быть клеточным или ответом, опосредуемым антителами (смотри, например, Roitt: Essential Immunology (10th Edition, Blackwell) для более детального определения иммуногенности). Иммуногенность может быть определена с использованием любого подходящего метода, известного специалистам в данной области, например, in vivo или in vitro.
Термин “время функционального полураспада in vivo” используется в своем стандартном смысле, то есть обозначает время, в течение которого 50% биологической активности полипептида все еще присутствует в теле/органе-мишени, или время, в течение которого активность полипептида составляет 50% от ее исходного значения.
В качестве альтернативы измерению времени функционального полураспада in vivo можно измерять “время полураспада в сыворотке”, то есть время, в течение которого 50% полипептида циркулирует в плазме или кровотоке. Определение времени полураспада в сыворотке часто является более простым, чем определение времени функционального полураспада in vivo, и значение времени полураспада в сыворотке обычно является хорошим показателем времени функционального полураспада in vivo. Альтернативными термину “время полураспада в сыворотке” являются термины “время полураспада в плазме”, “время полувыведения при циркуляции”, “клиренс сыворотки”, “клиренс плазмы” или “время полувыведения”. Удаление полипептида из циркуляции обеспечивается в результате работы одной или более ретикулоэндотелиальных систем (RES), почек, селезенки или печени, за счет удаления тканевого фактора, опосредованного SEC рецептором или другими рецепторами, или за счет специфического или неспецифического протеолиза. Обычно клиренс зависит от размера (относительно порога проницаемости при клубочковой фильтрации, glomerular filtration), заряда, наличия присоединенных углеводных цепей, а также наличия клеточных рецепторов для данного белка. Функциональные качества, которые необходимо сохранить, обычно выбирают из прокоагулянтной активности, протеолитической или рецептор-связывающей активности. Время функционального полураспада in vivo и время полураспада в сыворотке можно определить с помощью любого подходящего метода, известного специалистам в данной области.
Термин “увеличенное” в отношении времени функционального полураспада in vivo или времени полураспада в сыворотке используется для обозначения того, что время полураспада варианта полипептида статистически достоверно выше такового для молекулы сравнения, такой как rhFVIIa или [P10Q+K32E]rhFVIIa, при определении в сравнимых условиях (обычно определяется на экспериментальных животных, таких как крысы, кролики, свиньи или обезьяны).
Термин “AUCiv” или “площадь под кривой при внутривенном введении” (Area Under the Curve when administered intravenously) используется в своем стандартном значении, то есть для обозначения площади под кривой временной зависимости активности в сыворотке крови, когда полипептидный вариант вводится внутривенно, в частности, при внутривенном введении крысам. Обычно измеряемая активность является “свертывающей активностью” в соответствии с данным выше определением. После измерения активности в эксперименте в определенных временных точках параметр AUCiv можно легко рассчитать с помощью компьютерной программы, такой как GraphPad Prism 3.01.
Необходимо понимать, что для прямого сравнения значений AUCiv различных молекул (например, для вариантов настоящего изобретения и молекул сравнения, таких как rhFVIIa или [P10Q+K32E]rhFVIIa) необходимо вводить их в одинаковых по активности количествах. Следовательно, значения AUCiv обычно являются нормализованными (то есть скорректированными с учетом различий во вводимых дозах) выражаются как отношение AUCiv/применяемая доза.
Термин “пониженн