Способ для определения фрагментации днк в сперматозоидах животных
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано для определения целостности хроматина/ДНК в сперматозоидах животных. Проводят стадию обработки образца, содержащего сперматозоиды, денатурирующим ДНК раствором. Для экстракции ядерных белков проводят обработку лизирующим раствором, свободным от денатурирующих белки детергентов, в одну стадию. Затем визуально определяют целостность хроматина/ДНК сперматозоидов путем окрашивания на основании измерения размера гало сперматозоидов. Изобретение позволяет упростить и одновременно повысить точность определения целостности хроматина/ДНК в сперматозоидах животных. 2 н. и 12 з.п. ф-лы, 5 ил., 10 табл.
Реферат
Область техники, к которой относится изобретение
Область применения настоящего изобретения находится в сфере здравоохранения, главным образом, изобретение имеет отношение к биологической репродукции, в частности оно касается способов и методов определения качества спермы животных.
Уровень техники
В настоящее время 6% мужчин репродуктивного возраста в западных странах имеют определенные заболевания, которые нарушают нормальное размножение. В связи с этим Всемирная Организация Здравоохранения (ВОЗ) объединила в единый протокол несколько серий лабораторных методик, направленных на стандартизацию анализа качества спермы в разных странах. Эти исследования сфокусированы на измерении концентрации, морфологии и подвижности сперматозоидов, дополняемом проведением определенных функциональных тестов, а также на определении биохимических и ферментативных параметров спермы (ВОЗ, 1999). Этот набор тестов позволяет определить общий объем спермы и концентрацию сперматозоидов на миллилитр и позволяет установить, является ли бесплодие мужчины результатом отсутствия (азооспермия) или значительного снижения (олигоспермия) количества сперматозоидов в эякуляте. Кроме того, данный набор тестов позволяет определить возможные проблемы, связанные с подвижностью сперматозоидов (астенозооспермия), что делает невозможным для этих клеток продвижение через полость матки и успешное достижение внешней трети фаллопиевых труб. Тесты также позволяют проанализировать, имеются ли серьезные морфологические изменения частей сперматозоидов (головки, шейки, хвостика) (тератозооспермия), и могут ли эти изменения приводить к нарушению их способности эффективно оплодотворять яйцеклетку. Кроме того, тесты позволяют также оценить участие желез, таких как простата или семенные пузырьки, в развитии бесплодия (инфекции, неправильное развитие). Наконец, с помощью функциональных тестов, таких как тест HOS (ионная проницаемость клеточной мембраны) или определение способности сперматозоидов к движению in vitro, можно получить информацию о способности спермы к оплодотворению. В конечном счете, эти лабораторные исследования могут иногда дополняться исследованием гормональных профилей, биопсией семенников и/или определением кариотипа (исследование хромосом, которое позволяет определить характер наследования мужского или женского пола индивидуума) и/или молекулярно-генетическими тестами.
Несмотря на клинические и лабораторные исследования, причина бесплодия не может быть установлена примерно у 30-50% бесплодных мужчин, что получило название идиопатическое бесплодие. Недавно было установлено, что высокий процент таких случаев бесплодия может объясняться повреждением ДНК сперматозоидов (Evenson et al., 1999; Larson et al., 2000), после чего изучение фрагментации ДНК сперматозоидов стало предметом активных исследований и постоянных публикаций в специализированных журналах (Evenson et al., 2002). Аномалии хроматина или даже повреждения ядерной ДНК сперматозоидов могут иметь место или даже быть результатом нарушений в процессе укладки ДНК, происходящем в ходе сперматогенеза (Sailer et al., 1995). Также существует возможность, что эти повреждения могут быть результатом нарушений, вызываемых свободными радикалами, которые вызывают окислительный стресс (Aitken et al., 1998), следствием чего может стать процесс апоптоза (Gorczyca et al., 1993).
Существуют различные методы для определения целостности хроматина/ДНК в сперматозоидах человека. Среди этих методов можно выделить анализ разрывов ДНК in situ путем введения в них меченых нуклеотидов с использованием ферментов, таких как терминальная трансфераза (TUNEL) или ДНК-полимераза (ISNT, in situ ник-трансляция) (Gorczyca et al., 1993). Эти методы основаны на использовании ферментов и сперматозоидов, зафиксированных на предметном стекле. Из-за этого эффективность данных методов не очень высока, только меченые участки разрывов являются доступными для ферментов, что приводит к относительно низкой воспроизводимости результатов. Используемые реагенты также достаточно дороги, в результате чего данный подход используется только в исследовательских работах, и его применение в клинических исследованиях сперматозоидов практически невозможно. Другим техническим подходом является «кометный» анализ («comet assay)), Hughes et al., 1996). Сперматозоиды вводятся в агарозный микрогель на предметном стекле и подвергаются обработке лизирующими растворами для экстракции мембран и белков. В результате этого получают нуклеоид, который представляет собой депротеинизированное ядро, в котором петли ДНК расплетены в результате натяжения. Полученные нуклеоиды подвергаются электрофорезу в специальной камере, наполненной буфером, при котором нити ДНК мигрируют к аноду; получаемая картина напоминает комету с головой и хвостом, направленным в сторону движения ДНК при электрофорезе. Такие кометы окрашиваются флуоресцентным красителем для последующего анализа с помощью флуоресцентного микроскопа. Если в ядре имеет место фрагментация ДНК, большое количество ДНК при электрофорезе будет мигрировать и располагаться в зоне хвоста кометы. Данный метод является высокочувствительным, но также достаточно дорогим и сложным для использования в обычной клинической лаборатории. Действительно, данный метод требует нестандартного оборудования: источника постоянного тока и специальной камеры для электрофореза, флуоресцентного микроскопа, системы для регистрации изображения и его анализа. По всем этим причинам данный метод неприменим для клинических исследований спермы и используется только в исследовательских целях.
В настоящее время стандартным методом для исследования фрагментации ДНК в сперматозоидах является определение структуры хроматина по Эвенсону (SCSA: Sperm Chromatin Structure Assay; Evenson et al., 1980; 2000; Evenson and Jost, 1994). По данному методу к суспензии сперматозоидов добавляется кислый денатурирующий раствор. Сперматозоиды, не имеющие разрывов в своей ДНК, являются устойчивыми к такой кислотной денатурации, при этом сохраняется двухцепочечная структура ДНК. Однако в сперматозоидах с фрагментированной ДНК в участках разрывов ДНК денатурирует сама по себе и становится одноцепочечной. Затем проводят окрашивание акридиновым оранжевым. Этот краситель, когда он связан с двухцепочечной ДНК, испускает зеленую флуоресценцию. Однако в сперматозоидах с денатурированной ДНК, где она одноцепочечная, флуорохром испускает красную флуоресценцию. Сперматозоиды с денатурированной ДНК количественно подсчитываются с использованием проточной цитометрии, которая позволяет разделять оба типа флуоресценции. Метод SCSA, имеющий широкие возможности для клинического применения, был апробирован на большом числе пациентов. С его использованием было установлено, что когда индивидуум имеет 30% или более сперматозоидов с фрагментированной ДНК, вероятность забеременеть снижается до менее чем 1%, и это относится как к естественному, так и к искусственному оплодотворению (Evenson et al., 1999; Larson et al., 2000).
Процент сперматозоидов с фрагментированной ДНК может быть более или менее постоянным в различных циклах сперматогенеза данного индивидуума, но может также и варьировать в зависимости от внешних факторов или, например, после сильных лихорадочных заболеваний, таких как грипп (Evenson et al., 2000). В таком случае может проводиться серия исследований для выбора образцов с наименьшим уровнем фрагментации ДНК для их последующего использования для искусственного оплодотворения. Необходимо иметь в виду, что замораживание образцов спермы в жидком азоте не изменяет уровня фрагментации ДНК, поэтому исследования можно проводить с использованием замороженных образцов, которые впоследствии можно использовать для искусственного оплодотворения, оплодотворения in vitro (IVF, in vitro fertilization) или для введения сперматозоидов внутрь цитоплазмы (ICSI, Intracytoplasmatic Sperm Injection). Это создает значительные преимущества для пациента и для лаборатории.
Метод SCSA, хотя и является надежным и высоко воспроизводимым, является дорогим методом, трудным для выполнения и не очень подходящим для рутинных лабораторных исследований (De Jonge, 2002). По этой причине качество ДНК сперматозоидов до сих пор широко не определяется, несмотря на то, что подтверждено его клиническое значение при изучении бесплодия.
Недавно наша исследовательская группа предварительно описала метод, который позволяет диспергировать хроматин сперматозоидов человека in situ, продемонстрировав, что сперматозоиды, в которых не происходит диспергирования хроматина, содержат фрагментированную ДНК (Fernandez, J.L. et al., Journal of Andrology, 2003, vol.24, No.1, pp.59-66; "The Sperm Chromatin Dispersion Test: a simple method for the determination of sperm DNA fragmentation"). При использовании данного метода образцы спермы в агарозном микрогеле последовательно обрабатываются кислым денатурирующим раствором, двумя лизирующими растворами и промываются, после чего они могут быть высушены и позднее окрашены. Этот метод, который был назван Дисперсия Хроматина Сперматозоидов (SCD, Sperm Chromatin Dispersion), использует чрезвычайно агрессивные реагенты и условия. Описанный метод не дает согласующихся результатов, что затрудняет проведение повторных оценок. С другой стороны, качество и контраст получаемых изображений, и воспроизводимость результатов недостаточно высоки для возможности его коммерческого применения. Кроме того, структура сперматозоида нарушается и в образцах не виден хвостик сперматозоида. Эта проблема является важной, поскольку сперматозоиды не так легко отличить от других клеток в образце, что приводит к последующим ошибкам при количественном подсчете числа сперматозоидов с поврежденным хроматином/ДНК.
Таким образом, все еще сохраняется потребность в подходящем способе, который мог бы быть рутинно и легко использован для изучения качества спермы животных и, в частности, для определения целостности хроматина/ДНК. Этот способ должен быть надежным, легким в использовании, дешевым и доступным для стандартных лабораторий. Способ должен решить описанные выше проблемы. Он также должен давать однородные результаты в разных лабораториях и быть пригодным для автоматизации.
Раскрытие изобретения
Предметом настоящего изобретения является быстрый и точный способ для определения целостности хроматина/ДНК в сперматозоидах животных, который может быть введен в рутинную практику любых аналитических и ветеринарных лабораторий и лабораторий, специализирующихся на вопросах репродуктивной функции человека.
Таким образом, предметом настоящего изобретения является способ для определения целостности хроматина/ДНК в сперматозоидах животных, который включает:
а) стадию обработки образца, содержащего сперматозоиды, денатурирующим ДНК раствором;
б) одну стадию обработки лизирующим раствором для экстракции ядерных белков;
в) стадию определения целостности хроматина/ДНК сперматозоидов, характеризующуюся тем, что лизирующий раствор не содержит детергента, денатурирующего белки, и поэтому хвостик сперматозоида значительно не разрушается.
В целом предпочтительно, чтобы стадия а) предшествовала стадии б).
Как уже сказано, выбор лизирующего раствора является критическим для достижения целей настоящего изобретения. Среди денатурирующих белки детергентов, которые не должны использоваться, мы отмечаем анионные и катионные детергенты, например SDS (додецилсульфат натрия), алкилбензолсульфонат, гидратные соли гликолевой кислоты и т.п. Они являются детергентами, которые значительно разрушают мембраны, обладают лизирующим действием и в то же время активны в плане денатурации белков. Они используются для электрофореза в денатурирующих условиях, где белки мигрируют в условиях их полной денатурации (потери их трехмерной структуры). Эти детергенты особенно активны при кислых значениях рН, действуя предпочтительно на грамположительные бактерии. Их активность среди детергентов является высокой.
В способе по настоящему изобретению предпочтительно используются неионные денатурирующие детергенты, которые можно назвать детергентами, солюбилизирующими белки, но не денатурирующими их. Среди них предпочтительными являются токтилфеноксиполиэтоксиэтанол (Тритон Х-100), N,N-бис(3-D-глюконамидопропил)холамид (bigCHAP), Brij(r) 35 Р, N-деканоил-N-метилглюкамин, дигитонин, додеканоил-N-метилглюкамид, гептаноил-N-метилглюкамид, разветвленный октилфеноксиполи(этиленокси)этанол (Igepal СА-630), N-нонаноил-N-метилглюкамин, Nonidet P 40, N-октаноил-N-метилглюкамин, раствор Span 20, эфир полиоксиэтиленовой жирной кислоты 20 (Tween 20). Наиболее предпочтительным является Тритон Х-100, так как он дает хорошие результаты и легко доступен.
Предпочтительно, чтобы лизирующий раствор имел достаточную ионную силу для облегчения процесса лизиса без денатурации. Мы проверили, что эффективным раствором является раствор, который содержит от 1 М до 3 М хлорида натрия, от 0,001 М до 2 М дитиотрейтола (DTT), от 0,001 М до 2 М 2-амино-2-(гидроксиметил)-1,3-пропандиола (триса) и от 0,1% до 3% Тритона Х-100. Наиболее предпочтительным является раствор, который содержит около 2,5 М NaCl, около 0,2 М DTT, около 0,2 М триса, около 1% Тритона Х-100 и имеет рН около 7,5.
Раствор для денатурации ДНК предпочтительно является кислотой, например кислотой, выбираемой из соляной, уксусной, азотной кислот или их смесей. Предпочтительно этот раствор является раствором соляной кислоты.
Способ согласно настоящему изобретению включает стадию определения целостности хроматина/ДНК сперматозоидов после стадий а) и б). Хотя имеется несколько альтернативных возможностей для такого определения, предпочтительной является та, которая доступна для визуального наблюдения. С этой целью способ предпочтительно включает стадию окрашивания образца после стадий а) и б). Красителем, который дает превосходные результаты и позволяет визуализировать хвостик сперматозоида, а также формируемый вокруг клеток характерный ореол, является раствор, подобный раствору Райта (Wright solution).
В предпочтительном варианте изобретения сперматозоиды включаются в среду, подобную суспензии, предпочтительно в микрогель, особенно в агарозный микрогель.
Настоящее изобретение также направлено на создание набора для определения качества спермы животных, который включает:
а) денатурирующий ДНК раствор;
б) лизирующий раствор для экстракции ядерных белков,
и характеризуется тем, что лизирующий раствор не содержит денатурирующий белки детергент и значительно не разрушает хвостик сперматозоидов. Данный набор позволяет проводить исследование по способу настоящего изобретения, который только что был описан.
Краткое описание фигур
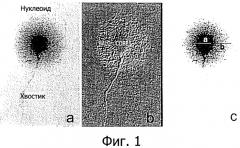
Фигура 1. Параметры, используемые для определения размера ореола сперматозоидов человека, согласно методологии настоящего изобретения. 1а: Нуклеоид, который соответствует в значительной степени депротеинизированному ядру сперматозоида, который состоит из двух частей: силуэта (контура) ядра сперматозоида, называемого ядром (сердцевиной), в центральной части, и периферического ореола диспергированного хроматина/ДНК. Хвостик сперматозоида ясно виден. 1b: Изображение, полученное с использованием рельефного фильтра для лучшей визуализации и определения границ между ореолом и ядром. 1с: Наименьший диаметр ядра (а) и толщина ореола (b) как пример измерений, используемых для определения разных размеров ореолов, как это объяснено в методологии настоящего изобретения.
Фигура 2. Различные типы сперматозоидов, выявленные согласно размеру ореола, который получен в результате применения способа настоящего изобретения. 2а: Сперматозоид с ореолом большого размера. 2b: Сперматозоид со средним размером ореола. 2с: Сперматозоид с маленьким размером ореола. 2d: Сперматозоид без ореола. 2е: Деградированный сперматозоид без ореола. 2f: Общая картина поля, на которой видны все описанные выше разные типы сперматозоидов.
Фигура 3. Корреляция между разными размерами ореолов, наблюдаемых после окрашивания DAPI (а-е, голубая флуоресценция), и сигнала гибридизации in situ с использованием в качестве зонда суммарной геномной ДНК человека, согласно методу DBD-FISH (а'-е', красная флуоресценция), используемому для визуализации уровня фрагментации ДНК. 3а: Сперматозоид с ореолом и с низким сигналом гибридизации (3а'). 3b: Сперматозоид со средним ореолом и с низким сигналом гибридизации, хотя и чуть более высоким, чем в предыдущем случае (3b'). 3с: Сперматозоид с маленьким ореолом и со значительным увеличением уровня гибридизации (3с'). 3d: Сперматозоид без ореола и с высоким уровнем гибридизации (3d'). 3е: Деградированный сперматозоид, демонстрирующий нерегулярное распределение гибридизации (3е').
Фигура 4. Применение способа по настоящему изобретению к образцу спермы следующих видов: мышь (Mus musculus), бык (Bos taurus), камбала-тюрбо (Scophthalmus maximus) и земляной червь (Lombricus terrestris). 4а соответствует быку, 4b, с, d соответствуют мыши, 4е соответствует земляному червю, 4f соответствует камбале-тюрбо.
Фигура 5. Пример пациента, имеющего высокий уровень лейкоцитоспермии. Отмечено отсутствие хвостиков у лейкоцитов, что позволяет отличать их от других типов клеток.
Осуществление изобретения
Как будет далее подробно описано, способ и набор по настоящему изобретению являются простой и удобной системой для определения частоты встречаемости сперматозоидов с фрагментированной ДНК. Предлагаемый способ применим в андрологических лабораториях и может быть полезен в клиниках, занимающихся вопросами искусственной репродукции, и лабораториях по разведению животных. Он является универсальной и гибкой системой, так как позволяет использовать замороженные образцы и исследовать их по мере необходимости без изменений в результатах анализа.
Способ по настоящему изобретению, который позволяет определять целостность хроматина/ДНК и сперматозоидов животных, включает:
а) стадию обработки образца, содержащего сперматозоиды, денатурирующим ДНК раствором;
б) одну стадию обработки лизирующим раствором для экстракции ядерных белков, при этом лизирующий раствор не содержит денатурирующего белки детергента и в значительной степени не разрушает хвостик сперматозоидов;
в) стадию определения целостности хроматина/ДНК в сперматозоидах.
Помимо других отличий принципиальные отличия способа по настоящему изобретению с учетом уровня техники в данной области и особенно с учетом работы Fernandez J.L. et al. (Journal of Andrology, 2003, vol.24, No.1, pp.59-66), лежат главным образом в области лизирования и окрашивания клеток. Например, используется только один лизирующий раствор вместо двух последовательных обработок. Состав лизирующего раствора отличается от известных составов, он не содержит SDS (анионный детергент, разрушающий белки) или ЭДТА (хелатирующий агент). Он может включать относительно мягкий, нейтральный, не денатурирующий детергент, такой как Тритон Х-100.
Технически эти различия приводят к сохранению хвостиков сперматозоидов. Это является принципиально важным усовершенствованием, поскольку выявление хвостиков является необходимой частью анализа получаемых результатов, так как позволяет выяснить, действительно ли изображение нуклеоида принадлежит сперматозоиду или соответствует другим типам клеток, которые могут присутствовать в образце, например клеткам, которые отшелушиваются от стенок мочеполовых путей, клеткам, участвующим в воспалительном ответе, клеткам крови и т.д. Сохранение хвостиков достигается за счет применения гораздо менее агрессивного лизирующего раствора, а также за счет отказа от использования SDS.
Более мягкие условия лизиса также позволяют достичь разворачивания нитей хроматина, лучшего сохранения морфологии головки или ядра и получить диспергированный ореол с большей плотностью материала хроматина, что приводит к его более интенсивному окрашиванию. В результате этого контрастность и возможность визуализировать ореолы разного размера в значительной степени улучшаются, особенно при использовании окрашивания по Райту.
Другим значительным преимуществом является то, что отсутствие денатурирующего белки детергента, такого как SDS, позволяет последовательно использовать описанный здесь способ в комбинации с другими методами для визуализации других клеточных компонентов. Так, после получения нуклеоида описанным способом могут использоваться методы для иммунодетекции белков, определения типов белка ламинина и других ядерных белков, а также методы определения РНК, ассоциированной с ядерным матриксом, и поскольку ДНК уже расплетена, количество ядерных структур сохраняется на максимально возможном высоком уровне. Это очень важно для определенных типов исследований структуры ядра сперматозоидов.
Другим дополнительным преимуществом является использование меньшего количества реагентов и, следовательно, более низкая стоимость способа по настоящему изобретению. Например, DTT довольно дорог, и снижение его концентрации, описанное в примерах (четвертая часть от количества, описанного в статье), значительно сказывается на стоимости.
Результатом всех обсуждаемых здесь аспектов является то, что способ по настоящему изобретению позволяет получить гораздо лучшие и более воспроизводимые изображения нуклеоидов сперматозоидов по сравнению с теми, которые доступны на настоящий момент. Можно четко определить, принадлежит ли данный нуклеоид зрелому сперматозоиду, или же он происходит из другого типа клеток, а также гораздо более четко и надежно определить, к какой категории относится размер ореола. Вследствие этого с использованием способа по настоящему изобретению определение уровня фрагментации ДНК в образце является гораздо более надежным; это означает, что способ по настоящему изобретению может использоваться рутинно, просто и с небольшими затратами. Применение способа по настоящему изобретению важно для разных лабораторий для клинических исследований образцов спермы человека, а также для ветеринарных лабораторий для исследования образцов спермы животных. Это очень важно, поскольку способ может использоваться в качестве теста с возможным клиническим применением на пациентах.
Последовательность стадий обработки образца может иметь любой порядок, с первичной обработкой образцов денатурирующим ДНК раствором с последующей стадией обработки лизирующим раствором, или наоборот. Однако предпочтительно обрабатывать образец сначала денатурирующим ДНК раствором и лишь затем лизирующим раствором, поскольку это дает лучшие результаты. В другом варианте (сначала лизис, а затем денатурация ДНК) сперматозоиды с фрагментированной ДНК ведут себя несколько иначе. В этом случае они диспергируют фрагменты хроматина/ДНК, давая увеличение ореола до больших размеров. Для наблюдения такого явления достаточно даже обработки одним лизирующим раствором, хотя в этом случае определение размера ореола является не очень точным.
Способ по настоящему изобретению детально описан ниже вместе с некоторыми вариациями и необязательными стадиями. Специалист в данной области должен понимать, что существуют другие пути для реализации и другие возможности для проведения исследований при условии, что будут сохранены основные аспекты способа, описанные здесь.
Первой стадией способа является приготовление образца для исследования. Это делается с использованием обычных в данной области процедур и измерения концентрации сперматозоидов в образце. Подходящие концентрации для проведения анализа по данному способу варьируют в области от 0,1 до 20 миллионов клеток на миллилитр. Если образец слишком концентрированный, он доводится до нужной концентрации путем разведения культуральной средой или физиологическим раствором с фосфатным буфером (PBS) или чем-то подобным.
Образец спермы должен быть помещен на подложку для его обработки согласно способу по настоящему изобретению и для того, чтобы сделать работу с ним более легкой. Предпочтительной подложкой является предметное стекло, которое может быть покрыто пленкой из обычной агарозы. Для этого раствор обычной агарозы в концентрации в диапазоне от 0,2% до 1% готовится на дистиллированной воде в чашке Коплина (Coplin jar) или подобной емкости. Емкость закрывается пластиковой пленкой и помещается в микроволновую печь. Микроволновая печь устанавливается на мощность между 300 Вт - 1000 Вт, например 500 Вт, емкость встряхивается для лучшего растворения агарозы и выдерживается в печи до кипения. Данная процедура может проводиться с использованием термостатированной водяной бани. После того, как раствор агарозы станет полностью прозрачным, он переносится в вертикальные контейнеры объемом от 10 мл до 250 мл. Контейнеры для агарозы должны быть предварительно нагреты до температуры от 60°С до 100°С, например до 70°С, в водяной бане, чтобы поддерживать раствор агарозы в жидком состоянии.
Перед тем, как поместить предметные стекла в раствор агарозы, их необходимо протереть тряпочкой для удаления возможных загрязнений. Предметные стекла погружаются в раствор агарозы вертикально и удерживаются пинцетом в зоне покрытия в течение 1-60 секунд, вынимаются из раствора и снова погружаются в него от 1 до 10 раз до тех пор, пока на стекле не образуется однородная пленка. Стекла затем помещаются горизонтально на гладкую поверхность, например на стекло или металл, и охлаждаются до температуры в диапазоне от 1°С до 15°С, предпочтительно до 4°С. Подложка с предметными стеклами помещается в холодильник с температурой 4°С на 30 минут, пока не становится видно, что агароза на поверхности стекла затвердела. Подносы со стеклами вынимаются из холодильника и поверхность предметных стекол, которая контактировала с подложкой, очищается от агарозы с помощью фильтровальной бумаги. Затем предметные стекла помещаются в горизонтальном положении в сушильный шкаф при температуре в диапазоне от 37°С до 100°С и выдерживаются до тех пор, пока агароза полностью не высохнет и не образует тонкую пленку, прилипшую к поверхности стекла. Обработанные таким способом предметные стекла могут использоваться сразу или храниться в хорошо закрытом контейнере при обычной (комнатной) температуре в течение нескольких месяцев.
Чтобы сделать обработку образца, который содержит сперму, более легкой, образец может быть помещен в среду с характеристиками, близкими к таковым суспензии, такую, например, как агарозный микрогель. В этом случае готовится раствор легкоплавкой агарозы (с низкой точкой плавления/точкой затвердевания) с концентрацией в диапазоне от 0,5% до 2% в дистиллированной воде. Плавление такого раствора агарозы проводится в микроволновой печи или на водяной бане, и он хранится при температуре в диапазоне от 30°С до 37°С в пробирках, помещенных в термостатированную баню или в сушильный шкаф. Сперма и раствор агарозы аккуратно смешиваются в пробирках Эппендорфа или в подобных пробирках так, чтобы конечная концентрация агарозы была в диапазоне от 0,3% до 1%. Например, смешиваются 70 микролитров (мкл) раствора агарозы с 30 мкл образца. Очень важно, чтобы температура раствора агарозы была не выше, чем 37°С, чтобы не повредить клетки.
Наконец, чтобы нанести образец на подложку, покрытые агарозой предметные стекла помещаются на гладкую и холодную поверхность стекла или металла с температурой в диапазоне от 1°С до 15°С, и образец наносится так, чтобы не образовывались пузырьки воздуха. Рекомендуется наносить каплю смеси объемом в диапазоне от 5 до 200 мкл с помощью микропипетки, помещая поверх капли покровное стекло. В качестве предосторожности рекомендуется готовить каждый образец в двух экземплярах и использовать каждый раз при проведении исследования контрольный образец. Подложка со стеклами помещается в холодильник с температурой 4°С на время от 2 до 30 мин до обеспечения полного затвердения агарозы. После того, как агароза застыла, предметные стекла вынимаются из холодильника и покровные стекла аккуратно удаляются; при этом необходимо убедиться, что микрогель не поврежден.
Когда образцы подготовлены должным образом для легкого и многократного использования, они затем обрабатываются согласно способу по настоящему изобретению ДНК-денатурирующим раствором и лизирующим раствором для экстракции ядерных белков.
В предпочтительном воплощении предметные стекла с образцом сначала помещаются в горизонтальном положении в контейнер, который содержит денатурирующий ДНК раствор. Денатурирующим ДНК раствором может быть раствор кислоты, например раствор уксусной кислоты, азотной кислоты, серной кислоты, или раствор щелочи, такой как, например, раствор гидроокиси натрия, гидроокиси бария, гидроокиси калия в низких концентрациях. В предпочтительном варианте используется раствор соляной кислоты с концентрацией в диапазоне от 0,01 N до 0,5 N, предпочтительно в диапазоне от 0,1 N до 0,3 N, особенно предпочтительно с концентрацией около 0,2 N. Рекомендуется готовить такой раствор в день проведения опыта и выдерживать в нем предметные стекла для инкубации с денатурирующим ДНК раствором в течение от 1 до 15 минут при температуре в диапазоне от 1°С до 37°С, предпочтительно 18-25°С, предпочтительно 20-22°С.
Когда первый этап обработки закончен, проводится лизис образца с использованием одного лизирующего раствора, который является достаточно мягким, чтобы не разрушать хвостики сперматозоидов. Для этого каждое предметное стекло погружается в горизонтальном положении в другую емкость, которая содержит лизирующий раствор.
Как отмечалось ранее, лизирующий раствор подбирается таким образом, чтобы достичь расплетания нитей хроматина с как можно лучшим сохранением морфологии области головки, что обеспечивает образование характерного ореола с высокой плотностью материала хроматина. Раствор должен быть также достаточно мягким, чтобы сохранить хвостики сперматозоидов. Это достигается путем устранения из раствора агрессивных детергентов и веществ, денатурирующих белки. Кроме того, контроль за концентрацией ионов также позволяет модулировать такое действие раствора.
В предпочтительном варианте такой раствор состоит из: хлорида натрия в концентрации в диапазоне от 1 М до 3 М, предпочтительно между 2 М и 3 М, дитиотрейтола (DTT) в концентрации между 0,001 М и 2 М, предпочтительно между 0,01 М и 0,8 М, 2-амино-2-(гидроксиметил)-1,3-пропандиола (триса) в концентрации от 0,001 М до 2 М, предпочтительно между 0,01 М и 0,4 М, и Тритона Х-100 в концентрации от 0,1% до 3%, предпочтительно между 0,5-1,5%. В таком растворе рН доводится до значений между 6,5 и 8,5, предпочтительно 7-7,5.
Существуют и альтернативные лизирующие растворы, или концентрации, время и температуры растворов могут варьировать с сохранением основных функциональных характеристик растворов. Также в качестве альтернативы DTT существуют соединения типа β-меркаптоэтанола и другие восстанавливающие агенты. В качестве альтернативы трису могут использоваться другие буферные растворы, такие как Hepes, Mops и Pipes. Как упоминалось выше, в качестве альтернативы Тритону Х-100 могут использоваться другие нейтральные детергенты.
В зависимости от используемого раствора и типа образца препараты инкубируются в лизирующем растворе в течение времени от 1 до 60 минут, предпочтительно между 15 и 35 минутами, время около 25 минут является наиболее предпочтительным; и при температуре в диапазоне от 1°С до 37°С, предпочтительно между 18-25°С, и температура между 20-22°С является наиболее предпочтительной.
В качестве полной альтернативы способу, описанному выше, порядок инкубации образца в денатурирующем и лизирующем растворах может быть изменен. Действие такого порядка обработки на хроматин сперматозоидов также позволяет отличить сперматозоиды с поврежденным хроматином/ДНК от остальных (неповрежденных) сперматозоидов. Детали наблюдаемых различий будут описаны в Примере 6.
После обработки денатурирующим ДНК раствором и лизирующим раствором препараты могут промываться для удаления остатков этих растворов. Для этого используется максимально мягкий промывочный раствор, не содержащий хелатирующих агентов или детергентов. Например, стекла помещаются в горизонтальном положении в резервуар, содержащий большой избыток дистиллированной воды, или буферного раствора, или физиологического раствора на время в диапазоне от 1 до 60 минут.
Затем образец обезвоживается. Для этого могут использоваться увеличивающиеся концентрации спирта. Например, предметные стекла погружаются в горизонтальном положении в резервуары, содержащие серию растворов этанола с увеличивающейся концентрацией в диапазоне от 5% до 100% на время от 30 секунд до 60 минут в каждом растворе, а затем препараты отставляют на воздухе для высыхания. В качестве альтернативы инкубации в серии растворов этанола препараты могут обезвоживаться путем инкубации в растворах других спиртов, таких как метанол, или даже высушиваться на воздухе или в сушильном шкафу.
После высушивания уже обработанные предметные стекла с образцами спермы могут храниться в коробках при обычной (комнатной) температуре в течение нескольких месяцев. Это позволяет разделить во времени процесс обработки препаратов по способу настоящего изобретения и следующую стадию определения целостности хроматина/ДНК сперматозоидов. Хранение позволяет проводить повторные определения через разные промежутки времени нескольких образцов, полученных от одного и того же индивидуума.
После того, как образцы были обработаны способом согласно настоящему изобретению, проводится стадия определения. Как говорилось ранее, имеется несколько возможных способов для определения целостности хроматина/ДНК в сперматозоидах. Преимуществом является то, что образцы, обработанные согласно настоящему изобретению, имеют гораздо более четкий для визуализации ореол и сохраненную структуру сперматозоидов, в частности сохраняются хвостики, что позволяет четко отличить сперматозоиды от других типов клеток.
В предпочтительном воплощении образец обрабатывается красителем, который облегчает визуальное определение. Выбирая подходящие условия окрашивания, можно получить изображения высокого качества и добиться хорошей воспроизводимости результатов определения. Существует несколько стратегий окрашивания в зависимости от того, какой микроскоп используется: обычный, микроскоп со светлым полем (clear field microscope) или флуоресцентный микроскоп.
Окрашивание для анализа при использовании микроскопа со светлым полем:
В этом случае красителями, которые могут быть использованы, являются краситель Райта, азур-II-эозин, орсеин, реактив Шиффа, уксусный кармин, красители типа тиазина и смеси типа смеси Романовского или производные вышеназванных красителей (смотри Chromosome banding by AT Sumner, pp.90-91).
Красители, такие как краситель Райта, являются предпочтительными, так как они обеспечивают более интенсивное окрашивание образца, в частности ореолов. При использовании этих красителей значительно улучшаются контрастность и возможность визуально различить ореолы разного размера. При их использовании также преимуществами являются низкая стоимость и легкая доступность для лабораторий любого типа. Их использование позволяет видеть хвостики сперматозоидов, которые обычно не видны при окрашивании ДНК флуорохромами, используемыми при флуоресцентной микроскопии. Важно подчеркнуть, что с этими красителями легко обращаться, чтобы получить подходящий уровень окрашивания, чего невозможно добиться при использовании Diff-Quik или подобных красителей.
Другие красители, такие как Diff-Quik, описанный в работе Fernandez, J.L. et al. (Journal of Andrology, 2003, vol 24, No.1, pp 59-66), являются значительно более слабыми и не позволяют достичь достаточного контраста ореола по отношению к фону. Вследствие этого, когда ореол сильно диспергирован, обычно трудно определить его внешнюю границу, что иногда приводит к ошибкам при маленьком ореоле, когда категория фрагментации приписывается сперматозоидам, которые содержат интактную ДНК. Таким образом, можно сказать, что предлагаемая в публикации методика окрашивания имеет тенденцию к завышению уровней фрагментации, в частности при окрашивании для микроскопии со светлым полем. Это является определенным недостатком при тестировании с возможным применением для пациентов. Таким образом, совершенно очевидно, что эти улучшения имеют