Способ определения предрасположенности человека к развитию агрессивных неходжкинских лимфом
Иллюстрации
Показать всеИзобретение относится к области медицины, конкретнее к медицинской генетике, онкологии и онкогематологии. Способ технически прост и малозатратнее по времени и средствам, а также обеспечивает возможность определения предрасположенности человека к развитию агрессивных НХЛ в тех случаях, когда другие способы не позволяют осуществить данное определение. Исследуют генотип 399-го кодона гена XRCC1. При обнаружении у обследуемого человека генотипа Gln/Gln делают вывод о его предрасположенности к развитию агрессивных неходжкинских лимфом, в частности диффузной В-крупноклеточной лимфомы, тогда как при обнаружении у обследуемого генотипа Arg/Arg делают вывод о сниженном по отношению к популяционному риске развития агрессивных вариантов НХЛ у данного обследуемого. 5 ил., 5 табл.
Реферат
Изобретение относится к области медицины, конкретнее к медицинской генетике, онкологии и онкогематологии.
Авторы не обнаружили в уровне техники сведений о способах определения предрасположенности человека к развитию именно агрессивных вариантов неходжкинских лимфом, поэтому были проанализированы сведения, относящиеся к способам определения предрасположенности человека к развитию лимфом.
Выявлено несколько генетических мутаций, которые могут определять предрасположенность человека к развитию ряда солидных новообразований и способствовать развитию лимфом: MTS, MTS2, ATM.
Известно изобретение «Ген MTS, мутации данного гена и способы диагностики злокачественных опухолей с использованием последовательности гена MTS» (патент РФ №2164419, прототип). Согласно данному способу обнаружение в зародышевой линии клеток человека мутации в гене многофункционального опухолевого супрессора (MTS) свидетельствует о предрасположенности этого человека к таким формам рака, как меланома, окулярная меланома, лейкоз, астроцитома, глиобластома, лимфома, глиома, лимфома Ходжкина, множественная миелома, саркома, миосаркома, холангиосаркома, чешуеклеточная карцинома, хронический лимфоидный лимфолейкоз (CLL), а также опухоли поджелудочной железы, молочной железы, мозга, простаты, мочевого пузыря, щитовидной железы, яичников, матки, семенников, почек, желудка, ободочной и прямой кишки.
Мутационные события в локусе MTS могут включать делеции, инсерции и точечные мутации как в кодирующих, так и в некодирующих последовательностях. Поэтому при диагностике предрасположенности пациента к указанным видам опухолевых заболеваний должны быть исследованы все локусы данного гена и сравнены с аналогичными локусами дикого типа данного гена.
Осуществление способа-прототипа требует дорогостоящих, высокотехнологичных методик (одноцепочечный конформационный анализ ("SSCA"); электрофорез в денатурирующем градиентном геле ("DGGE"); тест защиты от РНКазы; метод аллель-специфических олигонуклеотидов ("ASOs"); использование белков, узнающих нуклеотидные несовпадения, такие как mutS-белок Е.coli; клонирование, секвенирование и др.). Поскольку для выявления мутаций в гене MTS требуется сравнение со «здоровым контролем» (диким типом гена), необходима наработка или приобретение стандарта дикого типа гена.
Кроме того, генетические мутации - явления редкие. У людей, не имеющих мутации в гене MTS, тоже возникают онкологические заболевания, в частности агрессивные варианты неходжкинских лимфом. Обнаружить предрасположенность к ним могут помочь другие способы, в частности предлагаемый нами способ.
Предлагаемое изобретение основано на исследовании связи между наличием у человека полиморфизма Arg399Gln гена XRCC1 (X-ray cross-complementing group I) и возникновением у него агрессивных неходжкинских лимфом. Собственной ферментативной активности у белка XRCC1 не обнаружено, однако он формирует комплексы ферментов - участников репарации ДНК и входит в семейство белков, участвующих в контроле прохождения клеточного цикла и стабильности генома.
В белок-кодирующих областях гена XRCC1 были обнаружены три олигонуклеотидных полиморфизма, один из которых находится в кодоне 399 и состоит в замене аргинина на глицин (Arg>Gln).
Кодон 399 локализован в пределах 10 экзона гена XRCC1, и при полиморфизме Arg>Gln замена происходит в регионе, который кодирует биологически важную область BRCT-I. Полиморфизм распознается по отсутствию рестрикции эндонуклеазой Msp I в минорной аллели гена. Замена аргинина на глицин в первичной структуре приводит к конформационным изменениям белка и снижению его активности.
Относительно полиморфизма Arg399Gln гена XRCC1 в уровне техники имеются следующие сведения:
- наличие у человека 399С1n-аллеля гена XRCC1 является фактором, способствующим развитию немелкоклеточного рака легкого, особенно при воздействии канцерогенных веществ табака (The XRCC1 codon 399 Gln allele is associated with adenine to guanine p53 mutations in non-small cell lung cancer. // Casse C., Hu Y.C., Ahrendt S.A. // Mutat Res., - 2003, Jul 25. - 528 (1-2). - P.19-27);
- Gln-гомозиготность обнаруживает существенную связь с аденокарциномой легкого у курящих (The XRCC1 399 glutamine allele is a risk factor for adenocarcinoma of the lung. / Divine K.K., Gilliland F.D., Crowell R.E., Stidley C.A., Bocklage T.J., Cook D.L, Belinsky S.A. // Mutat Res., - 2001, Jan 5. - 461(4). - P.273-8);
- выявлена положительная связь между Arg/Gln и Gln/Gln генотипом по 399 кодону XRCC1 и раком молочной железы у чернокожих американок. У белых пациенток она отсутствует (Polymorphisms in the DNA repair gene XRCC1 and breast cancer. / Duell E.J., Millikan R.C., Pittman G.S., Winkel S., Lunn R.M., Tse C.K., Eaton A., Mohrenweiser H.W., Newman В., Bell D.A. // Cancer Epidemiol Biomarkers Prev. - 2001, Mar. - 10(3). - P.217-22);
- исследованиями Hu et. al. установлено, что Gln-аллель увеличивает чувствительность к радиации, алкилирующим агентам и свободным радикалам кислорода - факторам, предрасполагающим к развитию рака молочных желез (Genetic regulation of ionizing radiation sensitivity and breast cancer risk. / Hu J.J., Smith T.R., Miller M.S., Lohman K., Case L.D. // Environ Mol Mutagen. - 2002. - 39 (2-3). - P.208-15);
- исследованиями Abdel-Rahman et. al. в Египте было показано, что Gln-аллель как в гомозиготном, так и в гетерозиготном состоянии увеличивает риск развития колоректального рака (Inheritance of the 194Trp and the 399Gln variant alleles of the DNA repair gene XRCC1 are associated with increased risk of early-onset colorectal carcinoma in Egypt. / Abdel-Rahman S.Z., Soliman A.S., Bondy M.L., Omar S., El-Badawy S.A., Khaled H.M., Seifeldin I.A., Levin В. // Cancer Lett. - 2000, Oct. - 159 (1). - P.79-86). Подобное же исследование было выполнено на группе пациентов с колоректальным раком в Корее. Анализ показал, что количество алкоголя в пересчете на спирт ≥80 г/неделю - существенный фактор риска колоректального рака в сочетании с 399Gln генотипом (Polymorphisms of XRCC1 gene, alcohol consumption and colorectal cancer. / Hong Y.C., Lee K.H., Kim W.C., Choi S.K., Woo Z.H, Shin S.K, Kim H. // Int J Cancer. - 2005, Sep. - 116 (3). - P.428-32);
- китайские ученые Yu et. al. выявили, что частота XRCC1 399 Gln/Gln генотипа при сквамозоклеточном раке пищевода была значительно выше, чем в группе здоровых лиц. Курение значительно увеличивало риск людей с генотипом XRCC1 399 Gln/Gln заболеть сквамозоклеточным раком пищевода (DNA repair gene XRCC1 polymorphisms, smoking, and esophageal cancer risk. / Yu H.P., Zhang X.Y., Wang X.L, Shi L.Y., Li Y.Y., Li F., Su Y.H., Wang Y.J., Lu В., Sun X., Lu W.H., Xu S.Q. // Cancer Detect Prev. - 2004. - 28(3). - P.194-9);
- Sturgis et. al. выявили связь 399Gln аллеля с риском развития плоскоклеточного рака головы и шеи у курильщиков (Polymorphisms of DNA repair gene XRCC1 in squamous cell carcinoma of the head and neck. / Sturgis E.M., Castillo E.J., Li L., Zheng R., Eicher S.A., Clayman G.L., Strom S.S., Spitz M.R., Wei Q. // Carcinogenesis. - 1999, Nov. - 20 (11). - P.2125-9).
Таким образом, в уровне техники имеются сведения, которые показывают, что наличие у человека 399Cln-аллеля гена XRCC1 в гетерозиготном или гомозиготном состоянии является фактором риска развития у него некоторых видов опухолей.
В то же время имеется ряд исследований, которые показывают, что:
- 399Gln аллель гена XRCC1 может иметь не проонкогенный, а защитный эффект в отношении некоторых видов опухолей. Например, в исследовании, проведенном Skjelbred et. al., отмечено снижение риска развития колоректальных аденокарцином у носителей Gln-аллеля 399 кодона гена XRCC1 (Polymorphisms of the XRCC1, XRCC3 and XPD genes and risk of colorectal adenoma and carcinoma, in a Norwegian cohort: a case control study. / Skjelbred C.F., Saebo M., Wallin H., Nexo B.A., Hagen P.C., Lothe I.M., Aase S., Johnson E., Hansteen I.L., Vogel U., Kure E.H. // BMC Cancer. - 2006, Mar. - 6. - P.67). В двух работах отмечен протективный эффект Gln/Gln генотипа у курильщиков (DNA repair gene XRCC1 polymorphisms, smoking, and bladder cancer risk. / Stem M.C., Umbach D.M., van Gils C.H., Lunn R.M., Taylor J.A. // Cancer Epidemiol Biomarkers Prev. - 2001, Feb. - 10 (2). - P.125-31; Polymorphisms of the DNA repair genes XRCC1, XRCC3, XPD, interaction with environmental exposures, and bladder cancer risk in a case-control study in northern Italy. / Shen M., Hung R.J., Brennan P., Malaveille C., Donato F., Placidi D., Carta A., Hautefeuille A., Boffetta P., Porru S. // Cancer Epidemiol Biomarkers Prev. - 2003, Nov. - 12 (11 Pt 1). - P.1234-40);
- 399Gln аллель гена XRCC1 может никак не влиять на риск возникновения опухолевого заболевания. Не найдено связи данного полиморфизма с раком полости рта (Polymorphism in DNA repair genes and oral squamous cell carcinoma in Thailand. / Kietthubthew S., Sriplung H., Au W.W., Ishida T. // Int J Hyg Environ Health. - 2006, Jan. - 209 (1). - P.21-9). В исследовании Zhang et. al. показано, что полиморфизм Arg399Gln гена XRCC1 самостоятельного модифицирующего влияния на риск развития рака желудка не оказывает (Correlation of genetic polymorphisms in DNA repair genes ADPRT and XRCC1 to risk of gastric cancer. / Zhang Z., Miao X.P., Tan W., Guo Y.L., Zhang X.M., Lin D.X. // Ai Zheng. - 2006, Jan. - 25 (1). - P.7-10). В одном из исследований по раку мочевого пузыря не найдено никакой связи данного полиморфизма с раком мочевого пузыря (DNA repair gene polymorphisms, bulky DNA adducts in white blood cells and bladder cancer in a case-control study. / Matullo G., Guarrera S., Carturan S., Peluso M., Malaveille C., Davico L., Piazza A., Vineis P. // Int J Cancer. - 2001, May. - 92 (4). - P.562-7);
- риск развития некоторых опухолей связан с нормальным (диким) аллелем гена XRCC1. Lee G. M. et al. показали статистически значимое увеличение риска развития рака пищевода у Arg/Arg лиц, злоупотребляющих алкоголем, в сравнении с Arg/Gln и Gln/Gln пациентами (Genetic polymorphisms of XRCC1 and risk of the esophageal cancer. / Lee J.M., Lee Y.C., Yang S.Y., Yang P.W., Luh S.P., Lee C.J., Chen C.J., Wu M.T. // Int J Cancer. - 2001, Jul. - 95 (4). - P.240-6).
Таким образом, из уровня техники известно, что полиморфизм Arg399Gln гена XRCC1 предрасполагает его носителя к одним онкологическим заболеваниям, защищает от других онкологических заболеваний и является индифферентным по отношению к третьим видам онкологических заболеваний.
Данные о роли полиморфизма Arg399Gln гена XRCC1 при лимфомах, в частности агрессивных неходжкинских лимфомах, в уровне техники отсутствуют.
Раскрытие изобретения
Одной из самых распространенных форм гемобластозов являются неходжкинские лимфомы (НХЛ) - это опухоли системы крови, характеризующиеся неопластической пролиферацией лимфоидных клеток.
Сущность предлагаемого способа определения предрасположенности человека к развитию агрессивных неходжкинских лимфом состоит в следующем. Исследуют генотип 399-го кодона гена XRCC1. При обнаружении у обследуемого человека генотипа Gln/Gln делают вывод о предрасположенности обследуемого к развитию агрессивных неходжкинских лимфом, в частности к развитию диффузной В-крупноклеточной лимфомы, тогда как при обнаружении у обследуемого генотипа Arg/Arg делают вывод о сниженном по отношению к популяционному риске развития агрессивных вариантов НХЛ у данного обследуемого. При обнаружении генотипа Arg/Gln делают вывод о том, что риск развития у пациента агрессивных лимфом соответствует популяционному.
Сравнение предлагаемого способа с прототипом показывает следующее:
- в то время как в прототипе должны быть исследованы все локусы гена MTS и сравнены с аналогичными локусами дикого типа данного гена, для чего необходима наработка или приобретение стандарта дикого типа гена MTS, в предлагаемом способе необходимо анализировать единственное изменение, а именно замену Arg на Gln в 399-м кодоне гена XRCC1, что не требует сравнения с диким типом гена XRCC1, а следовательно, наработки или приобретения стандарта дикого типа гена;
- предлагаемый способ использует ПЦР-ПДРФ анализ (ПЦР - полимеразная цепная реакция; ПДРФ - полиморфизм длин рестрикционных фрагментов), который технически существенно проще и малозатратнее по времени и средствам в сравнении с прототипом;
- предлагаемый способ может выявить предрасположенность человека к развитию агрессивных неходжкинских лимфом в тех случаях, когда не работает прототип, т.е. у человека отсутствуют мутации в гене MTS.
При осуществлении предлагаемого способа на первом этапе в ПЦР реакции получают фрагмент гена XRCC1 обследуемого пациента длиной 615 пар нуклеотидов (п.н.). Этот фрагмент может содержать в 399-м кодоне Gln (мутантный аллель) либо Arg (дикий аллель). Затем проводят рестрикцию полученного на первом этапе ампликона с использованием эндонуклеазы рестрикции MspI, которая распознает только дикий вариант аллеля (содержащий в 399-м кодоне Arg) и разрезает его на два фрагмента длиной 376 п.н. и 239 п.н. Далее проводят электрофорез продуктов гидролиза. Могут получиться три варианта картин электрофореза. Наличие на электрофорезе одной полосы длиной 615 п.н. свидетельствует об отсутствии гидролиза ампликона, а следовательно, о гомозиготном минорном генотипе пациента Gln/Gln. Наличие на электрофорезе двух полос длиной 376 п.н. и 239 п.н. свидетельствует о гидролизе всего ампликона, а следовательно, о гомозиготном диком генотипе пациента Arg/Arg. Наличие на электрофорезе трех полос длиной 615 п.н., 376 п.н. и 239 п.н. свидетельствует о частичном гидролизе ампликона, а следовательно, о гетерозиготном генотипе пациента Arg/Gln.
Перечень фигур иллюстративного материала
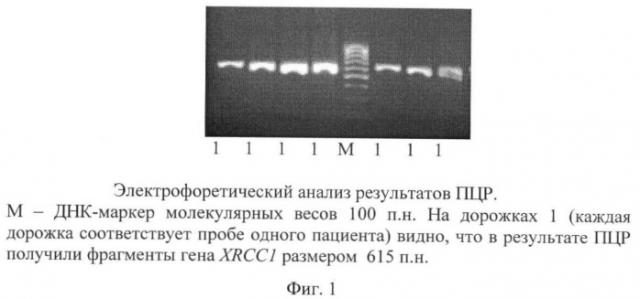
Фиг.1. Электрофоретический анализ результатов ПЦР фрагмента ДНК, содержащего 399-й кодон генаXRCC1.
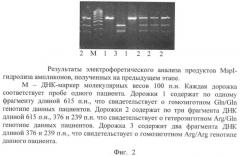
Фиг.2. Результаты электрофоретического анализа продуктов MspI-гидролиза полученных на предыдущем этапе ампликонов.
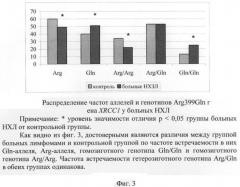
Фиг.3. Распределение частот аллелей и генотипов Arg399Gln гена XRCC1 у больных НХЛ.
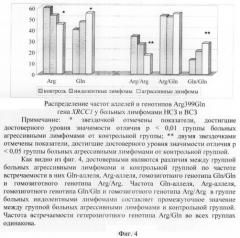
Фиг.4. Распределение частот аллелей и генотипов Arg399Gln гена XRCC1 у больных агрессивными и индолентными лимфомами.
Фиг.5. Распределение частот аллелей и генотипов Arg399Gln гена XRCC1 у больных ДВККЛ и ДВМКЛ.
Обоснование способа и его осуществление
Клиническая характеристика больных
Группу обследованных составили 98 пациентов с НХЛ Городского гематологического центра города Новосибирска. Исследовали генотип больных в 399 кодоне гена XRCC1.
Средний возраст больных составил 52,2±15,5 года (15-85 лет). По полу больные распределялись следующим образом: мужчины - 43 (44%), женщины - 55 (56%).
В обследованной группе больных НХЛ подавляющее большинство пациентов имели продвинутые стадии заболевания: 65 человек (66%) - IV стадию, 13 человек (13%) - III стадию, 17 человек (18%) - II стадию и 3 человека (3%) - I стадию лимфомы.
В обследованной группе 42 пациента (43%) имели лимфомы высокой степени злокачественности (ВСЗ, агрессивные), к которым относились диффузная крупноклеточная, беркиттоподобная, плеоморфная, лимфобластная, центробластная, иммунобластная, плазмобластная, анапластическая, фолликулярная 3-го цитологического типа, мантийноклеточная. 56 человек (57%) имели лимфомы низкой степени злокачественности (НСЗ, индолентные), среди которых были диффузная мелкоклеточная, пролимфоцитарная, центроцитарная, лимфоплазмоцитарная, фолликулярная 1-го цитологического типа, грибовидный микоз, маргинальноклеточная, MALT-лимфома.
Все больные были обследованы до начала активной полихимиотерапии.
Контролем служили данные по распространенности полиморфизма Arg399Gln гена XRCC1 среди здорового населения (n=180) Новосибирска и Новосибирской области (Belyavskaya V.A., Smetannikova N.A., Maksimov V.N. et. al. Polymorphism in XRCC1 DNA basic exision repair gene and some functionale related genes: Assosiation with longelity and cancer risk among the population of the Novosibirsk region. // Материалы международной конференции по химической биологии, 2-7 июня, Новосибирск, 2005 г., стр.49).
Диагноз неходжкинской лимфомы был установлен на основании гистологического исследования биоптатов лимфоузлов с иммуногистохимической верификацией варианта опухоли с использованием широкой панели моноклональных антител к кластерам дифференцировки гемопоэтических клеток.
Выделение ДНК из лейкоцитов цельной венозной крови больных лимфомами
Кровь для исследования генотипа пациента забирали из вены в объеме 5 мл. Полученный материал хранили до выделения ДНК при температуре -20°С.
Процедура выделения ДНК
1-й день. Перед выделением ДНК пробу крови размораживали, гомогенизировали и добавляли в нее 5 мл свежеприготовленного буфера А (в его состав входят: 10 mM трис-HCl pH 7,5, 10 mM NaCl, 3 mM MgCl2.) После тщательного встряхивания и центрифугирования пробы в течение 5 минут при 4 тыс.оборотов сливали надосадочную жидкость.
К осадку вновь добавляли 5 мл буфера А. Содержимое пробирки встряхивали, центрифугировали и сливали надосадочную жидкость. Такую последовательность действий повторяли еще 2-3 раза.
К отмытому осадку добавляли 1,9 мл буфера В (в его состав входят: 10 mM EDTA, 100 mM NaCl, 50 mM трис-HCl, pH 8,0). После тщательного встряхивания осадка с буфером добавляли 20% SDS (додецилсульфат натрия) в количестве 50 мкл и протеиназу К («Медиген», г.Новосибирск) в разведении 20 мг/мл в количестве 160 мкл. Содержимое пробирки перемешивали и оставляли для обработки белков протеиназой К на ночь в термостате при 37°С.
2-й день. В пробирку с пробой, в которой прошла обработка белков протеиназой К, добавляли 400 мкл 5М NaCl, 3 мл фенола, насыщенного буфером 0,1 М трис-HCl, pH 8,0, содержащим 0,2% 2-меркаптоэтанола. Содержимое пробирки встряхивали и центрифугировали при 4 тыс. оборотов в течение 5 минут. После разделения фаз на водную и фенольную аккуратно пипеткой собирали верхнюю (водную) фазу в чистую пробирку, добавляли в нее 3 мл смеси фенола с хлороформом в соотношении 1:1 (хлороформ содержал изоамиловый спирт в соотношении 24:1), встряхивали и вновь центрифугировали.
После разделения фаз на водную и хлороформ-фенольную аккуратно пипеткой собирали верхнюю (водную) фазу в чистую пробирку, добавляли в нее 3 мл хлороформа с изоамиловым спиртом в соотношении 24:1, содержимое пробирки встряхивали и вновь центрифугировали.
После разделения фаз на водную и хлороформную аккуратно пипеткой собирали верхнюю (водную) фазу в чистую пробирку, добавляли в нее 3 мл изопропилового спирта, аккуратно перемешивали содержимое пробирки до появления клубочка нитей ДНК.
Пробирки с пробой ДНК в изопропиловом спирте закрывали и оставляли на ночь при -20°С для оседания небольших фрагментов ДНК.
3 день. Пробирки с ДНК и изопропиловым спиртом центрифугировали при 4 тыс. оборотов в течение 5 минут для осаждения ДНК, спирт аккуратно сливали.
К осадку аккуратно добавляли 3 мл 75% этилового спирта, центрифугировали при 5 тыс.оборотов в течение 10 минут, спирт аккуратно сливали.
К осадку добавляли 3 мл 96% этилового спирта и вновь центрифугировали, спирт аккуратно сливали, остатки удаляли фильтровальной бумагой и подсушивали ДНК при 37°С до полного удаления спирта.
Растворяли осадок в би-дистиллированной воде до концентрации ДНК около 1 мг/мл и хранили до проведения ПЦР при -20°С.
Генотипирование полиморфизма Arg399Gln гена XRCC1
Анализ генотипа пациента по полиморфизму Arg399Gln гена XRCC1 включал несколько описанных ниже этапов.
1) Постановка (ПЦР). Состав реакционной смеси на 1 пробу ДНК для проведения ПЦР указан в табл.1. В примечании к табл.1 указаны использовавшиеся праймеры. Данные праймеры обеспечивают амплификацию фрагмента гена XRCC1 в 19q13.2 хромосоме от 23614 п.н. до 24228 п.н. размером 615 п.н., содержащего 399 кодон.
Программа температурно-временных циклов ПЦР (автоматический термоциклер «Eppendorf»):
- предварительная денатурация - 94°С, 3 мин;
| Таблица 1 | |
| Состав реакционной смеси на 1 пробу для ПЦР | |
| Реактив | Объем, мкл |
| Буфер ×10(100 mM трис-HCl, pH 8,3, 500 mM KCl, 25 mM MgCl2) | 1,5 |
| Смесь дезоксинуклеотидтрифосфатов (dNTPS) (концентрация каждого в смеси 2 мМ) | 1,5 |
| Праймер прямой (F, I)* (в разведении до 0,25 мкМ) | 1,5 |
| Праймер обратный (R, II)** (в разведении до 0,25 мкМ) | 1,5 |
| Tag-полимераза (в реакцию 1 ЕА) «Сибэнзим», г.Новосибирск | 1,0 |
| Вода | 7,0 |
| ДНК-проба в разведении 1 мг/мл | 1,0 |
| Примечание: *Прямой праймер: 5'-TTGTGCTTTCTCTGTGTCCA. | |
| **Обратный праймер: 5'-TCCTCCAGCCTTTTCTGATA |
- далее 30 циклов: денатурация - 94°С, 30 сек; отжиг праймеров - 55°С, 60 сек; элонгация - 72°С, 60 сек;
- постэлонгация - 72°С 3 мин.
2) Электрофоретический анализ результатов ПЦР в 1,5% агарозном геле. На гель наносится по 5 мкл амплификата проб нескольких пациентов. Используется ДНК-маркер молекулярных весов 100 п.н. в количестве 0,8 мкл. Маркер представляет собой смесь фрагментов ДНК последовательно возрастающей длины, отличающихся друг от друга на 100 п.н. Как видно из фиг.1, в результате ПЦР получили фрагменты гена XRCC1 размером 615 п.н.
3) Постановка гидролиза полученных ампликонов с использованием эндонуклеазы рестрикции MspI. Состав реакционной смеси на 1 пробу ДНК для гидролиза приведен в табл.2. Гидролиз проводился в течение 3-х часов при 37°С.
4) Электрофоретический анализ результатов MspI-гидролиза в 1,5% агарозном геле. На гель наносится по 10 мкл рестрикта каждого пациента и ДНК-маркер молекулярных весов 100 п.н. (в количестве 1,5 мкл). Варианты распределения полос на электрофореграмме приведены на фиг.2. Отсутствие гидролиза (наличие одной полосы размером 615 п.н. на дорожках под номером 1) свидетельствует о гомозиготном минорном генотипе (Gln/Gln) данных пациентов. Полный гидролиз (наличие двух полос размером 376 п.н. и 239 п.н. на дорожке под номером 3) свидетельствует о гомозиготном диком генотипе (Arg/Arg) данного пациента. Частичный гидролиз (наличие трех полос размером 615 п.н., 376 п.н. и 239 п.н. на дорожках под номером 2) свидетельствует о гетерозиготности (генотип Arg/Gln) данных пациентов по полиморфизму Arg399Gln гена XRCC1.
Статистические методы исследования
Анализ генетических полиморфизмов начинался с выявления частоты встречаемости каждого из аллелей и генотипов. Для изученного полиморфизма в выборке популяционного контроля и пациентов с лимфомами распределение генотипов соответствовало ожидаемому при равновесии Харди-Вайнберга, которое можно записать в виде формулы: p2AA+2pqAa+q2aa=1.
При сравнении частот аллелей и генотипов, а также для сравнения наблюдаемых и ожидаемых частот использовался стандартный критерий χ2 Пирсона. В случае если абсолютные частоты более 20% признаков в группе не превышали 5, использовали точный критерий Фишера.
Для оценки связи между определенными генотипами и риском развития заболевания было рассчитано отношение шансов OR (odd ratio). Отношение шансов указано с 95% доверительным интервалом (ДИ). Если верхнее и нижнее значение ДИ были больше единицы, то риск развития заболевания считался достоверно выше в группе с изучаемым изменением генотипа в сравнении с популяцией (Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. - М., МедиаСфера. - 2003. - 312 с.).
Результаты исследования
Как указывалось выше, полиморфизм гена репарации ДНК XRCC1 был исследован у 98 пациентов с НХЛ и 180 практически здоровых человек популяционной (контрольной) выборки г.Новосибирска и Новосибирской области (Belyavskaya V.A., Smetannikova N.A., Maksimov V.N. et. al. Polymorphism in XRCC1 DNA basic exision repair gene and some functionale related genes: Assosiation with longelity and cancer risk among the population of the Novosibirsk region. // Материалы международной конференции по химической биологии, 2-7 июня, Новосибирск, 2005 г., стр.49).
Из 196 генов XRCC1, принадлежащих 98 обследованным пациентам с НХЛ, Gln-аллель несли 100 генов (51%). В контрольной выборке из 360 генов (180 человек) Gln-аллель несли 144 гена (40%) (фиг.3). Частота встречаемости Gln-аллеля в группе пациентов с НХЛ является достоверно более высокой, чем частота его встречаемости в контрольной группе (р=0,012).
Частота Arg-аллеля в группе больных НХЛ и в контрольной группе составила 49% (96/196) и 60% (216/360) соответственно. Частота встречаемости Arg-аллеля в группе больных НХЛ является достоверно более низкой, чем частота его встречаемости в контрольной группе (р=0,012) (фиг.3).
Гомозиготный генотип Gln/Gln был обнаружен у 25% больных НХЛ (у 25 человек из 98), в контрольной группе он встретился у 13% обследованных (у 24 человек из 180), т.е. частота встречаемости гомозиготного генотипа Gln/Gln в группе больных с лимфомами является достоверно (р=0,016) более высокой, чем частота его встречаемости в контрольной группе (табл.3, фиг.3).
Гомозиготный генотип Arg/Arg найден у 22% больных (22/98) и у 34% здоровых обследованных (60/180). Частота встречаемости гомозиготного генотипа Arg/Arg в группе больных с лимфомами является достоверно (р=0,037) более низкой, чем частота его встречаемости в контрольной группе (табл.3, фиг.3).
Генотип Arg/Gln встречался в 53% случаев в контрольной группе и в 52% - в группе больных НХЛ (96/180 и 51/98 соответственно).
Для оценки связи между генотипами и риском развития НХЛ было рассчитано отношение шансов OR с 95% ДИ (табл.3). Согласно полученным данным риск развития НХЛ у лиц, имеющих гомозиготный Gln/Gln генотип, достоверно превышал популяционный в 1,9 раза (OR=1.9). При этом максимально риск развития НХЛ у лиц с генотипом Gln/Gln превышал популяционный в 3,6 раза, а минимально в 1,04 раза (95% ДИ [1,04; 3,6]). Генотипы Arg/Arg и Arg/Gln риск развития НХЛ достоверно не изменяли.
Неходжкинские лимфомы представляют собой гетерогенную группу заболеваний, поэтому был проведен сравнительный анализ частоты полиморфизма гена XRCC1 в группах пациентов с индолентными, агрессивными вариантами заболевания и в контрольной выборке.
| Таблица 2 | |||
| Состав реакционной смеси на 1 пробу ДНК для гидролиза | |||
| Реактив | Объем, мкл | ||
| 1 | 2 | 3 | |
| Буфер для эндонуклеазы рестрикции MspI B* | 2,0 | 2,0 | 2,0 |
| Эндонуклеза рестрикции MspI** (в реакцию 2 ЕА) | 0,1 | 0,1 | 0,1 |
| Вода | 15,9 | 12,9 | 7,9 |
| Ампликон | 2,0 | 5,0 | 10,0 |
| Примечание: *в состав входят 10 мМ трис HCl pH 7.6 при 25°С, 10 мМ MgCl, 1 mM DTT. | |||
| **«Сибэнзим», г.Новосибирск. |
| Таблица 3 | |||||
| Связь между генотипом Arg399Gln гена XRCC1 и риском развития НХЛ | |||||
| Генотип Arg399Gln XRCC1 | Контроль (n*=180)1 | Группа больных НХЛ (n*=98)2 | OR[95% ДИ] | ||
| Абс. кол-во | % | Абс. кол-во | % | ||
| Arg/Arg | 60 | 34 | 22 | 22P1-2<0,05 | 0,58[0,33; 1,02] |
| Arg/Gln | 96 | 53 | 51 | 52 | 0,95[0,58; 1,55] |
| Gln/Gln | 24 | 13 | 25 | 26P1-2<0,05 | 1.9[1.04; 3.6] |
| Примечание: *буквой n отмечено количество человек в группе. |
Частота встречаемости Gln-аллеля в группе пациентов с агрессивными лимфомами (42 пациента) составила 55% (47 аллелей из 84), в контрольной выборке - 40% (144/360), в группе больных индолентными лимфомами (56 человек) - 47% (53/112). Частота встречаемости Arg-аллеля в группе пациентов с агрессивными лимфомами составила 45% (37/84), в контрольной выборке - 60% (216/360), группе больных индолентными лимфомами - 53% (59/112).
Различия в частотах встречаемости минорного (Gln) и дикого (Arg) аллелей гена XRCC1 в группе больных индолентными лимфомами в сравнении с группой больных с агрессивными лимфомами, а также в сравнении с контрольной группой не являются достоверными (р>0,05). В то же время частота встречаемости минорного аллеля в группе больных агрессивными лимфомами является достоверно (р=0,005) более высокой по сравнению с частотой его встречаемости в контрольной группе. Частота встречаемости дикого аллеля в группе больных с агрессивными лимфомами оказалась достоверно (р=0,005) более низкой по сравнению с частотой его встречаемости в контрольной группе (фиг.4).
Частота встречаемости гомозиготного минорного генотипа (Gln/Gln) в группе больных агрессивными лимфомами составила 28% (12/42), в группе больных индолентными лимфомами - 21% (12/56), а в контрольной группе - 13% (у 24 человек из 180) (табл.4, фиг.4).
Частота встречаемости гомозиготного минорного генотипа была достоверно выше в группе больных агрессивными лимфомами по сравнению с частотой его встречаемости в контрольной группе (р=0,021), но не отличалась достоверно от частоты встречаемости данного генотипа в группе больных индолентными лимфомами.
Частота встречаемости нормального гомозиготного генотипа (Arg/Arg) в группе больных агрессивными лимфомами составила 17% (7 человек из 42), в группе больных индолентными лимфомами - 27% (15/56), а в контрольной группе - 34% (60/180) (табл.4).
Частота встречаемости нормального гомозиготного генотипа была достоверно ниже в группе больных агрессивными лимфомами по сравнению с частотой его встречаемости в контрольной группе (р=0,019), но не отличалась достоверно от частоты встречаемости данного генотипа в группе больных индолентными лимфомами (фиг.4).
Частота встречаемости гетерозиготного генотипа Arg/Gln составила 55% (23/42) в группе больных агрессивными лимфомами, 52% (29/56) в группе больных индолентными лимфомами и 53% (96/180) в контрольной группе (табл.4).
Различия в частоте встречаемости гетерозиготных генотипов в группах больных агрессивными и индолентными лимфомами и в контрольной группе не являются достоверными (p>0,05).
Было рассчитано отношение шансов OR с 95% доверительным интервалом (ДИ) (табл.4). У лиц, имеющих Gln/Gln генотип, риск развития агрессивных НХЛ превышал среднепопуляционный в 2,3 раза [1,04; 5,0]. У лиц, имеющих Arg/Arg генотип, риск развития агрессивных НХЛ был достоверно ниже, чем среднепопуляционный. Не отмечено связи между генотипом Arg/Gln и риском развития агрессивных лимфом, а также риском развития индолентных лимфом.
Таким образом, обнаруженные ранее различия в распределении генотипов и аллелей 399-го кодона гена репарации ДНК XRCC1 между больными лимфомами и популяционным контролем были обусловлены, в основном, пациентами с агрессивными НХЛ.
В связи с тем что как агрессивные, так и индолентные НХЛ включают в себя множество морфологических форм, были проанализированы частоты аллелей и генотипов изучаемого полиморфизма гена XRCC1 при наиболее часто встречающихся вариантах заболевания: диффузной В-крупноклеточной лимфоме (ДВККЛ, n=14) и диффузной В-мелкоклеточной лимфоме (ДВМКЛ, n=19).
Частота встречаемости Gln-аллеля гена XRCC1 в группе пациентов с диффузной В-крупноклеточной лимфомой составила 68% (19/28) и была достоверно выше, чем в контрольной выборке - 40% (144/360) (р=0,004) и группе больных диффузной В-мелкоклеточной лимфомой - 37% (14/38) (р=0,012).
Частота встречаемости Arg-аллеля у пациентов с ДВККЛ составила 32% (9/28) и была достоверно ниже (р=0,004), чем в контрольной выборке, где она составила 60% (216/360) и достоверно ниже (р=0,012), чем у пациентов с ДВМКЛ, где она была равна 63% (24/38) (фиг.5).
Частота встречаемости генотипа Gln/Gln в группе больных ДВККЛ составила 43% (6/14), что достоверно превышало (в 3,5 раза) частоту его встречаемости в контрольной группе (р=0,008)(табл.5), а также в группе ДВМКЛ, где она составляла 10,5% (2/19) (р=0,032).
Частота встречаемости дикого генотипа Arg/Arg среди пациентов с ДВККЛ составила 7% (1/14) и была достоверно (р=0,033) ниже (в 6 раз), чем в контрольной выборке, где она была равна 34% (60/180) (табл.5) и достоверно (р=0,049) ниже, чем у больных ДВМКЛ, где она составила 37% (7/19).
Частота встречаемости гетерозиготного генотипа в группе больных с ДВККЛ составила 50% (7/14), в группе больных ДВМКЛ - 52% (10/19), в контрольной группе 53% (96/180), т.е. достоверных различий по частоте гетерозиготного генотипа между группами больных с ДВМКЛ, с ДВМКЛ и здоровыми людьми не было (p>0,05) (фиг.5)
Распределение аллелей и генотипов Arg399Gln гена XRCCl у пациентов с ДВМКЛ в целом соответствовало популяционному.
Таким образом, при оценке связи между генотипами полиморфизма Arg399Gln XRCC1 и риском развития ДВККЛ было выявлено, что у лиц с генотипом Gln/Gln в 4.2 раза [1,4:14,9] повышен риск развития ДВККЛ по сравнению с контрольной группой (табл.5). Генотипы Arg/Arg и Arg/Gln риск развития ДВККЛ по отношению к популяционному достоверно не изменяли.
| Таблица 4 | |||||||
| Связь между генотипом Arg399Gln гена XRCC1 и риском развития агрессивных и индолентных лимфом | |||||||
| Генотип Arg399Gln XRCC1 | Контроль (n=*180)1 | Больные агрессивными лимфомами (n*=42)2 | Больные индолентными лимфомами (n*=56)3 | OR 1-2 [95% ДИ] | |||
| Абс. | % | Абс. | % | Абс. | % | ||
| Arg/Arg | 60 | 34 | 7 | 17P1-2<0,05 | 15 | 27 | 0,4[0,17; 0,95] |
| Arg/Gln | 96 | 53 | 23 | 55 | 29 | 52 | 1,06[0,54; 2,08] |
| Gln/Gln | 24 | 13 | 12 | 28P1-2<0,05 | 12 | 21 | 2 3[1,04; 5,0] |
| Примечание: * буквой n отмечено количество человек в группе. |
| Таблица 5Связь между генотипом Arg399Gln гена XRCC1 и риском развития ДВККЛ | |||||
| Генотип Arg399Gln XRCC1 | Контроль (n*=180)1 | Больные ДВККЛ (n*=14)2 | OR[95% ДИ] | ||
| Абс. | % | Абс. | % | ||
| Arg/Arg | 60 | 34 | 1 | 7P1-2<0,05 | 0,15[0,02; 1,2] |
| Arg/GIn | 96 | 53 | 7 | 50 | 0,88[0,29; 2,6] |
| Gln/Gln | 24 | 13 | 6 | 43P1-2<0,01 | 4.2[1,4; 12,9] |
| Примечание: * буквой n отмечено количество человек в группе. |
Способ определения предрасположенности человека к развитию лимфом, включающий анализ генотипа пациента, отличающийся тем, что определяют предрасположенность к развитию агрессивных неходжкинских лимфом, исследуют генотип 399-го кодона гена XRCC1 и при обнаружении у обследуемого генотипа Gln/Gln делают вывод о предрасположенности его к развитию агрессивных неходжкинских лимфом, в частности к развитию диффузной В-крупноклеточной лимфомы, тогда как при обнаружении у обследуемого генотипа Arg/Arg делают вывод о сниженном по отношению к популяционному риске развития агрессивных вариантов НХЛ у данного обследуемого.