Тиенопиридон карбоксамиды и их применение в медицине
Иллюстрации
Показать всеИзобретение относится к соединению формулы (I)
где R выбран из этила, н-пропила, изо-пропила, н-бутила и аллила; R' выбран из водорода, неразветвленного, разветвленного или циклического С1-С4алкила; неразветвленного, разветвленного или циклического C1-С3алкокси; фтора, хлора, брома, трифторометила и OCHxFy, где x=0, 1, 2, y=1, 2, 3 при условии, что х+у=3; R'' выбран из водорода, фтора и хлора, с условием, что R'' выбран из фтора и хлора только, когда R' выбран из фтора и хлора; R3 выбран из водорода и неразветвленного, разветвленного или циклического C1-C5алкила; R4 выбран из водорода, CH2OCOC(СН3)3, фармацевтически приемлемых неорганических или органических катионов, и COR4', где R' - неразветвленный, разветвленный или циклический C1-С5алкил, фенил, бензил и фенэтил; R7 выбран из метила и этила; один из А и В является серой, а другой - C-R2; когда А означает S, R2 выбран из водорода и метила, с условием что R2 означает метил только, когда R3 не является водородом; и когда В означает S, R2 является водородом; и к их любому таутомеру, а также к фармацевтической композиции, включающей соединение формулы (I), к способу получения этих соединений и способу лечения заболеваний, являющихся результатом аутоиммуного ответа или патологического воспаления. Технический результат: получены и описаны новые соединения, которые могут найти свое применение в лечении заболеваний, являющихся результатом аутоиммуного ответа или патологического воспаления. 4 н. и 31 з.п. ф-лы, 2 табл.
Реферат
Область техники, к которой относится изобретения
Настоящее изобретение относится к замещенным производным тиено[2,3-b]пиридин-5-карбоксамида и 2-тиа-4-аза-инден-6-карбоксамида, к способам их приготовления, к композициям, включающим их, и к способам и применению для клинического лечения заболеваний, причиной которых является возникновение аутоиммунного ответа и патологическое воспаление, а также злокачественных опухолей. Примерами таких аутоиммунных заболеваний являются рассеянный склероз (MS), инсулинзависимый сахарный диабет (LDDM), системная красная волчанка (SLE), ревматоидный артрит (RA), воспалительная болезнь кишечника (IBD) и псориаз. Другими заболеваниями, где воспаление играет основную роль, являются такие заболевания как астма, атеросклероз, инсульт и болезнь Альцгеймера. Кроме того, соединения настоящего изобретения особенно хорошо подавляют развитие твердых опухолей, включая, например, рак груди, рак толстой кишки, саркому Капоши, рак легких, рак яичника, рак простаты и рак кожи. Более конкретно, настоящее изобретение относится к производным тиено[2,3-b]пиридин-5-карбоксамида.
Уровень техники
Аутоиммунные заболевания, например, MS, LDDM, SLE, RA, IBD и псориаз представляют собой атаки иммунной системы организма, которые могут быть по природе системными или направленными на индивидуальные органы организма. Они, по-видимому, являются заболеваниями, при которых иммунная система делает ошибки, и вместо обеспечения защитных функций, становится агрессором (1).
MS представляет собой наиболее распространенное приобретенное нейрологическое заболевание среди молодых взрослых людей Западной Европы и Северной Америки. Он является причиной большего количества случаев, приводящих к нетрудоспособности и финансовым потерям (как за счет недополученных доходов, так и затрат в области медицинского обеспечения), чем любое другое нейрологическое заболевание этой возрастной группы. Общее количество случаев MS составляет примерно 1000000 в Соединенных Штатах и Европе.
Хотя причина возникновения MS неизвестна, успехи в визуализации мозга, иммунологии и молекулярной биологии улучшили понимание исследователями этой болезни. В настоящее время для лечения MS применяется несколько видов терапии, однако ни один из них не обеспечивает значительной эффективности лечения. Современные способы лечения MS попадают в три категории: лечение обострения, модуляция прогресса заболевания и терапия специфических симптомов.
MS влияет на центральную нервную систему и приводит к процессу димиелинизации, то есть к потере миелиновых оболочек нейрона, в то время как аксоны сохраняются. Миелин является изолирующим материалом нейрона, который делает возможным быстрое проведение нервного импульса. Очевидно, что при демиелинизации это свойство теряется. Хотя патогенные механизмы, ответственные за MS, остаются неясными, несколько линий доказательств свидетельствуют, что демиелинизация имеет иммунопатологическую основу. Патологические повреждения, пятна, характеризуются инфильтрацией иммунологически активных клеток, таких как макрофаги и активированные Т-клетки (2).
В патенте США 5219864 некоторые производные тиено[2,3-b]пиридина и таено[3,2-b]пиридина, представленные формулой (А)
где Z представлен пиридилом, заявляются как иммунорегуляторы и средства для профилактики и лечения остеопороза.
В WO 94/29295 раскрываются соединения общей формулы (В)
где Y среди других представляет
то есть производные тиено[3,2-b]пиридина, а N представляет собой бициклическую гетероциклическую группу, включающую, по меньшей мере, один атом азота, R5 представляет собой низший алкил и R6 - гидрокси, и которые обладают иммуномодулирующей активностью, противовоспалительной активностью и противораковой активностью.
Раскрытие изобретения
Первичная цель настоящего изобретения - обеспечить новые производные тиено[2,3-b]пиридин-5-карбоксамида и 2-тиа-4-аза-инден-6-карбоксамида, которые благодаря преимуществам их фармакологического профиля, высокой эффективности действия на экспериментальных моделях и низкого уровня побочных эффектов рассматриваются как ценные в лечении заболеваний, возникающих вследствие аутоиммунного ответа и патологического воспаления, а также злокачественных опухолей. Настоящее изобретение относится к новым замещенным производным тиено[2,3-b]пиридин-5-карбоксамида и 2-тиа-4-аза-инден-6-карбоксамида, к способам их получения, к композициям, включающим их, и к способам и применению для клинического лечения заболеваний, возникающих вследствие аутоиммунного ответа и патологического воспаления, а также злокачественных опухолей. Примерами таких аутоиммунных заболеваний является MS, IDDM, SLE, RA, IBD и псориаз, а также другие заболевания, где воспаление играет основную роль: астма, атеросклероз, инсульт и болезнь Альцгеймера.
Типы твердых опухолей, которые особенно хорошо подавляются соединениями настоящего изобретения, включают, например, рак груди, рак толстой кишки, саркому Капоши, рак легких, рак яичника, рак простаты и рак кожи. Подходом, который выбрали авторы изобретения, является ингибирование индуцированного опухолью ангиогенеза и стимуляция иммунной системы хозяина для индукции/усиления противоопухолевого ответа.
Более конкретно, настоящее изобретение относится к новым производным тиено[2,3-b]пиридин-5-карбоксамида и 2-тиа-4-аза-инден-6-карбоксамида.
Термин «лечение», как он применяется здесь, включает профилактику, облегчение симптомов заболевания, а также исцеление от заболевания.
Неожиданно было обнаружено, что соединения общей формулы (I)
где
R выбран из метила, этила, н-пропила, изо-пропила, н-бутила и аллила;
R' выбран из водорода, неразветвленного, разветвленного или циклического C1-C4алкила, предпочтительно неразветвленного, разветвленного или циклического C1-С3алкила; неразветвленного, разветвленного или циклического C1-С3алкокси; фтора, хлора, брома, трифторометила и OCHxFy,
где х=0, 1, 2,
y=1, 2, 3 при условии, что
х+y=3;
R'' выбран из водорода, фтора и хлора, при условии, что R'' выбран из фтора и хлора, только когда R' выбран из фтора и хлора;
R3 выбран из водорода и неразветвленного, разветвленного или циклического C1-C5алкила, более предпочтительно из неразветвленного, разветвленного или циклического C1-C4алкила;
R4 выбран из водорода, CH2OCOC(СН3)3, фармацевтически приемлемых неорганических катионов, таких как литий, натрий, калий, магний, кальций, медь (II), цинк, алюминий
и железо (III); органических катионов, таких как моноэтаноламин и диэтаноламин; и COR4', где R4' выбран из неразветвленного или разветвленного C1-C5алкила, фенила, бензила, фенэтила и подобного;
R7 выбран из метила и этила;
один из А и В - это сера, а другой - это C-R2;
если А - является S, R2 выбран из водорода и метила, при условии что R2 представляет собой только метил,
если R3 не является водородом; и
когда В представляет собой S, R2 - не является водородом;
и их любой таутомер,
являются неожиданно эффективными в лечении индивидуумов, страдающих от аутоиммунных и воспалительных заболеваний и злокачественных опухолей.
В приведенной выше формуле (I), если А представляет собой серу, кольцо
имеет следующий вид
то есть соединение является производным тиено[2,3-b]пиридина; а если В означает серу, кольцо
имеет следующий вид
(R2 - это водород), то есть соединение является производным 2-тиа-4-аза-индена.
Соединения общей формулы (I) могут существовать в различных таутомерных формах, и все эти формы включены в изобретение.
В предпочтительном воплощении изобретения
А означает серу,
R выбран из метила и этила,
R' выбран из пара-метокси, пара-фтор, пора-хлор, пара-трифторметил и пара-трифторметокси, когда R'' означает водород,
R'' - это opтo-фтор, при условии что R' означает пара- или мета'-фтор,
R2 означает водород,
R3 выбран из метила, этила и изо-пропила, и
R7 означает метил.
В другом предпочтительном воплощении изобретения
В означает сера,
R выбран из метила и этила,
R' выбран из пара-метокси, пара-фтор, пара-хлор, пара-трифторметила и пара-трифторметокси, когда R'' означает водород,
R'' означает орто-фтор при условии, что R' означает пара- или мета'-фтор,
R3 выбран из метила, этила и изо-пропила, и
R7 означает метил.
Предпочтительными воплощениями изобретения являются соединения, представленные формулой (1а) в таблице 1.
| Таблица 1. | ||||||
| Соединение | R2 | R3 | R7 | R | R' | R'' |
| №1 | Н | СН3 | СН3 | СН3 | Н | Н |
| №2 | Н | СН3 | СН3 | C2H5 | Н | Н |
| №3 | Н | С2Н5 | СН3 | СН3 | Н | Н |
| №4 | Н | изо-С3Н7 | СН3 | СН3 | Н | Н |
| №5 | Н | СН3 | СН3 | СН3 | пара-СН3 | Н |
| №6 | Н | СН3 | СН3 | СН3 | пара-ОСН3 | Н |
| №7 | Н | СН3 | СН3 | СН3 | пара-Cl | Н |
| №8 | Н | СН3 | СН3 | СН3 | пара-F | o-F |
| №9 | Н | СН3 | СН3 | СН3 | пара-OCF3 | Н |
Другим предпочтительным воплощением изобретения является соединение (Ib)
где R3 и R7 - это метил, R - это метил или этил, и R' и R'' - это водород. В предпочтительном соединении (соединение №10), R является метилом.
Для нескольких спонтанно возникающих аутоиммунных заболеваний человека имеются экспериментальные модели, которые спонтанно возникают у определенных линий лабораторных животных или могут быть вызваны у лабораторных животных путем иммунизации специфическим(и) антигеном(ами) из органа-мишени.
Экспериментальный аутоиммунный энцефаломиелит (ЕАЕ) как модель аутоиммунных воспалительных заболеваний центральной нервной системы (CNS) был наиболее широко распространенной моделью заболевания человека MS.
Аутоиммунный ответ по отношению к коллагену типа II может быть вызван экспериментально у определенных линий мышей или крыс и может привести к развитию полиартрита. Индуцированный коллагеном артрит имеет несколько общих особенностей с заболеванием человека RA.
Соединения общей формулы (I), а также соединения из уровня техники/соединения сравнения были исследованы на ингибирование острого ЕАЕ у мышей. При сравнении контрольных производных тиено [3,2-b]пиридин-6-карбоксамида с соответствующими производными тиено[2,3-b]пиридин-5-карбоксамида и 2-тиа-4-аза-инден-6-карбоксамида настоящего изобретения были получены удивительные и неожиданные результаты. Производные тиено[2,3-b]пиридин-5-карбоксамида и 2-тиа-4-аза-инден-6-карбоксамида изобретения совершенно ясно являются лучшими. В отличие от соединений изобретения, например, 6,7-дигидро-N,7-диметил-4-гидрокси-N-фенил-6-оксо-тиено[2,3-b]пиридин-5-карбоксамида и 4,5-дигидро-N,4-диметид-7-гидрокси-N-фенил-5-оксо-2-тиа-4-аза-инден-6-карбоксамида, соединение сравнения 4,5-дигидро-N,4-диметил-7-гидрокси-N-фенил-5-оксо-тиено[3,2-b]пиридин-6-карбоксамид является неактивным в модели острого ЕАЕ. Подобным образом замена N-фенильной группы на N-пиридильную в карбоксамидной части приводит к лучшей активности. Отсюда, соединение сравнения 6,7-дигидро-4-гидрокси-N-(3-пиридил)-N,3,7-триметил-6-оксо-тиено [2,3-b] пиридин-5-карбоксамид проявляет меньшую активность в сравнении с соединением изобретения 6,7-дигидро-4-гидрокси-N-фенил-N,3,7-триметил-6-оксо-тиено[2,3-b]пиридин-5-карбоксамидом. Соединение 6,7-дигидро-4-гидрокси-N-(3-пиридил)-6-оксо-тиено[2,3-b]пиридин-5-карбоксамид, раскрытое в патенте США 5219864, является неактивным.
Все воплощения изобретения, как раскрыто в формуле изобретения, включены, таким образом, в описание.
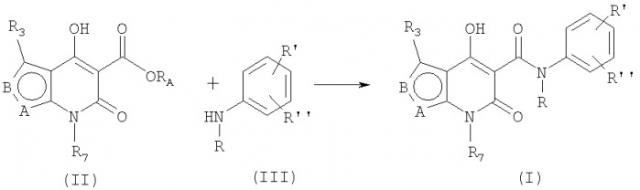
Соединения общей формулы (I) могут быть получены способами, описанными в литературе, а также следующими способами:
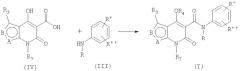
Способ А:
Соединения общей формулы (I) могут быть приготовлены известными способами, и, например, как показано выше, реакцией производного эфира карбоновой кислоты (II; RA - алкильная группа из 1-4 атомов углерода) с анилином в подходящем растворителе, например, в алифатическом углеводороде, таком как гептан, октан и подобное, или в ароматическом углеводороде, таком как толуол, ксилол и подобное. Основные способы приготовления производных эфира карбоновой кислоты формулы (II) описаны ниже, начиная с 2-аминотиофен-3-карбоксилата или 4-аминотиофен-3-карбоксилата. Аминотиофен-3-карбоксилаты доступны коммерчески или известны из литературы (3, 4, 5, 6, 7). N-алкилированные анилины формулы (III) доступны коммерчески или известны из литературы (8). Новые аминотиофен-3-карбоксилаты и N-алкилированные анилины формулы (III) могут быть приготовлены способами, которые в основном аналогичны тем, что приведены в литературе. Способ В:
Соединения формулы (I) также могут быть получены реакцией соединения формулы (IV) с анилином формулы (III). Могут быть применены различные сопрягающие реагенты, известные специалистам, например, карбодиимиды, известные из патента США 4547511. В одном из подходящих способов сопряжения применяется тионилхлорид в присутствии триэтиламина и приемлемый растворитель, такой как дихлорометан. Этот способ может быть применен в отдельных случаях, когда прямое сопряжение между эфиром и анилином не дает результатов, например, когда анилин включает электроноакцепторные заместители. Производные карбоновой кислоты формулы (IV) могут быть получены из соответствующих эфиров формулы (II) за счет кислотного расщепления, как описано ниже.
Следующие примеры предназначены для иллюстрации изобретения без ограничения его рамок.
Пример 1.
Этиловый эфир 6,7-Дигидро-3,7-диметил-4-гидрокси-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты (Интермедиат)
Этил-2-амино-4-метилтиофен-3-карбоксилат (27,0 ммоль, 5,0 г) нагревали в диэтилмалонате (25 мл) при 180°С в течение 3 ч и образовавшемуся этанолу позволяли перегоняться. Температура масляной бани была понижена, и диэтилмалонат был дистиллирован при пониженном давлении с получением промежуточного продукта, малонового амида, сложного этилового эфира 2-(2-этоксикарбонилацетиламино)-4-метилтиофен-3-карбоновой кислоты в виде масла, которое медленно кристаллизовалось при стоянии (7,7 г, 95%). Малоновый амид растворяли в N,N-диметилацетамиде (DMA, 40 мл), после чего был добавлен гидрид натрия (NaH 80%, 2,0 экв., 54 ммоль, 1,62 г). Смесь нагревали при 60°С в течение 1 ч. После охлаждения и добавления воды (300 мл) продукт был осажден добавлением концентрированной соляной кислоты (HCl) до рН 1,5. Осадок собирали фильтрацией и перекристаллизовали из метилизобутилкетона, получая сложный этиловый эфир 6,7-дигидро-4-гидрокси-3-метил-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты (3,8 г, 56%). Этиловый эфир карбоновой кислоты (11,9 ммоль, 3,02 г) растворяли в DMA (40 мл) и добавляли NaH (2,1 экв., 25 ммоль, 750 мг). Смесь нагревали до 40°С в течение 10 мин. После этого ее охлаждали до 10°С и добавляли диметилсульфат (1,2 экв., 14,3 ммоль, 1,37 мл). Смесь перемешивали при комнатной температуре в течение 1 ч и затем охлаждали на ледяной бане. Затем добавляли воду (200 мл), и смесь подкисляли 5 М HCl до рН 1,5. Собирали осадок и перекристаллизовали его из смеси толуол/гептан, получая соединение, указанное в заголовке (2,4 г, 75%).
1H ЯМР (CDCl3): σ 1,45 (3H, t), 2,48 (3H, d), 3,55 (3H, s), 4,45 (2H, q), 6,46 (1H, q, уш.), 14,22 (1H, s).
По сути тем же способом были получены следующие соединения из соответствующих исходных материалов:
метиловый эфир 6,7-дигидро-4-гидрокси-2,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты;
метиловый эфир 6,7-дигидро-3-этил-4-гидрокси-7-метил-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты;
метиловый эфир 6,7-дигидро-4-гидрокси-3-изопропил-7-метил-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты;
метиловый эфир 6,7-дигидро-4-гидрокси-7-метил-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты;
метиловый эфир 6,7-дигидро-2,7-диметил-4-гидрокси-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты;
этиловый эфир 6,7-дигидро-3-(4-фторофенил)-4-гирокси-7-метил-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты; и
метиловый эфир 4,5-дигидро-7-гидрокси-4-метил-5-оксо-2-тиа-4-азаинден-6-карбоновой кислоты.
Пример 2.
Этиловый эфир 4,5-дигидро-1,4-диметил-7-гидрокси-5-оксо-2-тиа-4-аза-инден-6-карбоновой кислоты (Интермедиат).
Этил-4-амино-2-метилтиофен-3-карбоксилат (12,8 ммоль, 2,37 г) растворяли в 1,4-диоксане (20 мл), после чего добавляли этилмалонил хлорид (90%) (19,2 ммоль, 2,73 мл). Реакционную смесь нагревали при 50°С в течение 1 ч, затем ей позволяли остыть до температуры окружающей среды. Реакционную смесь помещали в лед (60 г), и продукт получали путем фильтрации, промывали водой и сушили (3,32 г, 87%). Малоновый амид растворяли в N,N-диметилацетамиде (DMA, 35 мл) и добавляли гидрид натрия (NaH 60%, 2,0 экв., 22,1 ммоль). Реакционную смесь нагревали при 60°С в течение 1 ч. После охлаждения и добавления воды (50 мл) продукт осаждали добавлением 1 М соляной кислоты (HCl, водн.) (30 мл). Осадок собирали фильтрованием и перекристаллизовали из этанола, получая этиловый эфир 4,5-дигидро-7-гидрокси-1-метил-5-оксо-2-тиа-4-азаинден-6-карбоновой кислоты (1,46 г, 52%). Этиловый эфир карбоновой кислоты растворяли в диметилформамиде (DMA, 40 мл) и NaH (3,0 экв., 17,3 ммоль, 692 мг). Реакционную смесь нагревали до 40°С в течение 15 мин, а затем охлаждали до 10°С. Добавляли иодометан (1,3 экв., 7,49 ммоль, 0,47 мл), затем реакционную смесь перемешивали при комнатной температуре в течение 2 ч и выливали в 0,5 М HCl (водн.) (50 мл). Осадок собирали фильтрацией и перекристаллизовали из этанола, а затем вновь из метилизобутилкетона, получая соединение, указанное в заголовке (524 мг, 89%).
1Н ЯМР (NaOD/D2O): σ 1,28 (3H, t), 2,79 (3H, s), 3,82 (3H, s), 4,30 (2H, q), 6,81 (1H, s).
По сути тем же способом были получены следующие соединения из соответствующих начальных материалов:
метиловый эфир 6,7-дигидро-3-этил-4-гидрокси-7-метил-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты;
метиловый эфир 6,7-дигидро-4-гидрокси-7-метил-3-трет-бутил-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты;
метиловый эфир 6,7-дигидро-4-гидрокси-3-изобутил-7-метил-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты;
метиловый эфир 6,7-дигидро-3-(2,2-диметилпропил)-4-гидрокси-7-метил-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты;
метиловый эфир 6,7-дигидро-3-(1-этилпропил)-4-гидрокси-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты;
метиловый эфир 3-циклогексил-6,7-дигидро-4-гирокси-7-метил-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты; и
метиловый эфир 4,5-дигидро-3,4-диметил-7-гидрокси-5-оксо-2-тиа-4-азаинден-6-карбоновой кислоты.
Пример 3.
Этиловый эфир 4,5-дигидро-7-гидрокси-4-метил-5-оксо-тиено[2,3-b]пиридино-5-карбоновой кислоты (Не в соответствии с изобретением)
Смесь метил-3-аминотиофен-2-карбоксилата (63 ммоль, 10,0 г) и этилхлороформиата (50 мл) была подвергнута дефлегмации в течение 2 ч и затем выпарена до полного высушивания. Осадок растворяли в этаноле (130 мл), после чего добавляли водный раствор гидроксида натрия (NaOH, 65 ммоль, 3,84 г). После перемешивания при комнатной температуре в течение 48 ч смесь подкисляли 1 М HCl и разводили водой. Осадок собирали, промывали водой, высушивали под вакуумом и перекристаллизовали из смеси толуол/гептан с получением 3-этоксикарбониламинотиофен-2-карбоновой кислоты (10,2 г, 73%). Эту кислоту (23,2 ммоль, 5,0 г) и трибромид фосфора (12 ммоль, 1,14 мл) растворяли в 1,4-диоксане (50 мл). Смесь перемешивали при 100°С в течение 2 ч и затем охлаждали до того, как концентрировали на роторном испарителе. Осадок, образованный при добавлении толуола, был отделен фильтрованием с получением 1Н-тиено-[3,2-b][1,3]оксазин-2,4-диона (3,96 г, 100%). Этот интермедиат (20,6 ммоль, 3,5 г) растворяли в DMA (40 мл) и охлаждали на ледяной бане. Затем добавляли NaH (22,7 ммоль, 780 мг) с последующим добавлением метилиодида (25 ммоль, 1,6 мл). Смесь перемешивали при комнатной температуре в течение ночи и затем добавляли диэтилмалонат (25 ммоль, 3,85 мл) и NaH (22,7 ммоль, 780 мг). После добавления смесь нагревали при 85°С в течение 2 ч и затем охлаждали. Добавляли воду, смесь закисляли 1 н HCl и экстрагировали хлороформом. Экстракт высушивали, концентрировали и хроматографировали (SiO2, хлороформ/метанол/уксусная кислота; 40/1/0,1) с получением соединения, указанного в заголовке примера (1,4 г, 26%).
1Н ЯМР (CDCl3): σ 1,45 (3H, t), 3,61 (3H, s), 4,45 (2H, q), 7,00 (3H, d), 7,76 (1H, d), 13,92 (1Н, s, уш.).
Пример 4.
6,7-Дигидро-3,7-диметил-4-гидрокси-6-оксотиено[2,3-b]пиридин-5-карбоновая кислота (Интермедиат)
Этиловый эфир 6,7-дигидро-3,7-диметил-4-гидрокси-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоты (5,72 ммоль, 1, 45 г) нагревали до 55°С в 33% смеси бромисто-водородной кислоты/уксусной кислоты (35 ммоль HBr, 6,0 мл). Через 2 ч смесь охлаждали и добавляли 2-пропанол (30 мл). Осадок собирали фильтрацией и сушили в вакууме с получением требуемого соединения (1,28 г, 93%).
1Н ЯМР (CDCl3): σ 2,53 (3H, d), 3,67 (3H, s), 6,63 (1H, q уш.), 14,48 (1H, s), 15,29 (1H, s).
По сути тем же способом были получены следующие соединения из соответствующих исходных материалов:
6,7-дигидро-2,7-диметил-4-гидрокси-6-оксотиено[2,3-b]пиридин-5-карбоновая кислота;
6,7-дигидро-4-гидрокси-2,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоновая кислота;
6,7-дигидро-2,7-диметил-3-этил-4-гидрокси-6-оксотиено[2,3-b]пиридин-5-карбоновая кислота;
4,5-дигидро-7-гидрокси-4-метил-5-оксо-2-тиа-4-азаинден-6-карбоновая кислота; и
4,5-дигидро-7-гидрокси-4-метил-5-оксотиено[3,2-b]пиридин-6-карбоновая кислота.
Пример 5.
6,7-Дигидро-4-гидрокси-N-(4-метоксифенил)-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид (Метод А)
Этиловый эфир 6,7-Дигидро-3,7-диметил-4-гидрокси-6-оксотиено[2,3-b]пиридино-5-карбоновой кислоты (3,74 ммоль, 1,0 г), N-метил-пара-анизидин (3 экв., 11,2 ммоль, 1,57 г) и н-октан (60 мл) нагревали до точки кипения под азотом на масляной бане. Летучим веществам (примерно 40 мл) было позволено дистиллироваться в течение 6 ч, и оставшийся н-октан удаляли на роторном испарителе. Остаток растворяли в хлороформе и промывали холодной 1 М серной кислотой. Органическую фазу экстрагировали 0,5 М NaOH, и рН в водной фазе был доведен приблизительно до 6,5. Мутный раствор фильтровали через силит. Далее добавляли метанол (соответственно до 10% от объема), и затем прозрачный раствор был подкислен 1 М HCl до рН 1,5. Полученный осадок был оставлен на ночь, собран фильтрованием и высушен под вакуумом с получением требуемого соединения (1,06 г, 79%).
1Н ЯМР (CDCl3): σ 2,51 (3H, d), 3,29 (3Н, s, уш.), 3,43 (3H, s), 3,78 (3H, s), 6,45 (1H, q уш.), 6,79 (2H, d уш.), 7,12 (2H, d уш.), 12,60 (1Н, s уш.).
По существу тем же способом были получены следующие соединения из соответствующих исходных материалов.
6,7-Дигидро-Н,7-диметил-4-гидрокси-N-фенил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 53%.
1Н ЯМР (CDCl3): σ 3,27 (3H, s уш.), 3,48 (3H, s), 6,88 (1H, d), 7,15-7,22 (3H, m), 7,27 (2Н, t уш.), 7,32 (2H, d), 12,50 (1H, s уш.).
6,7-Дигидро-N,7-диметил-3-этил-4-гидрокси-N-фенил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 86%.
1Н ЯМР (CDCl3): σ 1,31 (3H, t), 2,98 (2H, q), 3,26 (3H, s уш.), 3,48 (3H, s), 6,48 (1H, s), 7,14-7,30 (5H, m), 12,78 (1H, s).
6,7-Дигидро-N,7-диметил-4-гидрокси-3-изо-пропил-N-фенил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 66%.
1Н ЯМР (CDCl3): σ 1,28 (6Н, d), 3,24 (3Н, s уш.), 3,47 (3H, s), 3,57-3,68 (1H, m), 6,52 (1H, s), 7,12-7,20 (3H, m), 7,23-7,29 (2Н, m), 12,94 (1H s уш.).
6,7-Дигидро-N,7-диметил-4-гидрокси-3-изо-бутил-N-фенил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 76%.
1Н ЯМР (CDCl3): σ 0,97 (6H, d), 2,04 (1Н, m), 2,77 (2H, d), 3,28 (3H, s уш.), 3,50 (3H, s), 6,47 (1H, s), 7,17-7,32 (5H, m), 12,85 (1H, s).
6,7-Дигидро-N,7-диметил-4-гидрокси-N-фенил-3-трет-бутил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 83%.
1Н ЯМР (CDCl3): σ 1,47 (9H, s), 3,28 (3H, s), 3,49 (3H, s), 6,61 (1H, s), 7,15-7,32 (5H, m), 13,60 (1H, s).
6,7-Дигидро-N,7-диметил-3-(1-этилпропил)-4-гидрокси-N-фенил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход: 23%.
1Н NMR (CDCl3): σ 0,89 (6H, t), 1,69 (4H, m), 3,27 (3H, bs), 3,44 (1H, bs), 3,48 (3H, s), 6,48 (1H, s), 7,18 (3H, m), 7,28 (2H, m), 12,97 (1H, bs).
6,7-Дигидро-N,7-диметил-3-(2,2-диметил-пропил)-4-гидрокси-N-фенил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 63%; не включено в формулу изобретения.
1Н ЯМР (CDCl3): σ 0.98 (9Hs), 2,96 (2Hs), 3,29 (3Hs уш.), 3,51 (3H, s), 6,48 (1H, s), 7,17-7,33 (5H, m), 12,85 (1H, s).
3-Циклогексил-6,7-дигидро-N,7-диметил-4-гидрокси-N-фенил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 60%; не включено в формулу изобретения.
1Н ЯМР (CDCl3): σ 1,22-2,18 (10Н, m, циклогескил-СН2), 3,30 (4Н, широкий сигнал, N-Me и циклогексил-СН), 3,50 (3H, s), 6,52 (1H, s), 7,17-7,32 (5H, m), 12,95 (1H, s).
6,7-Дигидро-3,7-диметил-N-этил-4-гидрокси-N-фенил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 87%.
1Н ЯМР (DMSO-d6): σ 1,01 (3H, t), 2,31 (3H, s), 3,29 (3H, s), 3,74 (2H, q уш.), 6,72 (1H, s уш.), 7,10-7,31 (5Н, m), 11,0 (1H, s уш.).
N,3-Диэтил-6,7-дигидро-4-гидрокси-7-метил-N-фенил-6-оксотиено [2,3-b]пиридин-5-карбоксамид, выход 76%.
1Н ЯМР (CDCl3) σ 1,20 (3H, t), 1,30 (3H, t), 2,97 (2H, q), 3,19 (3H, s), 3,97 (2H, q), 6,47 (1H, s), 7,15 (3H, t), 7,24 (2H, t), 12,83 (1H, bs).
6,7-Дигидро-N-этил-4-гидрокси-3-изо-пропил-7-метил-N-фенил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 67%.
1H ЯМР (CDCl3) σ 1,21 (3H, t), 1,30 (6H, d), 3,19 (3H, s), 3,64 (1H, m), 3,97 (2H, q), 6,51 (1H, s), 7,15 (3H, t), 7,24 (2H, m), 12,98 (1H, bs).
6,7-Дигидро-3,7-диметил-4-гидрокси-N-фенил-N-пропил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 58%.
1Н ЯМР (CDCl3) σ 0,92 (3H3t), 1,63 (2H, m), 2,52 (3H, d), 3,17 (3H, s), 3,87 (2H, t), 6,43 (1H, d), 7,14 (3H, t), 7,23 (2H, t), 12,62 (1Н, уш.).
Пирролидиновая соль 6,7-дигидро-N,3-диметил-7-этил-4-гидрокси-N-фенил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 75%.
1Н ЯМР (CDCl3): σ 1,08 (3Н, широкий сигнал), 1,79 (4H, m), 2,45 (3H, s), 2,98 (4H, m), 3,35 (3H, s), 3,85 (2H, широкий сигнал), 6,25 (1H,s уш.), 7,08-7,36 (5H, m).
6,7-Дигидро-4-гидрокси-N-(4-метилфенил)-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 81%.
1Н ЯМР (CDCl3): σ 2,29 (3H, s), 2,50 (3H, d), 3,26 (3H, s уш.). 3,43 (3H, s), 6,43 (1H, q уш.), 7,06 (4H, s), 12,70 (1H, s уш.).
6,7-Дигидро-4-гидрокси-N-(4-изо-пропил)-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 85%.
1H ЯМР (CDCl3): σ 1,22 (6H, d), 2,53 (3H, s), 2,88 (1H, m), 3,25 (3H, s уш.), 3,46 (3H, s), 6,45 (1H, s уш.), 7,07-7,17 (4H, m), 12,8 (1H, s).
6,7-Дигидро-4-гидрокси-N-(4-трифторометоксифенил)-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 76%.
1Н ЯМР (CDCl3): σ 2,52 (3H, s), 3,23 (3H, s), 3,47 (3H, s), 6,47 (1H, s уш.), 7,12 (2H, d), 7,22 (2H, d), 12,70 (1H, s).
6,7-Дигидро-N,7-диметил-4-гидрокси-3-этил-N-(4-метоксифенил)-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 67%.
1Н NMR (CDCl3) σ 1,29 (3H, t), 2,96 (2H, dq), 3,29 (3H, bs), 3,43 (3H, s), 3,77 (3H, s), 6,48 (1H, s), 6,79 (2H, d), 7,11 (2H, d), 12,69 (1H, bs).
N-(4-Хлорфенил)-6,7-дигидро-3,7-диметил-N-этил-4-гидрокси-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 54%.
1Н ЯМР (CDCl3): σ 1,19 (3H, t), 2,51 (3H, d), 3,23 (3H, s), 3,93 (2H, q), 6,45 (1H, d), 7,09 (2H, d), 7,21 (2H, d), 12,73 (1H, bs).
N-(4-Хлорфенил)-6,7-дигидро-N,7-диметил-3-этил-4-гидрокси-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 57%.
1Н ЯМР (CDCl3): σ 1,29 (3H, t), 2,96 (2H, q), 3,28 (3H, s), 3,45 (3H, s), 6,50 (1H, s), 7,13 (2H, d), 7,23 (2H, d), 12,79 (1H, bs).
N-(2,4-Дифторфенил)-6,7-дигидро-N,7-диметил-3-этил-4-гидрокси-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 44%.
1Н ЯМР (CDCl3): σ 1,29 (3H, t), 2,96 (2H, q), 3,25 (3H, bs), 3,38 (3H, s), 6,49 (1H, s), 6,69 (1H, bs), 6,86 (1H, bt), 7,05 (1H, bs), 12,72 (1H, bs).
N-(2,4-Дифторфенил)-1,6-дигидрокси-4-гидрокси-3-изо-пропил-N,7-диметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 37%.
1Н ЯМР (CDCl3): σ 1,29 (6H, d), 3,25 (3H, bs), 3,38 (3H, s), 3,62 (1H, m), 6,54 (1H, s), 6,71 (1H, bs), 6,87 (1H, bs), 7,05 (1H, bs), 12,85 (1H, bs).
6,7-Дигидро-N,7-диметил-3-(4-фторофенил)-4-гидрокси-N-фенил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 92%, не включено в формулу изобретения.
1Н ЯМР (CDCl3): σ 3,30 (3H, s уш.), 3,44 (3H, s), 6,68 (1H, s), 7,04-7,11 (2H, m), 7,14-7,20 (3H, m), 7,23-7,30 (1H, m), 7,42-7,49 (1H, m), 12,67 (1H, s уш.).
4,5-Дигидро-7-гидрокси-N-фенил-N,1,4-триметил-5-оксо-2-тиа-4-азаинден-6-карбоксамид, выход 87%.
1Н ЯМР (CDCl3): σ 2,86 (3H, s), 3,21 (3H, s, уш.), 3,48 (3H, s), 6,17 (1H, s), 7,13-7,32 (5H, m), 12,89 (1H, s уш.).
4,5-Дигидро-1,4-диметил-N-этил-7-гидрокси-N-фенил-5-оксо-2-тиа-4-азаинден-6-карбоксамид, выход 76%.
1Н ЯМР (CDCl3): σ 1,20 (3H, t), 2,86 (3H, s), 3,04 (3H, s), 3,97 (1H, q), 6,14 (1H, s), 7,15 (3H, m), 7,24 (2H, m), 12,93 (1H, bs).
4,5-Дигидро-7-гидрокси-N-(4-метилфенил)-N,1,4-триметил-5-оксо-2-тиа-4-азаинден-6-карбоксамид, выход 68%.
1Н ЯМР (CDCl3): σ 2,30 (3H, s), 2,85 (3H, s), 3,13 (3H, bs), 3,44 (3H, s), 6,18 (1H, s), 7,07 (4H, bs), 12,88 (1H, bs).
4,5-Дигидро-7-гидрокси-N-(4-метоксифенил)-N,1,4-триметил-5-оксо-2-тиа-4-азаинден-6-карбоксамид, выход 55%.
1H ЯМР (CDCl3): σ 2,85 (3H, s), 3,14 (3H, bs), 3,78 (3H, s), 6,18 (1H, s), 6,80 (2H, bd), 7,11 (2H, bd), 12,79 (1H, bs).
N-(4-Хлорфенил)-4,5-дигидро-7-гидрокси-N,1,4-триметил-5-оксо-2-тиа-4-азаинден-6-карбоксамид, выход 50%.
1Н ЯМР (CDCl3): σ 2,86 (3H, bs), 3,14 (3H, s), 3,44 (3H, s), 6,20 (1H, s), 7,12 (2H, d), 7,23 (2H, d), 12,87 (1H, bs).
N-(2,4-Дифторфенил)-4,5-дигидро-7-гидрокси-N,1,4-триметил-5-оксо-2-тиа-4-азаинден-6-карбоксамид, выход 14%.
1Н ЯМР (CDCl3): σ 2,85 (3H, s), 3,09 (3H, bs), 3,37 (3H, s), 6,18 (1H, bs), 6,70 (1H, bs), 6,86 (1H, bt), 7,05 (1H, bs), 12,83 (1H, bs).
N-(2,5-Дифторфенил)-4,5-дигидро-7-гидрокси-N,1,4-триметил-5-оксо-2-тиа-4-азаинден-6-карбоксамид, выход 48%.
1H ЯМР (CDCl3): σ 2,86 (3H, s), 3,15 (3H, bs), 3,39 (3H, s), 6,19 (1H, s), 6,88 (2H, m), 7,06 (1H, dt), 12,89 (1H, bs).
4,5-Дигидро-7-гидрокси-N-(4-трифторометилфенил)-N,1,4-триметил-5-оксо-2-тиа-4-азаинден-6-карбоксамид, выход 36%.
1Н ЯМР (CDCl3): σ 2,87 (3H, s), 3,08 (3H, s), 3,50 (3H, s), 6,21 (1H, s), 7,30 (2H, d), 7,52 (2H, d), 12,98 (1H, bs).
4,5-Дигидро-7-гидрокси-N-(4-трифторометоксифенил)-N,1,4-триметил-5-оксо-2-тиа-4-азаинден-6-карбоксамид, выход 52%.
1Н ЯМР (CDCl3): σ 2,86 (3H, s), 3,09 (3H, s), 3,46 (3H, s), 6,19 (1H, s), 7,11 (2H, d), 7,21 (2H, d), 12,87 (1H, bs).
Пример 6.
N-(2,5-Дифторфенил)-6,7-дигидро-4-гидрокси-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид (Метод В).
К 6,7-дигидро-3,7-диметил-4-гидрокси-6-оксотиено[2,3-b]пиридин-5-карбоновой кислоте (4,18 ммоль, 1,0 г) в дихлорметане (10 мл) добавляли триэтиламин (4 экв., 16,7 ммоль, 2.4 мл) и N-метил-2,5-дифторанилин (1,2 экв., 5,0 ммоль, 720 мг). К смеси, перемешиваемой под азотом и охлажденной до 0°С, в течение 30 мин был добавлен раствор тионилхлорида (1,3 экв., 5,4 ммоль, 0,4 мл) в дихлорметане (5 мл). Перемешивание продолжали при 0°С в течение 1 ч и затем при комнатной температуре в течение еще 20 мин. Реакционную смесь разводили хлороформом и быстро промывали холодной 1 М серной кислотой. Органическую фазу сразу же экстрагировали 0,5 М NaOH. Оставшиеся следовые количества хлорированных органических растворителей удаляли на роторном испарителе. рН был доведен чуть выше точки, в которой начинает осаждаться желаемый продукт (приблизительно рН 6,5), и раствор фильтровали через силит. Продукт осаждали доведением рН 1М HCl до значений приблизительно 1-2, и смесь оставляли на 2 ч. Полученный осадок собирали фильтрацией, промывали водой и высушивали под пониженным давлением с получением требуемого соединения (1,26 г, 83%).
1Н ЯМР (CDCl3): σ 2,53 (3H, d), 3,31 (3H, s уш.), 3,42 (3H, s), 6,49 (1H, q уш.), 6,84-6,95 (2H, m), 7,05-7,12 (1H, m), 12,73 (1H, s уш.).
По существу тем же способом были получены следующие соединения из соответствующих исходных материалов.
6,7-Дигидро-4-гидрокси-N-фенил-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 81%.
1Н ЯМР (CDCl3): σ 2,50 (3H, d), 3,23 (3H, s уш.), 3,46 (3H, s), 6,42 (1H, q), 7,12-7,19 (3H, m), 7,21-7,27 (2H, m), 12,65 (1H, s уш.).
6,7-Дигидро-4-гидрокси-N-фенил-N,2,3,7-тетраметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 75%.
1Н ЯМР (CDCl3): σ 2,32 (3H, s), 2,40 (3H, s), 3,21 (3H, s уш.), 3,47 (3H, s), 7,14-7,29 (3H, m), 7,26 (2H, t уш.), 12,60 (1H, s уш.).
6,7-Дигидро-3-этил-4-гидрокси-N-фенил-N,2,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 87%.
1Н ЯМР (CDCl3): σ 1,19 (3H, t), 2,34 (3H, s), 2,86 (2H, q), 3,22 (3H, s), 3,47 (3H, s), 7,14-7,22 (3H, m), 7,27 (2H, t уш.), 12,75 (1H, s уш.).
N-(4-Хлорфенил)-6,7-дигидро-4-гидрокси-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 90%.
1Н ЯМР (CDCl3): σ 2,50 (3H, d), 3,26 (3H, s), 3,43 (3H, s), 6,45 (1H, q уш.), 7,11 (2H, d), 7,21 (2H, d), 12,66 (1H, S уш.).
N-(2,4-Дифторфенил)-6,7-дигидро-4-гидрокси-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 92%.
1Н ЯМР (CDCl3): σ 2,51 (3H, d), 3,25 (3H, s уш.), 3,38 (3H, s), 6,45 (1H, s), 6,70 (1H, s уш.), 6,87 (1H, t уш.), 7,04 (1H, s уш.), 12,62 (1H, s уш.).
6,7-Дигидро-4-гидрокси-N-(4-трифторометилфенил)-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 76%.
1Н ЯМР (CDCl3): σ 2,52 (3H, d), 3,23 (3H, s), 3,50 (3H, s), 6,48 (1H, q уш.), 7,31 (2H, d), 7,53 (2H, d) 12,76 (1H, s уш.).
6,7-Дигидро-3,7-диметил-N-этил-4-гидрокси-N-(4-трифторометилфенил)-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 68%.
1Н ЯМР (CDCl3): σ 1,21 (3H, t), 2,52 (3H, s), 3,18 (3H, s), 3,99 (2H, q), 6,46 (1H, q уш.), 7,27 (2H, d), 7,50 (2H, d), 12, 86 (1H, s уш.).
Триэтиламиновая соль 6,7-дигидро-4-гидрокси-N-(3-пиридил)-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамимида, выход 94%; (контрольное соединение, не в соответствии с изобретением).
1Н ЯМР (CDCl3): σ 0,86 (9H, t), 2,24 (3Н, d уш.), 2,37 (6H, q), 3,10 (3H, s), 3,29 (3H, s), 6,18 (1H, q уш.), 7,10 (1H, dd), 7,67 (1H, dt), 8,00 (1H, dd), 8,34 (1H, d).
6,7-Дигидро-4-гидрокси-N-фенил-N,2,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид, выход 80%; не включено в формулу.
1Н ЯМР (CDCl3): σ 2,45 (3H, d), 3,22 (3H, s уш.), 3,47 (3H, s), 6,95 (1H, q уш.), 7,14-7,28 (5H, m), 12,10 (1H, s уш.).
4,5-Дигидро-N,4-диметил-7-гидрокси-N-фенил-5-оксо-2-тиа-4-азаинден-6-карбоксамид, выход 33%.
1Н ЯМР (CDCl3): σ 3,15 (3Н, s уш.), 3,49 (3H, s), 6,49 (1H, d), 7,15-7,21 (3H, m), 7,24-7,30 (2H, m), 7,98 (1H, d), 12,36 (1H, s уш.).
4,5-Дигидро-N-этил-7-гидрокси-4-метил-N-фенил-5-оксо-2-тиа-4-азаинден-6-карбоксамид, выход 30%.
1Н ЯМР (CDCl3+TFA): σ 1,22 (3H, t), 3,45 (3H, s), 3,97 (2H, q), 6,85 (1H, d), 7,21-7,25 (3H, m), 7,28-7,32 (2H, m), 8,10 (1H, d).
N-(2,5-Дифторфенил)-4,5-дигидро-N,4-диметил-7-гидрокси-5-оксо-2-тиа-4-азаинден-6-карбоксамид, выход 46%.
1Н ЯМР (CDCl3): σ 3,22 (3H, s уш.), 3,41 (3H, s), 6,55 (1H, d), 6,82-6,96 (2H, m), 7,02-7,11 (1Hm), 8,03 (1H, d), 12,41 (1H s уш.).
N-(2,4-Дифторфенил)-4,5-дигидро-N,4-диметил-7-гидрокси-5-оксотиено[3,2-6]пиридин-6-карбоксамид; выход 57%; (контрольное соединение, не в соответствии с изобретением).
1Н ЯМР (CDCl3): σ 3,32 (3H, s уш.), 3,38 (3H, s), 6,69 (1H, s уш.), 6,87 (1H, t уш.), 6,94 (1H, s уш.), 7,04 (1H, s уш.), 7,70 (1H, d), 12,46 (1H, s уш.).
Пример 7.
4,5-Дигидро-N,4-диметил-7-гидрокси-N-фенил-5-оксотиено[3,2-6]пиридин-6-карбоксамид (контрольное соединение, не в соответствии с изобретением) (Способ В).
4,5-Дигидро-7-гидрокси-4-метил-5-оксотиено[3,2-6]пиридин-6-карбоновая кислота (1,27 ммоль, 288 мг), N-метиланилин (1,92 ммоль, 0,211 мл,) и дициклогексилкарбодиимид (1,92 ммоль, 0,41 г) нагревали в толуоле (3 мл) при 70°С в течение 4 ч. Смесь охлаждали, добавляли 0,5 М серной кислоты (20 мл) и затем смесь экстрагировали хлороформом. Органическую фазу экстрагировали 1 М NaOH, pH доводили примерно до 6 и отфильтровывали осадок дициклогексилмочевины. Затем осадок, образованный при закислении водным раствором HCl, собирали и высушивали под вакуумом с получением требуемого соединения (225 мг, 56%).
1Н ЯМР (CDCl3): σ 3,30 (3H, s уш.), 3,47 (3H, s), 6,92 (1H, d), 7,13-7,21 (3H, m).
Пример 8.
Кальциевая соль 6,7-дигидро-4-гидрокси-N-фенил-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамида.
6,7-Дигидро-4-гидрокси-N-фенил-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид (0,304 ммоль, 100 мг) растворяли в смеси 1 М NaOH (0,304 ммоль, 0,304 мл) и этанола (1 мл). Смесь нагревали до 50°С и по каплям при перемешивании добавляли водный 1 М раствор моногидрата ацетата кальция (1,05 экв., 0,16 ммоль, 0,16 мл). После перемешивания при 50°С в течение 30 мин осадок отфильтровывали, промывали смесью этанол/вода и высушивали под вакуумом с получением титульного соединения (101 мг, 96%).
Расчет для C34H30CaN4O6S2; С 58,77%, Н 4,35%, N 8,06%, найдено С 58,8, Н 4,73, N 7,86. EDTA - титрометрическое определение Са дало 5,64% (теоретическое - 5,77%).
Пример 9.
Диэтаноламиновая соль 6.7-дигидро-4-гидрокси-N-фенил-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамида.
6,7-Дигидро-4-гидрокси-N-фенил-N,3,7-триметил-6-оксотиено[2,3-b)]пиридин-5-карбоксамид (0,304 ммоль, 100 мг), метанол (3 мл) и диэтаноламин (0,33 ммоль, 0,032 мл) смешивали и позволяли удалиться летучим веществам. Осадок кристаллизовали из этилацетата (2 мл) и гептана (5 мл) с получением требуемого соединения (101 мг, 76%). 1Н-ЯМР в D2O выявил две изомерных формы в соотношении 4/1. Сообщается только о сигналах от основной формы.
1Н-ЯМР (D2O) (основной ротамер) σ 2,37 (3H, s), 3,21 (4H, t), 3,26 (3H, s), 3,37 (3H, s), 3,85 (4H, t), 6,38 (1H, s), 7,10 (1H, t), 7,19 (2H, t), 7,33 (2H, d).
Расчет для C21H27N3O5S; С 58,18%, Н 6,28%, N 9,69%, найдено С 57,58, Н 6,40, N 9,51.
Пример 10.
Литиевая соль 6,7-дигидро-4-гидрокси-N-фенил-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамида.
6,7-Дигидро-4-гидрокси-N-фенил-N,3,7-триметил-6-оксотиено[2,3-b]пиридин-5-карбоксамид (0,304 ммоль, 100 мг) и этанол (0.48 мл) перемешивали, после чего по каплям добавляли раствор гидрата гидроксида лития (1,04 экв., 13,2 мг) в воде (0,26 мл). После перем