Способ получения трансгенных растений моркови, продуцирующих интерлейкин-10 человека
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и представляет собой способ получения трансгенных растений моркови, продуцирующих интерлейкин-10 человека. Конструируют рекомбинантную плазмидную ДНК pBi101-IL10, кодирующую синтез интерлейкина-10 человека, и переносят ее в штамм Agrobacterium. Получают каллус, индуцированный из зрелых зародышей семян моркови с использованием агаризованной питательной среды MS, содержащей 0,2 мг/л 2,4-Д и 0,2 мг/л кинетика. Проводят агробактериальную трансформацию каллуса конструкцией pBi101-IL10 с получением трансгенных эксплантов. Культивируют полученные экспланты для индукции канамицинустойчивого каллуса с использованием среды MS, содержащей 0,2 мг/л 2,4-Д, 0,2 мг/л кинетина, 100 мг/л канамицина и 500 мг/л цефотаксима. Сформировавшиеся эмбриоиды переносят для регенерации растений на бумажные мостики в пробирки с использованием жидкой среды MS, содержащей 100 мг/л канамицина, 500 мг/л цефотаксима с последующим выращиванием растений-регенерантов в условиях закрытого грунта. Способ позволяет проще и дешевле получать трансгенные растения моркови, продуцирующие интерлейкин-10 человека. 4 ил.
Реферат
Изобретение относится к области биотехнологии, в частности к биоинженерии высших растений, и может быть использовано для создания растительных продуцентов интерлейкина-10 (ИЛ-10) человека. Трансгенные растения - продуценты ИЛ-10 могут быть использованы для пероральной доставки ИЛ-10 человека к слизистым тонкого кишечника, а также для выделения ИЛ-10 в чистом виде для фармакологии. Известно, что некоторые цитокины являются эндогенными антивоспалительными медиаторами, блокирующими процесс воспаления, и только ИЛ-10 действует как универсальный ингибитор синтеза всех монокинов. Поэтому перспектива применения ИЛ-10 в совокупности с другими антивоспалительными цитокинами в терапии велика (Moore K.W., OGarra A., de Waal Malefyt R. et al. // Annu Rev Immunol.1993, V.11, P.165-190). Главным эффектом ИЛ-10 является угнетение секреции ИЛ-1а, ИЛ-1b, ИЛ-6, ИЛ-8, ИЛ-12, TNF-a, колониестимулирующих факторов, токсичных радикалов кислорода, реактивных азотистых посредников и простагландина Е2. Аналогичное влияние ИЛ-10 описано и в отношении полиморфонуклеарных лейкоцитов. Известно, что ИЛ-10 подавляет антигенпредставляющую способность моноцитов и макрофагов и развитие дендритных клеток, что позволяет использовать его для лечения аутоиммунных заболеваний (Asadullah К., Docke W.D., Ebling M. et аl. // Сell, 1999, V.75, Р.263-274). Особый интерес представляет возможность перорального введения в живой организм ИЛ-10 в составе съедобных вакцин, в результате чего достигается более щадящая доставка его к клеткам-мишеням.
Известны способы получения трансгенных растений, содержащих рекомбинантную плазмидную ДНК, кодирующую интерлейкины человека (Zhang В, Yang YH, Lin YM, Rao Q, Zheng GG, Wu KF //Biotechnol Lett. 2003 V.25 (19). P.1629-35, Park Y, Cheong H// Protein Expr Purif. 2002. V.25 (1). P.160-5). Основным недостатком данных способов является использование для трансформации растений, являющихся несъедобными для человека либо употребляющихся в пищу после термической обработки.
Наиболее близким к заявляемому способу (прототипом) является способ получения трансгенных растений моркови, продуцирующих белок холерного токсина В, включающий конструирование рекомбинантной плазмидной ДНК, содержащей целевой ген, перенос полученной плазмидной ДНК в штамм Agrobacterium с последующей агробактериальной трансформацией гипокотилей моркови и регенерацией трансгенных растений на селективных питательных средах В5 и MS. В результате получали трансгенные растения моркови, в корнях которых экспрессировался биологически активный белок холерного токсина В (Патент CN №1286120, кл. С12N 15/09, опубл. 07.03.2001).
Недостатком известного способа является трудоемкость выращивания донорных растений для получения гипокотилей.
Технической задачей настоящего изобретения является упрощение и удешевление способа получения трансгенных растений моркови.
Поставленная техническая задача достигается предлагаемым способом, заключающимся в следующем.
Способ конструирования заключается в клонировании участка кДНК гена IL-10 человека в плазмиде рЕТ15b(+) совместно с участком нуклеотидной последовательности шести аминокислот гистидина и сайта гидролиза ферментом тромбином. На следующем этапе фрагмент ДНК, состоящий из нуклеотидной последовательности гексагистидинового участка, тромбинового сайта и безлидерной последовательности кДНК IL10 человека гидролизовали с помощью эндонуклеаз рестрикции NcoI и BamHI и субклонировали в плазмиду pAVA321 по сайтам рестрикции NcoI/BglII. Плазмида pAVA321 содержит функциональные элементы, необходимые для экспрессии целевого гена в растении. На заключительном этапе клонирования HindIII - BamHI фрагмент плазмидной ДНК pAVA321, содержащий кДНК IL10 человека под управлением растительных элементов экспрессии, субклонировали в полилинкер Т-ДНК области векторной плазмиды pBi101. В результате получили рекомбитнантную плазмиду pBi 101-IL10, имеющую размер 15 т.п.н и содержащую следующие конструктивные элементы: фрагмент ДНК векторной плазмиды pBi101 размером 13,9 т.п.н; NdeI-BamHI фрагмент ДНК, являющийся участком кДНК гена IL-10 человека; NcoI-NdeI фрагмент плазмиды рЕТ15b+, кодирующий N-концевой гексагистидиновый участок; 5'UTR область из генома вируса гравировки табака; двойной 35S CaMV промотор из генома вируса мозаики цветной капусты; 3'UTR область из генома вируса мозаики цветной капусты и терминатор.
Сконструированную рекомбинантную плазмиду pBi101-IL10, несущую ген интерлейкина 10 человека, переносят в штамм агробактерий (Agrobacterium tumefaciens) LBA4404 с последующей агробактериальной трансформацией каллусной ткани моркови и регенерацией трансгенных растений на селективной питательной среде.
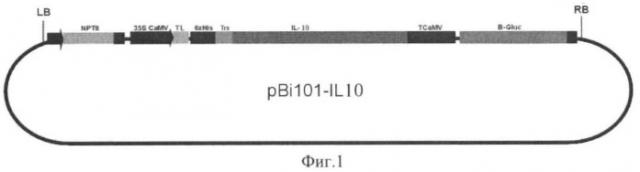
Физическая карта плазмиды pBi101-IL10 с указанием генетических маркеров приведена на фиг.1, где бхHis-последовательность ДНК, кодирующая шесть аминокислотных остатков гистидина; Trs-последовательность ДНК, кодирующая сайт узнавания ферментом тромбином; IL10-нуклеотидная последовательность зрелой формы ИЛ-10 человека, 35S CaMV-двойной промотор гена 35S РНК вируса мозаики цветной капусты; TL-лидерная последовательность трансляции из генома вируса гравировки табака; TcaMV - терминатор гена 35S РНК вируса мозаики цветной капусты; LB и RB - левая и правая границы Т-ДНК области; PNOS - промотор гена нопалинсинтазы из Ti-плазмиды Agrobacterium tumefaciens; NPTII-ген неомицинфосфотрансферазы II; TNOS-терминатор гена нопалинсинтетазы; B-Gluc-нуклеотидная последовательность бета-глюкуронидазы E.coli.
Определяющими отличительными признаками заявляемого способа по сравнению с прототипом являются:
- в качестве вектора используют рекомбинантную плазмидную ДНК pBi101-IL10, в которой целевым геном служит нуклеотидная последовательность химерного белка, состоящего из безлидерной (зрелой) формы ИЛ-10 человека, N-концевого пептида из шести аминокислот гистидина и сайта гидролиза ферментом тромбином между ними. Использование такой последовательности ДНК в качестве целевого гена позволит получать растения моркови - продуценты биологически активного ИЛ-10 человека, а также сделает возможным выделение рекомбинантного ИЛ-10 в чистом виде из растений моркови методами металл-хелатной аффинной хроматографии;
- в качестве растительного материала для трансформации используют каллус, индуцированный из зрелых зародышей моркови, обладающий высокой скоростью роста и высоким эмбриогенным потенциалом, что позволяет значительно упростить и удешевить процедуру получения большого количества трансгенных растений при использовании лишь двух типов питательных сред.
Изобретение поясняется следующими примерами конкретного выполнения способа.
Пример 1. Конструирование плазмиды pBi101-IL10.
Конструирование заключается в клонировании участка кДНК гена ИЛ-10 человека в плазмиде рЕТ15b(+) совместно с участком нуклеотидной последовательности шести аминокислот гистидина и сайта гидролиза ферментом тромбином. На следующем этапе фрагмент ДНК, состоящий из нуклеотидной последовательности гексагистидинового участка, тромбинового сайта и безлидерной последовательности кДНК IL10 человека гидролизовали с помощью эндонуклеаз рестрикции NcoI и BamHI и субклонировали в плазмиду pAVA321 по сайтам рестрикции NcoI/BglII. Плазмида pAVA321 содержит функциональные элементы, необходимые для экспрессии целевого гена в растении. На заключительном этапе клонирования HindIII - BamHI фрагмент плазмидной ДНК pAVA321, содержащий кДНК ИЛ-10 человека под управлением растительных элементов экспрессии, субклонировали в полилинкер Т-ДНК области векторной плазмиды pBi101. В результате получили рекомбинантную плазмиду pBi101-IL10 размером 15 т.п.н.
Пример 2. Получение трансгенных растений моркови
С помощью конструкции pBi101-IL10, описанной в примере 1, были получены трансгенные растения моркови (Daucus carota, сорт Нантская 4). Для агробактериальной трансформации в качестве исходных эксплантов были использованы девятинедельные каллусы, полученные из зрелых зародышей моркови. Для получения каллусов зрелые семена моркови сорта Нантская 4 стерилизовали 25% раствором Domestos в течение 10 минут. После этого семена промывали стерильной дистиллированной водой 4-5 раз, помещали в стерильную влажную камеру и оставляли на 30 часов для набухания. Набухшие семена моркови стерилизовали 50% раствором Domestos 20 мин, после чего промывали стерильной водой 4-5 раз. Выделенные зародыши помещали на среду для индукции каллуса (среда MS (Murashige and Skoog//Plant Physiol. 1962. V.15. P.473-497) с добавлением 0,2 мг/л 2.4-Д и 0,2 мг/л кинетина) и культивировали в темноте в течение 9-10 недель с пассажами на свежие среды того же состава каждые 3 недели.
Для трансформации использовали ночную культуру агробактерии Agrobacterium tumefaciens, плотностью 1 о.е. при 600 нм, предварительно разведенную средой MS в соотношении 1:3. Каллус 9-10 недельного возраста разделяли на небольшие фрагменты (3-5 мм в диаметре) и выкладывали на фильтровальную бумагу в чашки Петри. На каждый фрагмент наносили по 5-10 мкл приготовленной суспензии ночной культуры агробактерии. После того как избыток суспензии впитается фильтровальной бумагой, фрагменты каллуса переносили в чашки Петри со средой для индукции каллуса (Среда №1: MS ()+0,2 мг/л 2,4-Д+0,2 мг/л кинетина). Ко-культивирование проводили в течение 3 суток в темноте при температуре 22°С.
После ко-культивирования экспланты переносили на среду для индукции канамицинустойчивого каллуса (Среда №2: среда №1+100 мг/л канамицина +500 мг/л цефотаксима). Культивирование проводили при температуре 22°С, освещенности 5 тыс. люкс и световом периоде 16/8 с пассированием на свежую среду аналогичного состава каждые 3-4 недели до начала эмбриогенеза. Хорошо сформировавшиеся эмбриоиды с развивающейся первой листовой пластинкой переносили на бумажные мостики в пробирки с жидкой питательной средой (Среда №3: MS+100 мг/л канамицина +500 мг/л цефотаксима) для развития растений-регенерантов. Растения с хорошо развитой корневой системой и розеткой листьев пересаживали в закрытый контейнер со стерильным грунтом (смесь мелкой фракции керамзита и вермикулита) и выращивали 3-4 недели, постепенно приоткрывая крышку для адаптации растений к атмосферной влажности. Хорошо адаптированные растения переносили в теплицу и помещали в ванны с керамзитом и автоматической подачей питательного раствора (стандартный раствор Кноппа) при освещенности 20 тыс.люкс и световом периоде 18/6 часов.
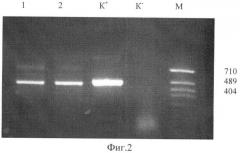
В результате были получены 65 первичных трансформантов, устойчивых к канамицину (100 мг/л). Трансгенная природа исходных растений была подтверждена методом полимеразной цепной реакции. На фиг.2 представлены результаты ПНР анализа геномных ДНК отобранных трансформантов на наличие последовательности ИЛ-10 (электрофореграмма, 1,5% агарозный гель), где 1, 2 - ДНК отобранных трансформантов поколения Т0 №1 и 2 соответственно; К- - ДНК нетрансгенного растения; К+ - положительный контроль (pBi101-IL10); M - маркер длин фрагментов ДНК pBlueskriptSK(+)/MspI (в пн). Наличие фрагментов ДНК, соответствующих гену ИЛ-10, подтверждает присутствие в растительном геноме встройки целевого гена интерлейкина 10.
Пример 3. Изучение биологических эффектов перорального введения трансгенной моркови, продуцирующей ИЛ-10, в экспериментальных моделях на мышах
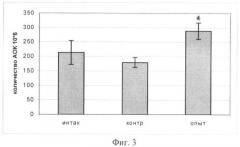
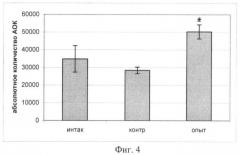
Биологическую активность полученных образцов генетически модифицированной моркови, экспрессирующей ген ИЛ-10 человека, тестировали по влиянию продукта на формирование гуморального иммунного ответа на Т-независимый антиген по количеству IgM антителообразующих клеток (АОК) в селезенке экспериментальных животных. В качестве модели были взяты мыши (самки) линии BALB/c в возрасте 8 недель (n=6). Мыши получали в качестве добавки к стандартному рациону обычную (контрольная группа) или трансгенную морковь (опытная группа) в дозе 1,7-2 г/мышь ежедневно в течение 16 дней. Интактная группа находилась на стандартном рационе. Определение содержания IgM антителообразующих клеток в селезенках мышей проводили после иммунизации мышей липополисахаридом (ЛПС) E.coli (Штамм 055:В5) на 11 день опыта. ЛПС, растворенный в забуференном физрастворе (ЗФР), вводили животным внутрибрюшинно в дозе 20 мкг/мышь объемом 0,5 мл. Гуморальный иммунный ответ был оценен на 5-е сутки. Было показано, что пероральное введение обычной моркови не приводит к статистически достоверному изменению количества антителообразующих клеток на Т-независимый антиген (ЛПС). В то же время употребление мышами генетически модифицированной моркови, экспрессирующей ген ИЛ-10 человека, индуцирует статистически достоверное увеличение количества АОК (относительного и абсолютного) по сравнению с контрольной группой. На фиг.3 представлены результаты по влиянию перорального введения генетически модифицированной моркови, экспрессирующей ген ИЛ-10 человека, на относительное количество АОК селезенки мышей, иммунизированных ЛПС (* - статистически достоверные различия с контрольной группой (р<0,05)), где интактная группа - стандартный рацион питания; контрольная группа - введение в рацион обычной моркови; опытная группа - пероральное введение генетически модифицированной моркови, экспрессирующей ген ИЛ-10 человека. На фиг.4 представлены данные по влиянию перорального введения генетически модифицированной моркови, экспрессирующей ген ИЛ-10 человека, на абсолютное количество АОК в селезенках мышей, иммунизированных ЛПС (* - статистически достоверные различия по сравнению с контрольной группой (р<0,005), где интактная группа - стандартный рацион питания; контрольная группа - введение в рацион обычной моркови; опытная группа - пероральное введение генетически модифицированной моркови, экспрессирующей ген ИЛ-10 человека. Увеличение абсолютного количества АОК не было связано с изменением общего количества клеток селезенки, т.к. при подсчете количества клеток селезенки не было выявлено достоверных различий между группами.
Таким образом, при исследовании влияния перорального введения генетически модифицированной моркови, экспрессирующей ген ИЛ-10 человека, на формирование гуморального иммунного ответа на Т-независимый антиген была показана ее эффективность, что выражалось в статистически достоверном увеличении количества антителообразующих клеток селезенки по сравнению с применением обычной моркови.
Использование предлагаемого способа позволяет проще и дешевле получать трансгенные растения моркови, продуцирующие интерлейкин-10 человека.
Способ получения трансгенных растений моркови, продуцирующих интерлейкин-10 человека, включающий конструирование рекомбинантной плазмидной ДНК, содержащей целевой ген, перенос полученной плазмидной ДНК в штамм Agrobacterium, инфицирование последним растительного материала, отбор трансгенных растений на селективной питательной среде с последующим тестированием отобранных трансформантов на наличие полноразмерной копии целевого гена, отличающийся тем, что конструируют и переносят в штамм Agrobacterium рекомбинантную плазмидную ДНК pBi101-IL10, кодирующую синтез интерлейкина-10 человека, получают каллус, индуцированный из зрелых зародышей семян моркови с использованием агаризованной питательной среды MS, содержащей 0,2 мг/л 2,4-Д и 0,2 мг/л кинетина, проводят агробактериальную трансформацию каллуса конструкцией pBi101-IL10 с получением трансгенных эксплантов, культивируют экспланты для индукции канамицин-устойчивого каллуса с использованием среды MS, содержащей 0,2 мг/л 2,4-Д, 0,2 мг/л кинетина, 100 мг/л канамицина и 500 мг/л цефотаксима, переносят сформировавшиеся эмбриоиды для регенерации растений на бумажные мостики в пробирки с использованием жидкой среды MS, содержащей 100 мг/л канамицина, 500 мг/л цефотаксима с последующим выращиванием растений-регенерантов в условиях закрытого грунта.