Способ диагностики рака толстой кишки и набор для его осуществления
Иллюстрации
Показать всеИзобретение относится к медицине и биологии, а именно к онкологии, и молекулярной биологии. Предложен способ диагностики рака толстой кишки, основанный на определении уровня мРНК гена AKR1B10, а также набор для его осуществления. Пониженный уровень мРНК в предположительно пораженной раком ткани человека по сравнению с ее уровнем в здоровой ткани служит диагностическим признаком рака толстой кишки. Предложенное изобретение позволяет с высокой достоверностью диагностировать рак толстой кишки, в том числе на ранних стадиях прогрессии опухолевой трансформации. 2 н. и 3 з.п. ф-лы, 2 табл., 3 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицины, в частности онкологии, и молекулярной биологии и может быть использовано для ранней диагностики рака толстой кишки.
Уровень техники
Рак толстой кишки занимает второе-третье место по смертности от онкологических заболеваний в России и индустриально-развитых странах Европы и Америки [Jemal A., Siegel R., Ward E., Murray Т., Xu J., Smigal C., Thun M.J. 2006, Cancer statistics, 2006. CA Cancer J. Clin., 56. 6-30]. В мире регистрируется ежегодно свыше 600000 случаев первичного рака толстой кишки (РТК), в России в последние 5 лет - более 50000 первичных случаев ежегодно [Вестник Российского онкологического научного центра им Н.Н.Блохина РАМН 2006. Статистика злокачественных новообразований в России и странах СНГ в 2004 г., т.17, №3 (прил.1), стр.47). Диагноз в половине случаев РТК устанавливают на далеко зашедшей стадии опухолевого процесса, что делает малореальным радикальное излечение. Успех лечения определяется возможностью раннего обнаружения опухолей.
Разработка за границей диагностикумов, основанных на идентификации специфических молекулярных маркеров, ведется достаточно интенсивно (компания Epigenomics AG, Германия; Roche, США; Epi/Partner и др. http://www.epigenomics.com/en/Products). Один из наиболее распространенных методов косвенной диагностики РТК - выявление скрытой фекальной крови, используется, например, компанией BioMerica (набор EZ Detect., аналог - Hemoccult). Достоинства такого рода тестов - относительная дешевизна и простота использования, а важнейшие недостатки - очень низкая чувствительность и неспецифичность (язва желудка, двенадцатиперстной кишки, геморрой также дают положительный ответ). Коммерчески доступно тестирование (GCC-B1™ Blood TestGCC-B1™) на присутствие в крови циркулирующих при РТК клеток с использованием маркерного белка фермента гуанилилциклазы - С (GCC) и его мРНК. Однако GCC считается хорошим маркером на РТК на поздней стадии, главным образом при метастазах, когда диагностика уже не может существенно помочь пациенту. С 2003 г. используют выявление ДНК в кале (PreGen-Plus, компания Exact Sciences). Тест определяет общую ДНК, т.е. это неспецифичный и, кроме того, очень дорогой диагностикум, хотя его чувствительность выше, чем для тестов на гемоглобин, и результат анализа не зависит от диеты пациента, как в случае тестирования гемоглобина.
Для выявления лиц группы риска колоректальной карциномы используют раковый антиген (РЭА), однако на уровень РЭА в крови влияет курение, употребление алкоголя. Уровень РЭА может повышаться также при многих неонкологических заболеваниях (бронхиты, пневмония и др.).
Необходимость идентификации новых онкомаркеров определяется: 1) отсутствием диагностикумов на РТК российского производства; 2) исключительной дороговизной и недостаточной надежностью диагностикумов, выпускаемых за рубежом (один анализ обходится в среднем $500-600); 3) ростом числа заболеваний РТК в России, в том числе случаев, выявленных на поздних стадиях заболевания, когда лечение малоэффективно; 4) длительностью и высокой стоимостью лечения в стационаре; 5) необходимостью увеличения средней продолжительности жизни трудоспособного населения РФ для улучшения общей демографической ситуации.
Большинство злокачественных опухолей толстой кишки, как правило, возникает в результате превращения доброкачественных опухолей (аденом) в злокачественные (аденокарциномы) [Kashida H., Kudo S. Early colorectal cancer: concept, diagnosis, and management. Int. J. Oncol. 2006, 11, 1-8]. Канцерогенез характеризуется фенотипически различными стадиями: гиперплазия, аденомы, аденокарциномы, метастазы. Этот ступенчатый процесс сопровождается активацией транскрипции ряда онкогенов, а также уменьшением или полной потерей транскрипционной активности так называемых генов-супрессоров опухолевого роста. Изменения активности этих двух групп генов могут служить диагностическим признаком злокачественных опухолей, включая РТК. Это изменение может быть определено с помощью обратной транскрипции с последующей стандартной полимеразной цепной реакцией (стандартный, полуколичественный метод ОТ-ПЦР) или ПЦР в реальном времени (ПЦР-РВ) - наиболее совершенным способом количественной оценки активности генов, определяемой по количеству мРНК, транскрибируемой с ДНК этих генов на клетку опухоли.
РТК сопровождается изменением функциональной активности многих генов. Для идентификации молекулярных биомаркеров РТК выявляют гены, чья экспрессия (синтез мРНК) сильно различается в норме и злокачественных опухолях толстой кишки. К отобранным генам получают олигонуклеотиды - праймеры, позволяющие избирательно измерять активность данного гена в синтезе мРНК. Из исследуемого образца выделяют мРНК и синтезируют на ее основе кДНК. Далее проводят стандартный ОТ-ПЦР или ПЦР-РВ с использованием наборов олигонуклеотидных праймеров и зондов, специфичных к мРНК изучаемых и контрольных генов. В качестве контрольных используют гены, активность которых практически одинакова в опухолевой и нормальной ткани.
Ген AKR1B10 рассматривают в числе перспективных потенциальных маркерных генов, вовлеченных в канцерогенез разных форм немелкоклеточного рака легкого [Fukumoto S., Yamauchi N., Moriguchi H., Hippo Y., Watanabe A., Shibahara J., Taniguchi H., Ishikawa S., Ito H., Yamamoto S., Iwanari H., Hironaka M., Ishikawa Y., Niki Т., Sohara Y., Kodama Т., Nishimura M., Fukayama M., Dosaka-Akita H., Aburatani H. 2005. Overexpression of the aldo-keto reductase family protein AKR1B10 is highly correlated with smokers' non-small cell lung carcinomas. Clin. Cancer Res. 11, 1776-1785; Penning T.M. 2005. AKR1B10: a new diagnostic marker of non-small cell lung carcinoma in smokers. Clin. Cancer. Res. 11, 1687-1690; Машкова Т.Д., Опарина Н.Ю., Зиновьева О.Л., Кропотова Е.С., Дубовая В.И., Полтараус А.Б., Фридман М.В., Копанцев Е.П., Виноградова Т.В., Зиновьева М.В., Лактионов К.К., Касымова О.Т., Зборовская И.Б., Свердлов Е.Д., Киселев Л.Л. Транскрипция генов TIMP3, DAPK1 и AKR1B10 при плоскоклеточном раке легкого. Мол. биол., 2006, 40, 1027-1054]. Ген AKR1B10 кодирует альдозоредуктазу В10 из семейства 1 альдокеторедуктаз (AKR). Белок AKR1B10 (36 кДа) относится к семейству ферментов с альдокеторедуктазной активностью. Все члены семейства AKR являются оксиредуктазами, зависят от NAD(P)H и катализируют восстановление многих соединений, включая ароматические и алифатические альдегиды и кетоны [Cao D., Fan S.T., Chung S.S. 1998. Identification and characterization of a novel human aldose reductaselike gene. J. Biol. Chem. 273, 11429-11435; Hyndman D., Bauman D.R., Heredia V.V., Penning T.M. 2003. The aldo-keto reductase superfamily homepage. Chem. Biol. Interact. 143-144, 621-631]. Повышенное содержание белка AKR1B10 обнаружено в злокачественных опухолях печени, но его роль в патогенезе не ясна [Hyndman D.J., Flynn T.G. 1998. Sequence and expression levels in human tissues of a new member of the aldo-keto reductase family. Biochim. Biophys. Acta. 1399, 198-202; Martin H.J., Breyer-Pfaff U., Wsol V., Venz S., Block S., Maser E. 2006. Purification and characterization of AKR1B10 from human liver: role in carbonyl reduction of xenobiotics. Drug Metab. Dispos. 34, 464-470; Scuric Z., Stain S.C., Anderson W.F., Hwang J.J. 1998. New member of aldose reductase family proteins overexpressed in human hepatocellular carcinoma. Hepatology. 27, 943-950].
Ген AKR1B10 не транскрибируется в большинстве нормальных тканей человека. мРНК и белок AKR1B10 обнаружены в норме только в тканях тонкой и толстой кишки и на низком уровне - в печени и надпочечниках, что согласуется с предполагаемой ролью AKR в метаболизме стероидов и инактивации химически активных альдегидов переваренной пищи в пищеварительном тракте. Однако изменение экспрессии гена AKR1B10 при РТК не изучали ни на транскрипционном уровне, ни на уровне трансляции. Следует отметить, что определение изменения транскрипционной активности этого гена в опухолях толстой кишки представляет большой интерес для диагностики РТК, т.к. с диагностической точки зрения существенную роль при выборе кандидата на роль диагностического маркера играет высокая стабильность образующегося транскрипта.
Изменение транскрипционной активности при РТК показано для нескольких генов. В работе (Arndt S., Bosserhoff А.К. Reduced expression of TANGO in colon and hepatocellular carcinomas. Oncol Rep. 2007, 18:885-91) выявлено понижение транскрипционной активности гена TANGO, нового члена семейства МIА (Melanoma Inhibitory Activity) генов, при РТК и гепатоцеллюлярном раке. Данный аналог наиболее близок по технической сущности заявленному изобретению и принят за прототип.
Из изложенного ясно, что в данной области существует настоятельная потребность в поиске нового диагностического маркера РТК, позволяющего достоверно и уже на ранних этапах диагностировать заболевание, и в разработке на его основе простого, чувствительного, надежного, применимого в условиях клинических или поликлинических медицинских учреждений способа диагностики РТК.
Раскрытие изобретения
Данное изобретение стало возможным в результате проведенного авторами сравнительного анализа уровня экспрессии гена AKR1B10 в опухолевых тканях толстой кишки различного типа и на разных этапах их злокачественного перерождения и открытия того факта, что уже ранние стадии развития злокачественной трансформации сопровождаются значительным уменьшением уровня мРНК гена AKR1B10.
Настоящее изобретение в своем аспекте относится к новому маркеру для диагностики рака толстой кишки, который представляет собой изменение уровня содержания мРНК гена AKR1B10. Пониженный уровень в предположительно пораженной раком ткани человека по сравнению с ее уровнем в здоровой ткани служит диагностическим признаком рака толстой кишки.
Данный способ включает следующие стадии:
а) получение исходной пары образцов ткани от пациента, где один из образцов получен из предположительно пораженной раком ткани, а второй получен из расположенной рядом гистологически нормальной (условно-нормальной) ткани;
б) выделение и очистка препаратов РНК из исходной пары образцов;
в) синтез одноцепочечной кДНК на матрице РНК с использованием олигонуклеотидных праймеров;
г) нормирование концентрации кДНК AKR1B10 по контрольному гену, уровень транскрипции которого постоянен в норме и при раке толстой кишки:
д) проведение количественной или полуколичественной реакции амплификации фрагмента гена AKR1B10 с использованием кДНК, полученной на стадии в), в качестве матрицы и пары геноспецифичных олигонуклеотидных праймеров;
е) сравнение количества амплифицированного фрагмента ДНК AKR1B10 для образца, полученного из предположительно пораженной раком ткани, с количеством амплифицированного фрагмента ДНК для образца, полученного из нормальной ткани, где указанные количества амплифицированного фрагмента ДНК отражают уровень транскрипции гена AKR1B10, причем понижение уровня мРНК гена. AKR1B10 служит диагностическим признаком рака толстой кишки.
В одном из воплощений способа изобретения на стадии в) олигонуклеотидные праймеры, используемые для синтеза одноцепочечной кДНК, выбирают из числа олиго(dT)n-содержащих праймеров, случайных гексамеров, или их комбинации, а также геноспецифичных праймеров.
В следующем воплощении способа настоящего изобретения для амплификации кДНК на стадии д) используют олигонуклеотидные праймеры, подобранные таким образом, что они специфически гибридизуются с кДНК даже в присутствии в препарате примеси геномной ДНК.
В отдельном предпочтительном воплощении данного изобретения последовательность праймеров представлена SEQ ID NO: 1 и 2.
В еще одном воплощении способа настоящего изобретения на стадии д) количественная или полуколичественная реакция амплификации фрагмента гена AKR1B10 представляет собой ПЦР в реальном времени или стандартную ОТ-ПЦР.
В одном воплощении заявленного способа на стадии г) в качестве контрольного гена используют так называемый «house-keeping» ген, кодирующий бета-актин, характеризующийся наиболее постоянным уровнем экспрессии как в нормальной слизистой оболочке кишечника, так и в опухолевых клетках толстой кишки. В качестве эндогенного контроля могут быть использованы и другие «гены домашнего хозяйства», например ген, кодирующий бета2-микроглобулин (В2М).
Еще одним аспектом настоящего изобретения является набор праймеров для осуществления полимеразной цепной реакции для определения уровня мРНК гена AKR1B10, имеющих последовательность SEQ ID NO: 1 и 2.
Перечень чертежей
Далее изобретение будет более подробно раскрыто со ссылкой на отдельные иллюстративные примеры и чертежи, где
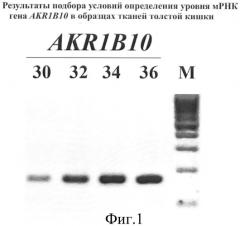
Фиг.1 показывает результаты подбора условий определения уровня мРНК гена AKR1B10 в образцах тканей толстой кишки. Электрофоретическое разделение в агарозном геле продуктов ПЦР (размер 145 п.н.), полученных после 30, 32, 34 и 36 циклов, проводили в 1,8%-ном агарозном геле. М - маркер молекулярных масс ДНК (ДНК плазмиды pBR222/AluI).
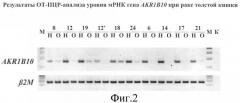
Фиг.2 показывает результаты ОТ-ПЦР-анализа уровня мРНК гена AKR1B10 при раке толстой кишки (после 30 циклов). Номера образцов указаны над дорожками. Т - опухоль, N - норма (нормальная слизистая оболочка толстой кишки на расстоянии около 10 см от опухоли). Ген, кодирующий бета 2-микроглобулин (В2М) (26 циклов ПЦР), использовали как внутренний контроль. Электрофоретическое разделение продуктов ПЦР проводили в 1,8%-ном агарозном геле.
Фиг.3 показывает результаты количественного определения изменения уровня мРНК гена AKR1B10 при раке толстой кишки с помощью ПЦР в реальном времени в 30 парных образцах норма-опухоль. В качестве контрольных генов использованы гены, кодирующие бета 2-микроглобулин (В2М) и бета-актин (АСТВ).
Осуществление изобретения
Данное изобретение обеспечивает новый генетический маркер для диагностики рака толстой кишки и основанный на определении уровня мРНК этого маркера простой, надежный способ диагностики РТК на разных стадиях развития злокачественной трансформации, включая начальные. Достоверно обнаруживаемое различие в уровне мРНК гена AKR1B10 в нормальных и опухолевых тканях может быть использовано для обнаружения рака толстой кишки.
Образцы тканей толстой кишки для анализа
В качестве образцов для проведения анализа может быть использован операционный и биоптатный материал, полученный при колоноскопии с прямой биопсией нормальной и предположительно пораженной раком слизистой оболочки толстой кишки.
Выделение РНК из образцов ткани кишечника
Способы выделения суммарной РНК из образцов ткани млекопитающих хорошо известны специалистам и, как правило, включают следующие стадии: измельчение в жидком азоте образцов опухолевых и нормальных тканей, лизис клеток, выделение РНК и ее очистку, проверку качества РНК электрофорезом в 1%-ном агарозном геле в присутствии красителя бромида этидия или в денатурирующем полиакриламидном геле, а также спектрофотометрическое определение количества РНК. Гомогенизацию кусочков ткани можно проводить вручную, растирая пестиком в керамической ступке, или с помощью механических гомогенизаторов, например, Omni Mixer или Micro-Dismembrator U фирмы Sartorius (Германия). Для выделения РНК могут быть использованы различные протоколы, широко известные специалистам в данной области. В классических методах выделения РНК используют сильные хаотропные агенты, такие, как гуанидинхлорид и гуанидинизотиоцианат, растворяющие белки, и последовательные экстракции фенолом и хлороформом для денатурации и удаления белков [Sambrook J., Fritsch E.F., Maniatis Т., Molecular Cloning. A laboratory Manual. 2nd Edition ed. 1989, Cold Spring Harbour: CSHL Press]. Широко используют также метод с использованием реагента Trizol [GIBCO/Life Technologies]. Для предотвращения разрушения РНК РНКазами могут быть использованы ингибиторы, такие как ингибитор RNAsin плацентарного или рекомбинантного происхождения или, например, ванадил-рибозидный комплекс - неспецифический ингибитор РНКаз широкого спектра действия.
Быстрое и качественное выделение РНК можно проводить с использованием ряда коммерчески доступных наборов (Клоноген, Санкт-Петербург; RNeasy mini и RNeasy micro kits (Qiagen); SV Total RNA Isolation System, Promega (США) и т.д.).
Чтобы исключить работу с агрессивными агентами, ускорить и упростить выделение РНК, применяют различные приборы, например, QuickGene-810 (Life Science, Япония). Для экстракции РНК в этом приборе используют 80 мкм пористую мембрану. которая в 12,5 раз тоньше обычно используемого в таких приборах стеклянного фильтра (1000 мкм). Это позволяет уменьшить деградацию РНК и увеличить ее выход.
Реакция обратной транскрипции: синтез кДНК на матрице РНК, выделенной из образцов ткани кишечника.
Процесс обратной транскрипции, в результате которой на РНК-матрице синтезируют одноцепочечную цепь ДНК, позволяет от нестабильных молекул РНК перейти к более стабильным молекулам ДНК и амплифицировать с помощью полимеразной цепной реакции до количеств, необходимых для детекции. ОТ-ПЦР-амплификация позволяет использовать очень малые количества исходной РНК (на уровне 1 нанограмма), а следовательно, и количество исследуемой ткани, из которой выделяют РНК.
Реакцию обратной транскрипции можно проводить с использованием ряда коммерчески доступных препаратов обратных транскриптаз, таких как обратная транскриптаза вируса лейкоза мышей Молони (M-MLV), вируса миелобластоза птиц (AMV), PowerScript (точечная мутация M-MLV-RT), С. Therm Polymerase и др., с помощью которых можно получать продукты амплификации длиною до нескольких тысяч и даже несколько десятков тысяч пар нуклеотидов (т.п.н.). Может быть использована термостабильная ДНК-полимераза Thermus thermophilus (Tth), обладающая обратной транскриптазной активностью в присутствии ионов Mn2+.
Для обратной транскрипции могут быть использованы различные праймеры, например:
1. Олиго(dT)n-содержащие праймеры, которые связываются с эндогенным полиА-хвостом на 3'-конце мРНК (число n обычно равно 12-18, но может достигать и большей величины). Эти праймеры наиболее часто используют для получения полноразмерных кДНК. К олиго(dT)-последовательности часто добавляют на 3'-конце нуклеотиды A, С или G, чтобы «заякорить» праймер на границу транскрипта и поли-А-тракта.
2. Случайные гексануклеотидные праймеры (статистические затравки), которые гибридизуются с РНК в многочисленных участках. При обратной транскрипции с этими праймерами получают короткие кДНК. Случайные гексамеры используют для преодоления трудностей, связанных с прочной вторичной структурой РНК, они более эффективны при обратной транскрипции 5'-областей мРНК.
3. Гексамеры или другие короткие олигонуклеотиды (10-12 нуклеотидов) случайного состава могут быть также использованы в комбинации с олиго(dT)-содержащими праймерами.
4. Специфические олигонуклеотидные праймеры используют для транскрипции участка мРНК, представляющего интерес для исследования. Эти праймеры успешно применяют для диагностических целей.
Анализ уровня мРНК гена AKR1B10 с помощью ПЦР
Используя первую цепь кДНК как матрицу, коммерчески доступную от широкого спектра производителей термостабильную ДНК-полимеразу (например, Taq, Pfu, Tfl, Tth, Tma и т.д.) и специфические праймеры, сайты для которых расположены в представляющем интерес транскрипте, проводят стандартный, полуколичественный ПЦР, в котором амплифицируемый фрагмент транскрипта детектируется простым гель-электорофорезом, или количественный ПЦР в реальном времени. Выбор специфических праймеров осуществляют способом, хорошо известным специалистам в данной области. Для подбора праймеров и температур отжига целесообразно использовать коммерчески доступные программы или программы, находящиеся в свободном доступе в Интернете. Среди таких программ можно упомянуть Oligo (версия 6.42), PrimerSelect из пакета Lasergene (www.dnastar.com), Primer Premier 5, primers3 (http://frodo.wi.mit.edu/cgibin/primer3/primer3_www.cgiC), EasyExonPrimer (Wu X., Munroe D.J. 2006, EasyExonPrimer: Automated Primer Design for Exon Sequences. Appl Biomformatics. 5, 119-120), ExPrimer (Sandhu K.S., Acharya K.K. 2005. ExPrimer: to design primers from exon-exon junctions. Bioinformatics. 21, 2091-2092), PerlPrimer, FastPCR (http://www.biocenter.helsinki.fi/bi/Programs./fastpcr.htm), PrimerQuest (http://scitools.idtdna.com/Primerquest/), а также программу PrimerDesigner, разработанную в Институте молекулярной биологии РАН. С учетом сложности анализируемого генома длина праймеров может быть выбрана в диапазоне от 18 до 25 п.н.
Праймеры для ПЦР можно подобрать таким образом, чтобы они специфически гибридизовались с кДНК даже в присутствии в препарате примеси геномной ДНК. Этого можно достигнуть, например, путем подбора праймеров к разным экзонам гена AKR1B10. При использовании геноспецифичных праймеров, комплементарных участкам разных экзонов, длина продукта ПЦР, амплифицированного с примесной геномной ДНК, будет значительно больше длины ожидаемого продукта ПЦР, амплифицированного с кДНК. Если хотя бы один из подобранных праймеров перекрывает границу между экзонами, примеси геномной ДНК не будут влиять на результаты реакции амплификации.
Специфичность подобранных праймеров проверяют выравниванием по мРНК и ДНК человека (http://www.ncbi.nlm.nih.gov/blast/Blast.cgi).
В предпочтительном воплощении используют праймеры:
AKR1B10_F (SEQ ID NO:1) 5'-GGACCTGTTCATCGTCAGCAA-3'
AKR1B10_R (SEQ ID NO:2) 5'-CCCCAGACTTGAATCCCTGTG-3'
Специалисту в данной области будет понятно, что могут быть подобраны и другие пары праймеров, различающиеся, например, по своей длине, по своей локализации относительно последовательности транскрипта гена AKR1B10, которые будут обеспечивать специфическую и эффективную амплификацию фрагмента транскрипта гена AKR1B10 даже в присутствии примеси геномной ДНК.
Количественная оценка уровня мРНК достигается с помощью параллельного проведения ПЦР с тестируемым транскриптом и контрольным/стандартным транскриптом. В качестве эндогенного внутреннего контроля, относительно которого проводилось нормирование продуктов амплификации исследуемого гена AKR1B10, выбраны «гены домашнего хозяйства», кодирующие бета 2-микроглобулин (В2М) - низкомолекулярный белок поверхностных антигенов клеточных ядер и глобулярный белок бета-актин (АСТВ). Экспрессия «генов домашнего хозяйства» (housekeeping genes) во всех клетках обычно примерно одинакова. Для этих двух выбранных генов в случае РТК показан наименьший разброс уровней транскрипции в нормальных и опухолевых тканях в сравнении с другими контрольными генами [Rubie С., Kempf K., Hans J., Su Т., Tilton В., Georg Т., Brittner В., Ludwig В., Schilling M. Housekeeping gene variability in normal and cancerous colorectal, pancreatic, esophageal, gastric and hepatic tissues. Mol. Cell Probes. 2005, 19:101-119].
Для анализа уровня транскрипции генов может быть использована стандартная ПЦР и ПЦР в реальном времени (ПЦР-РВ). В отличие от стандартного метода, где фиксируются только конечные продукты реакции. ПЦР в реальном времени использует флуоресцентно меченые олигонуклеотидные зонды для детекции ДНК в процессе ее амплификации, поэтому позволяет наблюдать накопление амплифицированных фрагментов в экспоненциальной фазе реакции, что увеличивает чувствительность метода. Зонд, комплементарный средней части амплифицируемого фрагмента, содержит на концах флуорофор и тушитель. Когда флуорофор и тушитель связаны с олигонуклеотидным зондом, наблюдается лишь незначительная флуоресцентная эмиссия. Во время процесса амплификации за счет 5'-экзонуклеазной активности Taq-полимеразы флуоресцентная метка переходит в раствор, освобождаясь от соседства с тушителем, и генерирует флуоресцентный сигнал, усиливающийся в реальном времени пропорционально накоплению амплификата.
Подбор зондов для проведения ПЦР-РВ может осуществляться в соответствии со стандартными рекомендациями производителя приборов для ПЦР-РВ. Если отсутствует необходимость мультиплексного анализа нескольких генов одновременно, экономичной альтернативой может быть система, использующая специфические к двухспиральной ДНК красители, например SYBR Green или EvaGreen, интенсивность флуоресценции которых возрастает в реальном времени пропорционально увеличению количества ампликонов. В таком варианте можно использовать праймеры без зонда. EvaGreen - насыщающий флуоресцентный краситель третьего поколения, специфически связывающийся с двухцепочечной ДНК. Этот краситель обладает низкой токсичностью и ингибирует полимеразную цепную реакцию в значительно меньшей степени, чем традиционные красители (такие, как SYBR Green), что позволяет использовать краситель в больших концентрациях и получать более высокий флуоресцентный сигнал. Использование насыщающего красителя позволяет также получать более точную информацию о содержании двухцепочечного фрагмента ДНК при данной температуре.
Для проведения ПЦР-РВ широко распространены реактивы фирм Applied Biosystems (США), BioRad (США) и др. Однако высокая стоимость реактивов ограничивает выполнение крупномасштабных исследований. Сравнение универсальных фирменных наборов фирмы Applied Biosystems (США) с отечественными наборами для ПЦР-РВ GenePakTM PCR Core («Изоген», Россия), набор («Синтол», Россия) и РиалитиТМ («Биочип-ИМБ», Россия) показало, что последний не уступает по всем основным параметрам фирменным наборам. Набор РиалитиТМ выбран для дальнейших исследований.
Варьирование концентраций праймеров для каждого контрольного и исследуемого генов от 100 до 500 нМ позволяет выбрать оптимальные концентрации, при которых амплитуда кривой, полученной в ходе ПЦР-РВ, была максимальна, а эффективность реакции (Е) близка к 100%.
Для проведения ПЦР в реальном времени различными фирмами разработаны амплификаторы, например: АВI Prism 7000 Sequence Detection System фирмы Applied Biosystems (США), Chromo4, MiniOpticon или iCycler iQ5 MJ Research (Bio-Rad), а также отечественные приборы ДТ-322 (ДНК-Технология), АНК-32 (Институт Аналитического Приборостоения РАН, http://www.syntol.ru/productank.htm) и т.д.
Применение ПЦР-РВ позволяет также уменьшить риск контаминации и автоматизировать процесс диагностики. Процесс продолжается от 40 минут до трех часов (в зависимости от используемого амплификатора) и включает одновременное проведение ПЦР, детекцию флуоресцентного сигнала, обработку данных и их представление в графическом виде (полной кинетической кривой) с помощью специального программного обеспечения. Результаты анализа становятся доступными сразу после завершения процесса и не требуют дополнительно очистки и анализа продуктов ПЦР.
Экспоненциальная стадия PCR описывается уравнением
где Pn - количество молекул продукта/репортерной флуоресценции к циклу n, Р0 - исходное количество молекул, содержащих амплифицируемый фрагмент, Е - эффективность амплификации. В идеальных условиях Е=2, т.е. на каждом цикле цепной реакции происходит удвоение количества продукта. После логарифмирования обеих частей уравнения 1 преобразуют его к виду
Пороговым циклом (threshold cycle, C(T)) называют такой цикл n, на котором достигается некий заданный уровень репортерной флуоресценции - пороговая флуоресценция PC(T)=const. Для n=С(Т) уравнение 2 принимает вид:
Т.е. значение С(Т) прямо пропорционально логарифму количества субстрата. Таким образом, ПЦР-РВ позволяет сравнивать количества субстрата при условии, что эффективность реакции и заданный уровень пороговой флуоресценции одинаковы для каждой из сравниваемых реакций.
Методы обработки данных ПЦР-РВ основаны на применении уравнения 3. Для обработки данных ПЦР-РВ используют два основных принципа: метод калибровочного графика и прямое сравнение данных.
1. Метод калибровочного графика. Этот метод предполагает построение калибровочного графика в координатах С(Т)-logP0 с серией разведений ДНК-стандарта, из которого находят концентрацию субстрата (Р0) в экспериментальных образцах. Предложены следующие варианты стандартов: очищенный RT-PCR-продукт; рекомбинантная ДНК; рекомбинантная РНК с последующей обратной транскрипцией; синтетический олигонуклеотид, содержащий амплифицируемую последовательность.
2. Метод прямого сравнения данных. Из уравнения 3 следует, что при равной эффективности реакции Е в образцах 1 и 2 относительная концентрация субстрата
R=P1/P2=E-(C(T)1-C(T)2)=E-ΔC(T)
Если провести нормализацию этих результатов по данным амплификации с контрольной последовательностью REF и, допуская, что реакция REF в обоих образцах протекает с эффективностью Eref, получаем
Если эффективности "контрольной" и "опытной" реакций сходны, приближенно можно записать
И, наконец, если обе реакции протекают со сходной эффективностью, близкой к 2, формула упрощается до вида
Свободно распространяемая программа REST выполняет расчеты по формуле 4 с дополнительным статистическим анализом для определения средних значений С(Т).
Далее настоящее изобретение будет подробно проиллюстрировано со ссылкой на конкретные примеры, представляющие собой наиболее предпочтительные воплощения данного изобретения. При этом должно быть понятно, что изобретение не ограничивается этими описанными воплощениями. Напротив, предполагается, что оно включает любые альтернативы, модификации или эквиваленты, допустимые с учетом сущности и объема изобретения.
Пример 1. Образцы тканей толстого кишечника
Анализировали 30 пар образцов тканей толстого кишечника (опухоль/норма) пациентов с РТК. Средний возраст пациентов, среди которых 22 мужчины и восемь женщин, составляет 62 года (диапазон 39-81 года). Для пациентов старше 50 лет составляет 80%. Диагноз в каждом случае устанавливали на основании результатов клинического, морфологического, эндоскопического и рентгенологического обследований. Все опухолевые образцы охарактеризованы согласно международной системе клинико-морфологической классификации опухолей TNM, где Т (tumor) - Т0-Т4 - категории, отражающие нарастание размера и/или местного распространения первичной опухоли, N (nodulus) - N0-N3 - категории, отражающие различную степень поражения метастазами регионарных лимфатических узлов; М (metastasis) - М0-М1 - характеризует отдаленные метастазы. Все возможные комбинации TNM объединяют в более крупные группы - стадии, отражающие течение опухолевого процесса. I стадия заболевания установлена у трех больных, II - у 13-ти, III - у четырех, IV - у шести. Никто из пациентов не подвергался до операции лучевой терапии и химиотерапии.
Пример 2. Выделение РНК из образцов тканей
Суммарную РНК выделяли из замороженных, измельченных в жидком азоте образцов опухолевых и нормальных тканей. Образцы тканей гомогенизировали на приборе Micro-Dismembrator U (Sartorius, Германия). Выделение РНК проводили с помощью набора "Rneasy Mini kit" или "Rneasy Micro kit" (Qiagen, США) согласно прилагаемым изготовителем протоколам, что позволяло эффективно избавиться не только от белков, труднорастворимых осадков гликопротеидов, ДНК, но и от низкомолекулярных РНК. Качество препарата РНК проверяли электрофорезом в 1%-ном агарозном геле в присутствии бромида этидия. Количество РНК определяли на спектрофотометре ND 1000 (NanoDrop Technologies). Для определения концентрации с помощью этого прибора достаточно 1 мкл раствора.
Пример 3. Реакция обратной транскрипции
Синтез первой цепи кДНК
На матрице РНК, выделенной, как описано в Примере 2, синтезировали одноцепочечную кДНК. Для получения кДНК использовали 10 пг - 5 мкг суммарной РНК, 200-500 нг oligo(dT)12-18 или 50-250 нг случайных гексамеров или 2 пмоля гено-специфичного праймера, Superscript™ III обратную транскриптазу (Invitrogen) - модифицированную M-MLV обратную транскриптазу с уменьшенной активностью РНКазы Н.
Условия реакции
Состав реакционной смеси (13 мкл):
| РНК (1 мкг/мкл) | 1,0 мкл |
| праймер oligo(dT)18 (50 мкМ) | 1,0 мкл |
| dNTP(10 мМ) | 1,0 мкл |
| стерильная деионизованная вода | 10,0 мкл |
Прогревали пробу при 65°С, 5 мин, помещали в лед и выдерживали 1 мин.
Добавляли 5 мкл смеси:
| буфер (Invitrogen) для построения 1-й цепи (5х) | 4,0 мкл |
| обратная транскриптаза Superscript™ III (Invitrogen) | 1,0 мкл |
Инкубировали при 50°С, 50 мин. Реакцию останавливали прогреванием при 70°С, 15 мин, и доводили объем пробы до 20 мкл.
Пример 4. Нормирование концентрации кДНК по контрольному гену
Образцы кДНК нормировали по контрольному гену АСТВ. Использовали праймеры, подобранные к разным экзонам гена АСТВ, причем один из праймеров перекрывает границу между экзонами:
ACTB_F: 5'-CCTTCCTGGGCATGGAGTC-3' и
ACTB_R: 5'-CTTGATCTTCATTGTGCTGGGT-3'.
Размер ПЦР-фрагмента составляет 191 п.н. Подбор условий проведения ПЦР осуществляли на нескольких образцах кДНК. Условия амплификации: предварительный прогрев при 94°С 3 мин; 94°С, 30 с, 59°С, 30 с и 72°С, 30 с - 26, 28 и 30 циклов; 72°С, 5 мин - 1 цикл.
ПЦР проводили на амплификаторе MasterCycler, Eppendorf (Германия) с нагревающейся крышкой или амплификаторе Терцик, ДНК-технология (Россия). Продукты амплификации анализировали в 1,8%-ном агарозном геле с 0,5 мкг/мл бромида этидия. В результате были подобраны оптимальные условия ОТ-ПЦР для АСТВ (26-28 циклов), при которых получали линейную зависимость между количеством продукта ПЦР и числом циклов. Все реакции амплификации повторяли трижды.
Интенсивность флуоресценции полос после электрофоретического разделения продуктов ПЦР оценивали количественно с помощью программы для денситометрии фотографий GeneProfiler (http://www/scanalytics.com) и выражали в виде значений относительной интенсивности норма/опухоль (N/T).
Пример 5. Подбор условий определения уровня мРНК гена AKR1B1O в образцах тканей кишечника стандартным полуколичественным методом ОТ-ПЦР
Протокол определения уровня мРНК
При подборе условий определения количества мРНК для амплификации одноцепочечной кДНК использовали геноспецифичные праймеры AKR1B10_F (SEQ ID NO:1) и AKR1B10_R (SEQ ID NO:2), которые были подобраны к разным экзонам гена AKR1B1O, причем один из праймеров перекрывает границу между экзонами. В этих условиях примеси геномной ДНК не влияют на результаты амплификации.
Размер ПЦР-фрагмента составлял 145 п.н. Подбор условий проведения ПЦР осуществляли на нескольких образцах кДНК. Амплификацию проводили в 25 мкл смеси, содержащей: 67 мМ Трис-HCl, рН 8,8, 16,6 мМ (NH4)2SO4, 0,1% Tween-20, 2,5 мМ MgCl2, 0,2 мМ каждого из dNTP, 0,1 мкг кДНК, 0,2 мкМ каждого из праймеров, 2 ед. активности ДНК-полимеразы SmarTaq (Dialat Ltd., Москва).
Условия проведения ПЦР:
Состав реакционной смеси (25 мкл):
| ПЦР-буфер (10х) | 2,5 мкл |
| MgCl2 (25 мМ) | 2,5 мкл |
| dNTP (10 мМ) | 0,5 мкл |
| праймер AKR1B10_F, 10 мкМ | 0,5 мкл |
| праймер AKR1B10_R, 10 мкМ | 0,5 мкл |
| кДНК (0,1 мкг/мкл) | 1,0 мкл |
| SmarTaq ДНК-полимераза, 5 ед./мкл | 0,3 мкл |
| стерильная деионизованная вода | 17,2 мкл |
Условия амплификации:
94°С, 3 мин - 1 цикл
94°С, 30 с; 56°С, 30 с; 72°С, 45 с 28, 30, 32 и 34 циклов
72°С, 5 мин - 1 цикл.
В результате были подобраны оптимальные условия ОТ-ПЦР для AKR1B10 (30-32 цикла), при которых получали линейную зависимость между количеством продукта ПЦР и числом циклов. Все реакции амплификации повторяли трижды.
Амплифицированные фрагменты гена AKR1B10 клонировали в векторе pGEM®-T Easy (Promega) и секвенировали. Их нуклеотидные последовательности полностью совпадали с последовательностями соответствующего фрагмента кДНК. Секвенирование проводили с помощью набора реактивов ABI PRISM® BigDye™ Terminator v.3.1 с последующим анализом продуктов реакции на автоматическом секвенаторе ДНК ABI PRISM 3100-Avant.
Пример 6. Определение изменения уровня мРНК гена AKR1B10 в образцах опухолевых тканей по сравнению с нормальными тканями методом ОТ-ПЦР
Протокол определения уровня мРНК
1. Приготовить master-mix, смешав все компоненты ПЦР кроме матрицы. Master-mix следует готовить из расчета 1 реакция объемом 25 мкл для каждого образца + 1 дополнительная реакция объемом 25 мкл. Состав реакционной смеси (25 мкл):
| ПЦР-буфер (10х) | 2,5 мкл |
| MgCl2 (25 мМ) | 2,5 мкл |
| dNTP (10 мМ) | 0,5 мкл |
| праймер AKR1B10_F, 10 мкМ | 0,5 мкл |
| праймер AKR1B10_R, 10 мкМ | 0,5 мкл |
| кДНК | 1,0 мкл |
| SmarTaq ДНК-полимераза, (Dialat Ltd., Москва) 5 ед/мкл | 0,3 мкл |
| стерильная деионизованная вода | 17,2 мкл |
2. В пробирки на 0,6 мл или 0,2 мл (помеченные для проведения 32 циклов амплификации) добавить по 24 мкл master-mix.
3. Добавить в пробирки по 1 мкл матрицы, перемешать пипетированием несколько раз.
4. В отдельной пробирке (контроль) смешать 24 мкл master-mix и 1 мкл стерильной деионизованной воды.
5. Добавить в каждую пробирку по 1 капле минерального масла (МР Biomedicals, LLC) и закрыть крышки пробирок (если ПЦР проводили на амплификаторе Терцик, ДНК-технология). В том случае, если ПЦР проводили на амплификаторе MasterCycler, Eppendorf, масло не добавляли.
6. Поместить пробирки в амплификатор и провести 30 циклов реакции амплификации.
7. После завершения реакции амплификации отобрать 4 мкл продуктов амплификации (30 циклов), продолжить реакции амплификации еще на 2 цикла, отобрать 4 мкл (32 цикла) и смешать с 2 мкл краски 6х Orange Loading Dye. Наносили образцы на 1,8%-ный а