Днк, повышающая продуцирование белка, и ее применение
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии и может быть использовано при производстве различных белковых продуктов с помощью технологии рекомбинантных ДНК. Определены и получены новые последовательности ДНК, относящиеся к областям прикрепления матрикса (MAR), которые характеризуются способностью повышать продуцирование белка в эукариотических клетках. Предложены способы трансфекции эукариотических клеток-хозяев, в том числе новый способ множественной трансфекции, основанные на применении активных последовательностей ДНК MAR по изобретению и обеспечивающие существенное повышение уровня экспрессии рекомбинантного белка по сравнению с аналогичными клетками, трансфицированными традиционными методами. 8 н. и 3 з.п.ф-лы, 20 ил., 9 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к очищенным и выделенным последовательностям ДНК, имеющим активность по повышению продуцирования белка, и, более конкретно, к применению областей прикрепления матрикса (MAR) для повышения активности продуцирования белка в эукариотической клетке. Также описан способ идентификации указанных активных областей, в частности, нуклеотидных последовательностей MAR, и применение этих охарактеризованных активных последовательностей MAR в новом способе множественной трансфекции.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В настоящее время принятой является модель организации эукариотических хромосом путем петлевых доменов (Boulikas T, "Nature of DNA sequences at the attachment regions of genes to the nuclear matrix", J.Cell Biochem., 52: 14-22,1993). Согласно данной модели хроматин организован в петли, которые охватывают 50-100 т.п.н., присоединенных к ядерному матриксу, белковой сети, состоящей из RNP и других негистоновых белков (Bode J, Stengert-Iber M, Kay V, Schalke T and Dietz-Pfeilstetter A, Crit. Rev. Euk. Gene Exp., 6: 115-138,1996).
Области ДНК, прикрепленные к ядерному матриксу, называются SAR или MAR, соответственно, по областям прикрепления к каркасу (во время метафазы) или матриксу (интерфаза) (Hart C and Laemmli U (1998), "Facilitation of chromatin dynamics by SARs" Curr Opin Genet Dev 8, 519-525).
Данные области как таковые могут определять границы независимых хроматиновых доменов, так что только окружающие цис-регуляторные элементы контролируют экспрессию генов в пределах данного домена.
Однако их способность полностью защищать хромосомный локус от близлежащих хроматиновых элементов и, таким образом, давать независимую от положения генную экспрессию не наблюдалась в стабильно трансфицированных клетках (Poljak L, Seum C, Mattioni T and Laemmli U. (1994) "SARs stimulate but do not confer position independent gene expression", Nucleic Acids Res 22, 4386-4394). С другой стороны, последовательности MAR (или S/MAR), как было показано, взаимодействуют с энхансерами, повышая доступность местного хроматина (Jenuwein T, Forrester W, Fernandez-Herrero L, Laible G, Dull M, and Grosschedl R. (1997) "Extension of chromatin accessibility by nuclear matrix attachment regions" Nature 385, 269-272). Конкретно, элементы MAR могут усиливать экспрессию гетерологичных генов в культивируемых клеточных линиях (Kalos M and Fournier R (1995) "Position-independent transgene expression mediated by boundary elements from the apolipoprotein B chromatin domain" Mol Cell Biol 15, 198-207), в трансгенных мышах (Castilla J, Pintado B, Sola, I, Sanchez-Morgado J, and Enjuanes L (1998) "Engineering passive immunity in transgenic mice secreting virus-neutralizing antibodies in milk" Nat Biotechnol 16, 349-354) и в растениях (Allen G, Hall GJ, Michalowski S, Newman W, Spiker S, Weissinger A, and Thompson W (1996), "High-level transgene expression in plant cells: effects of a strong scaffold attachment region from tobacco" Plant Cell 8, 899-913). Способность последовательностей MAR для разработки улучшенных векторов для генной терапии также выявлена (Agarwal M, Austin T, Morel F, Chen J, Bohnlein E, and Plavec I (1998), "Scaffold attachment region-mediated enhancement of retroviral vector expression in primary T cells" J Virol 72, 3720-3728).
Недавно было показано, что последовательности, модифицирующие структуру хроматина, включающие в себя MAR, на примере 5' MAR куриного лизоцима, способны значительно усиливать репортерную экспрессию в группах стабильных клеток яичника китайского хомячка (CHO) (Zahn-Zabal M, et al., "Development of stable cell lines for production or regulated expression using matrix attachment regions" J Biotechnol, 2001, 87(1): p. 29-42). Указанное свойство применяли для повышения доли высокопродуцирующих клонов, таким образом, снижая число клонов, которые необходимо подвергать скринингу. Указанные преимущества наблюдали в конструкциях с MAR, фланкирующими экспрессирующую трансген кассету, а также при совместной трансфекции конструкций с MAR на отдельной плазмиде. Однако уровни экспрессии после совместной трансфекции с MAR были не так высоки, как те, что наблюдались в конструкции, в которых две MAR ограничивают экспрессирующий трансген блок. Третий и предпочтительный процесс, как показано, представлял собой трансфекцию трансгенов с последовательностями MAR, как связанными с трангеном, так и находящимися на отдельной плазмиде (Girod et al., подано для публикации). Однако одним из сохраняющихся ограничений данного способа является количество ДНК на клетку, которое может трансфицироваться.
Многие протоколы множественной трансфекции разработаны для достижения высокой эффективности трансфекции при характеристике функции представляющих интерес генов. Протокол, применяемый Yamamoto et al, 1999 ("High efficiency gene transfer by multiple transfection protocol", Histochem. J. 31 (4), 241-243), приводит к эффективности трансфекции, примерно составляющей 80%, после 5 событий транфекции, в то время как при обычном протоколе трансфекции достигали уровня <40%. Хотя данный способ может использоваться, когда требуется повысить долю экспрессирующих клеток, он не приводит к образованию клеток с более высокой присущей им продуктивности. Поэтому он не может использоваться для образования моноклональных клеточных линий высокопродуцирующих клеток. Следовательно, ранее описанный способ имеет два основных недостатка: i) указанный способ не образует гомогенной популяции трансфицированных клеток, поскольку он не способствует интеграции дальнейшей генной копии, и не направляет трансгены в предпочтительные локусы хромосомы, ii) применение одного и того же маркера селекции в событиях множественной трансфекции не позволяет осуществлять селекцию дважды или трижды трансфицированных клеток.
В патентной заявке WO 02/074969 также было продемонстрировано применение MAR для разработки стабильных эукариотических клеточных линий. Однако в данной заявке не описано ни консервативной гомологии ДНК-элемента MAR, ни способа предсказания способности последовательности ДНК служить последовательностью MAR.
Фактически не было обнаружено какой-либо четкой консенсусной последовательности MAR (Boulikas T, "Nature of DNA sequences at the attachment regions of genes to the nuclear matrix", J. Cell Biochem., 52: 14-22, 1993), но эволюционно структура данных последовательностей кажется функционально консервативной в эукариотических геномах, поскольку MAR животных могут связываться с ядерными каркасами растений, и наоборот (Mielke C, Kohwi Y, Kohwi-Shigematsu T and Bode J, "Hierarchical binding of DNA fragments derived from scaffold-attached regions: correlation of properties in vitro and function in vivo", Biochemistry, 29: 7475-7485, 1990).
Идентификация MAR в биохимических исследованиях является длительным и непредсказуемым процессом; различные результаты могут быть получены в зависимости от анализа (Razin SV,"Functional architecture of chromosomal DNA domains", Crit Rev Eukaryot Gene Expr., 6: 247-269, 1996). С учетом огромного количества ожидаемых MAR в эукариотическом геноме и количества последовательностей, опубликованных в ходе геномных проектов, очень полезным был бы инструмент, способный отфильтровывать потенциальные MAR для проведения направленных экспериментов.
В настоящее время через Интернет доступны два различных предсказательных инструмента для MAR. Первый из них, MAR-Finder (http://futuresoft.org/MarFinder; Singh GB, Kramer JA and Krawetz SA, "Mathematical model to predict regions of chromatin attachment to the nuclear matrix", Nucleic Acid Research, 25: 1419-1425, 1997), основан на наборе профилей, идентифицированных в пределах различных MAR и на статистическом анализе совместного присутствия данных профилей. Предсказания MAR-Finder зависят от контекста последовательности, и это означает, что предсказанные MAR зависят от поданной на рассмотрение последовательности. Второе предсказательное программное обеспечение, SMARTest (http://www.genomatix.de; Frisch M, Frech K, Klingenhoff A, Cartharius K, Liebich I and Werner T, "In silico prediction of scaffold/matrix attachment regions in large genomic sequences", Genome Research, 12: 349-354,2001), использует весовые матрицы, происходящие из экспериментально идентифицированных MAR.
Сообщается, что SMARTest подходит для проведения широкомасштабных анализов. Но в действительности, из-за его относительно низкой специфичности количество гипотетических MAR при проведении им широкомасштабных анализов быстро становится огромным, и, поскольку SMARTest не имеет пути увеличения специфичности для снижения числа гипотетических MAR, он становится почти бесполезным для скрининга сильных MAR в больших последовательностях ДНК.
Также существуют некоторые другие программы, не доступные через Интернет; они также основаны на частоте мотивов MAR (критерий MRS; Van Drunen CM et al., "A bipartite sequence element associated with matrix/scaffold attachment regions", Nucleic Acids Res, 27: 2924-2930,1999), (ChrClass; Glazko GV et al., "Comparative study and prediction of DNA fragments associated with various elements of the nuclear matrix", Biochim. Biophys. Acta, 1517: 351-356,2001) или основаны на идентификации участков индуцированного стрессом ДНК-дуплекса (SIDD; Benham C and al., "Stress-induced duplex DNA destabilization in scaffold/matrix attachment regions", J. Mol. Biol., 274: 181-196, 1997). Однако остается неизвестным, подходят ли они для анализа геномных последовательностей, и не сообщается, могут ли данные инструменты обеспечить идентификацию повышающих продуцирование белка последовательностей.
Более того, вследствие относительно низкой специфичности данных программ (Frisch M, Frech K, Klingenhoff A, Cartharius K, Liebich I and Werner T, "In silico prediction of scaffold/matrix attachment regions in large genomic sequences", Genome Research, 12: 349-354, 2001) количество гипотетических MAR, идентифицированных в геномах, быстро становится неуправляемым при проведении широкомасштабных анализов, особенно если большинство из них не имеют активности или имеют слабую активность на практике. Таким образом, в отсутствие способа повышения специфичности предсказания для снижения числа гипотетических MAR многие из доступных программ становятся почти бесполезными для идентификации действенных генетических элементов в свете эффективного повышения продуцирования рекомбинантного белка.
Поскольку все указанные выше доступные способы предсказания имеют некоторые недостатки, которые предотвращают широкомасштабный анализ геномов для надежной идентификации новых и потенциальных MAR, целью данного изобретения является 1) понимание функциональных характеристик MAR, которые обеспечат улучшенную экспрессию рекомбинантного белка; 2) получение нового биоинформационного инструмента, компилирующего структурные характеристики MAR в виде предсказания функции, 3) выполнение широкомасштабных анализов геномов с целью идентификации новых и более действенных MAR и, наконец, 4) демонстрация улучшенной эффективности для повышения продуцирования рекомбинантных белков из эукариотических клеток или организмов при использовании новых идентифицированных последовательностей MAR.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данной цели достигали путем предоставления улучшенного и надежного способа идентификации последовательностей ДНК, имеющей активность по повышению продуцирования белка, в частности нуклеотидных последовательностей MAR, и применения данных охарактеризованных активных последовательностей MAR в новом способе множественной трансфекции для повышения продуцирования рекомбинантных белков в эукариотических клетках.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
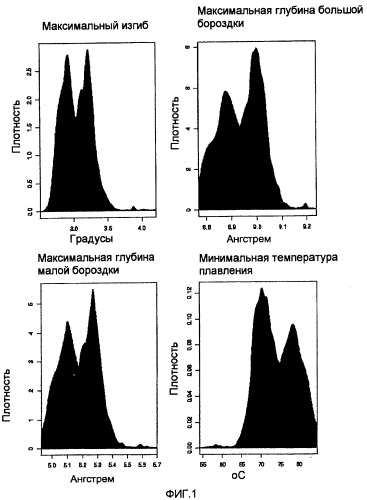
На фиг.1 приведены графики распределения MAR и не относящихся к MAR последовательностей. Гистограммы представляют собой графики плотности (относительная частота, разделенная на ширину элемента) по отношению к значению наблюдаемого параметра. Гистограмма плотности человеческих MAR в базе данных SMARt DB показана в черном цвете, тогда как гистограммы плотности для человеческой хромосомы 22 приведены серым.
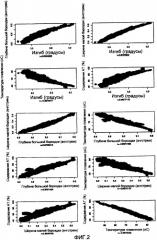
На фиг.2 приведены диаграммы рассеяния четырех различных критериев, использованных SMAR Scan®, и содержание AT в человеческих MAR из SMARt DB.
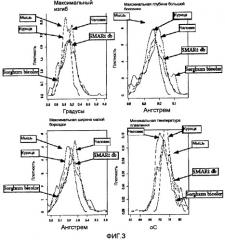
На фиг. 3 приведены графики распределения последовательностей MAR в организме. Последовательности MAR других организмов получены из SMARt и проанализированы. Распределения плотности последовательностей MAR для мыши, курицы, Sorghum bicolor и человека нанесены совместно.
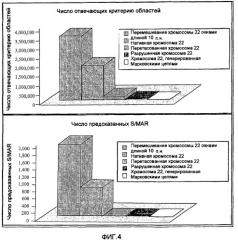
На фиг.4 приведены предсказания SMAR Scan® по человеческой хромосоме 22 и по перетасованной человеческой хромосоме 22. Верхний график: среднее число положительных результатов SMAR Scan®, полученных на пятикратно разрушенной, смешанной перетасованной неперекрывающимися окнами длиной 10 п.н. хромосоме 22 в модели Марковской цепи 1 порядка, и на нативной хромосоме 22. Нижний график: среднее число MAR, предсказанных SMAR Scan®.
На фиг.5 показан анализ способности 5'-MAR гена куриного лизоцима стимулировать экспрессию трансгена в клетках CHO-DG44. Фрагменты B, K и F характеризуются наиболее высокой способностью стимулировать экспрессию трансгена. Указанная относительная сила элементов основана на числе клеток с высоким уровнем экспрессии.
На фиг.6 показан эффект серийных делеций 5'-конца (верхняя часть) и 3'-конца (нижняя часть) 5'-MAR на потерю способности стимулировать экспрессию трансгена. Переход от повышенной к пониженной активности перекрывается с B-, K- и F-фрагментами.
На фиг.7 показано, что части F-фрагмента значимо стимулируют экспрессию трансгена. Области F-фрагмента, обозначенные светло-серой стрелкой, были мультимеризованы, встроены в pGEGFP-контроль и трансфицированы в клетки CHO. Элемент, который характеризуется наивысшей активностью, расположен в центральной части элемента и соответствует фрагменту Fill (помеченная черной полосой минимальная MAR). Кроме того, энхансерная активность расположена в 3'-фланкирующей части фрагмента Fill (помеченный темно-серой полосой энхансер MAR).
На фиг.8 приведена карта положений различных мотивов последовательности ДНК в cLysMAR.
На фиг.8 (B) представлена карта положений различных мотивов последовательности ДНК в cLysMAR. Вертикальные линии представляют собой положение предсказанных на компьютере участков или мотивов последовательности по 3034 парам оснований cLysMAR и его активных областей, как представлено на фиг.5. Предполагаемые участки факторов транскрипции (MEF2 05, Oct-1, USF-02, GATA, NFAT) для активаторов и (CDP, SATB1, CTCF, ARBP/MeCP2) для репрессоров транскрипции идентифицированы с использованием Matinspector (Genomatix), и островки CpG идентифицировали с использованием CPGPLOT. Мотивы, ранее ассоциированные с MAR-элементами, помечены черным и включают в себя CpG-динуклеотиды и CpG-островки, мотивы раскручивания (AATATATT и AATATT), поли-As и Ts, поли-Gs и Cs, участки связывания топоизомеразы II дрозофилы (GTNWAYATTNATTNATNNR), которые идентичны ядру длиной 6 п.н. и участкам связывания группы высокой подвижности I (HMG-I/Y). Другие структурные мотивы включают в себя участки связывания нуклеосомы и участки, неблагоприятные для связывания нуклеосомы, и мотив, который, как полагают, ослабляет сверхспирализованную цепь ДНК. На фиг.8 (A) приведено сравнение способности частей cLysMAR активировать транскрипцию с профилями коэффициента предсказания MAR, полученными посредством MarFinder. На верхней диаграмме показана активность фрагмента MAR, как на фиг.5, в то время как средняя и нижняя кривые показывают предсказанный MARFinder потенциал в плане активности MAR и в плане образования структур изогнутой ДНК соответственно.
На фиг.9 показана корреляция физико-химических свойств ДНК с активностью MAR. На фиг.9(A) представлены профили температуры плавления ДНК, изгибания двойной спирали, глубины большой бороздки и ширины малой бороздки 5'-MAR, и они определены с использованием алгоритмов Levitsky et al (Levitsky VG, Ponomarenko MP, Ponomarenko JV, Frolov AS, Kolchanov NA "Nucleosomal DNA property database", Bioinformatics, 15; 582-592, 1999). Наиболее активные фрагменты B, K и F, обозначенные вверху, соответствуют показанным на фигуре 1. На фиг.9(B) представлено увеличение данных, представленных на панели A для демонстрации карты фрагмента F, выровненной с графиками, соответствующими температуре плавления (верхняя кривая) и изгибанию ДНК (нижняя кривая). Положение наиболее активного фрагмента FIB и участка связывания белков - специфичных факторов транскрипции соответствует указанному.
На фиг.10 показано распределение предполагаемых участков связывания факторов транскрипции в пределах 5'-cLysMAR. Большие стрелки указывают положение элементов CUE, идентифицированных SMAR Scan®.
На фиг.11 показана схема соединения различных частей MAR. Указанные части cLysMAR амплифицировали путем ПЦР, вводили линкерные элементы BglII-BamHI с каждого конца и соединяли для получения обозначенных составных элементов. Например, верхняя конструкция состоит из соединения всех CUE и фланкирующих последовательностей в их исходном расположении, за исключением того, что каждый элемент отделяют линкерные последовательности BglII-BamHI.
На фиг.12 представлены карты плазмид.
На фиг.13 показано действие повторной транфекции первичных трансфектантов на экспрессию GFP. Клетки (CHO-DG44) повторно трансфицировали pSV40EGFP (левая пробирка) или pMAR-SV40EGFP (центральная пробирка) и pSVneo в качестве плазмиды устойчивости. Клетки, трансфицированные pMAR-SV40EGFP, повторно трансфицировали через 24 часа той же плазмидой и другой плазмидой селекции, pSVpuro (правая пробирка). После селекции в течение двух недель фенотип стабильно трансфицированной клеточной популяции анализировали посредством FACS.
На фиг.14 показано действие множественной загрузки содержащей MAR плазмиды. Вторичные трансфектанты pMAR-SV40EGFP/pMAR-SV40EGFP использовались в третьем цикле трансфекции в конце процесса селекции. Третичную трансфекцию проводили pMAR или pMAR-SV40EGFP с получением третичных трансфектантов. Через 24 часа клетки опять трансфицировали каждой плазмидой, происходящей из четвертичных трансфектантов (см. таблицу 4).
На фиг.15 показана сравнительная действенность алгоритмов предсказания SMAR на примере области WP18A10A7.
(A) Анализ путем SMAR Scan® проводили с настройками по умолчанию.
(B) Анализ SIDD (верхняя кривая и шкала слева) и связывание некоторых фрагментов ДНК с ядерным матриксом in vitro (гистограмма, шкала справа) приводили по Goetze et al (Goetze S, Gluch A, Benham C, Bode J, "Computational and in vitro analysis of destabilized DNA regions in the interferon gene cluster: potential of predicting functional gene domains." Biochemistry, 42: 154-166, 2003).
На фиг. 16 представлены результаты протокола, подобного генной терапии, с использованием MAR. Группа мышей, подвергнутая инъекции MAR-системой, индуцированной в начале эксперимента, характеризовалась улучшенной индукцией гематокрита по сравнению с мышами, инъецированными исходной системой без MAR. Через 2 месяца значения гематокрита в «МAR-содержащей группе» оставались по-прежнему на более высоком уровне (65%) по сравнению с нормальным гематокритом (45-55%).
На фиг.17 представлена диаграмма рассеяния процентных долей нуклеотидов AT (верх) и TA (низ) для 1757 последовательностей S/MAR в зависимости от предсказанного изгибания ДНК, вычисленного посредством SMAR Scan®.
На фиг.18 представлены графики распределения процентных долей динуклеотидов по 1757 не относящимся к S/MAR последовательностям.
На фиг.19 показано влияние различных элементов S/MAR на продуцирование рекомбинантного зеленого флуоресцирующего белка (GFP). Популяции клеток CHO, трансфицированных экспрессирующим GFP вектором, содержащим MAR-элемент, как указано, анализировали на сортере активированных флуоресценцией клеток (FACS®), и приведены типичные профили. Профили показывают подсчет числа клеток как функцию уровня флуоресценции GFP.
На фиг.20 обозначено действие индукции гематокрита у мышей, подвергнутых инъекции MAR-системой.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к очищенным и выделенным последовательностям ДНК, имеющим активность по повышению продуцирования белка, характеризующимся тем, что указанная последовательность ДНК включает в себя по меньшей мере один элемент изогнутой ДНК и по меньшей мере один участок связывания ДНК-связывающего белка.
Некоторые последовательности ДНК, как известно, образуют относительно «статичную кривую», где ДНК следует конкретному 3-мерному пути. Таким образом, вместо пребывания в нормальной В-конформации ДНК («прямой»), отрезок ДНК может образовывать плоскую, планарную кривую, также определяемую как изогнутая ДНК (Marini, et al, 1982 "Bent helical structure in kinetoplast DNA", Proc. Natl. Acad. Sci. USA, 79: 7664-7664).
Неожиданно авторами настоящего изобретения было показано, что элемент изогнутой ДНК из очищенной и выделенной последовательности ДНК, имеющей активность по повышению продуцирования белка, согласно изобретению обычно содержит по меньшей мере 10% динуклеотида TA и/или по меньшей мере 12% динуклеотида AT в отрезке из 100 следующих друг за другом пар оснований. Предпочтительно элемент изогнутой ДНК содержит по меньшей мере 33% динуклеотида TA и/или по меньшей мере 33% динуклеотида AT в отрезке из 100 следующих друг за другом пар оснований. Эти данные получены описанным далее способом.
Очищенная и выделенная последовательность ДНК согласно изобретению обычно содержит нуклеотидную последовательность MAR, выбранную из группы, состоящей из последовательностей SEQ ID No: 1-27, или элемент cLysMAR или его фрагмент.
Предпочтительно очищенная и выделенная последовательность ДНК представляет собой нуклеотидную последовательность MAR, выбранную из группы, состоящей из последовательностей SEQ ID No: 1-27, более предпочтительно из последовательностей SEQ ID No: 24-27.
Также к настоящему изобретению относятся комплементарные последовательности указанных выше последовательностей SEQ ID No: 1-27 и элемент или фрагмент cLysMAR, который может быть продуцирован с использованием ПЦР или другими средствами.
«Элемент» представляет собой консервативную нуклеотидную последовательность, которая несет общие функциональные свойства (т.е. участки связывания факторов транскрипции) или структурные черты (т.е. последовательность изогнутой ДНК).
Часть последовательностей SEQ ID No: 1-27 и элемента или фрагмента cLysMAR относится к последовательностям, имеющим по меньшей мере 70% нуклеотидов в длину с последовательностью, соответствующей SEQ ID No: 1-27. Данные последовательности могут использоваться до тех пор, пока они проявляют те же свойства, что и природная последовательность, из которой они происходят. Предпочтительно данные последовательности имеют более 80%, в частности более 90%, нуклеотидов в длину по сравнению с соответствующей последовательностью SEQ ID No: 1-27.
Настоящее изобретение также включает в себя варианты указанных выше последовательностей SEQ ID No: 1-27 и элемента или фрагмента cLysMAR, то есть нуклеотидные последовательности, которые изменяются по сравнению с указанными последовательностями за счет консервативных нуклеотидных замен, при которых один или несколько нуклеотидов замещаются на другие с теми же характеристиками.
Последовательности SEQ ID No: 1-23 идентифицировали путем сканирования человеческой хромосомы 1 и 2 с использованием SMAR Scan®, показав, что идентификации новых последовательностей MAR реальна с использованием описанных здесь и далее инструментов, тогда как SEQ ID No: 24-27 идентифицировали путем сканирования полного генома человека с использованием комбинированного способа SMAR Scan®.
На первой стадии полноразмерную хромосому 1 и 2 подвергали скринингу для идентификации элемента изогнутой ДНК как области, соответствующей наиболее сильному изгибу, глубине большой бороздки, ширине малой бороздки и минимальной температуре плавления, показанным на фигуре 3. На второй стадии данный набор последовательностей сканировали на предмет участков связывания регуляторных белков, таких как SATB1, GATA, и т.д., как показано на фигуре 8B), что давало последовательности SEQ ID No: 1-23.
Более того, последовательности 21-23, как было показано далее, расположены за известным геном из Human Genome Data Base.
Что касается SEQ ID No: 24-27, то данные последовательности были получены путем сканирования человеческого генома комбинированным способом и выбраны в качестве примеров из 1757 MAR-элементов, выявленных таким путем.
Молекулярные химеры последовательностей MAR также относятся к настоящему изобретению. Под молекулярной химерой подразумевается нуклеотидная последовательность, которая может включать в себя функциональную часть элемента MAR и которая может быть получена способами молекулярной биологии, известными специалистам в данной области.
Конкретные комбинации элементов или фрагментов MAR или их подчастей также относятся к настоящему изобретению. Данные фрагменты могут быть получены различными способами, известными в данной области. Данные способы включают в себя в качестве неограничивающих примеров расщепление ферментами рестрикции и получение фрагментов, химический синтез или полимеразные цепные реакции (ПЦР).
Поэтому конкретные комбинации элементов или фрагментов последовательностей SEQ ID No: 1-27 и элементов или фрагментов cLysMAR также относятся к настоящему изобретению, в зависимости от функциональных результатов, которые нужно получить. Элементы cLysMAR, например, представляют собой B-, K- и F-области, описанные в WO 02/074969, описание которых включено сюда полностью в качестве ссылки. Предпочтительные элементы cLysMAR, использованные согласно изобретению, представляют собой B-, K- и F-области. Только один элемент может использоваться, или могут использоваться множественные копии одного и того же или различных элементов (мультимеризованные элементы) (см. фиг.8 A)).
Под фрагментом подразумевается часть соответствующей нуклеотидной последовательности. Фрагменты нуклеотидной последовательности могут сохранять биологическую активность и, следовательно, связываться с очищенными ядерными матриксами и/или изменять профили экспрессии кодирующих последовательностей, функционально связанных с промотором. Фрагменты нуклеотидной последовательности MAR могут изменяться примерно от 100 до 1000 п.н., предпочтительно примерно от 200 до 700 п.н., более предпочтительно примерно от 300 до 500 п.н. Также рассматриваются любые комбинации фрагментов, которые имеют то же число нуклеотидов, что присутствует в синтетической последовательности MAR, состоящей из природного элемента MAR и/или фрагментов. Фрагменты предпочтительно соединены линкерными последовательностями. Предпочтительные линкеры представляют собой линкер BglII-BamHI.
«Активность по повышению продуцирования белка» относится к активности очищенной и выделенной последовательности ДНК, определяемой следующим образом: после введения в подходящих условиях в эукариотическую клетку хозяина последовательность способна повышать уровень продуцирования белка в культуре клеток по сравнению с культурой клеток, трансфицированной без указанной последовательности ДНК. Обычно повышение составляет от 1,5- до 10-кратного, предпочтительно от 4- до 10-кратного. Это соответствует скорости продуцирования или специфичной клеточной продуктивности, составляющей по меньшей мере 10 пг на клетку в сутки (см. пример 11 и фиг.13).
При использовании здесь предложены следующие определения для облегчения понимания данного изобретения.
«Хроматин» представляет собой белковый материал и материал нуклеиновой кислоты, составляющий хромосомы эукариотической клетки, и относится к ДНК, РНК и ассоциированным белкам.
«Элемент хроматина» означает последовательность нуклеиновой кислоты на хромосоме, обладающую свойствами по модификации структуры хроматина при интеграции в данную хромосому.
«Цис» относится к расположению двух или большего числа элементов (таких как элементы хроматина) на одной молекуле нуклеиновой кислоты (такой как один и тот же вектор, плазмида или хромосома).
«Транс» относится к расположению двух или большего числа элементов (таких как элементы хроматина) на двух или большем числе различных молекул нуклеиновой кислоты (например, на двух векторах или двух хромосомах).
Модифицирующие хроматин элементы, которые потенциально способны преодолевать эффекты положения и, следовательно, вызывают интерес в плане разработки стабильных клеточных линий, включают в себя граничные элементы (BE), участки прикрепления матрикса (MAR), области контроля локуса (LCR) и универсальные элементы открытия хроматина (UCOE).
Граничные элементы («BE»), или инсуляторные элементы, во многих случаях определяют границы хроматина (Bell A and Felsenfeld G. 1999; "Stopped at the border: boundaries and insulators, Curr Opin Genet Dev 9, 191-198) и могут играть роль в определении транскрипционного домена in vivo. BE не имеют присущей промоторной/энхансерной активности, но, тем не менее, как полагают, защищают гены от транскрипционного влияния регуляторных элементов в окружающем хроматине. Для идентификации инсуляторных элементов обычно применяют анализ энхансерного блока. В данном анализе элемент хроматина помещают между энхансером и промотором и измеряют активированную энхансером транскрипцию. Граничные элементы, как было показано, могут защищать стабильно трансфицированные репортерные гены от эффектор положения в клетках дрозофилы, дрожжей и млекопитающих. Также было показано, что они повышают долю трансгенных мышей с индуцированной экспрессией трансгена.
Области контроля локуса («LCR») являются цис-регуляторными элементами, требуемыми для исходной активации хроматина локуса и последующей транскрипции генов в их природных участках (Grosveld, F. 1999,"Activation by locus control regions?" Curr Opin Genet Dev 9, 152-157). Активирующая функция LCR также обеспечивает экспрессию связанного трансгена в подходящей ткани у трансгенных мышей, независимо от участка интеграции в геном хозяина. Хотя LCR, в общем, обеспечивают тканеспецифический уровень экспрессии связанных генов, эффективная экспрессия почти во всех тканях трансгенных мышей сообщалась для укороченного LCR человеческого T-клеточного рецептора и LCR крысиного LAP. Наиболее интенсивно охарактеризованным LCR является таковой из локуса глобина. В настоящее время оценивается его применение в векторах для генной терапии серповидноклеточной анемии и β-талассемии.
«MAR» по принятой модели могут опосредовать заякоривание специфичной последовательности ДНК в ядерном матриксе с образованием петлевых доменов хроматина, которые простираются в стороны от ядер гетерохроматина. Хотя MAR не содержат какой-либо очевидной консенсусной или распознаваемой последовательности, их наиболее присущей чертой оказывается общее высокое содержание A/T и преобладание оснований C на одной цепи (Bode J, Schlake T, Rios Ramirez M, Mielke C, Stengart M, Kay V and Klehr Wirth D, "Scaffold/matrix-attached regions: structural propreties creating transcriptionally active loci", Structural and Functional Organization of the Nuclear Matrix: International Review of Citology, 162A: 389-453,1995). Данные области имеют склонность образовывать изогнутые вторичные структуры, которые склонны к разделению цепей. Они часто обозначаются как области неспаренных оснований (BUR), и они содержат элемент-ядро раскручивания (CUE), который может представлять собой точку образования разделения цепей (Benham C and al., Stress induced duplex DNA destabilization in scaffold/matrix attachment regions, J. Mol Biol, 274: 181-196, 1997). Некоторые простые AT-богатые мотивы последовательности часто находятся в последовательностях MAR, но, по большей части, их функциональная значимость и потенциальный способ действия остается неясным. Данные мотивы включают в себя A-бокс (AATAAAYAAA), T-бокс (TTWTWTTWTT), мотивы раскручивания ДНК (AATATATT, AATATT), участки связывания SATB1 (H-бокс, A/T/C25) и консенсусные участки топоизомеразы II позвоночных (RNYNNCNNGYNGKTNYNY) или дрозофилы (GTNWAYATTNATNNR).
Универсальные элементы открытия хроматина («UCOE», также известные как «повсеместно действующие элементы открытия хроматина») описаны в WO 00/05393.
«Энхансер» представляет собой нуклеотидную последовательность, которая действует, усиливая транскрипцию генов независимо от сущности гена, положения данной последовательности по отношению к гену или ориентации данной последовательности. Векторы согласно изобретению необязательно включают в себя энхансеры.
«Ген» представляет собой дезоксирибонуклеотидную (ДНК) последовательность, кодирующую данный зрелый белок.
Используемый здесь термин «ген» не будет включать в себя нетранслируемые фланкирующие области, такие как сигналы инициации транскрипции РНК, участки полиаденилирования, промоторы или энхансеры.
«Ген продукта» представляет собой ген, который кодирует белковый продукт, имеющий требуемые характеристики, такие как диагностическое или терапевтическое применение. Ген продукта включает в себя, например, структурные гены и регуляторные гены.
«Структурный ген» относится к гену, который кодирует структурный белок. Неограничивающие примеры структурных генов включают в себя белки цитоскелета, белки внеклеточного матрикса, ферменты, белки ядерных пор и белки ядерного каркаса, ионные каналы и транспортеры, контрактильные белки и шапероны. Предпочтительные структурные гены кодируют антитела или фрагменты антител.
«Регуляторный ген» относится к гену, который кодирует регуляторный белок. Неогранивающие примеры регуляторных белков включают факторы транскрипции, гормоны, факторы роста, цитокины, молекулы трансдукции сигнала, онкогены, протоонкогены, трансмембранные рецепторы и протеинкиназы.
«Ориентация» относится к порядку нуклеотидов в данной последовательности ДНК. Например, обращенная ориентация последовательности ДНК представляет собой ту, в которой порядок 5'-3' последовательности по отношению к другой последовательности обратен по отношению к точке сравнения в ДНК, из которой получали данную последовательность. Такие точки сравнения могут включать в себя направление транскрипции других определенных последовательностей ДНК в исходной ДНК и/или точки начала репликации реплицируемых векторов, содержащих последовательность.
«Эукариотическая клетка» относится к любой клетке млекопитающего и к не относящейся к млекопитающему клетке из эукариотического организма. В качестве неограничивающего примера к изобретению относится любая эукариотическая клетка, способная поддерживаться в условиях культивирования клеток и впоследствии трансфицироваться. Особо предпочтительные клеточные типы включают в себя, например, стволовые клетки, эмбриональные стволовые клетки, клетки яичника китайского хомячка (CHO), COS, BHK21, NIH3T3, HeLa, C2C12, раковые клетки и первичные дифференцированные или недифференцированные клетки. Другие подходящие клетки хозяина известны специалистам в данной области.
Термины «клетка хозяина» и «рекомбинантная клетка хозяина» используются здесь взаимозаменяемо и обозначают эукариотическую клетку, в которую введены один или несколько векторов по изобретению. Понятно, что такие термины относятся не только к конкретной указанной клетке, но также и к потомству и потенциальному потомству такой клетки. Поскольку в последовательных поколениях могут происходить некоторые модификации вследствие мутации или влияний окружающей среды, такое потомство, фактически, может не быть идентично родительской клетке, но все равно входит в объем применяемого здесь термина.
Термины «введение очищенной ДНК в эукариотические клетки хозяина» или «трансфекция» обозначают любой способ, в котором внеклеточная ДНК, с сопровождающим материалом или без него, входит в клетку хозяина. Термин «клетка трансфицирована» или «трансфицированная клетка» означает клетку, в которую введена внеклеточная ДНК, и она, таким образом, несет внеклеточную ДНК. ДНК может вводиться в клетку так, что нуклеиновая кислота может реплицироваться в качестве интегрированного в хромосому или экстрахромосомного элемента.
Используемый здесь термин «промотор» относится к последовательности нуклеиновой кислоты, которая регулирует экспрессию гена.
«Совместная трансфекция» означает процесс трансфицирования эукариотической клетки более чем одним экзогенным геном, или вектором, или плазмидой, чужеродной в отношении данной клетки, один или несколько из которых придает клетке подлежащий селекции фенотип.
Очищенная и выделенная последовательность ДНК, имеющая активность по повышению продуцирования белка, также включает в себя, кроме одного или нескольких элементов изогнутой ДНК по меньшей мере один участок связывания ДНК-связывающего белка.
Обычно ДНК-связывающий белок представляет собой фактор транскрипции. Примерами факторов транскрипции служит группа, содержащая белки с доменом polyQpolyP. Другим примером фактора транскрипции является фактор транскрипции, выбранный из группы, включающей в себя SATB1, NMP4, MEF2, S8, DLX1, FREAC7, BRN2, GATA 1/3, TATA, Bright, MSX, AP1, C/EBP, CREBP1, FOX, Freac7, HFH1, HNF3-альфа, Nkx25, POU3F2, Pit1, TTF1, XFD1, AR, C/EBP-гамма, Cdc5, FOXD3, HFH3, HNF3-бета, MRF2, Oct1, POU6F1, SRF, V$MTATA_B, XFD2, Bach2, CDP CR3, Cdx2, FOXJ2, HFL, HP1, Myc, PBX, Pax3, TEF, VBP, XFD3, Brn2, COMP1, Evil, FOXP3, GATA4, HFN1, Lhx3, NKX3A, POU1F1, Pax6, TFIIA, или предпочтительна комбинация одного или нескольких факторов транскрипции. Наиболее предпочтительными являются SATB1, NMP4, MEF2 и белки с доменом polyQpolyP.
SATB1, NMP4 и MEF2, например, как известно, регулируют развитие и/или тканеспецифическую генную экспрессию у млекопитающих. Данные факторы транскрипции способны изменять геометрию ДНК, и, наоборот, связывание с ДНК, как с аллостерическим лигандом, модифицирует их структуру. Недавно было обнаружено, что SATB1 образует подобную клетке структуру, ограничивающую хроматин (Cai S, Han HJ, and Kohwi-Shigematsu T, "Tissue-specific nuclear architecture and gene expression regulated by SATB1" Nat Genet, 2003, 34(1): p. 42-51).
Еще одной целью настоящего изобретения является предоставление очищенного и выделенного элемента cLysMAR и/или его фрагмента, комплементарной ему последовательности, его части, захватывающей по меньшей мере 70% нуклеотидов в длину, его молекулярной химеры, их комбинаций и вариантов.