Способ производства пероксида водорода и хлората
Иллюстрации
Показать всеИзобретение относится к способу производства хлората щелочного металла, включающему в себя: обеспечение электрохимической ячейки, содержащей анод и катод в отдельных анодной и катодной камерах; контактирование катода с электролитом, содержащим по меньшей мере один органический медиатор и одну или более органическую или неорганическую кислоты; реагирование органического медиатора на катоде с образованием по меньшей мере одной восстановленной формы этого медиатора; реагирование упомянутой по меньшей мере одной восстановленной формы медиатора с кислородом с образованием пероксида водорода; контактирование анода с анолитом, содержащим хлорид щелочного металла; реагирование хлорида на аноде с образованием хлора, который гидролизуется; и реагирование гидролизованного хлора с образованием хлората. Способ обеспечивает повышение эффективности производства хлората щелочного металла. 18 з.п. ф-лы, 4 ил.
Реферат
Настоящее изобретение относится к способу производства хлората щелочного металла в диафрагменной электрохимической ячейке.
Хлорат щелочного металла и особенно хлорат натрия является важным химическим реагентом, особенно в целлюлозно-бумажной промышленности в качестве сырья для производства диоксида хлора, широко используемого при отбеливании. Традиционно хлорат щелочного металла производят электролизом хлоридов щелочных металлов в открытых бездиафрагменных электролитических ячейках, оснащенных катодами выделения водорода. Общая химическая реакция, протекающая в таких ячейках, следующая:
MCl + 3H2O → MClO3 + 3H2,
где М - щелочной металл.
Этот способ очень эффективен, хотя выделяющийся на катоде газообразный водород создает некоторое перенапряжение, увеличивающее энергопотребление.
Пероксид водорода также широко используется в целлюлозно-бумажной промышленности, и его обычно производят антрахиноновым способом с чередующимся гидрированием и окислением антрахинонов и/или тетрагидроантрахинонов в рабочем растворе. Этот способ, хотя и является очень эффективным, сложен в эксплуатации и требует разнообразного оборудования. До сих пор не было предложено альтернативных конкурентоспособных способов, за исключением относящихся к очень специальным случаям.
В WO 2004/005583 описывается производство хлората щелочного металла в электролитической ячейке, разделенной катионселективным сепаратором на анодную камеру, в которой находится анод, и катодную камеру, в которой находится газодиффузионный электрод. Кислород подают в катодную камеру и подвергают электролизу с образованием гидроксида щелочного металла.
Электрохимическое производство щелочного раствора пероксида водорода путем восстановления кислорода на катоде описывается, например, в US 6322690.
Электрохимическое производство щелочного раствора пероксида водорода путем восстановления кислорода на катоде с одновременным получением хлората натрия описывается в работе E.E. Kalu и C. Oloman «Одновременный электросинтез щелочного пероксида водорода и хлората натрия» ("Simultaneous electrosynthesis of alkaline hydrogen peroxide and sodium chlorate"), Journal of Applied Electrochemistry, 20 (1990), 932-940.
E.L. Gyenge и C.W. Oloman в работах «Электросинтез пероксида водорода в кислых растворах путем опосредованного восстановления кислорода в трехфазной (водной/органической/газовой) системе, Часть I: Структура эмульсии, кинетика электродных процессов и периодический электролиз» ("Electrosynthesis of hydrogen peroxide in acidic solutions by mediated oxygen reduction in a three-phase (aqueous/organic/gaseous) system Part I: Emulsion structure, electrode kinetics and batch electrolysis"), Journal of Applied Electrochemistry, (2003), 33(8), 655-663; и «Электросинтез пероксида водорода в кислых растворах путем опосредованного восстановления кислорода в трехфазной (водной/органической/газовой) системе, Часть II: Эксперименты в проточных электрохимических ячейках с неподвижным слоем и трехфазным потоком» ("Electrosynthesis of hydrogen peroxide in acidic solutions by mediated oxygen reduction in a three-phase (aqueous/organic/gaseous) system. Part II: Experiments in flow-by fixed-bed electrochemical cells with three-phase flow"), Journal of Applied Electrochemistry, (2003), 33(8), 665-674, описывают производство пероксида водорода путем электролитического восстановления 2-этил-9,10-антрахинона до соответствующего антрагидрохинона, растворенного в органической фазе, эмульгированной в воде. Этот антрагидрохинон подвергается реакции с газообразным кислородом с получением пероксида водорода.
В JP 61-284591 и US 4067787 описано производство пероксида водорода путем восстановления водорастворимого производного антрахинона в водном растворе с последующей реакцией с кислородом.
A. Huissoud и P. Tissot в работе «Электрохимическое восстановление 2-этил-9,10-антрахинона на сетчатом стекловидном углероде и опосредованное образование пероксида водорода» ("Electrochemical reduction of 2-ethyl-9,10-anthraquinone on reticulated vitreous carbon and mediated formation of hydrogen peroxide"), Journal of Applied Electrochemistry (1998), 28(6), 653-657, описывают электрохимическое восстановление 2-этил-9,10-антрахинона в диметоксиэтане, содержащем 5% воды и 0,1 моль/литр тетрафторбората тетраэтиламмония.
Электрохимическое восстановление кислорода на углеродном катоде с привитым антрахиноном описано, например, в WO 02/02846, Mirkhalaf, Fakhradin; Tammeveski, Kaido; Schiffrin, David J., «Влияния заместителей на электрокаталитическое восстановление кислорода на модифицированных хиноном стеклоуглеродных электродах» ("Substituent effects on the electrocatalytic reduction of oxygen on quinone-modified glassy carbon electrodes"), Phys. Chem.Chem.Phys.(2004), 6(6), 1321-1327 и Vaik, Katri; Schiffrin, David J.; Tammeveski, Kaido, «Электрохимическое восстановление кислорода на предварительно анодно обработанных и химически привитых стеклоуглеродных электродах в щелочных растворах» ("Electrochemical reduction of oxygen on anodically pre-treated and chemically grafted glassy carbon electrodes in alkaline solutions"), Electrochemistry Communications (2004), 6(1), 1-5.
Vaik, Katri; Sarapuu, Ave; Tammeveski, Kaido; Mirkhalaf, Fakhradin; Schiffrin, David J. в работе «Восстановление кислорода на модифицированных фенантренхиноном стеклоуглеродных электродах в 0,1 М КОН» ("Oxygen reduction on phenanthrenequinone-modified glassy carbon electrodes in 0.1 M KOH"), Journal of Electroanalytical Chemistry (2004), 564(1-2), 159-166, описывают использование катода с привитым фенантренхиноном.
В WO 03/004727 описан электросинтез органических соединений путем электрохимического превращения соединения в присутствии электролита, содержащего ионную жидкость комнатной температуры, и извлечения продукта.
Задачей изобретения является обеспечение эффективного способа производства хлората щелочного металла.
Еще одной задачей изобретения является обеспечение способа, обеспечивающего возможность одновременного производства хлората щелочного металла и пероксида водорода.
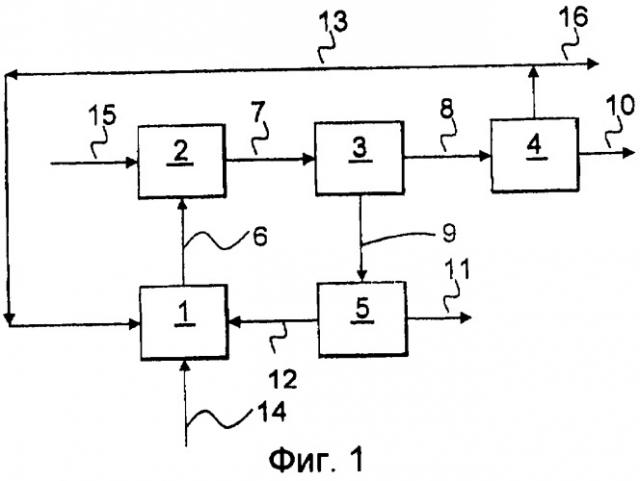
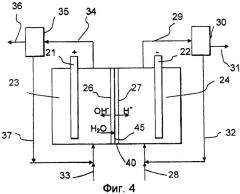
Изобретение относится к способу производства хлората щелочного металла, включающему в себя:
обеспечение электрохимической ячейки, содержащей анод и катод в отдельных анодной и катодной камерах;
контактирование катода с католитом, содержащим по меньшей мере один органический медиатор и одну или более органическую или неорганическую кислоты;
реагирование органического медиатора на катоде с образованием по меньшей мере одной восстановленной формы этого медиатора;
реагирование упомянутой по меньшей мере одной восстановленной формы медиатора с кислородом с образованием пероксида водорода;
контактирование анода с анолитом, содержащим хлорид щелочного металла;
реагирование хлорида на аноде с образованием хлора, который гидролизуется; и
реагирование гидролизованного хлора с образованием хлората.
Предпочтительно пероксид водорода отделяют от католита в качестве продукта или используют в качестве реагента для производства других химикатов без выделения из электролита. Однако в случае, если пероксид водорода на данной производственной площадке не нужен, можно также просто уничтожить его, например, путем каталитического разложения.
Анолит может иметь концентрацию хлорид-ионов вплоть до насыщения, предпочтительно от примерно 30 до примерно 300 г/л, более предпочтительно от примерно 50 до примерно 250 г/л, наиболее предпочтительно от примерно 80 до примерно 200 г/л, в расчете на хлорид натрия. Обычно анолит также содержит, по меньшей мере, некоторое количество хлората, предпочтительно от примерно 1 до примерно 1200 г/л, в расчете на хлорат натрия. В одном из вариантов осуществления его предпочтительное содержание составляет от примерно 300 до примерно 650 г/л, наиболее предпочтительно от примерно 500 до примерно 650 г/л, в расчете на хлорат натрия. В другом варианте осуществления его предпочтительное содержание составляет от примерно 1 до примерно 50 г/л, наиболее предпочтительно от примерно 1 до примерно 30 г/л, в расчете на хлорат натрия.
Для стимулирования гидролиза хлора рН в объеме анолита предпочтительно составляет, по меньшей мере, примерно 4, наиболее предпочтительно от примерно 4 до примерно 10. Следует понимать, что могут иметь место локальные отклонения величины рН и, в частности, могут существовать локальные зоны со значительно более низким рН, так как образуются протоны.
Для подавления нежелательных побочных реакций возможно вводить в анолит хромат, дихромат щелочного металла или другой подходящий рН буфер. Если в анолите присутствует хромат или дихромат, его содержание предпочтительно составляет от примерно 0,01 до примерно 10 г/л, наиболее предпочтительно от примерно 0,01 до примерно 6 г/л, в расчете на хромат натрия. Однако также возможно работать, по существу, в отсутствие хромата в анолите.
Если не указано иное, все концентрации в г/л даны относительно объема реального раствора.
Температура анолита предпочтительно составляет от примерно 20 до примерно 100°С, наиболее предпочтительно от примерно 40 до примерно 90°С.
Соответственно, большая часть хлора, образовавшегося в анодной камере, растворяется в растворе-анолите. Растворенный хлор самопроизвольно претерпевает частичный гидролиз с образованием хлорноватистой кислоты в соответствии с уравнением
Cl2 + H2O → HClO + HCl
Хлорноватистая кислота претерпевает диспропорционирование (в некоторых литературных источниках именуемое «автоокислением») до хлората в соответствии с общим уравнением
2HClO + ClO- → ClO3 - + 2Cl- + 2H+
Диспропорционирование может иметь место в данной ячейке, в отдельном хлоратном реакторе или и там, и там.
Предпочтительно анолит из анодной камеры, также именуемый «хлоратным электролитом» и обычно содержащий хлор и/или хлорноватистую кислоту, подают в хлоратный реактор для осуществления реакций диспропорционирования с получением хлората. Хлоратный реактор может быть обычного типа, например, как описанный в US 5419818, и может включать в себя одну или несколько хлоратных емкостей.
Когда диспропорционирование в достаточной мере завершено, хлоратный электролит может быть подан в кристаллизатор для осаждения и извлечения твердого хлората щелочного металла. Маточный раствор из кристаллизатора, обычно содержащий непрореагировавшие хлорид-ионы, гипохлорит и хлорат, затем предпочтительно рециркулируют в анодную камеру электрохимической ячейки для образования анолита вместе со свежедобавленным хлоридом щелочного металла. Также можно использовать хлоратный электролит как таковой без проведения кристаллизации, например, в качестве сырья, подаваемого в генератор диоксида хлора. Такой вариант осуществления является выгодным в интегрированном процессе, в котором обедненный в генераторе раствор из производства диоксида хлора возвращают в анодную камеру электрохимической ячейки для производства хлората.
Производство хлората щелочного металла может быть осуществлено непрерывно, периодически или в смешанном режиме.
Органический медиатор в католите предпочтительно растворен в преимущественно водной или преимущественно органической сплошной жидкой фазе, предпочтительно обладающей удельной электропроводностью при условиях процесса по меньшей мере, примерно 0,1 См/м, более предпочтительно по меньшей мере примерно 1 См/м, наиболее предпочтительно по меньшей мере примерно 3 См/м. Однако возможно также, чтобы органический медиатор был растворен в преимущественно органической фазе, эмульгированной в сплошной, преимущественно водной, фазе.
Органический медиатор представляет собой вещество, способное электрохимически реагировать на катоде с образованием одной или нескольких восстановленных форм, которые, в свою очередь, способны реагировать с предпочтительно молекулярным кислородом и преобразовываться обратно в свою первоначальную форму, тем самым обеспечивая возможность циклического процесса. Реакция восстановленных форм медиатора с кислородом предпочтительно происходит в присутствии протонов. Однако в отсутствие подходящего источника протонов возможно образование пероксидных солей, например Na2O2, которые впоследствии могут быть гидролизованы с получением пероксида водорода. Вне рамок какой-либо теории предполагается, что схема реакции образования пероксида водорода включает перенос двух электронов и двух протонов, происходящий в отдельных или комбинированных одновременных реакциях, и, как предполагается, с участием в качестве промежуточных частиц О2 -·, НОО· и НОО-.
Примеры классов органических веществ, образующих окислительно-восстановительные системы и применимых в качестве медиаторов, включают хиноны, флавохиноны, производные пиридина, такие как никотинамиды, и кетоны.
Подходящие хиноны включают молекулы, содержащие (бензо)хиноновый фрагмент (орто- или пара-формы), среди которых предпочтительными являются антрахиноны, тетрагидрохиноны, нафтохиноны, бензохиноны и их производные. Антрахиноны, нафтохиноны и бензохиноны являются предпочтительно замещенными, например, алкилзамещенными, как 2-алкил-9,10-антрахиноны. Конкретные примеры включают 2-этил-9,10-антрахинон, 2-третбутил-9,10-антрахинон, 2-гексенил-9,10-антрахинон, эвтектические смеси алкил-9,10-антрахинонов, смеси 2-амил-9,10-антрахинонов, причем все они имеют высокую стабильность. Конкретные примеры алкилзамещенных нафтохинонов включают 2-метил-1,4-нафтохинон, 2-этил-1,4-нафтохинон, 2-пропил-1,4-нафтохинон, 2-третбутил-1,4-нафтохинон, 2-третамил-1,4-нафтохинон, 2-изоамил-1,4-нафтохинон, 2,3-диметил-1,4-нафтохинон. Другие примеры заместителей, пригодные для управления реакционной способностью и растворимостью хинонов, включают -SO3H/-SO3 -, -PO2R-, -OPO3R-, -NO2, -OCH3, -SO2CH3, -OPh, -SPh, -SO2Ph, -COOH/-COO-, -CN, -OH, -COCH3, -F, -Cl, -Br, -CF3, -NH2/-NH3 +, -NRH/-NRH2 +, -NR2/-NR2H+, -NR3 +, -PH2/-NH3 +, -SR2 +, -PRH/-PRH2 +, -PR2/-PR2H+ и -PR3 +, где R предпочтительно представляют собой, независимо друг от друга, необязательно замещенный алкил, алкенил, или арил, или водород. Антрахинон может быть одно- или многозамещенным некоторой комбинацией из вышеуказанных и/или других заместителей. Также можно использовать производные хинона с несущими общий заряд заместителями, придающими молекуле ионный характер. Конкретные примеры замещенных не алкилами производных хинона включают антрахинон-2-сульфонат, 5,6,7,8-тетрагидро-9,10-антрахинон-2-сульфонат, антрахинон-2,6-дисульфонат, нафтохинон-2-сульфонат, 2-метокси-1,4-нафтохинон, 2-этокси-1,4-нафтохинон, 2-аминоантрахинон, 2-аминонафтохинон, 2-(алкиламино)-антрахинон, 2-(диалкиламино)-антрахинон, 2-(триалкиламоний)-антрахинон, 2-(алкиламино)-нафтохинон, 2-(диалкиламино)-нафтохинон, 2-(триалкиламмоний)-нафтохинон. Нафтохиноны могут, например, быть замещены в любом положении на боковом кольце, например нафтохинон-6-сульфонат или 6-триалкиламмонийнафтохинон. Также может быть выгодным один заместитель на каждом кольце, как, например, в 6-амилнафтахинон-2-сульфонате или 6-этил-2-триэтиламмонийнафтохиноне. Соответствующими примерами для бензохинона являются бензохинон-2-сульфонат и 2-(этил,диметил)аммоний. Также могут быть использованы антрахиноны и нафтохиноны с частично гидрированными боковыми кольцами, например 1,2,3,4-тетрагидроантрахинон, 5,6,7,8-тетрагидро-2-этилантрахинон, 5,6,7,8-тетрагидронафтохинон. Это также относится к замещенным антра- и нафтохинонам, включая те, которые соответствуют указанным выше типам.
В случае, когда хинон является замещенным и содержит одну или более необязательно замещенную алкильную, алкенильную или арильную группы, является предпочтительным, чтобы эти группы, независимо друг от друга, имели от 1 до 12 атомов углерода, наиболее предпочтительно от 1 до 8 атомов углерода. Если имеется более чем одна такая группа, то они предпочтительно имеют смешанную длину цепей. Алкильные, алкенильные и арильные группы также могут быть замещенными, например, одной или более гидроксильной группой.
Хиноны, включая антрахиноны, тетрагидроантрахиноны, нафтохиноны, бензохиноны и их производные, могут быть восстановлены до соответствующих гидрохинонов путем последовательного присоединения двух электронов и двух протонов. Наряду с хиноном и гидрохиноном, как полагают, присутствуют и являются активными ряд промежуточных форм, таких как семихиноновый радикал и семихиноновый анион, а также основные формы кислого гидрохинона. Все эти восстановленные формы могут реагировать с кислородом и вносить вклад в общую реакцию образования пероксида водорода и исходного хинона.
Другие медиаторные системы, способные восстанавливать кислород до супероксида и впоследствии пероксида водорода, включают флавохиноны, например флавин (см., например, H. Tatsumi и др. в работе «Механистическое исследование автоокисления восстановленных соединений флавина и хинона» ("Mechanistic study of the autooxidation of reduced flavin and quinone compounds") в Journal of Electroanalytical Chemistry (1998), 443, 236-242) и производные пиридина, такие как никотинамид, и их производные.
Другие медиаторные системы образованы кетонами и соответствующими им спиртами. Кетон может быть электрохимически восстановлен до соответствующего спирта, который реагирует с кислородом с образованием пероксида водорода и исходного кетона. Предпочтительными являются вторичные спирты и в особенности фенильные. Пригодные спирты включают изопропиловый спирт, бензиловый спирт, дифенилметанол, метилфенилметанол. Также могут быть использованы вторичные спирты, дополнительно содержащие несущую заряд группу.
Содержание органического медиатора, включая его восстановленные формы, в католите предпочтительно составляет по меньшей мере примерно 0,1 мас.%, более предпочтительно по меньшей мере примерно 1 мас.%, наиболее предпочтительно по меньшей мере примерно 3 мас.%. Оно ограничивается сверху только растворимостью, которая зависит от используемого медиатора и состава жидкой фазы, однако во многих случаях может достигать примерно 10 мас.% или примерно 20 мас.% или даже более. В одном варианте осуществления, в котором значительная часть пероксида водорода образуется вне ячейки, содержание органического медиатора предпочтительно составляет по меньшей мере примерно 1 мас.%, более предпочтительно по меньшей мере примерно 3 мас.%, наиболее предпочтительно по меньшей мере примерно 10 мас.%.
Если католит содержит преимущественно водную сплошную фазу, в которой растворен органический медиатор, эта фаза предпочтительно содержит по меньшей мере примерно 50 мас.%, наиболее предпочтительно по меньшей мере примерно 80 мас.% воды и других неорганических компонентов. Тогда является предпочтительным, чтобы медиатор выбирался из тех, которые обладают высокой растворимостью в воде, например хинонов, имеющих одну или более гидрофильную группу, такую как -SO3H/-SO3 -, -NO2, -COOH/-COO-, -ОН, -NH2/-NH3 +, -NRH/-NRH2 +, -NR2/-NR2H+, -NR3 +, -PH2/-NH3 +, -PRH/-PRH2 +, -PR2/-PR2H+ и -PR3 +, где R предпочтительно представляет собой, независимо друг от друга, водород или необязательно замещенный алкил или алкенил.
Если католит содержит преимущественно органическую сплошную фазу, в которой растворен органический медиатор, эта фаза предпочтительно содержит по меньшей мере примерно 50 мас.%, наиболее предпочтительно по меньшей мере примерно 80 мас.%, органических компонентов и в крайних случаях может, по существу, не содержать неорганических компонентов. Однако является предпочтительным, чтобы содержались по меньшей мере примерно 5 мас.%, наиболее предпочтительно по меньшей мере примерно 20 мас.%, неорганических компонентов. Этими неорганическими компонентами могут быть, например, неорганические ионы солей, образованных как органическими, так и неорганическими ионами.
Сплошная жидкая фаза католита предпочтительно содержит по меньшей мере частично органическую соль, содержащую по меньшей мере один вид органического катиона и/или органического аниона. Ее содержание в сплошной жидкой фазе предпочтительно составляет от примерно 20 мас.% до примерно 99 мас.%, более предпочтительно от примерно 40 мас.% до примерно 95 мас.%, наиболее предпочтительно от примерно 60 мас.% до примерно 90 мас.%.
Сплошная жидкая фаза католита предпочтительно имеет рН меньше 7. Если эта жидкая фаза является преимущественно органической, то этот рН соответствует рН, полученному в воде, поддерживаемой в равновесии с преимущественно органической жидкой фазой.
По меньшей мере частично органическая соль может быть выбрана из группы солей, именуемых ионными жидкостями, т.е. широкого класса жидкостей, по существу, состоящих из ионов. Ионная жидкость может быть простой и содержать один вид анионов и один вид катионов или же может быть сложной и содержать смесь различных анионов и/или различных катионов. Некоторые ионные жидкости имеют низкую температуру плавления и пренебрежимо малое давление паров вблизи или ниже комнатной температуры и часто называются ионными жидкостями комнатной температуры. Такие ионные жидкости обычно остаются жидкими в широком диапазоне температур.
По меньшей мере частично органическая соль может быть также выбрана из солей, которые сами по себе не могут быть классифицированы как ионные жидкости, но обладают такими свойствами, когда присутствуют вместе с нейтральным сорастворителем, таким как вода или низкомолекулярный спирт типа метанола, этанола или пропанола, из которых предпочтительным является вода. Массовое отношение соли к сорастворителю предпочтительно составляет от примерно 1:1 до примерно 1000:1, более предпочтительно от примерно 2:1 до примерно 100:1, наиболее предпочтительно от примерно 5:1 до примерно 20:1.
Предпочтительно использовать такую по меньшей мере частично органическую соль, которая сама по себе или в сочетании с нейтральным сорастворителем образует жидкую фазу при атмосферном давлении ниже примерно 130°С, предпочтительно ниже примерно 100°С, наиболее предпочтительно ниже примерно 80°С. Кроме того, парциальное давление этой соли при 100°С предпочтительно составляет ниже примерно 10 кПа, более предпочтительно ниже примерно 1 кПа, наиболее предпочтительно ниже примерно 0,1 кПа (исключая парциальное давление необязательного нейтрального сорастворителя).
Жидкость с подходящими физическими свойствами может содержать одну по меньшей мере частично органическую соль или смесь двух или более по меньшей мере частично органических солей, предпочтительно в сочетании с одним или более нейтральными сорастворителями, из которых предпочтительным является вода. Она также может содержать анионы и катионы, которые сами по себе не образуют солей с подходящими свойствами.
Такая по меньшей мере частично органическая соль может быть образована различными сочетаниями катионов и анионов, среди которых по меньшей мере один вид иона является органическим. Эти ионы предпочтительно являются одновалентными. Примеры катионов включают 1-алкил-3-метилимидазолий, 1-бутил-3-метилимидазолий [BMIM], 1-этил-3-метилимидазолий [EMIM], 1,2,3-триметилимидазолий, н-алкилпиридиний, н-бутилпиридиний [BPY], пирролидиний, гуанидиний и алкилгуанидиний, изоуроний, PR4 +, NR4 +, SR3 +, тетраметиламмоний, холин, кокомоний и их смеси, где R предпочтительно представляют собой, независимо друг от друга, необязательно замещенный алкил, алкенил, или арил, или водород. Другие примеры включают замещенные хиноны, обозначаемые здесь [Q-NR3 +] и [Q-PR3 +], где Q означает хинон, такой как антрахинон, нафтохинон или бензохиноны, а R - то же, что и выше. Примеры анионов включают гексафторфосфат [HFP], тетрафторборат [TFB], фторсульфонат, гексафторантимонат, гексафторарсенат, хлоралюминат, бромалюминат, бис(трифторметилсульфонил)имид, трис(трифторметилсульфонил)метид, трицианометид, дицианамид, нонафторбутансульфонат, трифторметансульфонат, 2,2,2-трифторэтансульфонат, нитрат, сульфат, фосфат, RPO4 2-, R2PO4 -, R2PO2 - (например, диалкилфосфинат), перхлорат, ацетат, алкилсульфонат, бис(2-этилгексил)натрия сульфосукцинат, диэтиленгликольмонометилэфирсульфат, алкилолигоэфирсульфат, пивалат, тетраалкилборат, пропионат, сукцинат, сахаринат, гликолят, стеарат, лактат, малат, тартрат, цитрат, аскорбат, глютамат, бензоат, салицилат, метансульфонат, толуолсульфонат и их смеси, где R означает то же, что и выше. Другие примеры включают замещенные хиноны, обозначаемые здесь [Q-(O)-SO3 -] и [Q-(O)-PO3R-], где Q означает хинон, такой как антрахинон, нафтохинон или бензохиноны, (О) обозначает необязательный кислород (например, сульфат/сульфонат и фосфат/фосфонат), а R означает то же, что и выше.
В случае, когда любой катион или анион содержит одну или более необязательно замещенную алкильную, алкенильную или арильную группы, предпочтительно, чтобы эти группы, независимо друг от друга, имели от 1 до 12 атомов углерода, наиболее предпочтительно от 1 до 8 атомов углерода. Если имеется более чем одна такая группа, то они предпочтительно имеют смешанную длину цепей. Алкильные, алкенильные и арильные группы также могут быть замещенными, например, одной или более гидроксильной группой.
Примеры солей, применимых в настоящем изобретении, включают любую комбинацию следующих катионов: [1,3-диалкилимидазолий], [триалкиламмоний], [тетраалкиламмоний], [триалкилфосфоний], [тетраалкилфосфоний], [алкилпиридиний], [холин], [Q-NR3 +] и [Q-PR3 +], в сочетании с любым из следующих анионов: [сульфат], [фосфат], [алкилсульфат], [алкилсульфонат], [диалкилфосфат], [алкилфосфонат], [Q-(O)-SO3 -] и [Q-(O)-PO3R-], где Q, (О) и R означают то же, что и выше.
Конкретные комбинации групп включают в себя [1,3-диалкилимидазолий][алкилсульфонат], такой как любой из следующих: [1-бутил-3-метилимидазолий][метил-SO3 -], [1-этил-3-метилимидазолий][этилсульфонат], [1-гексил-3-метилимидазолий][тозилат], [1-бутил-3-метилимидазолий][антрахинон-2-сульфонат] или [1-бутил-3-метилимидазолий][5-третамилнафтохинон-2-сульфонат]; [тетраалкиламмоний][Q-(O)-SO3 -], такие как любой из следующих: [метил,триэтиламмоний][5-третамилнафтохинон-2-сульфонат], [метил,диэтил,бутиламмоний][антрахинон-2-сульфонат] или [холин][5-амилбензохинон-2-сульфонат]; или [Q-NR3 +][алкилсульфонат], такой как [5,6,7,8-тетрагидроантрахинон-2-аминий, н,н,н-(метил,диэтил)][метилсульфонат]; [тетраалкилфосфоний][диалкилфосфат], такой как любой из следующих: [этилтрибутилфосфоний][диэтилфосфат], [фенилтриэтилфосфоний][диизобутилфосфат].
Вне связи с конкретными комбинациями групп возможно множество комбинаций, таких как любая из следующих: [триизобутил(метил)фосфоний][тозилат], [тригексил(тетрадецил)фосфоний][бис-2,4,4-триметилпентилфосфинат] [тетрабутиламмоний][метансульфонат][1-этил-3-метилимидазолий] [HFP], [трипентилсульфоний][дипентил,бензиламмоний], [бензохинон-2-аминий-н,н,н-диэтил,фенил][5,6,7,8-тетрагидро-9,10-антрахинон-2-сульфонат], [холин][5-этокси-1,4-нафтохинон-6-сульфат], [н-пропилпиридиний][сахаринат].
Кроме упомянутых выше, могут быть использованы также и другие виды имеющихся в продаже или иным образом известных ионных жидкостей или солей, обладающих такими свойствами в сочетании с нейтральным сорастворителем.
Также можно использовать соль, в которой по меньшей мере один из ионов также действует в качестве медиатора, который подвергается реакции на катоде с образованием восстановленной формы и таким образом участвует в циклическом процессе получения пероксида водорода. В этом случае используемый медиатор может частично или полностью состоять из ионов такой соли. Примеры включают соли, содержащие катион или анион замещенного хинона или производного никотинамида, такого как упомянутые выше.
Использование по меньшей мере частично органической соли, как описано выше, в составе сплошной фазы электролита обеспечивает преимущества комбинирования высокой растворимости органических медиаторов, таких как хиноны, с хорошей электропроводностью. Другим преимуществом является очень низкая воспламеняемость, что дает возможность безопасно осуществлять реакцию с кислородом при более высоких концентрациях кислорода и более высокой температуре, чем было бы возможно при использовании обычных воспламеняющихся растворителей. Также облегчается отделение от него пероксида водорода, например, путем выпаривания или экстракции и тем самым получение пероксида водорода либо высокой чистоты, либо в подлежащей дальнейшей переработке смеси с выбранным соединением, например водой. Другим примером является смесь метанол/пероксид водорода для использования в качестве реагента в реакции эпоксидирования. Использование ионных жидкостей для образования пригодной для проведения реакций с участием пероксида водорода среды было описано в работе B. Chhikara и др. «Окисление спиртов пероксидом водорода, катализируемое новым ионом имидазолия на основе фосфорновольфраматного комплекса в ионной жидкости» ("Oxidation of alcohols with hydrogen peroxide catalyzed by a new imidazolium ion based phosphotungstate complex in ionic liquid"), Journal of Catalysis 230 (2005, 436-439).
Католит дополнительно содержит одну или более органическую или неорганическую кислоты, такие как муравьиная кислота, уксусная кислота, монохлоруксусная кислота, бензойная кислота, сульфоновые кислоты, фосфоновые кислоты, азотная кислота, серная кислота, хлористоводородная (соляная) кислота, йодистоводородная кислота, бромистоводородная кислота, хлорная кислота или фосфорная кислота.
Католит также может содержать и другие компоненты. Например, преимущественно органическая сплошная жидкая фаза может содержать, как упоминалось ранее, нейтральный сорастворитель, предпочтительно воду. Количество нейтрального сорастворителя предпочтительно составляет вплоть до примерно 50 мас.%, наиболее предпочтительно от примерно 1 до примерно 20 мас.%. Особенно предпочтительное содержание нейтрального сорастворителя может составлять, например, от примерно 1 до примерно 5 мас.% или от примерно 5 до примерно 10 мас.%. Примеры других необязательных добавок включают стабилизаторы пероксида водорода, эмульгаторы, ингибиторы коррозии, противовспениватели, буферы, усилители проводимости, понизители вязкости и т.д. Примеры стабилизаторов пероксида водорода включают широко используемые для этой цели стабилизаторы, такие как фосфорная кислота, комплексообразующие вещества на основе фосфоновой кислоты, защитные коллоиды типа станната щелочного металла и поглотители радикалов типа пиридинкарбоновых кислот. К примерам комплексообразующих веществ на основе фосфоновой кислоты относятся 1-гидроксиэтилиден-1,1-дифосфоновая кислота, 1-аминоэтан-1,1-дифосфоновая кислота, аминотри(метиленфосфоновая кислота), этилендиаминтетра(метиленфосфоновая кислота), гексаметилендиаминтетра(метиленфосфоновая кислота), диэтилентриаминпента(метиленфосфоновая кислота), диэтилентриамингекса(метиленфосфоновая кислота), 1-аминоалкан-1,1-дифосфоновые кислоты (такие как морфолинметандифосфоновая кислота, н,н-диметиламинодиметилдифосфоновая кислота, аминометилдифосфоновая кислота), продукты их реакции и их соли, предпочтительно соли натрия.
Предпочтительно, чтобы преимущественно органическая жидкая фаза в католите имела вязкость при рабочих условиях ниже примерно 100 мПа·с, более предпочтительно ниже примерно 30 мПа·с, а наиболее предпочтительно ниже примерно 10 мПа·с. Кроме того, из-за опасностей, с которыми сопряжено обращение с, по существу, чистым пероксидом водорода, извлекаемый продукт предпочтительно представляет собой смесь пероксида водорода с водой или низкомолекулярными спиртами, например метанолом. Парциальное давление при 100°С жидких компонентов, которые не составляют часть смеси-продукта, должно предпочтительно быть ниже примерно 10 кПа, более предпочтительно ниже примерно 1 кПа, наиболее предпочтительно ниже 0,1 кПа.
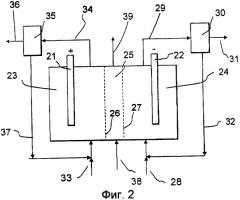
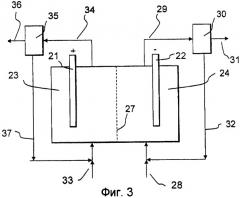
Электрохимическая ячейка может включать в себя только одну камеру для анода и одну для катода или же может дополнительно включать в себя одну или несколько камер в промежутке между ними, например электродиализный пакет, позволяющий осуществлять любой известный электродиализ. Средство для разделения этих камер может представлять собой неселективный физический барьер, например пористую мембрану или диафрагму, или же оно может быть селективно проницаемым для некоторых частиц, таких как катионы или анионы. Также может быть использовано сочетание мембран, такое как биполярные мембраны, позволяющие разделять воду на протоны и гидроксид-ионы. Неселективные барьеры могут быть изготовлены, например, из асбеста, керамики, стекла, полиолефинов, политетрафторэтилена (ПТФЭ), поливинилхлорида (ПВХ) и т.д. Катионселективные мембраны могут быть изготовлены, например, из органических полимеров, таких как ПТФЭ, полистирол, стирол/дивинилбензол или винилпиридин/дивинилбензол, модифицированный кислотными группами, такими как сульфонат, карбоксилат или фосфонат. Анионселективные мембраны могут быть изготовлены, например, из органических полимеров, таких как ПТФЭ, полистирол, стирол/дивинилбензол или винилпиридин/дивинилбензол, модифицированный основными группами, такими как четвертичный аммоний. Биполярные мембраны могут содержать проницаемую для анионов мембрану и проницаемую для катионов мембрану, наслоенные вместе, необязательно - со слоем катализатора между ними. Ионселективные и биполярные мембраны имеются в продаже, например, под товарными знаками Nafion™, Flemium™, Neosepta bipolar®.
Электролит в катодной камере может содержать одну, две или более жидких фаз. В системе с одной жидкой фазой имеется только преимущественно органическая или преимущественно водная жидкая фаза электролита. В системе с двумя жидкими фазами несплошная фаза может быть эмульгирована или просто смешана в сплошной жидкой фазе. Если имеется более чем одна жидкая фаза, то компоненты в электролите будут распределяться между этими фазами в зависимости от их свойств растворимости. Помимо жидкой фазы или фаз также могут присутствовать газ и/или твердые вещества.
Температура и давление в катодной камере могут быть такими же, как в анодной камере, или отличающимися от анодной камеры и предпочтительно задаются так, что католит является жидкостью. Высокая температура способствует низкой вязкости, высокой электропроводности и высоким скоростям массопереноса, тогда как низкая температура способствует стабильности пероксида водорода и компонентов в электролите. Обычно температура предпочтительно составляет от примерно 0 до примерно 200°С, более предпочтительно от примерно 40 до примерно 150°С, наиболее предпочтительно от примерно 60 до примерно 100°С. Давление предпочтительно составляет от примерно 10 до примерно 30000 кПа, более предпочтительно от примерно 80 до примерно 2000 кПа, наиболее предпочтительно от примерно 100 до примерно 800 кПа.
Реакция одной или более восстановленных форм медиатора и кислорода с образованием пероксида водорода может происходить внутри ячейки или в отдельной емкости или и там, и там, обычно приводя к образованию пероксида водорода в католите и повторному образованию медиатора для участия в другом реакционном цикле. Обычно к электролиту, содержащему восстановленный медиатор, добавляют молекулярный кислород, но часть его может происходить из кислорода, образовавшегося в ходе анодных реакций и перенесенного через электролит в ячейке, необязательно - через мембрану, или выделенного в виде отдельного потока и повторно введенного в ячейку. Молекулярный кислород может быть добавлен растворенным в жидкости или в виде любого кислородсодержащего газа, такого как воздух, обогащенный кислородом воздух или, по существу, чистый кислород. Добавление по меньшей мере части кислорода в виде газа непосредственно в ячейку обеспечивает преимущество улучшения перемешивания, а также может создавать газлифт для переноса электролита из ячейки, альтернативно вносить вклад в отгонку пероксида водорода из электролита. Добавление кислорода непосредственно в ячейку может позволить завершить полный каталитический цикл медиатора внутри ячейки, по существу, устраняя необходимость выводить поток, содержащий восстановленную форму медиатора, и подавать поток, содержащий медиатор. Реакции, в результате которых образуется пероксид водорода, облегчаются благодаря присутствию протонов, которые могут происходить из любого доступного источника, такого как вода, гидрохинон, протоны, образующиеся на аноде, или любая кислота, которая была добавлена к электролиту. Если реакция с кислородом происходит в