Способ электрохимического мультисенсорного обнаружения и идентификации алкалоидов
Иллюстрации
Показать всеИзобретение относится к области химического и биологического анализа, в частности для электрохимического детектирования алкалоидов. Техническим результатом изобретения является повышение достоверности получаемых результатов, упрощение способа и сокращение времени его осуществления. Сущность изобретения: в способе электрохимического мультисенсорного обнаружения и идентификации алкалоидов формирование электрохимического сенсора ведут путем смешения не менее четырех солей металлов, выбранных из ряда: Sn, Co, Cr, Mn, Fe, Сu, Zn, Cd, Pb, Ag, Ga в концентрации
1÷5·10-5 M в растворе электролита, с последующим введением его в электрохимическую ячейку, кривые электрохимической индикации снимают методом инверсионной вольтамперометрии с потенциалом катодного осаждения металлов -1,8÷-1,5 В относительно хлорсеребряного электрода сравнения и последующей разверткой потенциала от -1,8÷-1,5 В до +0,1÷+0,3 В, затем снимают кривую после введения пробы и о наличии алкалоида судят по изменению характера полученных кривых электрорастворения осажденных металлов, а идентификацию ведут путем компьютерной обработки полученных кривых и сравнения полученной при этом разностной кривой в виде N-мерного векторного образа с образами из базы данных, полученных для отдельных алкалоидов. Электролитом служит 0,05 М раствор хлористого калия в воде, а соли металлов взяты в виде азотнокислых или солянокислых. 1 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к области химического и биологического анализа и может быть использовано в области детектирования электрохимическим методом алкалоидов, образующих комплексы с металлами, для производственного и экологического мониторинга объектов как природного, так и искусственного происхождения.
Изобретение относится к области мультисенсорного анализа в формате «электронный язык» и предназначено для детектирования, обнаружения и идентификации алкалоидов методом инверсионной вольтамперометрии.
Химические и биологические сенсоры [Будников Г.К. Что такое химические сенсоры. // Соросовский Образовательный Журнал, 1998, №3, с.72-76; Fluorescent Chemosensors for Ion and Molecule Recognition, ACS Symp.Ser. / ed. A.W.Czamik //, AChS Publ, Washington. DC 1992, 225 p.] представляют собой датчики, которые дают прямую информацию об ионном или молекулярном составе среды (раствора), в которую погружен датчик, без отбора анализируемой пробы и ее специальной подготовки. Сенсоры используются в комбинации с каким-либо аналитическим регистрирующим прибором. Основным элементом любого сенсора является иммобилизованное (прикрепленное к доступной поверхности датчика) активное вещество, способное к селективному взаимодействию с определяемыми компонентами. Разновидностью сенсоров являются химические или биологические чипы [Reviews: The Chipping Forecast // Nature Genetics, 1999, v.21, p.1-60; Gilbert W., DNA sequencing and gene structure / Science, 1981, v.214, p.1305-1312; Барский В., Колчинский А., Лысов Ю., Мирзабеков А. Биологические микрочипы, содержащие иммобилизованные в гидрогеле нуклеиновые кислоты, белки и другие соединения: свойства и приложения в геномике. // Мол. биология, 2002, т.36, с.563-584] - аналитические датчики, содержащие набор различных активных веществ в одном сенсоре или набор сенсоров с отличающимися друг от друга характеристиками, в каждом из которых находится активное вещество одного типа. Химический или биологический чип дает информацию об анализируемых смесях не в виде числа, как отклика на единичное измерение, а в виде некоторого образа - двумерной или трехмерной картинки, которая является компактной и точной характеристикой ("отпечатком пальцев") всей смеси. Каждая точка такой картинки, характеризующая наличие и концентрацию того или иного вещества, может быть неточной, но за счет многократного дублирования таких точек и за счет дополнительной информации в виде целостного образа чипы позволяют добиться селективности и однозначности в анализе. В литературе по отношению к химическим чипам также используются понятия электронный (химический) "нос" или электронный (химический) "язык", чтобы подчеркнуть, что селективность, как и в живых организмах, достигается за счет набора сенсоров с отличающимися характеристиками [S.Ampuero, J.O.Bosset, The electronic nose applied to dairy products: a review // Sensors and Actuators B: Chemical, 2003, v.94, p.1-12].
Известны различные типы сенсоров: электрохимические (в том числе, потенциометрические датчики, ион-селективные электроды) [Будников Г.К. Что такое химические сенсоры. // Соросовский Образовательный Журнал, 1998, №3, с.72-76], сенсоры на основе полевых транзисторов и других устройств, магнитные сенсоры, термометрические датчики, а также сенсоры, чувствительные к изменению пьезоэлектрических или акустических характеристик. Основным недостатком указанных аналитических датчиков является ограниченность ассортимента определяемых компонентов - практически на каждый компонент приходится конструировать свой сенсор с определенным типом активного вещества.
Известны флуоресцентные сенсоры, в которых активное вещество, взаимодействующее с определяемыми компонентами среды, нанесено (пропитывает) или химически пришито к мембранам или к микрогранулам твердых пористых материалов, образующим сорбционный слой, состоящий из большого количества монослоев [Seitz W.R. Fiber optic sensors // Anal. Chem., 1984, v.86, №1, p.16-25]. После обработки поверхности активным веществом снимают спектр флуоресценции.
Основным недостатком указанных устройств является то, что их нельзя использовать как чипы, позволяющие получать отдельный сигнал с каждого участка активной поверхности сенсора. Указанный недостаток устраняется при использовании монослоев микрогранул твердых активных веществ или микрососудов с жидкими активными веществами. Флуоресцентные сенсоры (биочипы) изготавливаются путем вырезания микроотверстий в носителе из стекла, кварца, керамики, пластика или иного инертного материала. В эти отверстия помещаются в определенном регулярном порядке активные вещества, селективно взаимодействующие с биологически активными макромолекулами из анализируемой среды [патент Российской Федерации №2157385, опубл. 10.10.2000; P.Zhang, T.Beck., W.Tan, Design a molecular beacon with two dye molecules, Angewandte Chemie International Edition, 2001, v.40, р.402-405]. Число микроучастков с активными веществами, достигаемое в таких устройствах, не превышает нескольких тысяч единиц, что в ряде случаев недостаточно для получения чувствительного метода анализа.
В ряде способов моделируются упомянутые выше принципы, заложенные в обонятельной и вкусовой рецепторной системе живых организмов, определяемых в настоящее время понятием «электронный нос», «электронный язык», при этом каждому тестируемому веществу соответствует некоторая характерная картина откликов мультисенсорной системы [S.Ampuero, J.O.Bosset. The electronic nose applied to dairy products: a review // Sensors and Actuators B: Chemical, 2003, v.94, p.1-12].
Так, например, известны кросс-реактивные сенсорные линейки на основе металлоксидных и полимерных проводящих структур, тонкопленочных полимерных сенсоров на основе пьезоэлектрических микровесов поверхностно-акустических волн, оптико-волоконных сенсоров с флуоресцентными и металлоорганическими красителями и другие.
Известен способ электрохимической индикации биологических жидкостей - иммунохимически активных макромолекул - в растворах при помощи иммуночувствительного мультисенсора. Данный способ использован нами в качестве прототипа [патент РФ №2107296, МКИ G01N 33/48, опубл. 1998.03.20, прототип [1]].
Способ предусматривает формирование иммуноспецифического сенсора с мембраной с иммобилизованными в нее специфическими рецепторами, составление электрохимической измерительной ячейки из связанных измерительным прибором иммуночувствительного сенсора и электрода сравнения, помещение последних в емкость, заполненную рабочим раствором с фиксированным значением рН. Далее проводят потенциометрическое измерение величины фонового напряжения на электрохимической ячейке, осуществляют контакт сенсора с определяемым веществом путем введения последнего в электрохимическую ячейку, регистрируют величину конечного напряжения на электрохимической ячейке и характер изменения напряжения в рабочем растворе и оценивают величину смещения изоэлектрической точки, используя разность между величинами фонового и конечного напряжения на электрохимической ячейке, строят калибровочный график и используют его для определения содержания анализируемого вещества в исследуемых растворах. В качестве электрохимического датчика используют электрод для потенциометрических измерений. Мембрану на поверхности электрохимического датчика формируют из электропроводящего полимера путем электрохимического синтеза из раствора мономера в полярном растворителе (воде, ацетонитриле). Иммобилизацию рецепторов в мембрану проводят одновременно с электрохимическим синтезом мембраны, для этого рецепторы растворяют в растворе для электрохимического синтеза. В качестве мономера для электрохимического синтеза мембраны использованы анилин, тиофен, фуран, пиррол, специфическими рецепторами выступают антитела, белки, гормоны и др.
Данный способ и, соответственно, тип мультисенсорной линейки, как и другие ранее перечисленные способы, характеризуются общим системным недостатком, связанным с технологическими трудностями получения воспроизводимых достоверных результатов, что существенно снижает качество и надежность идентификации тестируемых органических соединений, высокая трудоемкость и низкая технологичность процесса, высокая вероятность получения невоспроизводимых результатов вследствие невозможности контроля за свойствами мембраны в ходе электрохимического синтеза.
Задачей настоящего изобретения является повышение достоверности получаемых результатов, упрощение способа и сокращение времени его осуществления.
Поставленная задача решается тем, что способ электрохимического обнаружения и идентификации алкалоидов включает в себя формирование электрохимического сенсора, получение фоновой кривой электрохимической индикации металлов и кривой индикации после введения пробы, последующее использование разностной картины индикации для установления наличия искомого вещества в исследуемом растворе. Формирование электрохимического сенсора ведут путем смешения не менее четырех солей металлов, выбранных из ряда Sn, Со, Cr, Mn, Fe, Сu, Zn, Cd, Pb, Ag, Ga, в концентрации 1÷5*10-5 М в растворе хлористого калия с последующим введением его в электрохимическую ячейку. Кривые электрохимической индикации снимают методом инверсионной вольтамперометрии с потенциалом катодного осаждения металлов -1,8÷-1,5 В (относительно хлорсеребряного электрода сравнения) с последующей разверткой потенциала от -1,8÷-1,5 В до +0,1÷+0,3 В. При этом о наличии тестируемого вещества судят по изменению характера полученных кривых электрорастворения осажденных металлов, а идентификацию ведут путем компьютерной обработки этих кривых и сравнения полученной при этом разностной кривой в виде N-мерного векторного образа с базой данных, полученной для отдельных алкалоидов.
Для формирования электрохимического сенсора используют азотнокислые или солянокислые соли названных металлов, а в качестве электролита используют раствор хлористого калия в виде 0,05М раствора при следующем соотношении компонентов: мас.%:
| соли Sn, Со, Cr, Mn, Fe, Сu, Zn, Cd, Pb, Ag, Ga | 3÷-5·10-4 |
| KCl в виде 0,05M раствора | 2÷4·10-1 |
| Вода | остальное |
Новизна способа заключается в использовании мультисенсорной тест-системы в виде раствора, содержащего набор ионов различных металлов, которые обладают способностью образовывать комплексные соединения с органическими веществами. Таким образом, роль множества сенсоров выполняют катионы металлов, содержащиеся в разработанной тест-системе.
Изобретательский уровень заключается в следующем.
Метод инверсионной вольтамперометрии известен и используется при определении металлов, но при использовании этого метода нельзя ожидать возможности идентификации алкалоидов, поскольку не является очевидным, что присутствие алкалоидов в растворе будет влиять на осажденные металлы таким образом, что даст возможность провести их идентификацию. Известно, что алкалоиды способны образовывать координационные соединения с металлами. Нашими исследованиями установлено, что алкалоиды влияют на электроактивность металлов в растворе, это приводит к изменению количества осажденных металлов на электроде и по кривым их электрорастворения позволяет идентифицировать природу алкалоида.
Достоверность идентификации алкалоидов определяется тем, что оценка влияния алкалоидов на тест-систему проводится по их влиянию на несколько металлов, а именно не менее четырех. Это позволяет сформировать для каждого из алкалоидов характерный многомерный образ, что достаточно для проведения достоверной идентификации.
В отличие от прототипа предложенный способ значительно проще в реализации, не требуются операции по формированию мембран с иммобилизованными рецепторами, что может привести к плохой воспроизводимости результатов. В заявленном способе тест-система получается растворением солей металлов в 0,05М КСl, что гарантирует постоянство состава раствора и, соответственно, воспроизводимость измерений и достоверность получаемых данных.
При электрорастворении металлов на электроде возможно образование интерметаллических соединений, например цинка и кобальта. Нами найден интервал потенциалов электроосаждения -1,8÷-1,5 В, при котором образующееся интерметаллическое соединение осаждаемых металлов имеет определенный (постоянный) состав, тем самым обеспечиваются стабильные фоновые токи при анодном растворении металлов.
Скорость анодной развертки потенциала может воспроизводиться в широком интервале, однако она должна быть не ниже 500 мВ/с, в этом лучае кислород раствора не влияет на фоновые токи.
В целом заявляемый способ характеризуется следующими стадиями его осуществления.
1. Формирование электролита электрохимического сенсора заключается в приготовлении раствора смеси солянокислых или азотнокислых солей металлов Sn, Со, Cr, Mn, Fe, Сu, Zn, Cd, Pb, Ag, Ga в концентрации 1÷5·10-5 M в 0,05М КСl. Раствор вводится в электрохимическую ячейку, содержащую электроды: индикаторный из инертного материала, вспомогательный и сравнения.
2. Снятие фоновой кривой активности металлов электрохимического сенсора методом инверсионной вольтамперометрии. Для этого металлы из раствора электроосаждаются на индикаторном электроде, а затем при наложении анодной развертки потенциала они последовательно электрорастворяются с поверхности индикаторного электрода и переводятся обратно в раствор, при этом каждый металл дает свой вклад в кривую регистрируемого тока электрорастворения в соответствии с присущей каждому металлу электрохимической активностью.
3. Введение пробы в электрохимическую ячейку.
4. Снятие кривой электрорастворения металлов в растворе, содержащем анализируемое вещество, в соответствии с п.2
5. Полученные после выполнения п.2 и 4 результаты отражают изменение электрохимической активности металлов. О наличии индивидуального органического вещества (или смеси веществ) в тестируемом образце судят по изменению характера кривых электрорастворения металлов после введения в пробу алкалоида (см. фиг.1, 2, 3). Далее результаты опытов вводятся в компьютер и обрабатываются по соответствующей программе. Полученная в результате компьютерной обработки разностная кривая токов электрорастворения металлов, имеющая вид N-мерного векторного образа, сравнивается с соответствующими данными из базы данных, полученных для отдельных алкалоидов, на основании чего делается вероятностный вывод о степени соответствия тестируемого образца с максимально близким образцом из базы данных, что при высокой степени совпадения позволяет идентифицировать исследуемое вещество.
Идентификация образца по его индивидуальному N-мерному образу, характеризующему конкретное тестируемое органическое вещество (или смесь веществ), проводится в результате последовательного осуществления операций:
1) оцифровки кривых электрорастворения металлов в присутствии алкалоидов и в их отсутствии (фоновая кривая) путем разбиения этих кривых на N поддиапазонов и усреднения показаний в пределах каждого поддиапазона;
2) вычитания из оцифрованной кривой в присутствии пробы соответствующих значений оцифрованной фоновой кривой с получением разностной кривой электроактивности;
3) занесения оцифрованной индивидуальной разностной кривой электрорастворения (индивидуального N-мерного образа) в электронную базу данных;
4) сравнения индивидуального N-мерного образа тестируемого образца с базой данных и оценка относительного соответствия исследуемого образца образцам, имеющимся в базе данных;
5) оценки степени соответствия исследуемого образца наиболее близкому образцу из базы данных с вероятностным выводом о его составе.
Что касается концентрации металлов, нами подобран оптимальный интервал концентраций металлов (1÷5·10-5 М), позволяющий за небольшое время осаждения (1 мин) получать хорошо выраженные анодные токи растворения. При этой концентрации металлов имеет место заметное влияние алкалоидов до их минимальной концентрации 1·10-3 мг/мл.
Пример 1
Электролит для электрохимического сенсора представляет собой водный раствор (рН 7,0) смеси азотнокислых солей четырех металлов (Zn, Cd, Pb, Со) в концентрации 5·10-5 М в 0,05 М КСl.
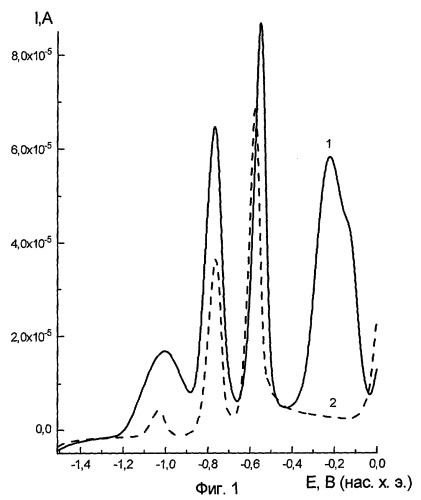
На фиг.1 приведены результаты влияния папаверина на токи электрорастворения сенсорных металлов (Zn, Cd, Pb, Со), где кривая 1 является фоновой (сенсорный электролит); кривая 2 - электролит с добавкой папаверина; фиг.1а - векторный образ пробы папаверина, полученный после компьютерной обработки результатов.
Пример 2
Аналогично примеру 1 получены фоновая кривая и кривая электрорастворения сенсорных металлов в присутствии бруцина в концентрации С=5·10-2 мг/мл. Электрохимический сенсор представляет собой смесь азотнокислых солей металлов (Zn, Cd, Pb, Со) в концентрации 5·10-5 М в 0,05 М КСl.
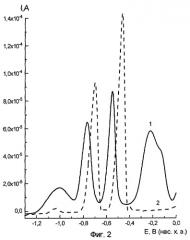
На фиг.2 представлено влияние бруцина на токи электрорастворения сенсорных металлов, где кривая 1 - фоновый электролит, кривая 2 - электролит с добавкой бруцина, фиг.2а - векторный образ пробы бруцина после компьютерной обработки результатов.
Пример 3
На фиг 3: кривая 1 - фоновый (сенсорный) электролит, представляющий собой смесь азотнокислых солей Zn, Cd, Fe, Сu в концентрации 5·10-5 М в 0,05 М КСl; кривая 2 - сенсорный электролит с добавкой криптопина (С=5·10-2 мг/мл), фиг.3а - векторный образ пробы криптопина.
Приведенные примеры показывают, что различные алкалоиды специфическим образом влияют на разностную картину токов электрорастворения сенсорных металлов, регистрируемую методом инверсионной вольтамперометрии. Таким образом подтверждается возможность использования заявленного способа для идентификации алкалоидов методом инверсионной вольтамперометрии.
1. Способ электрохимического мультисенсорного обнаружения и идентификации алкалоидов, включающий формирование электрохимического сенсора, получение фоновой кривой и кривой после введения пробы с последующим использованием разностной картины индикации для установления наличия искомого вещества в исследуемом растворе, отличающийся тем, что формирование электрохимического сенсора ведут путем смешения не менее четырех солей металлов, выбранных из ряда: Sn, Co, Cr, Mn, Fe, Сu, Zn, Cd, Pb, Ag, Ga концентрации 1÷5·10-5 М, в растворе электролита с последующим введением его в электрохимическую ячейку, кривые электрохимической индикации снимают методом инверсионной вольтамперометрии с потенциалом катодного осаждения металлов (-1,8)÷(-1,5) В относительно хлорсеребряного электрода сравнения и последующей разверткой потенциала от (-1,8)÷(-1,5) В до 0,1÷0,3 В, затем снимают кривую после введения пробы, а о наличии алкалоидов судят по изменению характера полученных кривых, а идентификацию ведут путем компьютерной обработки полученных кривых и сравнения полученной при этом разностной кривой в виде N-мерного векторного образа с образами из базы данных.
2. Способ по п.1, отличающийся тем, что в состав электролита для электрохимического сенсора входят: не менее четырех азотнокислых или солянокислых солей металлов, выбранных из ряда Sn, Со, Cr, Mn, Fe, Сu, Zn, Cd, Pb, Ag, Ga, хлористый калий в виде 0,05 М раствора и вода - при следующем соотношении компонентов, мас.%:
| Соли Sn, Со, Cr, Mn, Fe, Сu, Zn, Cd, Pb, Ag, Ga | 3÷5·10-4 |
| КСl в виде 0,05 М раствора | 2÷4·10-1 |
| Вода | Остальное |