Способ интраоперационной визуализации элементов нервно-сосудистого пучка при радикальной цистэктомии и радикальной простатэктомии
Иллюстрации
Показать всеИзобретение относится к медицине и предназначено для интраоперационной визуализации нервно-сосудистого пучка при радикальной простатэктомии и/или радикальной цистэктомии. Визуализацию элементов нервно-сосудистого пучка при радикальной простатэктомии и/или радикальной цистэктомии проводят методом кросс-поляризационной оптической когерентной томографии (ОКТ) с одномоментным получением ОКТ-изображений в прямой и в ортогональной поляризации. ОКТ-сканирование в каждой точке производят дважды, с изменением угла сканирования на 90° путем поворота датчика томографа. Получают ОКТ-изображение тканей в продольном и поперечном сечениях. Дифференцировку элементов нервно-сосудистого пучка осуществляют по результатам ОКТ-сканирования. Предлагаемый способ позволяет четко идентифицировать и дифференцировать нервные стволы, артериальные и венозные сосуды, соединительно-тканные элементы по результатам кросс-поляризационной оптической когерентной томографии. 1 з.п. ф-лы, 12 ил.
Реферат
Предлагаемое изобретение относится к медицине, а именно к функциональной диагностике, урологии и онкологии, и может быть использовано при лечении и реабилитации больных после удаления мочевого пузыря или предстательной железы.
За последние годы хирургическая техника лечения больных раком предстательной железы и инвазивного рака мочевого пузыря усовершенствовалась, позволив значительно уменьшить послеоперационную летальность в данной группе пациентов [1]. Среди осложнений в настоящее время на первое место выходят те, которые связаны с ухудшением качества жизни пациентов в отдаленном послеоперационном периоде. Наиболее частыми и социально-значимыми осложнениями являются недержание мочи и эректильная дисфункция. По данным различных авторов восстановление эректильной функции происходит от 9 до 68% случаев [1, 2, 3]. Учитывая это, отдается предпочтение операциям с сохранением нервно-сосудистого пучка, значительно повышающим вероятность сохранения эректильной функции в послеоперационном периоде [1, 4]. Сохранение нервно-сосудистого пучка возможно как с одной, так и с обеих сторон у выборочного контингента больных [5].
Основными механизмами развития эректильной дисфункции (далее ЭД) в послеоперационном периоде считаются нейрогенный, артериальный, веноокклюзивный и смешанный. Нейрогенная ЭД после радикальной простатэктомии и радикальной цистэктомии связана с повреждением тазового сплетения и кавернозных нервов в процессе операции. У части пациентов, особенно после нервосберегающей радикальной простатэктомии, нарушения эрекции имеют преимущественно сосудистый генез. Кавернозные тела кровоснабжаются кавернозными артериями, являющимися конечными ветвями внутренних половых артерий, а также добавочными кавернозными артериями, происходящими из различных артерий и имеющими место примерно у 70% мужчин. Развитие артериальной ЭД у больных после радикальной простатэктомии может быть связано с повреждением добавочных кавернозных артерий, которые у части мужчин могут являться основным источником кровоснабжения кавернозной ткани. Веноокклюзивная ЭД после радикальной простатэктомии является следствием фиброзных изменений кавернозной ткани, вызванных снижением ее оксигенации в результате повреждения нервов или артериальных сосудов [15].
Несмотря на широкое применение нервсберегающей оперативной техники процент возникновения эректильной дисфункции после выполнения подобных операций колеблется от 8 до 75% в зависимости от возраста, клинической стадии заболевания [1], что связано с проблемой идентификации нервного пучка. Это заставляет искать прецизионные методы интраоперационного контроля сохранности нервно-сосудистого пучка.
С этой целью в современной медицине применяются различные методы интраоперационного контроля кавернозного нерва. Большинство из них основаны на оценке функционального состояния кавернозного нерва путем его электростимуляции [6] или лазерной стимуляции [10].
Электросимуляция кавернозного нерва производится в течение 30 с, при этом интраоперационно с помощью датчика, выявляющего изменения тумесценции, оценивается изменение интракавернозного давления. Повышение интракавернозного давления с 10 до 80 мм рт.ст., по мнению авторов, свидетельствует об адекватной визуализации нерва.
При проведении лазерной стимуляции используется тилиумный лазер с длиной волны 1870 nm. Оценка адекватности нахождения кавернозного нерва проводится также при помощи измерения интракавернозного давления. Преимуществом лазерной стимуляции является бесконтактная стимуляция и меньшее количество артефактов. Определение нервно-сосудистого пучка с помощью электро- и лазерной стимуляции выполнялась в эксперименте на крысах на макроскопически видимом нервном стволе, т.е. объективная визуализация кавернозного нерва является необходимым условием для применения данных методик. Однако, как показывает практика, сосудисто-нервный пучок макроскопически не всегда четко определяется, и можно предположить, что оценка адекватности проведения нервсберегающих операций, с помощью методов, основанных на функциональной оценке нерва в условиях плохой видимости элементов сосудисто-нервного пучка, будет недостаточной.
Наиболее близким аналогом разработанного способа по решаемой задаче и совокупности сходных существенных признаков является способ визуализации элементов нервно-сосудистого пучка с помощью стандартной оптической когерентной томографии (далее ОКТ). Метод апробирован в эксперименте на крысах группой Fried M.N. et al. [6] и во время лапароскопической простатэктомии Aron М, et al. [7]. Последняя работа (выполненная при проведении лапароскопической простатэктомии [7]) выбрана за прототип. Во время традиционно выполнявшихся оперативных вмешательств выполнялось ОКТ - сканирование тканей на стандартном оптическом когерентном томографе - «Niris» (производства кампании «Imalux») в проекции нервно-сосудистого пучка с получением ОКТ-изображений в прямой поляризации. Авторы способа-прототипа пытались отдельно визуализировать на ОКТ-изображениях сосуды, нервные стволы, жировую ткань, капсулу и ткань предстательной железы, лимфатические сосуды, однако ОКТ-изображения отдельных элементов нервно-сосудистого пучка, как показывает анализ приведенных в публикациях иллюстраций, выглядят схоже. Четкого описания критериев определения и дифференцировки вышеуказанных элементов не представлено. Отсутствие четких идентификационных признаков элементов нервно-сосудистого пучка затруднит их интраопрационную дифференцировку.
Кроме того, недостатком стандартной ОКТ-визуализации (изображение только в прямой поляризации), выполненной как моноисследоваие, является ее относительно низкая чувствительность для тканей, не имеющих послойного строения. ОКТ-изображения кавернозного нерва, представленные в публикациях [5, 6], выглядят схоже с соединительно-тканной капсулой, элементами фасции и жировой ткани (на фиг.9, 10, 11 и 12 приведены копии ОКТ-изображений из публикации о способе-прототипе).
В задачу предлагаемого изобретения положена четкая идентификация и дифференциация следующих элементов нервно-сосудистого пучка: нервных стволов, сосудов артериального и венозного типов, соединительно-тканных элементов. Поставленная задача достигается тем, что визуализацию элементов нервно-сосудистого пучка проводят при радикальной простатэктомии и радикальной цистэктомии, при этом исследование осуществляется методом кросс-поляризационной ОКТ с одномоментным получением ОТК-изображений в прямой и в ортогональной поляризации, причем ОКТ-сканирование в каждой точке производят дважды, с изменением угла сканирования на 90° путем поворота датчика томографа и получением, таким образом, ОКТ-изображения тканей в продольном и поперечном сечениях, а дифференцировку элементов нервно-сосудистого пучка осуществляют следующим образом:
- нервные стволы в прямой и в ортогональной проекции визуализируют в поперечном сечении как округлые, расположенные в верхних слоях тканей гомогенные образования с гиперинтенсивным свечением, без просвета внутри; а в продольном сечении как продольно расположенные в верхних слоях тканей гомогенные волокна с гиперинтенсивным свечением, без просвета внутри;
- артериальные и венозные сосуды визуализируют в поперечном сечении как крупные округлые, с гиперэхогенной стенкой образования, расположенные в разных слоях тканей, имеющие гипоэхогенный просвет в центре, видимые как в прямой, так и в ортогональной поляризации, а в продольном сечении - как продольно расположенные гиперэхогенные волокна, имеющие гипоэхогенный просвет внутри, видимые как в прямой, так и в ортогональной поляризации;
- соединительно-тканные элементы визуализируют и в прямом, и в поперечном сечении как продольные слои с гиперинтенсивным свечением, не меняющиеся при поворотах датчика, без просвета внутри, при этом в ортогональной поляризации эти слои имеют негомогенную структуру и при поворотах датчика также не меняют свою структуру. К соединительно-тканным элементам относят внутритазовую фасцию, капсулу простаты, боковую фасцию таза.
Предлагаемый способ визуализации элементов нервно-сосудистого пучка отличается от способа-прототипа тем, что используется кросс-поляризационный метод ОКТ-визуализации с применением модифицированного варианта оптического когерентного томографа, способного одновременно in vivo получать стандартные и кросс-поляризационные изображения (изображения в прямой и ортогональной поляризации), что значительно повышает специфичность исследования.
Кросс-поляризационная ОКТ (далее КП ОКТ) является одним из вариантов развития ОКТ, однако дополнительно использует поляризационные характеристики рассеянного света. КП ОКТ помимо информации об обратном рассеянии тканью зондирующего излучения (изображение в основной поляризации) также демонстрирует его деполяризацию при рассеянии на локальных анизотропных микронеоднородностях в целом изотропной среды (которой в данном способе является нервно-сосудистый пучок). Такое рассеяние приводит к появлению изображений в ортогональной поляризации. Получение и сравнение изображений рассеяния в исходной и ортогональной поляризациях являются основой КП ОКТ, которая позволяет получать детальную информацию о микроструктурных и биохимических изменениях деполяризующих компонентов ткани. Ранее применение КП ОКТ было описано для коллагена [11-14]. Использование кросс-поляризационной ОКТ для визуализации нервной ткани в литературе не описано.
Способ поясняется чертежами (ОКТ-изображения+гистологические препараты).
На фиг.1-12 представлены ОКТ-изображения и гистологические изображения нервно-сосудистого пучка.
На фиг.1-7 обозначено:
а - КП ОКТ-изображение;
б - изображение гистологического среза.
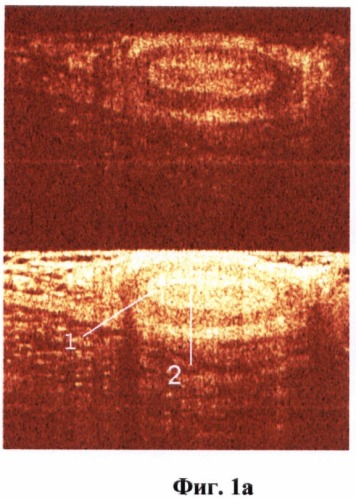
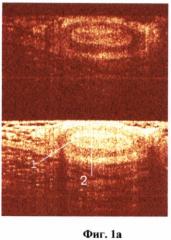
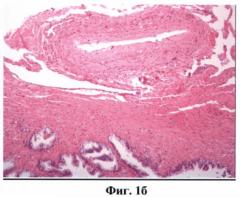
На фиг.1 (а, б) изображен сосуд артериального типа.
На фиг.1 обозначено:
1 - стенка артерии (мышечный слой),
2 - просвет артерии.
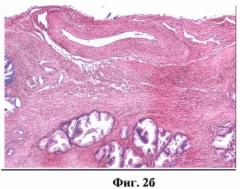
На фиг.2 (а, б) изображен сосуд венозного типа.
На фиг.2 обозначено:
3 - просвет вены,
4 - стенка вены.
На фиг.3 (а, б) изображен нервный ствол (поперечное сечение), сохраняющий свои оптические свойства в кроссполяризационном изображении.
На фиг.3 обозначено:
5 - изображение нерва (поперечное сечение) в стандартной поляризации,
6 - изображение нерва (поперечное сечение) в кроссполяризации.
На фиг.4 (а, б) изображен нервный ствол (продольное сечение), сохраняющий свои оптические свойства в кроссполяризационном изображении.
На фиг.4 обозначено:
7 - изображение нерва (продольное сечение) в стандартной поляризации,
8 - изображение нерва (продольное сечение) в кроссполяризации.
На фиг.5 (а, б) изображена жировая ткань.
На фиг.6 (а, б) изображено соединительно-тканное образование, видимое лишь на стандартном ОКТ-скане.
На фиг.6 обозначено:
9 - гиперэхогенное образование в ОКТ,
10 - отсутствие свечения в кроссполяризации.
На фиг.7 (а, б) изображены капсула и ткань предстательной железы.
На фиг.7 обозначено:
11 - капсула предстательной железы в кроссполяризации,
12 - ткань предстательной железы в кроссполяризации,
13 - капсула предстательной железы в стандартной поляризации,
14 - ткань предстательной железы в стандартной поляризации.
На фиг.8 изображен общий вид операционного поля во время выполнения КП ОКТ сканирования при выполнении радикальной простатэктомии.
На фиг.9 изображен ОКТ-скан нервно-сосудистого пучка in vivo до удаления предстательной железы во время выполнения лапароскопической простатэктомии.
На фиг.10 изображен ОКТ-скан сохраненного нервно-сосудистого пучка in vivo после выполнения лапароскопической простатэктомии.
На фиг.11 изображен ОКТ-скан правого нервно-сосудистого пучка ex vivo на препарате предстательной железы после выполнения роботизированной простатэктомии без сохранения нервно-сосудитого пучка.
На фиг.12 изображено гисто-патологическое исследование, подтверждающее наличие крупного нервного ствола (указан стрелкой) правого нервно-сосудистого пучка, расположенного снаружи от капсулы предстательной железы, в отмеченной области, соответствующей ОКТ - изображению на фиг.11.
В ходе разработки способа для визуализации нервно-сосудистого пучка использовался оптоволоконный оптический когерентный томограф «ОКТ1300-У», разработанный в ИПФ РАН (г.Нижний Новгород) и оснащенный торцевым эндоскопическим зондом, наружный диаметр которого составляет 2.7 мм (Gelikonov VM, Gelikonov GV. New approach to cross-polarized optical coherence tomography based on orthogonal arbitrarily polarized modes. Laser Physics Letters. 2006 Sep; 3(9):445-51). В «ОКТ1300-У» используется зондирующее излучение с длиной волны 1300 нм и мощностью 3 мВт. Каждое ОКТ изображение имеет следующие характеристики: 200×200 пикселей, размер 2×2 мм, разрешение по глубине 15 мкм в свободном пространстве, продольное разрешение 25 мкм. Изображение регистрируется в течение 2 секунд. Прибор имеет два канала и одновременно демонстрирует два сопряженных изображения: в прямой поляризации (нижнее из двух изображений) и в ортогональной поляризации (верхнее изображение) со строгим взаимным соответствием пространственного расположения элементов изображений. ОКТ-устройство оснащено торцевым многофункциональным эндоскопическим зондом диаметром 2,7 мм [8, 9].
Техника операций была традиционной. Радикальная простатэктомия выполнялась позадилонным доступом, радикальная цистэктомия - из срединной лапаротомии. После рассечения латеральной фасции таза выполнялось ОКТ-сканирование тканей в проекции нервно-сосудистого пучка.
ОКТ изображениями сосудов считались крупные округлые включения, видимые в обеих поляризациях, с четкими стенками, с гиперинтенсивным сигналом и гипоинтенсивной зоной в центре (просвет). Причем у сосудов артериального типа определялась более толстая мышечная стенка (слой с гиперинтенсивным сигналом) (фиг.1а, б). Венозный сосуд выраженной мышечной стенки не имел (фиг.2а, б). Кроме того, сосуды артериального типа при проведении исследования подвергались компрессии в меньшей степени.
При получении на ОКТ-изображении однородных гиперинтенсивных включений округлой формы, расположенных в верхних слоях, считалось, что они соответствуют поперечным срезам нервного ствола (фиг.3а, б). Основными признаками нервного ствола считалось расположение образования в верхних слоях сканируемых тканей, наличие у него деполяризующих свойств, то есть оно визуализировалось как однородное гиперинтенсивное включение как на изображении в стандартной поляризации, так и на кроссполяризационном изображении. Причем при повороте датчика на 90° и соответственно изменении угла сканирования нервные стволы визуализировались в верхних слоях изображения как однородные гиперинтенсивные, продольно расположенные волокна (фиг.4а, б).
Жировая ткань в обеих поляризациях была представлена характерной ячеистой структурой (фиг.5а, б).
Недостатком стандартной ОКТ - визуализации, выполненной как моноисследование, является ее относительно низкая чувствительность для тканей, не имеющих послойного строения. Стандартные ОКТ-изображения могут выявлять структуры, которые лишь напоминают нервный ствол и не имеют при этом гиперинтенсивного сигнала в КП. При этом они могут выглядеть схоже с соединительно-тканной капсулой, элементами фасции и жировой ткани. При отсутствии интенсивного сигнала в кросс-поляризационном изображении округлое включение или продольное волокно, видимое на стандартном ОКТ - изображении, нервным стволом не считалось (фиг.6).
Учитывая близость расположения элементов сосудисто-нервного пучка к простате, также отдельно изучены методом КП ОКТ капсула и ткань предстательной железы. Капсула предстательной железы в стандартной поляризации выглядела как гиперинтенсивный гомогенный продольный слой, расположенный ниже элементов нервно-сосудистого пучка. Ее изображение и локализация не менялись при поворотах датчика, то есть всегда фиксировался продольный слой. Учитывая то, что соединительно-тканные элементы образованы волокнами, переплетающимися в разных направлениях в кроссполяризации, капсула выглядела негомогенной линейной структурой, расположенной ниже элементов нервно-сосудистого пучка (фиг.7а, б).
ОКТ сканирование выполнялось до получения четкого поперечного изображения нервно-сосудистого пучка (фиг.8). Производилось ОКТ - сканирование нескольких точек вдоль пучка. У части пациентов нервно-сосудистый пучок с учетом полученных при сканировании данных сохранялся, для чего выполнялось смещение тканей, содержащих нервно-сосудистый пучок, латерально и кзади. При интраоперационном выявлении инфильтративного процесса с одной или обеих сторон главной задачей оставалась радикальность проведения операции, измененные ткани широко иссекались. Нервно-сосудистые пучки при этом не сохранялись.
После удаления комплекса (предстательная железа+семенные пузырьки или мочевой пузырь+предстательная железа+семенные пузырьки) ОКТ-визуализация нервно-сосудистых пучков in vivo проводилась повторно, что позволяло проконтролировать интраоперационную сохранность нервно-сосудистых пучков.
Во всех случаях ex vivo проводилось контрольное ОКТ-сканирование препаратов в проекции нервно-сосудистых пучков. Из точек сканирования выполнялась вырезка для гистологического исследования. Присутствие или отсутствие элементов нервно-сосудистого пучка на препарате позволяло сделать вывод об адекватности проведения нервсберегающей операции.
Преимуществами предложенного способа являются:
- возможность атравматичного получения изображения элементов нервно-сосудистого пучка в реальном времени in vivo,
- возможность применения во время лапароскопических и робот-ассоциированных операций.
Таким образом, описываемый способ визуализации элементов нервно-сосудистого пучка является новым среди способов контроля их сохранности при проведении радикальной простатэктомии и цистэктомии.
Данный способ визуализации элементов нервно-сосудистого пучка апробирован в урологической клинике ФГУ ПОМЦ «Росздрава». У 13 пациентов при выполнении радикальной цистэктомии и простатэктомии проводилась интраоперационная визуализация нервно-сосудистого пучка с использованием кроссполяризационной ОКТ. Каких-либо осложнений, связанных с интраоперационным проведением ОКТ-сканирования, не было. Данные гистологогических исследований препаратов соответствуют данным ОКТ-сканирования, проведенным in vivo во время операции и ех vivo на препаратах. Это дает основание для применения данного способа в клинике по показаниям у соответствующей категории пациентов.
Предлагаемый способ осуществляют следующим образом.
Во время радикальной цистэктомии или радикальной простатэктомии после рассечения латеральной фасции таза проводят ОКТ-сканирование тканей в проекции нервно-сосудистого пучка с использованием оптоволоконного оптического когерентного томографа, позволяющего одномоментно получать ОКТ-изображения в прямой и в ортогональной поляризации. Например, можно использовать прибор - оптоволоконный оптический когерентный томограф «ОКТ1300-У». Используют традиционную технику операций. Радикальную простатэктомию выполняют позадилонным доступом, радикальную цистэктомию - из срединной лапаротомии. После рассечения латеральной фасции таза выполняют ОКТ - сканирование тканей в проекции нервно-сосудистого пучка.
ОКТ изображениями сосудов считают крупные округлые включения, видимые в обеих поляризациях, с четкими стенками, с гиперинтенсивным сигналом и гипоинтенсивной зоной в центре (просвет) (фиг.2, 3).
При получении на ОКТ-изображении однородных гиперинтенсивных включений округлой формы, расположенных в верхних слоях, считают, что они соответствуют поперечным срезам нервного ствола (фиг.3а, б). Основными признаками нервного ствола считают расположение образования в верхних слоях сканируемых тканей, наличие у образования деполяризующих свойств, то есть его визуализируют как однородное гиперинтенсивное включение как на изображении в стандартной поляризации, так и на кроссполяризационном изображении. Причем при повороте датчика на 90° и соответственно изменении угла сканирования нервные стволы визуализируют в верхних слоях изображения как однородные гиперинтенсивные, продольно расположенные волокна (фиг.4а, б).
Жировую ткань в обеих поляризациях визуализируют как характерную ячеистую структуру (фиг.5а, б).
ОКТ сканирование выполняют до получения четкого поперечного изображения нервно-сосудистого пучка (фиг.8). Производят ОКТ - сканирование нескольких точек вдоль пучка. У части пациентов нервно-сосудистый пучок с учетом полученных при сканировании данных сохраняют, для чего выполняют смещение тканей, содержащих нервно-сосудистый пучок, латерально и кзади. При интраоперационном выявлении инфильтративного процесса с одной или обеих сторон главной задачей считают радикальность проведения операции, измененные ткани широко иссекают. Нервно-сосудистые пучки при этом не сохраняют.
После удаления комплекса (предстательная железа+семенные пузырьки или мочевой пузырь+предстательная железа+семенные пузырьки) ОКТ-визуализацию нервно-сосудистых пучков in vivo проводят повторно, что позволяет проконтролировать интраоперационную сохранность нервно-сосудистых пучков.
Во всех случаях ex vivo проводят контрольное ОКТ - сканирование препаратов в проекции нервно-сосудистых пучков. Из точек сканирования выполняют вырезку для гистологического исследования. Присутствие или отсутствие элементов нервно-сосудистого пучка на препарате позволяет сделать вывод об адекватности проведения нервсберегающей операции.
Клинические примеры.
Пример №1. Больной А, 59 л. ИБ 5930. Диагноз: рак предстательной железы T1cN0M0 Глисон 2+3=5. Диагноз был установлен по данным мультифокальной биопсии предстательной железы, показанием к выполнению которой явилось повышение уровня PSA до 9,1 нг/мл. Жалоб на момент поступления не было. При обследовании (спиральная компьтерная томография органов малого таза, УЗИ органов брюшной полости, почек, рентгенографии легких) отдаленных метастазов выявлено не было, сопутствующей патологии не выявлено. Экскреторная урография не выявила нарушений функции почек и уродинамики верхних мочевых путей. Клинически и по данным проведенного анкетирования (IIEF) эректильная функция до операции была удовлетворительной. По результатам обследования больному была показана радикальная простатэктомия. Выполнялась радикальная нервсберегающая простатэктомия с интраоперационной КП ОКТ-визуализацией элементов нервно-сосудистого пучка. Учитывая отсутствие местного инфильтративного процесса, решено было сохранить нервно-сосудистые пучки с обеих сторон. Интраоперационно проводилось КП ОКТ-сканирование в проекции нервно-сосудистого пучка. Были получены изображения элементов нервно-сосудистого пучка. Основываясь на ОКТ данных, ткани, содержащие элементы нервно-сосудистого пучка, были сохранены путем смещения их латерально и кзади. После удаления комплекса предстательная железа+семенные пузырьки ОКТ-сканирование выполнено повторно. В дальнейшем ex vivo произведено исследование препарата: макроскопически структуры нервно-сосудистого пучка не были обнаружены. Произведено ОКТ-сканировнание заднелатеральной поверхности предстательной железы и семенных пузырьков в нескольких точках справа и слева. Из этих точек была выполнена вырезка для гистологического исследования. В материалах вырезки получены капсула простаты, ткань простаты, сосуды венозного сплетения. При контрольных ОКТ-сканированиях ex vivo и по результатам гистологического исследования операционного материала крупных нервных стволов обнаружено не было. Срок послеоперационного наблюдения составил 3 мес. Функция удержания мочи удовлетворительная. Отмечается появление спонтанных эрекций через 2 мес. Через 5 месяцев после операции отмечается возникновение эрекций без фармокологической поддержки, достаточных для проведения полового акта.
Пример №2. Больной М., 46 л., ИБ 795. Диагноз: переходноклеточный рак мочевого пузыря. pT3bN0M0 G3. Поступил с жалобами на гематурию в течение 1 года. При диагностической цистоскопии выявлена инфильтративно-экзофитная опухоль, занимающая всю левую боковую стенку мочевого пузыря с переходом на шейку мочевого пузыря. Экскреторная урография не выявила нарушений функции почек и уродинамики верхних мочевых путей. При обследовании (СКТ органов малого таза, УЗИ органов брюшной полости, почек, рентгенографии легких) отдаленных метастазов выявлено не было, выраженной сопутствующей патологии не выявлено. Клинически и по данным проведенного анкетирования (IIEF) эректильная функция до операции удовлетворительная. РSА=5 нг/мл, ректальное пальцевое обследование и УЗИ простаты патологии не выявило. По результатам обследования больному была показана радикальная цистэктомия. Учитывая наличие инвазии шейки мочевого пузыря и простатического отдела уретры, методом деривации мочи была выбрана пластика по Майнц-Пауч 2. Выполнялась радикальная цистпростатэктомия с интраоперационной КП ОКТ-визуализацией элементов нервно-сосудистого пучка. Учитывая наличие местного инфильтративного процесса элементы нервно-сосудистого пучка были удалены с обеих сторон. Интраоперационно проводилось КП ОКТ-сканирование в проекции нервно-сосудистого пучка. Были получены изображения его элементов. После удаления комплекса мочевой пузырь+предстательная железа+семенные пузырьки ОКТ-сканирование выполнено ex vivo. Произведено исследование препарата: макроскопически были выявлены элементы нервно-сосудистого пучка. Произведено ОКТ-сканирование заднелатеральной поверхности предстательной железы и семенных пузырьков в нескольких точках справа и слева. Из этих точек была выполнена вырезка для гистологического исследования. При контрольных ОКТ-сканированиях ex vivo и по результатам гистологического исследования операционного материала, взятого из точек сканирования, были обнаружены крупные нервные стволы и сопровождающие их сосуды. Срок послеоперационного наблюдения составил 1 мес. Эректильная функция отсутствует.
Источники информации
1. Коган М.И., Лоран О.Б., Петров С.Б. Радикальная хирургия рака предстательной железы. - М.: ГЭОТАР-Медиа, 2006. - 352 с.
2. Oefelein M.G. Prospective predictors of urinary continence after anatomical radical retropubic prostatectomy: a multivariate analysis // World Journal of Urology. - Aug. 2004, Volume 22, Number 4, P.267-271.
3. Shunichi N., Seiichi S., Makoto S., Shigeto I., et al. Quality of Life after Radical Prostatectomy in Japanese Men: 2 year Longitudinal Study // Japanese Journal of Clinical Oncology 2005 35(9): P.551-558.
4. Walsh P.C., Schlegel P.N. Radical pelvic surgery with preservation of sexual function // Annals of Surgery. - 1988 October; 208(4): P.391-400.
5. Пушкарь Д.Ю. Радикальная простатэктомия. - 2-е изд. - М.: МЕДпресс-информ, 2004. - 168 с.
6. Fried N.M., Rais-Bahrami S., Lagoda G.A., Chuang Y., Burnett A.L. et al. Imaging the cavernous nerves in the rat prostate using optical coherence tomography // Lasers in Surgery and Medicine. - 2006, Volume 39, Issue 1, Pages 36-41.
7. Aron M., Chung B.E. et al. Preliminary experience with the Niris™ optical coherence tomography system during laparoscopic and robotic prostatectomy // Journal of endourology. - August 2007; Volume 21 Num. 8.
8. Руководство по оптической когерентной томографии. / Под ред. д.м.н., проф. Н.Д.Гладковой, д.м.н. Н.М.Шаховой, чл.-корр., д.ф.-м.н. А.М.Сергеева. - М.: ФИЗМАТЛИТ, 2007 г. - 296 с.
9. Оптическая когерентная томография в ряду методов медицинской визуализации: Курс лекций. Н.Д.Гладкова, Н.Новгород: ИПФ РАН, 2005. - 324 с.
10. Fried N.M., Rais-Bahrami S., Lagoda G.A., Scott N.J., Burnett A.L. et al Noncontact stimulation of the cavernous nerves in the rat prostate using a tunable-wavelenght thilium fiber laser // J. Endourology. - February 2008, num.7.
11. Schmitt JM, Xiang SH. Cross-polarized backscatter in optical coherence tomography of biological tissue. Optics Letters. 1998 July 1; 23(13):1060-2.
12. Kuranov RV, Sapozhnikova VV, Shakhova NM, Gelikonov VM, Zagainova EV, Petrova SA. Combined application of optical methods to increase the information content of optical coherent tomography in diagnostics of neoplastic processes. Quantum Electronics. 2002; 32(11):993-8.
13. Kuranov RV, Sapozhnikova VV, Turchin IV, Zagainova EV, Gelikonov VM, Kamensky VA, et al. Complementary use of cross-polarization and standard OCT for differential diagnosis of pathological tissues. Optics Express. 2002 Jul 29; 10(15):707-13.
14. Геликонов Г.В., Геликонов B.M., Куранов P.B., Баландина Е.Б. Поляризационные методы оптической когерентной томографии. В кн.: Руководство по оптической когерентной томографии. Под ред. Гладковой Н.Д., Шаховой Н.М., Сергеева A.M. - Москва: Физматлит, Медицинская книга, 2007, 264-270.
15. Е.Б.Мазо, С.И.Гамидов, Р.И.Овчинников, В.В.Иремашвили. Новые аспекты патогенеза, профилактики и лечения эректильной дисфункции у больных после радикальной простатэктомии // CONSILIUM MEDICUM, 2004, том 6, №7.
1. Способ интраоперационной визуализации нервно-сосудистого пучка при радикальной простатэктомии и/или радикальной цистэктомии, отличающийся тем, что визуализацию элементов нервно-сосудистого пучка при радикальной простатэктомии и/или радикальной цистэктомии проводят методом кросс-поляризационной оптической когерентной томографии (ОКТ) с одномоментным получением ОКТ-изображений в прямой и в ортогональной поляризации, причем ОКТ-сканирование в каждой точке производят дважды с изменением угла сканирования на 90° путем поворота датчика томографа и получением, таким образом, ОКТ-изображения тканей в продольном и поперечном сечениях, а дифференцировку элементов нервно-сосудистого пучка осуществляют следующим образом:нервные стволы как в прямой, так и в ортогональной проекции визуализируют в поперечном сечении как округлые, расположенные в верхних слоях тканей гомогенные образования с гиперинтенсивным свечением, без просвета внутри, а в продольном сечении как продольно расположенные в верхних слоях тканей гомогенные волокна с гиперинтенсивным свечением, без просвета внутри;артериальные и венозные сосуды визуализируют в поперечном сечении как крупные округлые, с гиперэхогенной стенкой образования, расположенные в разных слоях тканей, имеющие гипоэхогенный просвет в центре, видимые как в прямой, так и в ортогональной поляризации, а в продольном сечении - как продольно расположенные гиперэхогенные волокна, имеющие гипоэхогенный просвет внутри, видимые как в прямой, так и в ортогональной поляризации;соединительно-тканые элементы визуализируют и в прямом, и в поперечном сечениях как продольные слои с гиперинтенсивным свечением, не меняющиеся при поворотах датчика, без просвета внутри, при этом в ортогональной поляризации эти слои имеют негомогенную структуру и при поворотах датчика также не меняют свою структуру.
2. Способ по п.1, отличающийся тем, что к соединительно-тканым элементам относят внутритазовую фасцию, капсулу простаты, боковую фасцию таза.