Способ диагностики зоны жизнеспособного миокарда
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к кардиохирургии. Для диагностики зоны жизнеспособного миокарда у пациентов кардиохирургического профиля определяют скорость сцинтилляционного счета с помощью гамма-зонда во время оперативного вмешательства. В качестве маркера определения границы жизнеспособной и нежизнеспособной ткани используют радиофармпрепарат жирную кислоту, меченную изотопом 123I. Если скорость сцинтилляционного счета над областью жизнеспособной ткани превышает скорость сцинтилляционного счета над участками рубцовой ткани на 40% и более диагностируют жизнеспособный миокард. Способ повышает точность диагностики жизнеспособного миокарда, позволяет наиболее эффективно провести аортокоронарное шунтирование. 7 ил.
Реферат
Изобретение относится к медицине и может быть использовано в медицинских учреждениях, оснащенных радиодиагностическими лабораториями.
Актуальной проблемой кардиохирургического лечения ишемической болезни сердца является оценка объема жизнеспособного миокарда [1, 2]. Определение зоны жизнеспособности пораженного миокарда имеет особое значение у больных с выраженной дисфункцией ЛЖ (ФВ<35%) и недостаточностью кровообращения. Сложность оперативного вмешательства у больных кардиохирургического профиля связана не только со сложностью оперативного вмешательства, но и с повышенной периоперационной летальностью. Тем не менее, доказано что у пациентов с тяжелой левожелудочковой дисфункцией и диагносцированным жизнеспособным миокардом уже на ранних сроках происходит улучшение ФВ ЛЖ, функционального класса недостаточности кровообращения и качества жизни [3, 4].
В связи с этим выявление жизнеспособного миокарда в областях коронарной ишемии необходимо не только для выбора вида оперативного лечения ишемической болезни сердца, но и тактики ведения хирургических больных в послеоперационный период, поскольку успех хирургической реваскуляризации напрямую зависит от объема жизнеспособного миокарда.
Известен способ диагностики жизнеспособного миокарда [5], суть которого заключается в регистрации скорости сцинтилляционного счета с помощью гамма-зонда над областью жизнеспособной и нежизнеспособной ткани после внутривенного введения 740 МБк 99mТс-тетрофосмина. Результаты данного способа показали его высокую эффективность в индикации границы жизнеспособного миокарда и рубцовой ткани, что создало предпосылки для внедрения этого метода в клиническую практику.
Данный способ является наиболее близким к заявляемому по технической сущности и достигаемому результату и выбран в качестве прототипа.
Недостатком указанного способа является использование в качестве маркера жизнеспособной ткани накопление 99mТс-тетрофосмина [6, 7], который распределяется в миокарде пропорционально миокардиальному кровотоку и не отражает биоэнергитеческих процессов в кардиомиоците. В связи с этим, по мнению многих авторов, чувствительность диагностики жизнеспособного миокарда с использованием 99mТс-тетрофосмина низкая [8, 9, 10].
Цель изобретения - повышение точности диагностики зоны жизнеспособного миокарда у больных кардиохирургического профиля.
Поставленная цель достигается техническим решением, представляющим собой определение скорости сцинтилляционного счета с помощью гамма-зонда во время оперативного вмешательства, в качестве маркера определения границы жизнеспособной и нежизнеспособной ткани используют радиофармпрепарат жирную кислоту, меченную изотопом 123I, при этом скорость сцинтилляционного счета над областью жизнеспособной ткани превышает скорость сцинтилляционного счета над участками рубцовой ткани на 40% и более. Использование данного способа позволяет с более высокой точностью диагностировать область жизнеспособной ткани и участки рубцовой ткани.
Указанные параметры получены опытным путем. Исследование было выполнено у 1 больного ишемической болезнью сердца, с инфарктом миокарда перед операцией аортокоронарного шунтирования с резекцией аневризмой левого желудочка. При анализе полученных результатов оказалось, что в среднем скорость сцинтилляционного счета над жизнеспособной тканью составила в среднем 101±2 импульсов в секунду, а над рубцовыми участками в среднем 72±4 импульсов в секунду.
Новым в предлагаемом способе является использование в качестве маркера жизнеспособной ткани радиофармпрепарат жирную кислоту, меченную изотопом 123I, при этом скорость сцинтилляционного счета над областью жизнеспособной ткани должна превышать скорость сцинтилляционного счета над участками рубцовой ткани на 40% и более.
Новые признаки проявили в заявляемой совокупности новые свойств, явным образом не вытекающие из уровня техники в данной области и не являющиеся очевидными для специалиста.
Идентичной совокупности признаков не обнаружено в патентной и научно-медицинской литературе.
Предлагаемый способ может быть использован в сердечно-сосудистой хирургии для повышения качества кардиохирургической помощи.
Исходя из выше изложенного следует считать предлагаемое изобретение соответствующим критериям «Новизна», «Изобретательский уровень», «Промышленная применяемость».
Изобретение будет понятно из следующего описания и предложенных к нему чертежей.
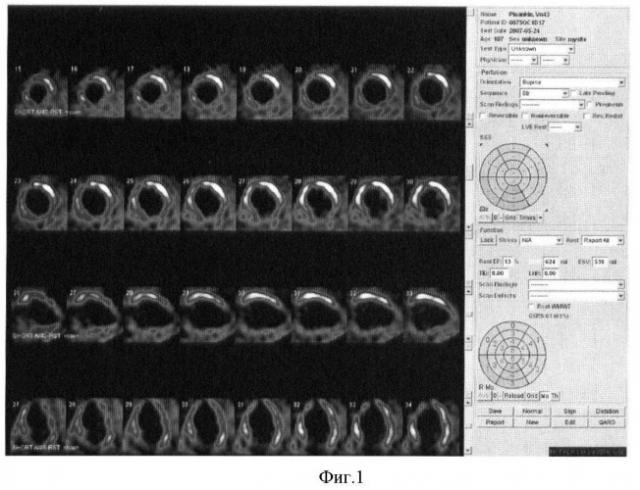
На фиг.1 представлены исходные перфузионные сцинтиграммы миокарда больного П.
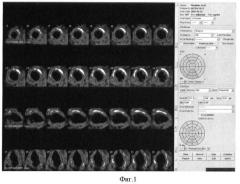
На фиг.2 представлены исходные метаболические сцинтиграммы миокарда больного П.
На фиг.3 представлен способ сбора информации с помощью гамма-зонда.
На фиг.4 представлено показание уровня сцинтилляционного счета над областью жизнеспособной ткани.
На фиг.5 представлено показание уровня сцинтилляционного счета над областью нежизнеспособной ткани.
На фиг.6 и 7 представлены морфологические исследования больного П.
Способ осуществляется следующим образом
За сутки до проведения кардиохирургической операции внутривенно вводят 110 МБк 123I - жирной кислоты, которая накапливается в жизнеспособных кардиомиоцитах. Через 90 минут от момента введения проводится однофотонная эмиссионная компьютерная томография с целью определения радионуклидных признаков накопления жирной кислоты, меченной изотопом 123I, в жизнеспособных участках миокарда левого желудочка.
На следующие сутки в процессе кардиохирургической операции по предварительно полученной информации о наличии участков жизнеспособной ткани по данным однофотонной эмиссионной компьютерной томографии врач-хирург визуально оценивает область рубцовой ткани и производит регистрацию скорости сцинтилляционного счета с помощью гамма-зонда с целью определения исходного значения количества импульсов в секунду. По мере перемещения зонда к визуально сохранной ткани сердечной мышцы повышение сцинтилляционного счета на 40% и более по сравнению с рубцовой тканью свидетельствует о наличии жизнеспособного миокарда.
Пример: пациент П., 43 года. Страдает ишемической болезнью сердца с 38 лет, в 2003 г. перенес крупноочаговый инфаркт миокарда задней стенки левого желудочка. Весной 2007 года почувствовал ухудшение общего состояния, без причины появилась одышка, которая сопровождалась общей слабостью, головокружением, болью за грудиной. При приеме нитроглицерина отмечал уменьшение боли за грудиной. Обратился в кардиохирургическое отделение ГУ НИИ кардиологии ТНЦ СО РАМН. После сбора анамнеза, физикального, лабораторных и инструментальных методов обследования был выставлен диагноз:
- осн: ИБС. Стенокардия напряжения 3 ФК, ПИКС (2003). Стенозирующий атеросклероз коронарных артерий. Хроническая аневризма левого желудочка. Недостаточность митрального клапана 3 ст., недостаточность трикуспидального клапана 2 ст.HIIB ФК III;
- фоновое: Гипертоническая болезнь 3 ст., риск 4;
- сопутствующее: Хронический бронхит, ремиссия. Нарушение обмена веществ, нарушение толерантности к глюкозе.
Пациенту П. были выполнены сцинтиграфические исследования:
однофотонная эмиссионная компьютерная томография миокарда с 99mТс-тетрофосмином в покое (фиг.1).
Заключение: по данным исследования в покое отмечаются дефекты перфузии в области верхушки, перегородочной, задней и боковой стенках левого желудочка (~40%).
Однофотонная эмиссионная компьютерная томография миокарда с
I123-жирной кислотой (фиг.2).
Заключение: признаки жизнеспособного миокарда в перегородочной области и базальных отделах задней стенки левого желудочка. Рубцовая ткань в области верхушки и боковой стенки (~23%).
Результаты комплексного сцинтиграфического исследования миокарда позволили диагностировать наличие жизнеспособного миокарда.
Во время операции с использованием гамма-зонда (фиг.3) согласно полученным данным сцинтиграфического обследования производился подсчет скорости сцинтилляционного счета над областью рубцовой ткани задней стенки (фиг.4) по направлению к передне-перегородочной области с наличием сохранного миокарда (фиг.5). Оказалось, что скорость сцинтилляционного счета над участком с жизнеспособным миокардом превышает счет над рубцовой тканью на 44%.
С области участка рубцовой ткани, где скорость сцинтилляционного счета составляла 75 импульсов в секунду, участка миокарда, где скорость сцинтилляционного счета составляла 89 импульсов в секунду, и участка, где скорость сцинтилляционного счета составляла 105 и 108 импульсов в секунду, были взяты биопсийные материалы для гистологического исследования.
Заключение для участков со скоростью сцинтилляционного счета 105 и 108 импульсов в секунду: на гистологических препаратах, окрашенных гематоксилином и эозином и по методу Маллори, с помощью обычной световой микроскопии было обнаружено, что кардиомиоциты (КМЦ) были, как правило, гипертрофированы, располагались поодиночке или небольшими очагами, окруженными полями рубцовой ткани, сформированной на месте предшествующих инфарктов. Следует отметить выраженный полиморфизм ядер КМЦ: увеличение их размеров, изменения формы и тинкториальных свойств. Внутриклеточный отек в КМЦ миокарда ЛЖ встречался повсеместно, причем выраженность его значительно варьировала между соседними клетками. Следует отметить значительные вариации диаметра соседствующих миокардиальных клеток. Отдельные кардиомиоциты находились в состоянии гипертрофии и достигали 60 мкм в диаметре. Соседние же клетки едва достигали 8-10 мкм, причем некоторые из них находились в состоянии глубокой дистрофии. Кардиомиоциты ишемизированного миокарда находятся в состоянии гибернации, общим проявлением которой является редукция сократительного аппарата, часто обозначаемая как «таяние» миофибрилл (фиг.6).
Морфологическое исследование из рубцового участка миокарда со скоростью сцинтилляционного счета 75 и 89 импульсов в секунду: межуточный мелкопетлистый, периваскулярный миокардиосклероз, отложение жира под эпикардом. Перикард склерозирован, с явлениями исхода хронического воспаления. Мышечные волокна неравномерной толщины с тенденцией к гипертрофии, явлениями зернистой дистрофии, неравномерным скоплением зерен липофусцина по периферии ядер. Стенки сосудов утолщены за счет атеросклеротических изменений, просвет их сужен. Во фрагментах миокарда задней стенки ЛЖ, МЖП крупные, сливающиеся зоны некроза волокон с выраженной лейкоцитарной инфильтрацией с примесью нейтрофилов в виде вала, очагами кровоизлияний (фиг.7.).
Применение предлагаемого способа позволяет с высокой точностью диагностировать зоны жизнеспособного и нежизнеспособного миокарда, что дает возможность в процессе кардиохирургической аневризмэктомии произвести точное иссечение рубцовой ткани и наиболее эффективно провести аортокоронарное шунтирование.
Литература
1. Mock M.B., Ringquist I., Fisher L.D. et al. Survival of medicallytreated patients in the Coronary Artery Surgery Study (CASS). Circulation 1982;66:562-568.
2. Беленков Ю.Н., Саидова М.А. Оценка жизнеспособности миокарда: клинические аспекты, методы исследования // Кардиология. - 1999. - Т. 39. - № 1. - С.6-13.
3. Di Carli M., Davidson M., Little R. el at. Value of metabolic imaging with positron emission tomography for evaluating prognosis in patients with coronary artery disease and left ventricular dysfunction. Am J Cardiol 1994;73:527-533.
4. Беленков Ю.Н., Акчурин Р.С.и др. Жизнеспособный миокард: сравнительная оценка хирургического и медикаментозного методов лечения больных ИБС с постинфарктным кардиосклерозом и хронической сердечной недостаточностью. Тер. арх., 2002; 2:60-64.
5. Spadafora M., Ferrara P., Varrella P. et all. In vivo radioguided surgery for ventricular remodeling in patients with large post-infarction akinetik scars: a new tool to discriminate viable myocardium and transmural fibrosis. European Journal of Nucl Med and Mol Imag. 2007, Oct.; 34(2): 254.
6. Hambye A.S., Vervaet A., Dobbeleir A. Quantification of 99Tc-sestamibi and 123I-BMIPP uptake for predicting functional outcome in chronically ischaemic dysfunctional myocardium. Nucl Med Commun. 1999, Aug.; 20(8):737-45.
7. Yang J.Y., Ruiz M., Calnon D.A., Watson D.D., Beller G.A., Glover D.K. Assessment of myocardial viability using 123I-labeled iodophenylpentadecanoic acid at sustained low flow or after acute infarction and reperfusion. J Nucl Med. 1999, May; 40(5):821-8.
8. Marzullo P., Sambuceli G., Parodi O. The role sestamibi scintigraphy in the radioisotopic assessment of myocardial viability. J Nucl Med, 1992;33:1925-1930.
9. Cuocolo A., Pase L., Ricciardelli B. el al. Identification of viable myocardium in patients with coronary artery disease: Comparison of thallium-201 scintigraphy with reinjection and technetium-99m methoxyisobutyl isonitrile. J Nucl Med, 1992;33:505-511.
10. Dilsizian V., Arrighi J.A., Diodali J.G. el al. Myocardial viability in patients with chronic coronary artery disease. Comparison, 99mTc-sestamibi with thallium reinjection and 18F-fluorodeoxyglucose. Circulation 1994; 89:578-587.
Способ диагностики зоны жизнеспособного миокарда у пациентов кардиохирургического профиля, заключающийся в определении скорости сцинтилляционного счета с помощью гамма-зонда во время оперативного вмешательства, отличающийся тем, что в качестве маркера определения границы жизнеспособной и нежизнеспособной ткани используют радиофармпрепарат - жирную кислоту, меченную изотопом 123I, при этом скорость сцинтилляционного счета над областью жизнеспособной ткани превышает скорость сцинтилляционного счета над участками рубцовой ткани на 40% и более.