Способ восстановления почв и грунтов, загрязненных нефтью и нефтепродуктами, в том числе застарелых нефтяных загрязнений
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к области охраны окружающей среды. Способ включает внесение углеводородокисляющих микроорганизмов с последующей периодической аэрацией почвы с одновременным внесением питательных элементов. Для повышения эффективности очистки почв от нефти и нефтепродуктов из микроорганизмов используют консорциум штаммов микроорганизмов - деструкторов нефти, обладающих повышенной активностью к тяжелым фракциям нефти, состоящий из микроскопического гриба Cladosporium elegantulum Pidopliczko et Deniak IB-KF1, псевдомонад P.putida (биовар A) IB-K1 и P.putida (биовар A) IB-K2, восьми видов бацилл В.brevis IB-К3, IB-K17, В.circulans IB-K4, IB-K6, IB-K11, В.coagulans IB-K16, В.popilliae IB-K10, B.stearothermophilus IB-K19, а также четырех культур родококков: R.maris IB-K5, R.luteus IB-K7, R.maris IB-K20, R.rubropertinctus IB-K8. Предпочтительно аэрацию почвы проводить с периодичностью 20-25 суток, а питательные элементы вносить в виде диаммофоски в количестве 0,25-0,5% масс. Изобретение позволяет повысить эффективность очистки почвы от нефти и нефтепродуктов. 1 з.п. ф-лы, 6 ил., 7 табл.
Реферат
Изобретение относится к области охраны окружающей среды и биотехнологии, а именно к способам восстановления почв и грунтов, загрязненных нефтью и нефтепродуктами.
Известен способ очистки воды и почвы от нефти, нефтепродуктов и полимерных добавок в буровом растворе, включающий внесение микроорганизмов, отличающийся тем, что из микроорганизмов используют ассоциацию штаммов бактерий Rhodococcus erythropolis BKM Ac-1339D, Bacillus subtilis BKM B-1742D и Pseudomonas putida BKM 1301 (патент РФ №2093478, опубл. 20.10.1997 г.).
Недостатком способа является низкая степень очистки почвы от нефтяных загрязнений и невозможность восстановления почв с застарелыми нефтяными загрязнениями, так как известная ассоциация штаммов бактерий не способна к биологическому разложению углеводородов тяжелых нефтяных остатков.
Наиболее близким предлагаемому способу по достигаемому техническому результату является способ восстановления почв и грунтов, загрязненных нефтью и нефтепродуктами, включающий распределение загрязненной почвы на горизонтальной площадке, внесение смеси чистой почвы и песка, внесение сорбента и нефтеокисляющих микроорганизмов в виде бактериального препарата "Деворойл", комплексного минерального удобрения, увлажнение и периодическую аэрацию почвы. Обработку сорбентом, препаратом «Деворойл» и комплексным удобрением производят периодически в соответствии с микробиологическими показателями грунта (патент РФ №2322312, опубл. 20.04.2008).
Недостатком данного способа является то, что использование бактериального препарата "Деворойл" не позволяет обеспечить высокую скорость деструкции углеводородов нефти на заключительной стадии очистки, что снижает эффективность очистки и увеличивает сроки восстановления почв с застарелыми нефтяными загрязнениями.
Задачей предлагаемого изобретения является повышение эффективности очистки почв от нефти и нефтепродуктов, в том числе от застарелых нефтяных загрязнений.
Поставленная задача решается тем, что в способе восстановления почв и грунтов, загрязненных нефтью и нефтепродуктами, в том числе застарелых нефтяных загрязнений, путем внесения углеводородокисляющих микроорганизмов с последующей периодической аэрацией почвы с одновременным внесением питательных элементов из микроорганизмов используют консорциум штаммов микроорганизмов - деструкторов нефти, обладающих повышенной активностью к тяжелым фракциям нефти, состоящий из микроскопического гриба - Cladosporium elegantulum Pidopliczko et Deniak IB-KF1, псевдомонад - P.putida (биовар A) IB-K1 и P. putida (биовар A) IB-K2, восьми видов бацилл В.brevis IB-K3, IB-K17, В.circulans IB-K4, IB-K6, IB-K11, В. coagulans IB-K16, В. popilliae IB-K10, В.stearothermophilus IB-K19, а также четырех культур родококков: R.maris IB-K5, R.luteus IB-K7, R.maris IB-K20, R.rubropertinctus IB-K8.
Кроме того, аэрацию почвы проводят с периодичностью 20-25 суток, а питательные элементы вносят в виде диаммофоски в количестве 0,25-0,5% масс.
Использование в качестве углеводородокисляющих микроорганизмов консорциума из 15 штаммов микроорганизмов, способных разлагать углеводороды нефти и обладающих повышенной активностью к тяжелым фракциям нефти, позволяет обеспечить скорость деструкции нефтяных загрязнений на максимально высоком уровне за счет высокой утилизирующей способности консорциума по отношению к нефти и нефтепродуктам в широком диапазоне содержания последних в углеводородсодержащем субстрате.
В результате экспериментов было выявлено, что предлагаемый консорциум штаммов микроорганизмов сохраняет свойства высокой активности на всех стадиях процесса биодеградации нефти, биодеградации окисленных фракций нефти, что позволяет повысить эффективность очистки почв за счет обеспечения высокой эффективности деструкции нефтяных загрязнений на заключительной стадии микробиологического этапа очистки нефтезагрязненных почв и грунтов. Этот эффект наиболее важен при ликвидации застарелых нефтяных загрязнений, в которых нефть деградирована и представлена тяжелыми фракциями.
Проведение аэрации почвы с периодичностью 20-25 суток и внесение при этом питательных веществ в количестве 0,25-0,5% масс. является оптимальным условием поддержания численности микроорганизмов на максимально высоком уроне, что позволяет обеспечивать эффективность процесса биодеградации нефти.
В результате экспериментов было установлено, что численность микроорганизмов предлагаемого консорциума начинает снижаться через 20-25 суток из-за уменьшения содержания питательных веществ - азота, фосфора, калия, потребляемых в результате их жизнедеятельности. Внесение этих элементов через 20-25 суток поддерживает жизнедеятельность микроорганизмов на высоком уровне и, соответственно, обеспечивает повышение эффективности очистки.
Консорциум штаммов микроорганизмов выделен из почвы, загрязненной углеводородами нефти Белебеевского района Республики Башкортостан и представляет собой консорциум штаммов аборигенных углеводородокисляющих микроорганизмов, адаптированных к данному региону. Общеизвестно, что при активизации аборигенной микрофлоры, последняя проявляет высокую активность к окислению углеводородов нефти. В связи с продолжительностью процесса активизации активизируются не только углеводородокисляющие микроорганизмы, но и вся пула почвы в целом, поэтому не исключена возможность активизации и развития патогенных микроорганизмов, что может привести к бактериологическому заражению местности проведения работ. Для исключения этого недостатка консорциум и штаммы, входящие в его состав подвергнуты токсикологической экспертизе.
Полученный консорциум состоит из 15 штаммов микроорганизмов (далее биопрепарат КШБ-15).
Численность штаммов Р.putida (биовар A) (IB-K1 и IB-K2) составляет не более 9-14% (2-3×107 КОЕ/мл) от общей численности микроорганизмов на среде МПА, ГПД и Раймонда.
Численность родококков составляет порядка 80% (1,6-2,4×108 КОЕ/мл) от общей численности микроорганизмов на среде МПА, ГПД и Раймонда, где 66% (1,3-1,9×108 КОЕ/мл) составляют штаммы R.maris (IB-K5 и IB-K20), 10% (2-3×107 КОЕ/мл) штамм R.luteus IB-K7 и 4% (8×106-1×107 КОЕ/мл) штамм R.rubropertinctus IB-K8.
Численность бацилл В. brevis (IB-K3, IB-K17), В.circulans (IB-K4, IB-K6, IB-K11), В. coagulans IB-K16, В. popilliae IB-K10 и В. stearothermophilus IB-K19 составляет 10-15% (2-3×107 КОЕ/мл) от общей численности микроорганизмов на среде МПА, ГПД и Раймонда.
Численность гриба Cladosporium elegantulum Pidopliczko et Deniak IB-KF1 в консорциуме составляет 0,03-0,001% (2-3×103 КОЕ/мл) от общей численности микроорганизмов на среде Раймонда.
Штаммы микроорганизмов, входящие в консорциум, характеризуются следующими признаками.
Характеристика гриба Cladosporium elegantulum Pidopliczko et Deniak IB-KF1
Морфолого-культуральные признаки. Мицелий стелющийся, септированный, поверхностный, темноокрашенный состоящий из большого количества конидиеносцев. Конидиеносцы древовидной формы, с мутовчато-древовидным ветвлением, прямостоящие, одиночные, септированные, гладкие, оливково-коричневые. Конидиеносцы до 100 мкм длиной, 3-5 мкм толщиной. Конидии одноклеточные, гладкие, от продолговатой до эллипсоидальной формы, в разветвленных цепочках шаровидные, яйцевидные и обратнояйцевидные, оливково-коричневые, с заметным рубчиком на одном конце. Верхушечные конидии шаровидные 2,7-3,0 мкм, яйцевидные и обратнояйцевидные 2,1-2,7×3,2-5,4 мкм. Базальные - 2,7-3,2×4,3-6,7 мкм.
На твердой среде Чапека при 28°С на 3 сутки размер колоний 9-14 мм, ризоидной формы, темно-песочного цвета, окраска спороносящей части буроватая, обратная сторона колоний темно-песочного цвета, колония полупрозрачная, мягкой консистенции, с запахом плесени. Много одиночных конидиеносцев, на одном конидиеносце образуется более сотни конидий, конидиеносец состоит их густых ветвистых, коротких цепочек конидии. На 6 сутки колония 25-29 мм: в центре выпуклый бархатистый бугорок, бежевый, непрозрачный; серединная часть колонии чуть прозрачная, табачно-бурого цвета, меньшей бархатистости, чем центр; края полупрозрачные, грязно-бурые, чуть бархатистые. Обратная сторона темно-коричневая, края табачно-бурые. К 10 суткам колонии 30-35 мм, а к 15 - 32-37 мм, слабо радиально расчерченные, чем дальше от центра, тем прозрачнее, в остальном внешний вид колонии без изменений.
Физиолого-биохимические признаки. Разжижает желатину, растет на глицерине (Чапека с глицерином) и целлюлозе, окисляет углеводороды нефти и дизельного топлива, хорошо растет при 28-37°С, слабый рост при 13°С.
Характеристика штамма Р.putida (биовар А) - IB K1
Морфолого-культуральные признаки. Грамотрицательные, подвижные палочки, размером 0,44-0,55×1,10-2,53 мкм. На среде МПА в первые сутки образуются колонии 1 мм, круглые, грязно-белые, непрозрачные, гладкие, выпуклые, блестящие, с ровным краем, мелкозернистые, мягкие, липкие и маслянистые. На вторые сутки колонии 3,0-4,0 мм, кремового цвета, наблюдается выделение бледно-желтого пигмента в питательный субстрат. На пятые сутки колонии 5,0-8,0 мм.
Физиолого-биохимические признаки. Образует желто-зеленый диффундирующий в среду флуоресцирующий пигмент. Усваивает глюкозу, арабинозу, ксилозу с выделением кислоты. Не усваивает маннит, сорбит, трегалозу, мезоинозит. Среди аминокислот хорошо усваивает аланин, аргинин и не усваивает валин, метионин, цистеин. Хорошо усваивает фенилуксусную, гиппуровую и никотиновую кислоты, креатин и не усваивает винной кислоты и гераниол. В качестве источника азота усваивает как органические формы (пептон, автолизаты, экстракты), так и минеральные (соли аммония, нитраты).
Оксидазоположительный. Каталазоположительный. Аргининдигидролаза положительный. Не имеет орнитиндекарбоксилазы. Не образует включений поли-β-гидроксибутирата внутри клеток. Леван из сахарозы не образует, желатин не разжижает, крахмал не гидролизует, лецитиназной и липазной активностью не обладают, лактозу не сбраживает, не гидролизует липидов. Тирозин и казеин разлагает.
Аэроб. Хорошо растет в интервале температур от 13 до 28°С.
Характеристика штамма Р.putida (биовар А) - IB K2
Морфолого-культуральные признаки. Грамотрицательные, подвижные палочки, размером 0,44-0,55×1,10-2,42 мкм. На среде МПА в первые сутки образуются колонии до 1 мм, круглые, бесцветные, полупрозрачные, гладкие, плоские, блестящие, с ровным краем, однородные, мягкие и маслянистые. На вторые сутки колонии 2,0-3,0 мм, слабо выпуклые, кремового цвета с незначительным желтоватым отливом, в среду выделяется бледно-желтый пигмент. На шестые сутки колонии 2,0-5,0 мм, полупрозрачные, мелкие колонии отличаются большей прозрачностью, чем крупные.
Физиолого-биохимические признаки. Образует желто-зеленый диффундирующий в среду флуоресцирующий пигмент. Усваивает глюкозу, арабинозу, ксилозу с выделением кислоты. Не усваивает маннит, сорбит, трегалозу, мезоинозит. Среди аминокислот хорошо усваивает аланин, аргинин и не усваивает валин, метионин, цистеин. Хорошо усваивает никотиновую кислоту, креатин и не усваивает винную, гиппуровую и фенилуксусную кислоты и гераниол. В качестве источника азота усваивает как органические формы (пептон, автолизаты, экстракты), так и минеральные (соли аммония, нитраты).
Оксидазоположительный. Каталазоположительный. Аргининдигидролаза положительный. Не имеет орнитиндекарбоксилазы. Не образует включений поли-β-гидроксибутирата внутри клеток. Леван из сахарозы не образует, желатин не разжижает, крахмал не гидролизует, лецитиназной и липазной активностью не обладают, лактозу не сбраживает, не гидролизует липидов. Тирозин и казеин разлагает.
Аэроб. Хорошо растет при температуре 13-28°С.
Характеристика штамма В.brevis IB-K3
Морфолого-культуральные признаки. Грамположительные, подвижные палочки, размером 0,54-0,65×1,65-4,40 мкм. Споры, эллиптические, расположение терминальное, реже субтерминальное, незначительно раздувают спорангий. Величина спор 0,88-0,99×1,21-1,54 мкм. На среде МПА образуются колонии 1,0-2,0 мм, круглые, бесцветные, полупрозрачные, гладкие, слабовыпуклые, блестящие, с ровным краем, мелкозернистые, мягкие и маслянистые. На 3 сутки колонии 2,0-4,0 мм, беловатого цвета, непрозрачные, слабовыпуклые - в центре наблюдается небольшой бугорок, край слегка волнистый. На 6 сутки размер колоний 3,0-5,0 мм, края колонии принимают вид мелких фестонов.
Физиолого-биохимические признаки. Оксидазоотрицательный. Каталазоположительный. Реакция Фогес-Проскауэра (образование ацетилметилкарбинола) отрицательная. Не усваивает глюкозу, арабинозу, ксилозу и маннит. При сбраживании сахаров газ не образуется, кислота не выделяется. Желатин разжижает, казеин и тирозин разлагает, лецитиназной и липазной активностью обладает. Гидролизует липиды (Твин 60 и Твин 80). Образует аммиак. Крахмал не гидролизует, цитрат и пропионат не использует, дезаминирование фенилаланина не происходит, индол и сероводород не образует. Нитрат не восстанавливает.
Аэроб. Растет при рН 5,7-6,8. Не растет в присутствии 5% NaCl. Растет в интервале температур от 30 до 50°С.
Характеристика штамма В. brevis IB-K17
Морфолого-культуральные признаки. Грамположительные, подвижные палочки, размером 0,77-0,88×1,65-5,05 мкм. Споры, эллиптические, расположение терминальное, реже субтерминальное, раздувают спорангий. Величина спор 0,88-1,10×1,65-2,20 мкм. На среде МПА колонии на 2 сутки до 1,5 мм и менее, круглые, палевые, блестящие, непрозрачные, гладкие, слабовыпуклые, с ровным краем, однородные, мягкие, липкие. На 3 сутки 1,0-2,0 мм, слабо радиально расчерченные, с чуть волнистым краем. На 9 сутки 2,0-4,0 мм, темно-кремового цвета, слабовыпуклые, шероховатые, с чуть заметной концентрической исчерченностью, край мелковолнистый.
Физиолого-биохимические признаки. Оксидазоположительный. Каталазоположительный. Реакция Фогес-Проскауэра (образование ацетилметилкарбинола) отрицательная. Усваивает глюкозу с выделением кислоты, газ не образуется. Не усваивает арабинозу, ксилозу и маннит. При сбраживании сахаров газ не образуется, кислота не выделяется. Желатин разжижает, казеин и тирозин разлагает, цитрат использует.
Гидролизует липиды (Твин 60 и Твин 80). Крахмал не гидролизует, лецитиназной и липазной активностью не обладает, пропионат не использует, дезаминирование фенилаланина не происходит, индол и аммиак не образует. Нитрат восстанавливает до нитритов.
Аэроб. Не растет в присутствии 5% NaCl. Растет в интервале температур от 30 до 50°С.
Характеристика штамма В. circulans IB-K4
Морфолого-культуральные признаки. Грамположительные, подвижные палочки, размером 0,44-0,56×1,76-3,30 мкм. Споры, эллиптические, расположение преимущестенно центральное, реже парацентральное, раздувают спорангий. Величина спор 0,99-1,10×1,65-1,98 мкм. На среде МПА на 2 сутки колонии 1,0-2,0 мм, круглые, грязно-белые, непрозрачные, гладкие, слабовыпуклые, блестящие, с ровным краем, однородные, мягкие и маслянистые. На 3 сутки колонии диаметром 1,0-3,0 мм, кремового цвета, мелкозернистые. Мелкие колонии слабовыпуклые и гладкие, у крупных колоний также выпуклых в центре появляется небольшая вмятина. На 6 сутки колонии 2,0-6,0 мм, они выглядят как и на 3 сутки, только края становятся слегка волнистыми, кое-где наблюдаются мелкие зубцы. Со временем колонии врастают в агар.
Физиолого-биохимические признаки. Оксидазоположительный. Каталазоположительный. Реакция Фогес-Проскауэра (образование ацетилметилкарбинола) отрицательная. Усваивает глюкозу, арабинозу, ксилозу и маннит. При сбраживании сахаров кислота выделяется, газ не образуется. Гидролизует крахмал, липиды (Твин 60 и Твин 80), желатин разжижает. Казеин и тирозин не разлагает. Лецитиназной и липазной активностью не обладает. Цитрат и пропионат не использует. Дезаминирование фенилаланина не происходит. Индол и сероводород не образует. Нитрат восстанавливает до нитритов. Образует аммиак.
Анаэроб. Растет при рН 5,7-6,8. Растет в присутствии 5% NaCl и в интервале температур от 30 до 50°С.
Характеристика штамма В.circulans IB-K6
Морфолого-культуральные признаки. Грамположительные, подвижные палочки, размером 0,33-0,55×1,43-3,85 мкм. Споры, эллиптические, расположение преимущественно терминально, реже субтерминально, раздувают спорангий. Величина спор 0,77-1,10×1,21-1,65 мкм. На среде МПА на 2 сутки образуются колонии до 1,0 мм и менее, круглые, бесцветные, прозрачные, гладкие, выпуклые, блестящие, с ровным краем, однородные, мягкие. На 5 сутки колонии 1,0-2,0 мм, палевые, полупрозрачные, гладкие, блестящие, с мелкозернистой консистенцией.
Физиолого-биохимические признаки. Оксидазоположительный. Каталазоположительный. Реакция Фогес-Проскауэра (образование ацетилметилкарбинола) отрицательная. Усваивает глюкозу, арабинозу, ксилозу и маннит. При сбраживании сахаров кислота выделяется, газ не образуется. Гидролизует крахмал. Желатин не разжижает, казеин и тирозин не разлагает, липиды не гидролизует (Твин 60 и Твин 80), лецитиназной и липазной активностью не обладает, цитрат и пропионат не использует, дезаминирование фенилаланина не происходит, индол и сероводород не образует. Нитрат восстанавливает до нитритов. Образует аммиак.
Анаэроб. Растет при рН 5,7-6,8. Не растет в присутствии 5% NaCl. Растет в интервале температур от 30 до 40°С.
Характеристика штамма В.circulans IB-K11
Морфолого-культуральные признаки. Грамположительные, подвижные палочки, размером 0,34-0,57×1,98-3,52 мкм. Споры, эллиптические, расположение терминально, раздувают спорангий. Величина спор 0,57-0,86×1,18-1,62 мкм. На среде МПА на 4 сутки образуются колонии до 1,0 мм, круглые, кремовые, непрозрачные, выпуклые, блестящие, с слегка волнистым краем, мелкозернистые, мягкие. На 6 сутки колонии 1,0-1,5 мм, с ровным краем, зернистые. На 15 сутки 1,5-3,0 мм, круглые, непрозрачные, с приглушенным блеском, слегка шероховатые, у крупных колоний мелколопастный край, у мелких зубчатый по краю идет небольшой уплощенный бордюр, основная часть колонии сильно выпуклая по отношению к бордюру, со слабыми концентрическими кругами, зернистые, пастообразные, присутствуют зоны протеолетической активности.
Физиолого-биохимические признаки. Оксидазоположительный. Каталазоположительный. Реакция Фогес-Проскауэра (образование ацетилметилкарбинола) отрицательная. Усваивает глюкозу, арабинозу, ксилозу и маннит. При сбраживании сахаров кислота выделяется, газ не образуется. Гидролизует крахмал, разлагает казеин. Желатин не разжижает, тирозин не разлагает, липиды не гидролизует (Твин 60 и Твин 80), лецитиназной и липазной активностью не обладает, пропионат не использует, дезаминирование фенилаланина не происходит, индол и сероводород не образует. Нитрат восстанавливает до нитритов.
Анаэроб. Не растет в присутствии 5% NaCl. Растет в интервале температур от 30 до 50°С.
Характеристика штамма В. coagulans IB-K16
Морфолого-культуральные признаки. Грамположительные, подвижные палочки, размером 0,33-0,55×1,43-3,30 мкм Споры, эллиптические, расположение терминально, сильно раздувают спорангий. Величина спор 0,88-1,21×1,32-1,98 мкм. На среде МПА колонии на 2 сутки 1,0 мм, круглые, бесцветные, блестящие, прозрачные, гладкие, слабовыпуклые, с ровным краем, однородные, мягкие. На 3 сутки 1,0-1,5 мм, бледно-сероватые, непрозрачные, выпуклые, с чуть заметным бугорком, у крупных колоний край мелкозубчатый, у мелких колоний ровный. На 9 сутки 1,0-4,0 мм, выпуклые, профиль колонии изогнутый, от краев поднимается вверх до центральной части колонии, которая в виде высокой уплощенной площадки, крупнозернистые. У крупных колоний наблюдается зона вторичного роста ввиде прозрачной вуали, неправильной формы с очень волнистым краем.
Физиолого-биохимические признаки. Оксидазоположительный. Каталазоположительный. Реакция Фогес-Проскауэра (образование ацетилметилкарбинола) положительная. Усваивает глюкозу, арабинозу, ксилозу и маннит. При сбраживании сахаров кислота выделяется, газ не образуется. Гидролизует крахмал. Желатин не разжижает, казеин и тирозин не разлагает, липиды не гидролизует (Твин 60 и Твин 80), лецитиназной и липазной активностью не обладает, пропионат и цитрат не использует, дезаминирование фенилаланина не происходит, индол и сероводород не образует. Нитрат восстанавливает до нитритов. Образует аммиак.
Анаэроб. Растет при рН 5,7-6,8. Не растет в присутствии 5% NaCl. Растет в интервале температур от 30 до 50°С.
Характеристика штамма В.popilliae IB-К10
Морфолого-культуралъные признаки. Грамположительные, подвижные палочки, размером 0,55-0,77×2,20-7,70 мкм. Споры, эллиптические, расположение субтерминальное или терминальное, раздувают спорангий. На среде МПА на 4 сутки колонии до 1,0 мм, круглые, бесцветные, полупрозрачные, слабовыпуклые и мелкобугристые, блестящие, с волнистым краем, переходящим местами в мелкие зубцы, однородные, мягкие. На 6 сутки колонии 1,0-1,5 мм, бледно-песочного цвета, выглядят так же, как на 4 сутки. На 15 сутки колонии 1,5-2,0 мм, слабовыпуклые, с приглушенным блеском, полупрозрачные, в центре колони небольшой бугорок, края мелкозубчатые, переходящие в радиальные сглаженные складки, не доходящие до центра, мягкие, липкие, крупнозернистые.
Физиолого-биохимические признаки. Оксидазоотрицательная. Каталазоотрицательная. Реакция Фогес-Проскауэра (образование ацетилметилкарбинола) отрицательная. Усваивает глюкозу с выделением кислоты, газ не выделяет. Не усваивает арабинозу, ксилозу и маннит. Казеин разлагает, лецитиназной активностью обладает. Не гидролизует крахмал и липиды, желатин не разжижает, пропионат не использует, дезаминирование фенилаланина не происходит, индол не образует. Образует аммиак.
Анаэроб. Не растет в присутствии 5% NaCl. Растет при температуре 30°С.
Характеристика штамма В.stearothermophilus IB-K19
Морфолого-культуральные признаки. Грамположительные, подвижные палочки, размером 0,66-0,77×1,32-3,30 мкм. Споры, эллиптические, расположение центрально реже парацентральное, незначительно раздувают спорангий. Величина спор 0,99-1,10×1,22-1,64 мкм.
На среде МПА колонии на 2 сутки 1,5-2,0 мм, круглые, с ровным краем, палевые, блестящие, непрозрачные, гладкие, слабовыпуклые, похожи на «яичницу» - «белок» слегка полупрозрачный и менее выпуклый, «желток» приподнятый и непрозрачный, однородные, мягкие, липкие. На 9 сутки 2,5-5,0 мм, палевые, слабовыпуклые, на некоторых колониях наблюдаются на поверхности мелкие пузырьки. Мелкие колонии гладкие, с ровным краем. У крупных колоний в центральной части большое, высокое ровное плато с небольшим бугорком в центре, ниспадающий мелкозубчатый широкий край.
Физиолого-биохимические признаки. Оксидазоположительный. Каталазоотрицательная. Реакция Фогес-Проскауэра (образование ацетилметилкарбинола) отрицательная. Усваивает глюкозу с выделением кислоты, газ не выделяет. Не усваивает арабинозу, ксилозу и маннит. При сбраживании сахаров кислота выделяется, газ не образуется. Гидролизует крахмал и липиды (Твин 60, Твин 80), казеин разлагает, желатин разжижает, лецитиназной и липазной активностью обладает. Пропионат и цитрат не использует, дезаминирование фенилаланина не происходит, индол, сероводород и аммиак не образует.
Анаэроб. Не растет в присутствии 5% NaCl. Растет в интервале температур от 30 до 55°C.
Характеристика штамма R.maris IB-K5
Морфолого-культуральные признаки. Грамположительные, некислотоустойчивые. Морфогенетический цикл состоит из трех стадий (кокки - палочки - кокки). Размер клеток 0,56-0,84×2,80-3,50 мкм. Клетки неподвижные.
На среде МПА на 2 сутки образуются колонии 1,0-3,0 мм, круглые, бесцветные, полупрозрачные, гладкие, слабовыпуклые, блестящие, с ровным краем, однородные, мягкие и маслянистые. На 5 сутки колонии 3,0-5,0 мм, мраморно-розового цвета, непрозрачные.
Физиолого-биохимические признаки. Усваивает с выделением кислоты глюкозу, глицерин, сахарозу, фруктозу и не усваивает арабинозу, галактозу, дульцит, инозит, ксилозу, лактозу, маннит, мальтозу, рамнозу, рафнозу, сорбит, целлобиозу. Усваивает натриевые соли бензойной, масляной, молочной, пировиноградной, пропионовой, уксусной и янтарной кислот. Не усваивает натриевые соли винной, лимонной, салициловой, щавелевой и фенилуксусной кислот. В качестве источника азота усваивает как органические формы (пептон, автолизаты, экстракты), так и минеральные (нитраты), слабый рост на безазотистой среде Эшби. Восстанавливает нитраты до нитритов.
Оксидазоотрицательный. Каталазоположительный. Гидролизует крахмал и липиды (Твин 60, Твин 80), разлагает казеин, обладает уреазной активностью. Желатин не разжижает, лецитиназной и липазной активностью не обладает. Тирозин не разлагает. Цитрат использует.
Устойчив к действию внешних факторов среды: способен расти при 7% NaCl; при исходном значении рН 5,7 и 8,0; при температуре от 5 до 42°C; выдерживает нагревание при 60°C в течение 30 мин и 72°C в течение 15 мин; толерантен к антимикробным агентам: растет в средах, содержащих 0,003% основного фуксина, 0,0004% кристаллического фиолетового и 0,1% фенола.
Характеристика штамма R.luteus IB-K7
Морфолого-культуральные признаки. Грамположительные, некислотоустойчивые. Морфогенетический цикл состоит из трех стадий (кокки - палочки - кокки). Размер клеток 0,54-0,72×2,85-5,23 мкм. Клетки неподвижные.
На среде МПА образуются точечные колонии менее 1,0 мм, круглые, бесцветные, прозрачные, гладкие, выпуклые, блестящие, с ровным краем, однородные, мягкие. На 9 сутки колонии менее 1,0 и до 1,5 мм, круглые. На среде ГПА колонии точечные менее 1,0 мм, круглые, бесцветные, прозрачные, гладкие, плоские, блестящие, с ровным краем, однородные, мягкие. На 9 сутки колонии менее 1,0 и до 3,0 мм, круглые, восково-желтого цвета, выпуклые с небольшой ямкой по центру колонии.
Физиолого-биохимические признаки. Усваивает с выделением кислоты арабинозу, галактозу, глюкозу, глицерин, ксилозу, маннит, сахарозу, сорбит, фруктозу и не усваивает дульцит, инозит, лактозу, мальтозу, рамнозу, рафнозу, целлобиозу. Усваивает натриевые соли лимонной, масляной, молочной, пировиноградной, уксусной и янтарной кислот. Не усваивает натриевые соли бензойной, винной, пропионовой, салициловой, щавелевой и фенилуксусной кислот. В качестве источника азота усваивает как органические формы (пептон, автолизаты, экстракты), так и минеральные (аммония, нитраты), хороший рост на безазотистой среде Эшби. Не восстанавливает нитраты до нитритов.
Оксидазоотрицательный. Каталазоположительный. Гидролизует липиды (Твин 40, Твин 60, Твин 80), обладает уреазной активностью. Не гидролизует крахмал, желатин не разжижает, не разлагает казеин, лецитиназной и липазной активностью не обладает. Тирозин не разлагает.
Устойчив к действию внешних факторов среды: способен расти при 7% NaCl; при исходном значении рН 5,7 и 8,0; при температуре от 10 до 37°C; выдерживает нагревание при 60°C в течение 30 мин и 72°С в течение 15 мин; толерантен к антимикробным агентам: растет в средах, содержащих 0,003% основного фуксина и 0,0004% кристаллического фиолетового.
Характеристика штамма R.maris IB-K20
Морфолого-культуральные признаки. Грамположительные, некислотоустойчивые. Морфогенетический цикл состоит из трех стадий (кокки - палочки - кокки). Размер клеток 0,44-0,76×2,53-3,30 мкм. Клетки неподвижные.
На среде МПА на 2 сутки колонии менее 1,0 мм, круглые, чуть розоватые, непрозрачные, гладкие, выпуклые, блестящие, с ровным краем, однородные, мягкие. На 4 сутки колонии 0,5-1,5 мм, телесно-розовые, центр более насыщенного цвета, наблюдается 2 типа колоний: 1 - равномерно выпуклые; 2 - центральная часть колонии более выпуклая, чем края.
Физиолого-биохимические признаки. Усваивает с выделением кислоты глюкозу, глицерин, фруктозу и не усваивает арабинозу, галактозу, дульцит, инозит, ксилозу, лактозу, маннит, мальтозу, рамнозу, рафнозу, сахарозу, сорбит, целлобиозу. Усваивает натриевые соли бензойной, масляной, молочной, пировиноградной, пропионовой, уксусной и янтарной кислот. Не усваивает натриевые соли винной, лимонной, салициловой, щавелевой и фенилуксусной кислот. В качестве источника азота усваивает как органические формы (пептон, автолизаты, экстракты), так и минеральные (аммония, нитраты), слабый рост на безазотистой среде Эшби. Восстанавливает нитраты до нитритов.
Оксидазоотрицательный. Каталазоположительный. Гидролизует крахмал и липиды (Твин 40, Твин 60, Твин 80), разлагает казеин, обладает уреазной активностью. Желатин не разжижает, лецитиназной и липазной активностью не обладает. Тирозин не разлагает. Цитрат использует.
Устойчив к действию внешних факторов среды: способен расти при 7% NaCl; при исходном значении рН 5,7 и 8,0; при температуре от 10 до 42°C; выдерживает нагревание при 60°С в течение 30 мин и 72°С в течение 15 мин; толерантен к антимикробным агентам: растет в средах, содержащих 0,003% основного фуксина, 0,0004% кристаллического фиолетового и 0,1% фенола.
Характеристика штамма R.rubropertinctus IB-K8
Морфолого-культуральные признаки. Грамположительные, некислотоустойчивые. Морфогенетический цикл состоит из трех стадий (кокки - палочки - кокки). Размер клеток 0,30-0,50×2,70-4,76 мкм. Клетки неподвижные.
На среде МПА колонии появляются на 3 сутки, очень мелкие и чуть заметные. На 4 сутки точечные колонии менее 1,0 мм, круглые, белые, непрозрачные, гладкие, плоские, тусклые, с ровным краем, однородные, мягкие. На 5 сутки колонии 1,0 мм, бледно оранжевые, сильно выпуклые колонии напоминают формой «крутой вулкан» с широким основанием и небольшим «кратером» на вершине, мелкие сглаженные складки проходят от края колонии к его вершине, с волнистым краем, мелкозернистой структурой, врастающие в агар, творожистой консистенцией. На 17 сутки колонии 2,0-3,0 мм, ржавого цвета, фестончатый край колонии переходит в глубокие складки по направлению к вершине колонии «кратеру».
Физиолого-биохимические признаки. Усваивает с выделением кислоты глюкозу, глицерин, маннит, сахарозу, сорбит, фруктозу и не усваивает арабинозу, галактозу, дульцит, инозит, ксилозу, лактозу, мальтозу, рамнозу, рафнозу, целлобиозу. Усваивает натриевые соли масляной, молочной, пировиноградной, пропионовой, уксусной и янтарной кислот. Не усваивает натриевые соли бензойной, винной, лимонной, салициловой, щавелевой и фенилуксусной кислот. В качестве источника азота усваивает как органические формы (пептон, автолизаты, экстракты), так и минеральные (аммония, нитраты), хороший рост на безазотистой среде Эшби. Восстанавливает нитраты до нитритов.
Оксидазоотрицательный. Каталазоположительный. Гидролизует липиды (Твин 40), обладает уреазной активностью. Крахмал и казеин не гидролизует, желатин не разжижает, лецитиназной и липазной активностью не обладает. Тирозин не разлагает. Цитрат использует.
Устойчив к действию внешних факторов среды: способен расти при 7% NaCl; при исходном значении рН 5,7 и 8,0; при температуре от 10 до 37°C; выдерживает нагревание при 60°С в течение 30 мин и 72°C в течение 15 мин; толерантен к антимикробным агентам: растет в средах, содержащих 0,003% основного фуксина, 0,0004% кристаллического фиолетового и 0,1% фенола.
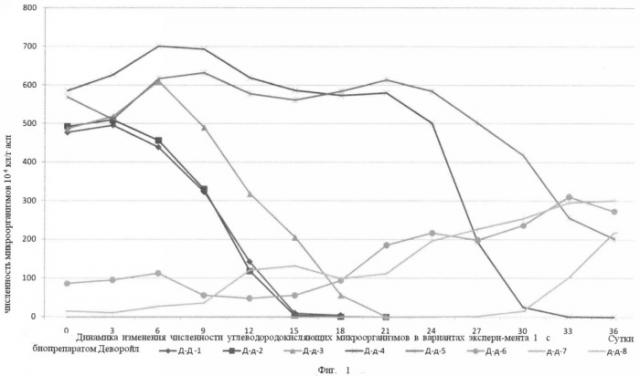
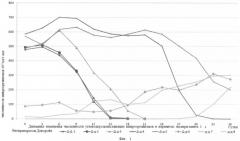
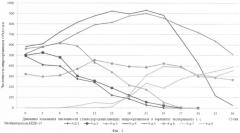
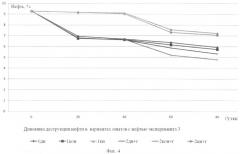
Предлагаемый способ восстановления почв и грунтов, загрязненных нефтью и нефтепродуктами, в том числе застарелых нефтяных загрязнений, иллюстрируется следующими графиками: на фиг.1 показана динамика изменения численности углеводородокисляющих микроорганизмов в вариантах эксперимента 1 с биопрепаратом Деворойл; на фиг.2 - динамика изменения численности углеводородокисляющих микроорганизмов в вариантах эксперимента 1 с биопрепаратом КШБ-15; на фиг.3 - динамика изменения численности углеводородокисляющих микроорганизмов в зависимости от внесения питательных элементов эксперимента 2; на фиг.4 - динамика деструкции нефти в вариантах опытов с нефтью эксперимента 3; на фиг.5 - динамика деструкции нефти в вариантах опытов с нефтешламом эксперимента 3; на фиг.6 - динамика деструкции нефти в вариантах опытов с загрязненной нефтью почвой (взятая с места застарелого нефтяного загрязнения) эксперимента 3.
Эффективность заявляемого способа была подтверждена экспериментально.
С целью подтверждения повышения эффективности очистки при заявленных параметрах способа было поставлено 3 эксперимента.
Для всех экспериментов использовали распространенный для республики Башкортостан тип почв - серую лесную среднесуглинистую. Химическая, физико-химическая характеристика данной почвы представлена в таблице 1.
Степень загрязнения почвы для всех экспериментов составляла, % масс.: нефтью - 9,27%, нефтешламом - 4,07%, почва нефтяного загрязнения (взятая с места застарелого нефтяного загрязнения) - 7,9%.
Объем пробы каждого варианта опыта составлял 0,5 кг.
Дозировка растворов биологических препаратов в каждую пробу составляла 30 мл с начальным содержанием микроорганизмов 106 кл/мл. В этом же объеме вносили и растворы питательных элементов различной концентрации.
В каждом эксперименте закладывались варианты опытов с внесением гумми 0,05-0,08% масс.
Данные всех вариантов опытов подтверждались в трех повторах.
В качестве питательной добавки применялось минеральное удобрение - диаммофоска.
Инкубацию каждой пробы проводили при постоянной температуре 29-30°C.
О глубине и интенсивности процесса биоразложения нефтепродуктов судили по количественному остаточному содержанию нефтепродуктов (% мас.).
Эксперимент 1 проводили с целью определения оптимальной дозировки питательных элементов. Необходимость постановки заключается в том, что при проведении экспериментальных и полевых исследований при внесении расчетной дозы раствора питательных элементов отмечалось замедленное развитие микроорганизмов консорциума (далее биопрепарат КШБ-15). При внесении их в форме гранул развитие микроорганизмов зависело от количества осадков. В этой связи было выдвинуто предположение, что должна существовать оптимальная дозировка, которая с целью независимости от погодных условий (количества осадков) в вегетационный период года (минимальный период биологического этапа) должна вноситься в растворенном виде.
Эксперимент включает варианты опытов, представленные в таблице 2.
Результаты эксперимента представлены в таблице 3 и на фиг.1,2.
Анализ результатов эксперимента как в варианте с биопрепаратом Деворойл, так и варианте биопрепаратом КШБ-15 показал, что оптимальная разовая дозировка минеральных питательных элементов (диаммофоска) составляет 0,25-0,5% масс. к массе обрабатываемой почвы. При меньших концентрациях рост численности углеводородокисляющих микроорганизмов быстро начинает снижаться, а при более высоких концентрациях их первоначальный рост значительно замедлен и только по истечении определенного времени начинает увеличиваться, но не достигает значений, полученных при оптимальной дозировке.
Эксперимент 2 проводили с целью определения периодичности внесения питательных элементов при соблюдении условий дозировки питательных элементов, определенных в эксперименте 1. Необходимость постановки этого эксперимента заключается в том, что в первом эксперименте доза питательных элементов определена меньшей, чем необходимая для всего вегетационного периода, что приводит по исходу определенного периода времени к снижению численности углеводородокисляющих микроорганизмов до их фонового содержания в данном виде почвы.
Эксперимент включает варианты опытов, представленные в таблице 4.
Дозировка питательных элементов составляет 0,3% к массе обрабатываемой почвы.
Результаты эксперимента представлены в таблице 5 и на графике 3.
Анализ результатов экспериментов показал, что численность углеводородокисляющих микроорганизмов начинает снижаться через 20-25 суток и при повторном внесении питательных веществ через 25 суток восстанавливается.
Таким образом, установлено, что для поддержания численности углеводородокисляющих микроорганизмов на максимально высоком уровне периодичность внесения питательных элементов в растворенном виде должна составлять 20-25 суток.
Эксперимент 3 проводили с целью определения эффективности деструкции нефти и нефтепродуктов биопрепаратами КШБ-15 в предлагаемом способе и Деворойл - в способе-прототипе. В качестве исследуемых объектов рассмотрены варианты почвы, загрязненной нефтью Арланского месторождения (высокосернистая нефть), нефтешламом (деградированная нефть с содержанием 10% фракций, выкипающих до 250°С) и непосредственно почвы, отобранной с места старого нефтяного загрязнения, существовавшего более 3 лет. Эксперимент проводился при соблюдении условий, определенных в экспериментах 1 и 2 - дозировки питательных экспериментов и периодичности их внесения.
Эксперимент включает варианты опытов, представленные в таблице 6.
Дозировка питательных элементов составляет 0,3% к массе обрабатываемой почвы. Периодичность внесения - 25 суток.
Результаты эксперимента представ