Стереоселективный синтез аминокислот для получения изображения опухоли
Иллюстрации
Показать всеИзобретение относится к новым по существу чистым син-аминокислотам формул I и II, которые обладают способностью специфического связывания в биологической системе и могут быть использованы для получения изображения опухоли
и
В формулах I и II Y и Z независимо выбраны из группы, состоящей из СН2 и (CR4R5)n, n=1, 2; R1-R3 независимо выбраны из группы, состоящей из Н и алкила C1-C4; R4, R5=H и R7=18F. Изобретение относится также к способу синтеза син-аминокислот формулы II, который включает в себя стадии превращения кетона в транс-спирт формулы I и превращения полученного транс-спирта в син-аминокислоту формулы II, а также к фармацевтической композиции для получения изображения опухоли и способу получения изображения опухоли. 5 н. и 7 з.п. ф-лы, 1 табл., 3 ил.
Реферат
Перекрестная ссылка на родственные заявки
Данная заявка заявляет приоритет предварительной заявки №60/693385, зарегистрированной 23 июня 2005, которая включена здесь во всей ее полноте до степени, не совместимой с настоящей заявкой.
Подтверждение о финансировании исследования Федеральными органами
Данное изобретение выполнено с правительственной поддержкой по гранту №5-R21-CA-098891, предоставленному Национальным Институтом Здоровья (National Institute of Health). Правительство имеет определенные права на это изобретение.
Уровень техники
Данное изобретение относится к способу синтеза аналогов син-аминокислот и соединениям, синтезированным согласно данному способу, в частности аналогам син-1-амино-3-циклобутан-1-карбоновой кислоты (АСВС). Аналоги аминокислот изобретения обладают способностью специфического связывания в биологической системе и их можно применять в способах получения изображения позитронно-эмиссионной томографией (ПЭТ) и однофотонной эмиссионной компьютерной томографией (ОЭКТ).
Разработка меченых радиоактивными изотопами аминокислот для применения в качестве метаболических индикаторов для получения изображения опухолей с применением позитронно-эмиссионной томографии (ПЭТ) и однофотонной эмиссионной компьютерной томографии (ОЭКТ) проводилась в течение некоторого времени. Хотя меченые радиоактивными изотопами аминокислоты применяли для различных типов опухолей, их применению для внутричерепных опухолей уделяли значительное внимание вследствие потенциальных преимуществ относительно других модальностей получения изображений. После хирургической резекции и/или радиотерапии опухолей головного мозга общепринятые методы получения изображения, такие как СТ (компьютерная томография) и MRI (ЯМР-томография), надежно не отличают остаточную или рецидивирующую опухоль от повреждения ткани вследствие вмешательства и не являются оптимальными для мониторинга эффективности лечения или обнаружения рецидива опухоли [Buonocore, E (1992), Clinical Positron Emission Tomography. Mosby-Yaer Book, Inc. St. Louis, МО, p. 17-22; Langleben, DD et al. (2000), J. Nucl. Med. 41: 1861-1867].
Основной применяемый в ПЭТ агент для диагноза и получения изображения опухолей 2-[18F]фтopдeoкcиглюкoзa (FDG) имеет ограничения при получении изображения опухолей головного мозга. Нормальная кортикальная ткань головного мозга показывает высокое поглощение [18F]FDG, как и воспалительная ткань, которая может иметь место после лучевой терапии или хирургической терапии; эти факторы могут осложнять интерпретацию изображений, полученных с [18F]FDG [Griffeth, LK et al. (1993), Radiology. 186: 37-44; Conti, PS (1995)].
В ряде публикаций сообщается, что получение изображения методом ПЭТ и ОЭКТ с мечеными радиоактивными изотопами аминокислотами позволяет лучше определить границы опухоли в нормальном головном мозге, чем СТ или MRI, что позволяет лучше планировать лечение [Ogawa, Т et al. (1993), Radiology, 186: 45-53; Jager, PL et al. (2001), Nucl. Med., 42: 432-445]. Кроме того, некоторые исследования позволяют предположить, что степень поглощения аминокислоты коррелирует со стадией развития опухоли, которая может обеспечить важную прогностическую информацию [Jager, PL et al. (2001) J. Nucl. Med. 42: 432-445].
Аминокислоты являются питательными веществами, требуемыми для пролиферации клеток опухоли. Были получены различные аминокислоты, содержащие испускающие позитроны изотопы углерод-11 и фтор-18. Их оценивали для потенциального применения в клинической онкологии для получения изображения опухолей у пациентов с опухолями головного мозга и системных опухолей (опухолей во всем организме) и получили превосходные характеристики по сравнению с 2-[18F]FDG для некоторых опухолей. Эти аминокислотные кандидаты можно разделить на две основные категории. Первая категория представлена мечеными радиоактивными изотопами - существующими в природе аминокислотами, такими как [11С]валин, I-[11С]лейцин, L-[11С]метионин (MET) и L-[1-11С]тирозин и структурно подобными аналогами, такими как 2-[18F]фтop-L-тиpoзин и 4-[18F]фтop-L-фeнилaлaнин. Движение этих аминокислот через мембраны клеток опухолей преимущественно происходит посредством носителя, опосредуемого переносом натрий-независимой системой переноса лейцина, аминокислоты типа "L". Повышенное поглощение и пролонгированное удерживание этих существующих в природе, меченых радиоактивным изотопом аминокислот в опухолях по сравнению с нормальной тканью является отчасти результатом значительного и быстрого регионального включения в белки. Из этих меченых радиоактивными изотопами аминокислот [11C]MET наиболее широко применяли клинически для обнаружения опухолей. Хотя обнаружено, что [11C]MET является пригодным при обнаружении опухолей головного мозга и системных поражений опухолями, он является восприимчивым in vivo к метаболизму посредством многочисленных путей, приводящему к образованию многочисленных меченых радиоактивными изотопами метаболитов. Поэтому графический анализ с необходимой точностью для надежного измерения метаболической активности опухоли является невозможным. Изучения кинетического анализа поглощения опухолью [11С]MET у людей убедительно позволяют предположить, что перенос аминокислот может обеспечить более чувствительное измерение пролиферации опухолевых клеток, чем синтез белка.
Недостатки, связанные с [11С]МЕТ, могут быть преодолены второй категорией аминокислот. Они являются неприродными аминокислотами, такими как 1-аминоциклобутан-1-[11С]карбоновая кислота ([11C]ACBC). Преимуществом [11C]ACBC по сравнению с [11C]MET является то, что она не метаболизируется. Значительным ограничением в применении меченых углеродом-11 аминокислот для клинического применения является короткий 20-минутный период полураспада углерода-11. 20-Минутный период полураспада углерода-11 требует присутствия ускорителя частиц на участке для получения меченой углеродом-11 аминокислоты. Кроме этого, только одну или относительно очень мало доз можно получить из каждой партии получения меченой углеродом-11 аминокислоты. Следовательно, меченые углеродом-11 аминокислоты являются слабыми кандидатами с региональным распределением для широко распространенного клинического применения.
Для преодоления ограничения применения углерода-11 из-за физического периода полураспада авторы изобретения в последнее время сосредоточили свои усилия на разработке нескольких новых меченых фтором-18 неприродных аминокислот, некоторые из которых описаны в патентах США 5808146 и 5817776, оба из которых включены здесь в качестве ссылки. Эти аминокислоты включают в себя анти-1-амино-3-[18F]фторциклобутил-1-карбоновую кислоту (анти-[18F]FACBC), син-1-амино-3-[18F]фторциклобутил-1-карбоновую кислоту (син-[18F]FACBC), син- и анти-1-амино-3-[18F]фторметилциклобутан-1-карбоновую кислоту (син- и aнти-[18F]FMACBC). Эти фтор-18-аминокислоты можно применять для получения изображения головного мозга и системных опухолей in vivo, основанного на переносе аминокислоты, способом получения изображения позитронно-эмиссионной томографией (ПЭТ). Разработка авторов включала меченые фтором-18 циклобутиламинокислоты, которые движутся через капилляры опухоли посредством опосредуемого носителем переноса, включающего в себя системы переноса в основном большой нейтральной аминокислоты типа "L" и в меньшей степени аминокислоты типа "А". Предварительная оценка авторами циклобутиламинокислот, меченых излучателями позитронов, которые являются прежде всего субстратами для системы транспорта "L", показала превосходный потенциал в клинической онкологии для получения изображения опухоли у пациентов с опухолью головного мозга и системными опухолями. Основными причинами для предложения 18F-меченых циклобутил/разветвленных аминокислот вместо 11С (t1/2=20 мин) являются существенные логистические и экономические преимущества, получаемые при применении 18F-меченых радиофармацевтических средств вместо 11С-меченых радиофармацевтических средств при клинических применениях. Преимущество получения изображений опухолей с применением 18F-меченых радиофармацевтических средств в отделении медицинской радиологии, в первую очередь, обусловлено более длительным периодом полураспада 18F (t1/2=110 мин). Более длительный период полураспада 18F делает возможным распределение вне участка и получения многих доз при одном получении партии радиоактивного индикатора. Кроме того, эти неметаболизированные аминокислоты могут также иметь широкое применение в качестве агентов для получения изображения некоторых системных солидных опухолей, хорошее изображение которых нельзя получить ПЭТ с применением 2-[18F]FDG. В WO 03/093412, который включен здесь в качестве ссылки, дополнительно описаны примеры фторированных аналогов α-аминоизомасляной кислоты (AIB), таких как 2-амино-3-фтор-2-метилпропановая кислота (FAMP) и 3-фтор-2-метил-2-(метиламино)пропановая кислота (N-MeFAMP), подходящие для мечения при помощи 18F и применения при получении изображения ПЭТ. AIB является неметаболизируемой α,α-диалкиламинокислотой, которая активно переносится в клетки прежде всего при помощи системы переноса аминокислоты типа А. Перенос аминокислот системой А повышается во время роста и деления клеток и, как было также обнаружено, позитивно регулируется в клетках опухоли [Palacin, M et al. (1998), Physiol. Rev. 78: 969-1054; Bussolati, O et al. (1996), FASEB J. 10: 920-926]. Исследования экспериментально индуцированных опухолей у животных и самопроизвольно появляющихся опухолей у людей показали повышенное поглощение меченого радиоактивным изотопом AIB в опухолях относительно нормальной ткани [Conti, PS et al. (1986), Eur. J. Nucl. Med. 12: 353-356; Uehara, H et al. (1997), J, Cereb. Blood Flow Metab. 17: 1239-1253]. N-Метилированный аналог AIB, N-MeAIB обнаруживает даже большую селективность для системы переноса аминокислот типа А, чем AIB [Shotwell, МА et al. (1983), Biochim. Biophys. Acta. 737: 267-84]. N-MeAIB метили радиоактивным изотопом углерод-11 и показали, что он является метаболически стабильным в организме людей [Nagren, К et al. (2000), J. Labelled Cpd. Radiopharm. 43: 1013-1021].
Хотя преимущества аналогов аминокислот, содержащих изотопы, испускающие позитроны, для получения изображения опухолей у пациентов с опухолями головного мозга и системными опухолями достаточно одобрены в данной области, все же имеется потребность в надежном и эффективном синтетическом способе, который может обеспечить получение большого количества стереоспецифических изомеров этих соединений. Когда соединение-кандидат делает возможным переход от исследования валидации в моделях клеток и животных к применению для людей, применяемые синтетические способы должны быть адаптированы для общепринятого, надежного получения такого соединения. С этой целью авторы изобретения здесь разработали надежную стереоселективную синтетическую стратегию для получения аналогов син-1-амино-3-циклобутан-1-карбоновой кислоты (АСВС). В приведенном ниже описании будет очевидно, что стереоселективная синтетическая стратегия является подходящей для синтеза различных аналогов аминокислот, особенно аналогов, содержащих радиоактивные индикаторы, для получения изображения опухоли методами ПЭТ и ОЭКТ.
Сущность изобретения
Изобретение предлагает синтетическую стратегию, которая позволяет получать определенный стереоизомер ключевого предшественника для синтеза аналога аминокислоты в син(syn)-изомерной форме. Эта стратегия является особенно пригодной для синтеза аналогов син-1-амино-3-циклобутан-карбоновой кислоты (АСВС). Ключевая стадия в синтезе заключается в восстановлении синтонов-предшественников в транс-спирты, которые превращают в конечный продукт в син-изомерной форме. Синтетическая стратегия, описанная здесь, является надежной, эффективной и позволяет проводить получения в масштабе граммов ключевого предшественника для радиосинтеза аналогов син-АСВС. Кроме того, синтетическая стратегия, описанная здесь, включает введение подходящего изотопа в качестве последней стадии для максимизации пригодного периода полураспада изотопа.
Настоящее изобретение предлагает транс-спирты, имеющие формулу:
Y и Z независимо представляют собой =СН2, N, О, S, Se, (CR4R5)n, n равно 1-4, R1-R3 независимо представляют собой Н, алкил, циклоалкил, ацил, арил, алкенил, алкинил, галогеналкил, галогенацил, гетероарил, галогенарил, галогенгетероарил, галогеналкенил, галогеналкинил,
R4-R5 независимо представляют собой Н, алкил, циклоалкил, ацил, арил, галоген, галогеналкил, галогенацил, гетероарил, галогенарил, галогенгетероарил, алкинил, алкенил, галогеналкенил, галогеналкинил, где галогеном является нерадиоактивный F, CI, Вr, I.
Изобретение предлагает также способы синтеза транс-спиртов, имеющих общую структуру формулы 1. Ключевой стадией в синтезе транс-спиртов указанной формулы является непосредственное восстановление гидридом металла с применением восстанавливающих агентов, связанных с полимером (например, продукта связывания борогидрид-полимер Aldrich 32864-2, осажденного на амберлит IRA 400; осажденного продукта связывания цианоборогидрид-полимер Aldrich 52630-4; продукта связывания борогидрид-полимер Aldrich 35994-7, осажденного на амберлит А-26; продукта связывания цинкборогидрид-полимер Aldrich 59603-5). На схеме 3 здесь приведен пример такой реакции с применением триизобутилборана лития и ZnCl2.
Описанную синтетическую стратегию можно применять для получения син-изомеров различных аминокислотных соединений для применения при детектировании и оценке опухоли головного мозга и опухолей всего тела и других применений. Эти соединения объединяют благоприятные свойства 1-аминоциклоалкил-1-карбоновой кислоты, а именно ее быстрое поглощение и пролонгированное удерживание в опухолях, со свойствами галогенных заместителей, включающих в себя некоторые пригодные изотопы галогенов, в том числе фтор-18, иод-123, иод-125, иод-131, бром-75, бром-76, бром-77, бром-82, астат-210, астат-211 и другие изотопы астата. Кроме того, соединения можно метить изотопами технеция и рения с применением хелатированных комплексов. Подробное описание см. в WO 03/093412 и патенте США 5817776.
Аналоги син-аминокислот можно получить с применением изобретательской синтетической стратегии, включающей в себя транс-спирты, которые включают в себя, но не ограничиваются ими, соединения, имеющие следующую формулу:
Y и Z независимо представляют собой =СН2, N, О, S, Se, (CR4R5)n, n равно 1-4, R1-R3 независимо представляют собой Н, алкил, циклоалкил, ацил, арил, алкенил, алкинил, галогеналкил, галогенацил, гетероарил, галогенарил, галогенгетероарил, галогеналкенил, галогеналкинил,
R4-R5 независимо представляют собой Н, алкил, циклоалкил, ацил, арил, галоген, галогеналкил, галогенацил, гетероарил, галогенарил, галогенгетероарил, алкенил, алкинил, галогеналкенил, галогеналкинил, где галогеном является нерадиоактивный F, Cl, Вr, I,
R7 представляет собой галоген, галогеналкил, галогеналкенил, галогеналкинил, галогенгетероалкил, галогенгетероалкенил, галогенгетероалкинил, галогенарил, галогенгетероарил, где галоген представляет собой F, Cl, Вr, I, причем включаются меченые соединения, такие как содержащие F-18, I-123, I-124, Тс-99m и Re хелаты.
Конкретные, меченые радиоактивным изотопом аналоги аминокислот, которые можно получить с применением изобретательских способов, описанных здесь, включают в себя, но не ограничиваются перечисленным, фтор-, бром- или иодзамещенные циклопропил-, циклобутил-, циклопентил-, циклогексил-, циклогептил-, циклооктил-, циклононил-, циклодециламинокислоты, имеющие структуру, показанную выше, или алициклические соединения, содержащие гетероатом, т.е. N, О и S и Se.
Производные аминокислот, полученные согласно изобретению, обладают высокой специфичностью для опухолевой ткани при введении субъекту in vivo. В соответствии с этим изобретение предлагает также фармацевтические и диагностические композиции, включающие в себя аналоги син-аминокислот, полученные согласно способу изобретения. Предпочтительные производные аминокислот, проявляющие отношение мишени к немишени, по меньшей мере, 2:1, являются стабильными in vivo и по существу локализуются в мишени через 1 час после введения. Примеры предпочтительных производных аминокислот включают в себя син-[18F]-1-амино-3-фторциклобутан-1-карбоновую кислоту (FACBC), син-[123I]-1-амино-3-иодциклобутан-1-карбоновую кислоту (IАСВС) и син-[18F]-1-амино-3-фторалкилциклобутан-1-карбоновую кислоту, например син-[18F]-1-амино-3-фторметилциклобутан-1-карбоновую кислоту (FMACBC).
Аналоги аминокислот изобретения являются пригодными в качестве агента для получения изображения опухоли для детектирования и/или проведения мониторинга развития опухолей у субъекта. Аналог аминокислоты, применяемый в качестве агента для получения изображения опухоли, вводят in vivo и применяют для проведения мониторинга с применением способа, подходящего для метки. Предпочтительные способы детектирования и/или проведения мониторинга с применением аналога аминокислоты в качестве агента для получения изображения включают в себя позитронно-эмиссионную томографию (ПЭТ) и однофотонную эмиссионную компьютерную томографию (ОЭКТ).
Краткое описание графического материала
На фиг.1 показано поглощение in vivo соединения в опухолях 9L. Результаты выражены как процентное поглощение относительно контроля через 60 минут после инъекции. Подробности см. в примере 2.
На фиг.2 показано поглощение in vivo соединений в контралатеральном нормальном головном мозге через 60 минут после инъекции.
На фиг.3 показано отношение поглощения in vivo соединений в клетках опухоли к поглощению нормальными клетками через 60 минут после инъекции. Отношение получали из процентных величин, показанных на фиг.1 и 2.
Подробное описание изобретения
Данное изобретение относится к новым способам синтеза аналогов син-аминокислот, пригодных для получения изображения опухоли среди других применений. Авторы настоящего изобретения разработали синтетическую стратегию, которая позволяет проводить стереоселективный синтез ключевого предшественника в транс-изомерной форме для синтеза аналогов син-АСВС.
Аналоги АСВС, полученные изобретательской синтетической стратегией, являются по существу чистой син-изомерной формой. Термин «по существу чистый», применяемый здесь, означает, что продукт в его изомерной форме имеет чистоту, по меньшей мере, 60%, предпочтительно чистоту 70%, более предпочтительно чистоту выше 90% в син-изомерной форме. Предполагается, что здесь включены все промежуточные величины от 60% до 100% и все промежуточные диапазоны в них, независимо от того, перечислены ли они по отдельности или не перечислены.
В общем термины и фразы, применяемые здесь, имеют их принятое в данной области значение, которое можно найти ссылкой на стандартные книги, журнальные ссылки и контексты, известные специалисту в данной области. Нижеследующие определения предложены для прояснения их специфического применения в контексте изобретения.
Термин «фармацевтически приемлемая соль», применяемый здесь, относится к тем карбоксилатным солям или кислотно-аддитивным солям соединений настоящего изобретения, которые являются подходящими для применения в контакте с тканями пациентов без излишней токсичности, раздражения, аллергической реакции и тому подобного, имеют приемлемое отношение польза/риск и являются эффективными для их предполагаемого применения, а также к цвиттерионным формам, когда возможно, соединений изобретения. Термин «фармацевтически приемлемая соль» относится к относительно нетоксичным, аддитивным солям соединений настоящего изобретения и неорганическим и органическим кислотам. Включены также такие соли, полученные из нетоксичных органических кислот, таких как алифатические моно- и дикарбоновые кислоты, например уксусная кислота, фенилзамещенные алкановые кислоты, гидроксиалкановые и алкандиовые кислоты, ароматические кислоты и алифатические и ароматические сульфоновые кислоты. Эти соли можно получить in situ во время последнего выделения и очистки соединений или отдельно реакцией очищенного соединения в его форме свободного основания с подходящей органической или неорганической кислотой и выделением таким образом образованной соли. Далее репрезентативные соли включают в себя гидробромид, гидрохлорид, сульфат, бисульфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактиобионат и лаурилсульфонат, пропионат, пивалат, цикламат, изетионат и тому подобное. Они могут включать в себя катионы на основе щелочных и щелочноземельных металлов, таких как натрий, литий, калий, кальций, магний и тому подобное, а также нетоксичные катионы аммония, четвертичного аммония и амина, включающие в себя, но не ограничивающиеся перечисленным, катионы аммония, тетраметиламмония, тетраэтиламмония, метиламина, диметиламина, триметиламина, триэтиламина, этиламина и тому подобное. См., например, публикацию Berge S. M., et al., Pharmaceutical Salts, J. Pharm. Sci. 66; 1-19 (1977), которая включена здесь в качестве ссылки.
Аналогично этому термин «фармацевтически приемлемый носитель», применяемый здесь, является органической или неорганической композицией, которая служит в качестве носителя/стабилизатора/разбавителя активного ингредиента настоящего изобретения в фармацевтической или диагностической композиции. В некоторых случаях фармацевтически приемлемыми носителями являются соли. Следующие примеры фармацевтически приемлемых носителей включают в себя, но не ограничиваются перечисленным, воду, забуференный фосфатом солевой раствор, солевой раствор, регулирующие рН агенты (например, кислоты, основания, буферы), стабилизаторы, такие как аскорбиновая кислота, изотонизирующие агенты (например, хлорид натрия), водные растворители, поверхностно-активное вещество (ионогенное и неионогенное), такое как полисорбат или твин 80(TWEEN 80).
Термин «алкил», применяемый здесь сам по себе или как часть другой группы, относится к насыщенному углеводороду, который может быть неразветвленным, разветвленным или циклическим и содержит вплоть до 10 атомов углерода, предпочтительно 6 атомов углерода, более предпочтительно 4 атома углерода, такому как метил, этил, пропил, изопропил, бутил, трет-бутил и изобутил. Алкильные группы изобретения включают в себя такие группы, необязательно замещенные, где один или несколько атомов углерода в главной цепи могут быть заменены гетероатомом, один или несколько атомов водорода могут быть заменены на галоген или -ОН. Термин «арил», применяемый здесь сам по себе или как часть другой группы, относится к моноциклическим или бициклическим ароматическим группам, содержащим 5-12 атомов углерода в циклической части, предпочтительно 6-10 атомов углерода в циклической части, таким как фенил, нафтил или тетрагидронафтил. Одно или несколько колец арильной группы могут включать в себя конденсированные кольца. Арильные группы могут быть замещены одной или несколькими алкильными группами, которые могут быть неразветвленными, разветвленными или циклическими. Арильные группы могут также быть замещены в положениях кольца заместителями, которые не оказывают значительное вредное влияние на функцию соединения или части соединения, в котором он найден. Замещенные арильные группы включают в себя также группы, имеющие гетероциклические ароматические кольца, в которых один или несколько гетероатомов (например, N, О или S, необязательно с атомами водорода или заместителями для подходящей валентности) заменены одним или несколькими атомами углерода в кольце.
Термин «алкокси» применяют здесь для обозначения алкильного радикала с неразветвленной или разветвленной цепью, как указано выше, если только, кроме того, длина цепи не ограничена, связанного с атомом кислорода, такой термин включает в себя, но не ограничивается перечисленным, метокси, этокси, н-пропокси, изопропокси и тому подобное. Цепь алкокси в длину предпочтительно содержит 1-6 атомов углерода, более предпочтительно 1-4 атома углерода в длину.
«Ацильной» группой является группа, которая включает в себя группу - СО-.
Термин «моноалкиламин», применяемый здесь сам по себе или как часть другой группы, относится к аминогруппе, которая замещена одной алкильной группой, указываемой выше.
Термин «диалкиламин», применяемый здесь сам по себе или как часть другой группы, относится к аминогруппе, которая замещена двумя алкильными группами, указываемыми выше.
Термин «галоген», применяемый здесь сам по себе или как часть другой группы, относится к атому хлора, брома, фтора или иода.
Термин «гетероцикл» или «гетероциклическое кольцо», применяемый здесь, за исключением случаев, когда указано иначе, представляет собой систему стабильного 5-7-членного моногетероциклического кольца, которое может быть насыщенным или ненасыщенным и который состоит из атомов углерода и одного-трех гетероатомов, выбранных из группы, состоящей из N, О и S, где атом азота и серы может быть необязательно окислен. Особенно пригодными являются кольца, которые содержат один атом азота в комбинации с одним атомом кислорода или серы или два атома азота. Примеры таких гетероциклических групп включают в себя пиперидинил, пирролил, пирролидинил, имидазолил, имидазолинил, имидазолидинил, пиридил, пиразинил, пиримидинил, оксазолил, оксазолидинил, изоксазолил, изоксазолидинил, тиазолил, тиазолидинил, изотиазолил, гомопиперидинил, гомопиперазинил, пиридазинил, пиразолил и пиразолидинил, наиболее предпочтительно тиаморфолинил, пиперазинил и морфолинил.
Термин «гетероатом» применяют здесь для обозначения атома кислорода ("О"), атома серы ("S") или атома азота ("N"). Должно быть понятно, что когда гетероатомом является атом азота, он может образовывать часть NRaRb, где Ra и Rb представляют собой, независимо друг от друга, водород или С1-4алкил, С2-4аминоалкил, С1-4галогеналкил, галогенбензил или Ra и Rb взяты вместе с образованием 5-7-членного гетероциклического кольца, необязательно имеющего О, S или NRc в указанном кольце, где Rc представляет собой водород или С1-4алкил.
Соединения изобретения являются пригодными в качестве связывающихся с опухолью агентами и в качестве лигандов, связывающих рецептор NMDA, и в форме с радиоактивным изотопом являются особенно пригодными в качестве соединений-индикаторов для способов получения изображений опухолей, в том числе получения изображения способами ПЭТ и ОЭКТ. Особенно пригодными в качестве агента для получения изображения являются такие соединения, меченые F-18, поскольку F-18 имеет период полураспада 110 минут, который обеспечивает достаточное время для получения меченого радиоактивным изотопом индикатора, для очистки и введения в организм человека или животного. Кроме того, F-18-меченые соединения можно применять в установках, удаленных от циклотрона в радиусе, более чем приблизительно до 200 миль.
В приборе для получения изображения ОЭКТ применяют изотопные индикаторы, которые испускают фотоны высокой энергии (γ-излучатели). Диапазон пригодных изотопов больше, чем для РЭТ, но ОЭКТ обеспечивает более низкое трехмерное разрешение. Тем не менее, ОЭКТ широко применяют для получения клинически значимой информации о скоростях связывания, локализации и выведения аналогов. Подходящим изотопом для получения изображения ОЭКТ является [123I], γ-излучатель с периодом полураспада 13,3 час. Соединения, меченые [123I], можно перевозить на расстояние приблизительно до 1000 миль от места производства или сам изотоп можно транспортировать для синтеза «на месте». Восемьдесят процентов испусканий изотопов являются фотонами 159 кэV, которые легко измеряют при использовании применяемым в настоящее время инструментом ОЭКТ.
Соответственно этому, соединения изобретения можно быстро и эффективно метить [123I] для применения в анализе ОЭКТ в качестве альтернативы получения изображения ПЭТ. Кроме того, из-за того факта, что одно и то же соединение можно метить любым изотопом, можно сравнивать результаты, полученные ПЭТ и ОЭКТ с применением одного и того же индикатора.
Для получения изображения ПЭТ или ОЭКТ или для общепринятого мечения изотопным индикатором можно применять другие изотопы галогенов. Они включают в себя 75Br, 76Вr, 77Вr и 82Вr, как имеющие приемлемые периоды полураспада и характеристики эмиссии. В общем, существует химический способ для замены описанных изотопов любой галогенной частью. Следовательно, биохимические или физиологические активности любого галогенированного гомолога соединений изобретения являются теперь доступными для применения специалистами в данной области, включая гомологи со стабильным изотопом галогена. Другие изотопы галогена можно заменить на астат, [210At] излучает альфа-частицы с периодом полураспада 8,3 час. Следовательно, At-замещенные соединения являются пригодными для терапии опухолей, когда связывание является достаточно опухоль-специфическим.
Изобретение предлагает способы получения изображения с применением ПЭТ и ОЭКТ. Эти способы включают в себя введение субъекту (которым может быть человек или животное для экспериментальных и/или диагностических целей) создающего изображение количества соединения изобретения, меченого подходящим изотопом, и затем измерение распределения соединения ПЭТ, если применяют [18F] или другой излучатель позитронов, или ОЭКТ, если применяют [123I] или другой гамма-излучатель. Создающим изображение количеством является количество, которое, по меньшей мере, способно создавать изображение в сканере ПЭТ или ОЭКТ, при принятии во внимание чувствительности детектирования и уровень помех сканера, срок службы изотопа, размер тела субъекта и путь введения, причем все такие параметры являются типовыми параметрами, известными и объясняемыми вычислениями и измерениями, известными специалисту в данной области без применения излишнего экспериментирования.
Будет понятно, что соединения изобретения можно метить изотопом любого атома или комбинацией атомов в структуре. Хотя [18F], [123I] и [125] выделены здесь как особенно пригодные для ПЭТ, ОЭКТ и анализа методом меченых атомов, рассматриваются другие применения, включающие в себя применения, которые вытекают из физиологических и фармакологических свойств гомологов со стабильными изотопами и должны быть очевидными для специалистов в данной области.
Соединения изобретения можно также метить технецием (ТС) с помощью аддуктов Тc. Изотопы Тc, а именно Tc99m, применяли для получения изображения опухолей. Настоящее изобретение предлагает комплексные аддукты Тc и соединений изобретения, которые являются пригодными для получения изображения опухоли. Такие аддукты являются координационными комплексами Tс, связанными с циклической аминокислотой цепью с 4-6 атомами углерода, которая может быть насыщенной или имеет двойную или тройную связь. Когда присутствует двойная связь, можно синтезировать либо Е (транс)-, либо Z (цис)-изомеры и можно применять любой изомер. Изобретательские соединения, меченые Тс, синтезируют включение изотопа 99mТс в качестве последней стадии для максимизации пригодного срока службы изотопа.
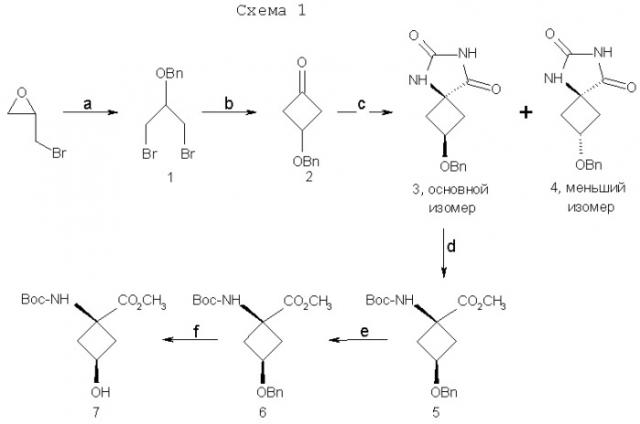
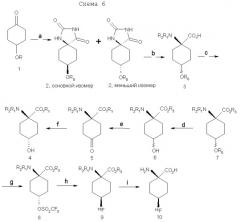
В патенте США 5817776 описана десятистадийная последовательность реакций для синтеза (анти[18F]-1-амино-3-фторциклобутан-1-карбоновой кислоты (FACBC)), которая включает в себя разделение трудоемкой полупрепаративной жидкостной хроматографией при высоком давлении после стадии 4 смеси 75:25 ключевых промежуточных соединений, цис-1-амино-3-бензилоксициклобутан-1-карбоновой кислоты и транс-1-амино-3-бензилоксициклобутан-1-карбоновой кислоты соответственно. Очищенный основной изомер, цис-1-амино-3-бензилоксициклобутан-1-карбоновую кислоту, затем превращают в трифлатный предшественник в шестистадийной последовательности реакций.
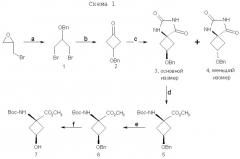
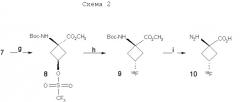
При попытке усовершенствовать синтетические методы авторы изобретения разработали стереоселективный синтез транс(анти)-1-амино-3-[18F]фторциклобутан-1-карбоновой кислоты (aнти-[18F]FACBC) для синтеза в больших масштабах как предшественника для радиомечения, метилового эфира цис-1-трет-бутилкабамат-3-трифторметансульфонокси-1-циклобутан-карбоновой кислоты (8), так и транс-1-амино-3-фторциклобутан-1-карбоновой кислоты (aнти-[18F]FACBC) (10). На схемах 1 и 2 показаны стадии синтеза анти-FACBC. С применением показанных синтетических стадий авторы смогли получить трифлатный предшественник (8) семистадийной последовательностью реакций. Ключевой стадией в синтезе является получение синтона, 3-бензилоксициклобутанона (2). Получение циклобутанона 3 включает в себя циклизацию обработкой 1-бром-2-бензилокси-3-бромпропана (1) метилэтилсульфоксидом и н-бутиллитием. Кетон 2 превращали непосредственно в гидантоины 3 и 4 в условиях реакции Bucherer-Strecker. Смесь 80:20 цис:транс-изомеров гидантоина легко очищали флэш-хроматографией, получая при этом требуемый цис-гидантоин 4. Превращение 4 в трифлатный предшественник, метиловый эфир цис-1-трет-бутилкарбамат-3-трифторметансульфонокси-1-циклобутан-карбоновой кислоты (8) проводили последовательностью реакций, описанных в патенте США 5817776. С применением этого метода авторы изобретения смогли получить граммовые количества соединения 9 [McConathy et al. (2003) Jour. Of Applied Radiation and Isotopes, 58: 657-666].
а) бензилбромид, Hg2Cl2, 150°C; b) nBuLi, CH3S(O)CH2SCH3, THF then 35% HClO4/Et2O; c) NH4(CO3)2, NH4Cl, KCN,1:1 EtOH: H2O, 60°C; d) 3N NaOH, 180°C then Boc2O, 9:1 CH3OH:Et3N; e) (CH3)3SiCHN2, 1:1 CH3OH:THF; f) 10% Pd/C, H2, CH3OH.
g) (CF3SO2)2O, пиридин, CH2Cl2; h) K18F, K222, K2CO3, 90°C; i) 4N HCl, 120°C .
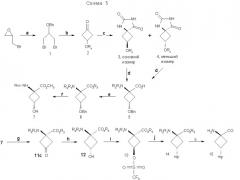
Для получения достаточных количеств аналогов аминокислот в син-изомерной форме для получения изображения опухолей, в частности цис(син)-1-амино-3-фторциклобутан-1-карбоновой кислоты (син-FACBC), разработали новый общий синтетический подход, как показано на схемах 3-5, для получения в больших масштабах метилового эфира транс-1-трет-бутилкарбамат-3-трифторметансульфонокси-1-циклобутан-1-карбоновой кислоты. Ключевая стадия в синтезах включает в себя восстановление синтонов, метилового эфира 1-трифторацетамидоциклобутан-3-он-1-карбоновой кислоты (11а), метилового эфира 1-фталамидоциклобутан-3-он-1-карбоновой кислоты (11b), метилового эфира 1-трет-бутилкарбаматциклобутан-3-он-1-карбоновой кислоты (11с) и метилового эфира 1-бензамидоциклобутан-3-он-1-карбоновой кислоты (11d). Кетоны 11a-d превращали непосредственно в транс(анти)-спирты с выходом 63-80% обработкой литийтриизобутилборана и ZnCl2. Этот метод дал смеси 95:5, 97:3, 70:30 и 90:10 транс:цис-спиртов 12а, 12b, 12с и 12d соответственно. Спирты 12a-12d легко очищали флэш-хроматографией с получением требуемых транс-спиртов 12a-d. Превращение 12a-d в трифлатные предшественники можно проводить последовательностью реакций, описанных в патенте США 5817776. Разработка этих синтетических подходов является существенной для обеспечения легкодоступной поставки предшественника для распределения в центрах ПЭТ для будущих клинических исследований во многих центрах для подтверждения пригодности син- и анти-FACBC в качестве ценного агента для получения изображения для диагностики и проведения лечения рака.
Указанную выше реакцию проводят следующим образом. К раствору кетона (11а, b, с или d) в ТГФ (безводн.) добавляют 2 эквивалента ZnCl2 (безводн., в ТГФ) при комнатной температуре (к.т.) в атмосфере аргона. Раствор перемешивают при комнатной температуре в течение 30 мин с последующим добавлением 1,5 эквивалента LiBR'3H при -78°C. Смесь перемешивают при -78°С в течение 2 час, затем при к.т. на протяжении ночи. Добавляют NH4Cl (1 н. водный раствор, 3 экв.) и смесь перемешивают при к.т. в течение 30 мин. Реакционную смесь промывают насыщенным раствором соли и водную фазу снова экстр