Фенилазадитиа-15-краун-5-содержащий 9-стирилакридин в качестве оптического сенсора на катионы меди (ii) и способ его получения
Иллюстрации
Показать всеНастоящее изобретение относится к акридиновым стириловым красителям, а именно к фенилазадитиа-15-краун-5-содержащий 9-стирилакридину следующей формулы:
а также к способу его получения. Технический результат: получено новое соединение, полезное в качестве оптического сенсора на катионы меди (II). 2 н.п. формулы.
Реферат
Изобретение относится к органической химии, а именно к акридиновым и стириловым красителям, конкретно к новому соединению - фенилазадитиа-15-краун-5-содержащему 9-стирилакридину следующей формулы:
и способу его получения.
Изобретение наиболее успешно может быть использовано при создании оптических полимерных сенсоров и спектрофотометрических датчиков, применяемых для оперативного контроля концентраций примесей в жидкостях как в лабораторных, так и в полевых условиях.
Указанное соединение, его свойства и способ получения в литературе не описаны. Соединение содержит неизвестное ранее сочетание таких типов связей, совокупность которых составляет фрагменты 9-стирилакридина и фенилазадитиакраун-эфира с новой электронной структурой связи между ними, что позволяет отнести это соединение к новому классу красителей - дитопных рецепторов на катионы тяжелых металлов.
Известны тиакраун- и азатиакраун-соединения различного строения, например:
[М.Хираока, Краун-соединения свойства и применение, М., Мир, 1986, 363 С.], для которых обнаружена способность к связыванию катионов тяжелых металлов, однако отсутствует поглощение в видимой области спектра.
Известны катионные 18(15)-краун-6(5)-содержащие стириловые красители общей формулы:
где R1-R3 - водород, алкильная, алкоксильная, арильная группы или R3 и R4 вместе С4Н4-бензогруппа;
R5 - алкильная группа;
Y - сера, кислород, селен, группа С(СН3)2 или СН=СН;
Х - анион иода или перхлората;
n=1 или 2,
в качестве селективных реагентов на катионы аммония, щелочных или щелочно-земельных металлов (Громов С.П., Федорова О.А., Фомина М.В., Алфимов М.В. Патент РФ 2012574, бюл. изоб., 1994, №9). Для таких красителей характерны наличие поглощения в видимой области спектра и способность к комплексообразованию с катионами щелочных- или щелочно-земельных металлов, определяемой размером краун-эфирной полости. Однако комплексообразование с катионами тяжелых металлов отсутствует из-за того, что кислородные краун-эфиры не имеют сродства к таким катионам.
Известны катионные тиакраунсодержащие стириловые красители общей формулы:
где R1-R4 - атом водорода, низший алкил, арильная группа, R3 и R4 вместе составляют С4Н4-бензогруппу, алкоксильная группа, диалкиламиногруппа, ациламиногруппа, атом галогена;
R5 - низший алкил, сульфоалкильная, карбоксиалкильная, фосфонатоалкильная, тиоцианатоалкильная, цианоалкильная группы;
Х - атом серы, атом селена, атом кислорода, группа С(СН3)2, группа СН=СH;
Y и Z - атом кислорода, атом серы при условии, что в состав макроцикла входят атомы серы в различных комбинациях с атомами кислорода;
n-0-3;
А=Cl, Br, I, ClO4, BF4, TsO,
в качестве селективных сенсоров на катионы тяжелых или переходных металлов (Громов С.П., Федорова О.А., Ведерников А.И., Ещеулова С.В., Федоров Ю.В., Алфимов М.В. Патент РФ 2176256, бюл. изоб., 2001, №33). Однако устойчивость комплексов оказывается существенно ниже, чем устойчивость комплексов простых краун-эфиров аналогичной структуры из-за имеющегося положительного заряда на молекуле-комплексообразователе.
Известны краунсодержащие гетарилфенилэтены, являющиеся структурными аналогами соответствующих катионных стириловых красителей, но не несущими положительный заряд, например:
(Yu. V. Fedorov, О.A.Fedorova, Е.N.Andryukhina, S.P.Gromov, M.V.Alfimov, L.G.Kuzmina, A.V.Churakov, J.А.К. Howard and J.-J.Aaron. "Ditopic complex formation of the crown-containing 2-styrylbenzothiazole." // New J. Chem. - 2003, 27, No. 2, P.280-288). Такие соединения имеют более высокие константы устойчивости комплексов, однако не поглощают в видимой области спектра.
Известен способ получения стирилзамещенных акридинов кипячением 9-метилакридина с аминозамещенными бензальдегидами в уксусном ангидриде (Lindauer H., Czerney P., Grummt U.-W. 9-(4-Dialkylaminostyryl)-acridines - A new class of acidochromic dyes // J. Prakt. Chem. - 1994. - V. 336. - 6. - P.521-524), однако для краунсодержащих соединений данный способ ранее не применялся.
Данный способ был взят в качестве прототипа.
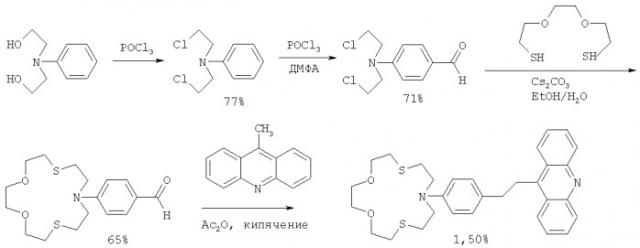
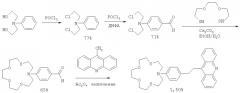
Задачей настоящего изобретения является получение нового соединения -фенил-азадитиа-15-краун-5-содержащий 9-стирилакридина структурной формулы (I), разработка нового способа получения целевого продукта.
Поставленная задача достигается структурой заявляемого соединения формулы (I) и способом его получения, заключающимся в хлорировании N-фенилдиэтаноламина под действием хлорокиси фосфора с предварительным охлаждением до 5±1°С и последующим нагреванием до 100±2°С, с последующим формилированием полученного продукта смесью хлорокиси фосфора и диметилформамида с предварительным охлаждением до 0±1°С и последующим нагреванием до 40±1°С, полученный продукт подвергают макроциклизации с 2-[2-(2-меркаптоэтокси)
этокси]этил гидросульфидом в кипящем водном этаноле в присутствии карбоната цезия, продукт макроциклизации конденсируют с 9-метилакридином кипячением в уксусном ангидриде и с выделением конечного продукта I известными методами. Строение полученного соединения доказано с помощью ПМР- и УФ-спектроскопии, а также подтверждено данными элементного анализа.
Реакция протекает по схеме:
Реактивы, необходимые для проведения синтеза заявляемого соединения, являются коммерчески доступными реагентами: N-фенилдиэтаноламин (Aldrich, 235334), 9-метилакридин (Acros, 27649 0010), 2-[2-(2-меркаптоэтокси)этокси]этил гидросульфид (Acros, 21617 0250), хлорокись фосфора (Aldrich, 320455), диметилформамид (Acros, 32687 0010), уксусный ангидрид (Acros, 222130010), этанол (Acros, 27066 0010), карбонат цезия (Acros, 20360 0250).
Сущность изобретения иллюстрируется примером.
Пример 1. Получение 9-[(Е)-2-(1,4-диокса-7,13-дитиа-10-азациклопентадекан-10-ил)винил]акридина (I).
К (46 г, 0.3 моль) хлорокиси фосфора небольшими порциями прибавляют при 5°С (20 г, 0.11 моль) N-фенилдиэтаноламина. Смесь нагревают 1 час при 100°С, охлаждают и выливают в 60 мл бензола, а полученный бензольный раствор - в 100 г льда. Затем бензольный раствор отделяют, а водный - экстрагируют бензолом (3×50 мл). Бензольные растворы объединяют, сушат сульфатом натрия. Растворитель упаривают на роторном испарителе. Выход N,N-бис(2-хлорэтил)анилина после перекристаллизации из горячего СН3ОН составил 18.6 г (77%); Т.пл. 44°С. Лит. данные 41-45°С (М.В.Рубцов, А.Г.Байчиков, Синтетические химико-фармацевтические препараты. Под ред. д.ф.н. А.Г.Натрадзе, Москва, Медицина, 1971, 67).
К раствору (13.2 г, 0.086 моль хлорокиси фосфора в 65.7 мл диметилформамида, охлажденному до 0°С, прибавляют раствор (18.6 г, 0.085 моль) N,N-бис(2-хлорэтил)анилина в 65.7 мл диметилформамида. После выдерживания реакционной массы 15 минут при 15°С нагревают реакционную смесь в течение 2 часов при 40°С. Выливают в смесь льда с водой и быстро отфильтровывают не вошедший в реакцию N,N-бис(2-хлорэтил)анилин. Фильтрат оставяют на полчаса при температуре 0°С, осадок отфильтровывают. После перекристаллизации из EtOH получено 14,9 г 4-[бис(2-хлорэтил)амино]бензальдегида (71%); Т.пл. 88°С. Лит. данные 85-88°С (М.В.Рубцов, А.Г.Байчиков, Синтетические химико-фармацевтические препараты. Под ред. д.ф.н. А.Г.Натрадзе, Москва, Медицина, 1971, 67). 1H ЯМР (CDCl3, 30°C, δ, м.д., J/Гц): 3.66 (т, 4 Н, Н(9), Н(14), 3J=6.44), 3.82 (т, 4 Н, Н(8), Н(13), 3J=6.44), 6.73 (д, 2 Н, Н(2), Н(6), 3J=8.3), 7.75(д, 2 Н, Н(3), Н(5), 3J-8.3), 9.76 (с, 1 Н, Н(11)).
К кипящему раствору, содержащему (9.3 г, 0.028 моль) карбоната цезия, 300 мл этилового спирта и 300 мл воды в течение 1 часа одновременно добавляют растворы (1.14 г, 0.006 моль) 2-[2-(2-меркаптоэтокси)этокси]этил гидросульфида и (1.4 г, 0.006 моль) 4-[бис(2-хлорэтил)амино]бензальдегида в 75 мл этанола. Реакционную смесь кипятят при перемешивании при 60 С в течение 20 часов, затем растворитель упаривают в вакууме. Остаток экстрагируют бензолом из воды, экстракты промывают водой, упаривают в вакууме. Остаток хроматографируют на SiO2, элюент - гексан - этилацетат 1:2; т.пл. 86°С. Получают 1.4 г (65%) 4-(1,4-диокса-7,13-дитиа-10-азациклопентадекан-10-ил)бензальдегида. 1Н ЯМР (CDCl3, 30°С, δ, м. д., J/Гц) 2.74 (с, 4 Н, Н(11), Н(15)), 2.88 (т, 4 Н, Н(2), Н(9), 3J=7.5), 3.62 (с, 4 Н, Н(5), Н(6)), 3.70 (т, 4 Н. Н(3), Н(8), 3J=7.5), 3.78 (т, 4 Н, Н(12), (14)), 6.65 (д, 2Н, Н(17), Н(21), 3J-8.3), 7.69 (д, 2Н, Н(18), Н(20)), 9.7 (с, 1 Н, Н(22)). 13С ЯМР (100 MHz, CDCl3) 29.34 (C(11), C(15)), 31.43 (C(2), C(9)), 51.96 (C(12), C(14)), 70.67 (C(3), C(8)), 74.26 (C(5), C(6)), 111.09 (C(17), C(21)), 125.48 (C(16)), 132.18 (C(18), C(20)), 151.69 (C(19)), 189.88 (C(22)). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн(%)): 355 (100) [M+], 282 (9), 269 (4), 220(8), 204 (24), 192 (22), 160 (32), 147 (34), 134 (23), 118 (12), 104 (8), 87 (12), 74 (13), 60 (11), 45 (11). Смесь 0.21 ммоль 9-метилакридина и 0.21 ммоль 4-(1,4-диокса-7,13-дитиа-10-азациклопентадекан-10-ил)бензальдегида растворяют в 0.47 мл уксусного ангидрида, далее кипятят с обратным холодильником в течение 1 часа. Реакционную смесь охлаждают и нейтрализуют 10% раствором гидроксида калия. Водную фазу отделяют, а к остатку добавляют 5 мл ацетонитрила. Полученный осадок 9-[(Е)-2-(1,4-диокса-7,13-дитиа-10-азациклопентадекан-10-ил)винил]
акридина (I) отфильтровывают. Очистка - колоночная хроматография на Аl2Оз, элюент - бензол - ацетонитрил 15:1. Выход 50%. Спектр 1H ЯМР (CD3CN, 400 МГц), 30°С, δ, м. д., J/Гц: 2.75 (т, 4Н, Н-11, Н-15, 3J=5.2), 2.85 (т, 4Н, Н-2, Н-9, 3J=7.6), 3.59 (с, 4Н, Н-5, Н-6), 3.66 (т, 4Н, Н-3, Н-8, 3J-7.6), 3.71 (т, 4 Н, Н-12, Н-14, 3J-5.2), 6.73 (д, 2Н, Н-17, Н-21, 3J=8.8), 7.01 (д, 1Н, Н-22, 3Jtrans,=16.5), 7.59 (т, 2Н, Н-31, Н-35, 3J=8.8, 4J=1.2), 7.82 (т, 2Н, Н-32, Н-36, 3J-8.8, 4J-1.2), 7.92 (д, 1Н, Н-23, 3Jtrans=16.5), 8.13 (д, 2Н, Н-33, Н-37, 3J-8.8), 8.40 (д, 2Н, Н-30, Н-31, 3J-8.8). Найдено (%): С, 70.30; Н, 6.57; N, 5.32. С27Н35СlN2O6S3. Вычислено (%): С, 70.15; Н, 6.46; N, 5.28. Масс спектр в MeCN (ИЭР, 2 кВ), m/z:531.1 [I·Н+].
Синтезированное соединение имеет глубокую окраску с максимумом длинноволновой полосы в спектре поглощения 435 нм, которая связана со способностью электронной пары атома азота азадитиакраун-эфирного фрагмента, находящегося в пара-положении к двойной связи, участвовать в сопряжении с гетероциклическим остатком.
При исследовании свойств полученного соединения была обнаружена высокая чувствительность электронной структуры красителя к комплексообразованию краун-эфирным и акридиновым фрагментами, что является следствием его дитопного характера. При добавлении в раствор полученного соединения в органическом растворителе (ацетонитрил, тетрагидрофуран, этанол и др.) или в воде кислот (уксусной, соляной, хлорной и др.) наблюдается батохромный сдвиг длинноволновой полосы в спектре поглощения на 175-180 нм. Это связано с протонированием акридинового фрагмента красителя. В присутствии сильных кислот в высокой концентрации наблюдается обратный сдвиг длинноволновой полосы поглощения за счет протонирования атома азота краун-эфирного фрагмента молекулы.
Заявляемое новое соединение проявляет высокую селективность к катионам тяжелых металлов. Так, добавление в раствор указанного соединения солей щелочных и щелочно-земельных металлов не вызывает изменений в электронном спектре молекулы, что свидетельствует об отсутствии комплексообразования с данными катионами металлов. При добавлении в раствор полученного соединения в ацетонитриле солей двухвалентной меди наблюдаются характерные изменения в спектре поглощения, величина которых зависит от концентрации соли. При эквивалентном соотношении катионов меди и красителя в спектре поглощения появляется полоса с максимумом 610 нм, при двукратном избытке соли меди данная полоса поглощения исчезает и вместо нее появляется полоса с максимумом при 510 нм. Это связано с образованием в растворе комплексов меди с красителем различного состава за счет дитопности красителя.
Измеренные с помощью методов спектрофотометрического титрования константы устойчивости комплексов указывают на большую прочность комплексов с катионами меди. Спектры поглощения записывали на спектрофотометре Specord M-40. Ацетонитрил марки ОСЧ и перхлорат двухвалентной меди использовали без дополнительной очистки. Получены следующие значения констант устойчивости комплексов в ацетонитриле при 293 К:
| Сu2+ | Лиганд | LgK | Равновесие |
| 1 | 1 | 9.3±0.3 | L+Cu2+↔LCu2+ |
| 1 | 2 | 15±0.5 | 2L+Cu2+↔L2Cu2+ |
| 2 | 1 | 16±0.4 | L+2Cu2+↔LCu2 2+ |
Обнаруженные нами свойства полученного соединения дают возможность его использования, например, при разработке оптических сенсоров на катионы меди. К настоящему времени известно несколько коммерчески доступных оптических реагентов на катионы меди, полученных на основе производных 1-(2-пиридилазо)-2-нафтола. Заявляемое соединение обладает высокой селективностью благодаря наличию макроциклического связывающего центра, хорошо подходящего к связываемому катиону металла как по размеру, так и по природе координирующих гетероатомов. Отличительной чертой заявляемого соединения является высокий цветовой контраст, возникающий в процессе комплексообразования, что облегчает определение катионов металла оптическими методами.
1. Фенилазадитиа-15-краун-5-содержащий 9-стирилакридин следующей формулы: в качестве оптического сенсора на катионы меди (II).
2. Способ получения соединения по п.1, заключающийся в хлорировании N-фенилдиэтаноламина под действием хлорокиси фосфора с предварительным охлаждением до 5±1°С и последующим нагреванием до 100±2°С, с последующим формилированием полученного продукта смесью хлорокиси фосфора и диметилформамида с предварительным охлаждением до 0±1°С и последующим нагреванием до 40±1°С, с последующей макроциклизацией полученного продукта с 2-[2-(2-меркаптоэтокси)этокси]этил гидросульфидом в кипящем водном этаноле в присутствии карбоната цезия, с последующей конденсацией полученного продукта макроциклизации с 9-метилакридином кипячением в уксусном ангидриде и с выделением конечного продукта I известными методами.