Способ определения способности микроорганизмов регулировать антагонистическую активность бактерий
Иллюстрации
Показать всеИзобретение относится к микробиологии и может быть использовано для изучения механизма межмикробных взаимодействий. Способ предусматривает следующее. Из исследуемой культуры микроорганизмов получают клеточные компоненты, представляющие собой экзометаболиты, клеточный экстракт и клеточные стенки. Полученные клеточные компоненты обеззараживают хлороформом из расчета 0,1 мл хлороформа на 3 мл клеточных компонентов. Затем смешивают каждый из выделенных клеточных компонентов со штаммом-антагонистом в соотношении 1:2 соответственно. Параллельно готовят две контрольные пробы, при этом контроль 1 готовят из жидкой питательной среды и физиологического раствора, а контроль 2 - из жидкой питательной среды и штамма-антагониста. После чего опытные и контрольные пробы инкубируют. После этого разбавляют жидкой питательной средой, инкубируют и отделяют супернатанты центрифугированием. Полученные супернатанты обеззараживают путем обработки их хлороформом из расчета 0,1 мл хлороформа на 3 мл сутпертатанта. Обеззараженные супернатанты смешивают с взвесью индикаторного штамма в соотношении 1:2 соответственно. Инкубируют и разбавляют жидкой питательной средой. После чего высевают индикаторный штамм на плотную питательную среду и культивируют. Затем подсчитывают КОЕ в опытных и контрольных пробах. Рассчитывают антагонистическую активность штамма-антагониста и по изменению антагонистической активности в опытных пробах по сравнению с контролем судят о способности исследуемой культуры микроорганизмов регулировать антагонистическую активность бактерий. Изобретение позволяет определять способность микроорганизмов регулировать антагонистическую активность бактерий. 1 табл.
Реферат
Изобретение относится к микробиологии и может быть использовано для изучения механизма межмикробных взаимодействий, в частности роли отдельных клеточных компонентов микроорганизмов в регуляции антагонистических отношений в микробных сообществах.
Антагонизм в мире микробов широко распространен и характеризуется тем, что один вид микроорганизмов так или иначе подавляет развитие или задерживает рост других микроорганизмов [Егоров Н.С. Основы учения об антибиотиках: Учебник. 6-е изд., перераб. и доп.М.: Изд-во МГУ; Наука, 2004. 503 с.]. Антимикробный потенциал реализуется за счет веществ различной природы: органические кислоты, перекись водорода, ферменты, антибиотики.
Известно о различных механизмах регуляции продукции антимикробных факторов. В случае ферментов-антибиотиков синтез последних, как правило, индуцируется субстратом [Уотсон Дж. Молекулярная биология гена/ Под ред.акад. Энгельгардта В.А. М.: Мир, 1978. 720 с.], а активность регулируется физико-химическими факторами среды [Диксон М., Уэбб Э. Ферменты: Пер. с англ. М.: Мир. Т.2. 1982. 515 с.].
Синтез большого количества антимикробных факторов находится в прямой зависимости от условий среды, мало зависит от субстрата, большее значение имеет соотношение углерод/азот, наличие микроэлементов, факторов роста, аэрация и др. [Егоров Н.С. Основы учения об антибиотиках: Учебник. 6-е изд., перераб. и доп. М.: Изд-во МГУ; Наука 2004. 503 с., Биотехнология: Учебн. пособие для вузов. В 8 кн. Под ред. Н.С.Егорова, В.Д.Самуилова. Кн. 6: Микробиологическое производство биологически активных веществ и препаратов. М.: ВШ, 1987. 134 с.].
Известны регуляторы синтеза бактериоцинов - белки у грамположительных и лактоны у грамотрицательных бактерий, методы их выделения и изучения [Brurberg М.В., Nes I.F., Eijsink V.G.H. Pheromone-induced production of antimicrobial peptides in Lactobacillus // Mol. Microbiol. 1997. V.26. P.347-360].
Многие микроорганизмы синтезируют метаболиты, которые являются факторами роста для штаммов-продуцентов антибиотиков. Так, известны способы увеличения продукции антибиотиков на основе добавления в среду культивирования факторов роста биологической природы [Биотехнология: Учебн. пособие для вузов. В 8 кн. Под ред. Н.С.Егорова, В.Д. Самуилова. Кн. 6: Микробиологическое производство биологически активных веществ и препаратов. М.: ВШ, 1987. 134 с.] метаболитов бактерий [Вахитов Т.Я., Яшина О.Ю., Петров Л.Н. и др. Действие препарата аутостимуляторов роста Escherichia coli M-17 (Актофлор) на рост чистых и смешанных культур бактерий // Журн. микробиол. 2000. №3. С.20-24, Хохлов А.С. Низкомолекулярные микробные ауторегуляторы. М.: Наука, 1988. 272 с.], клеточных стенок бактерий [Fermor Т.R., Wood D.A., Lincoln S.P., Fenlon J.S. Bacteriolysis by Agaricus bisporus. // J. of General Microbiology. 1991. V.130. P.761-769, Bronneke V., Fiedler F. Production of bacteriolytic enzymes by exogenous bacterial cell walls. Appl. Environ. Microbiol. 1994. Vol.60. V.3. P.785-791].
Известен способ регуляции выхода антибиотика [Хохлов А.С. Низкомолекулярные микробные ауторегуляторы. М.: Наука, 1988. 272 с., Горбунова Н.А., Яковлева Е.П. Действие собственного антибиотика на продуцент имбирцина при выращивании на агаризованной среде // Антибиотики и химиотерапия. 2000. №5. С.45-48.], основанный на изучении способности фильтрата бульонной культуры продуцента антибиотика регулировать образование изучаемого продукта. Однако способ не позволяет оценить антагонистическую активность бактерий, т.к. выход продукта тестируют не биологическими методами, а физико-химическими, например, по светопоглощению.
Актуальность разработки способа определения способности микроорганизмов регулировать антагонистическую активность бактерий обусловлена возможностью изучения механизма межмикробных взаимодействий, в частности роли отдельных микроорганизмов и их клеточных компонентов в регуляции антагонистических отношений в микробных сообществах, что позволит изучать механизмы формирования и функционирования микробиоценозов и разрабатывать на основе полученных знаний методические подходы к созданию новых способов и препаратов для лечения инфекционных болезней, санации бактерионосителей и коррекции дисбиотических состояний.
Технический результат, на достижение которого направлено изобретение, заключается в создании способа, позволяющего определять способность исследуемых микроорганизмов регулировать антагонистическую активность бактерий и роль отдельных клеточных компонентов исследуемых культур микроорганизмов (экзометаболита, клеточного экстракта или клеточной стенки) в ее регуляции.
Для достижения указанного технического результата в заявляемом способе определения способности микроорганизмов регулировать антагонистическую активность бактерий из исследуемой культуры микроорганизмов получают клеточные компоненты: экзометаболиты, клеточный экстракт и клеточные стенки, обеззараживают их хлороформом из расчета 0,1 мл на 3 мл клеточных компонентов, смешивают каждый из выделенных клеточных компонентов со штаммом-антагонистом в соотношении 1:2, параллельно готовят две контрольные пробы, при этом контроль 1 готовят из жидкой питательной среды и физиологического водного раствора, а контроль 2 - из жидкой питательной среды и штамма-антагониста, опытные и контрольные пробы инкубируют, разбавляют жидкой питательной средой, инкубируют, отделяют супернатанты центрифугированием, обеззараживают их хлороформом из расчета 0,1 мл на 3 мл супернатанта, затем смешивают с взвесью индикаторного штамма, инкубируют, разбавляют жидкой питательной средой, высевают индикаторный штамм на плотную питательную среду, культивируют, затем подсчитывают КОЕ в опытных и контрольных пробах, рассчитывают антагонистическую активность штамма-антагониста и по изменению антагонистической активности в опытных пробах по сравнению с контролем судят о способности исследуемой культуры микроорганизмов регулировать антагонистическую активность бактерий.
Технический результат от реализации изобретения выражается в создании способа, позволяющего определять новое свойство микроорганизмов - способность регулировать антагонистическую активность бактерий различных таксонов за счет выявления различного влияния (стимулирующего, ингибирующего или индифферентного) клеточных компонентов исследуемых культур микроорганизмов (экзометаболитов, клеточного экстракта и клеточных стенок) на антагонистическую активность бактерий, а также за счет выявления способности микроорганизмов регулировать антагонизм бактерий, имеющих различные требования к питанию.
Аналогов изобретения в патентной и научно-технической литературе не обнаружено.
Известно изучение роли клеточных компонентов микроорганизмов в стимуляции синтеза лактацина Б путем отдельного исследования ее экзометаболитов, вещества, ассоциированного с клеточной стенкой, клеточного экстракта и фрагментов-мономеров клеточной стенки промышленного производства. В способе определяется способность микроорганизмов повышать синтез лактацина Б у штамма-продуцента L.acidophilus. [Barefoot, S.F. et. all. Identification and purification of a protein that induces production of the Lactobacillus acidophilus bacteriocin lactacin В. // Appl. Environ. Microbiol. 1994. Vol.60. V.10. P.3522-3528].
Однако способ не позволяет выявить характер влияния исследуемых культур микроорганизмов на антагонистическую активность бактерий - стимулирующее, ингибирующее или индифферентное, не позволяет оценить способность микроорганизмов регулировать антагонизм бактерий, имеющих различные требования к питанию, определить роль клеточных стенок в регуляции антагонистической активности бактерий.
Авторами экспериментально установлена способность микроорганизмов регулировать антагонистическую активность бактерий и определена роль отдельных клеточных компонентов исследуемой культуры микроорганизма, а именно экзометаболита, клеточного экстракта и клеточной стенки, в ее регуляции.
Авторами были проведены следующие исследования.
Для штаммов Enterococcus faecalis и Lactobacillus casei методом прямого антагонизма [Murrey R., Loeb L. Antibiotics produced by micrococci and streptococci that show selective inhibition within genus Streptococcus // Canad.J. Res. 1950. №28. P.177-185] определили чувствительные виды микроорганизмов - Staphylococcus aureus и Enterobacter cloacae.
Далее изучали способность Micrococcus luteus и Corynebacterium minutissimum регулировать антагонистическую активность штаммов-антагонистов E.faecalis и L.casei по отношению к S.aureus и E.cloacae. Для этого из исследуемых культур M.luteus и С.minutissimum получали клеточные компоненты: экзометаболиты, клеточный экстракт и клеточные стенки, используя общепринятые в микробиологии и химии методы (Методы химии углеводов. М.: Мир. 1967, Лизоцим. / Составитель У.Я.Каульньи. Рига: Авотс. 1982, Методы общей бактериологии. Т.2. / Под ред. Ф.Герхардта. М.: Мир. 1984).
Для получения экзометаболитов суточные бульонные культуры M.luteus и C.minutissimum центрифугировали при 3000 об/мин 15 минут, отбирали супернатанты, обеззараживали их хлороформом 20 минут (на 3 мл супернатанта - 0,1 мл хлороформа), центрифугировали при 3000 об/мин 15 минут и снова отбирали супернатанты.
Для получения клеточных экстрактов осадок, полученный после центрифугирования суточных бульонных культур M.luteus и C.mmutissimum дважды отмывали физиологическим раствором, доводили МПБ до изначальной мутности (ОД=0,15 для M.luteus и 0,225 для C.minutissimum, при λ=492 нм, в 96-луночном планшете, объем пробы 200 мкл), подвергали однократной заморозке (-20°С) - отморозке (37°С), обеззараживали хлороформом 20 минут (на 3 мл супернатанта 0,1 мл хлороформа), центрифугировали при 3000 об/мин 15 минут и отбирали супренатанты.
Клеточные стенки получали путем последовательной обработки биомассы исследуемых культур M.luteus и C.minutissimum смесью этилового спирта и хлороформа (3:1), 2М водным раствором гидроксида натрия, кислым раствором трипсина в концентрации 100 мкг/мл (после нейтрализации щелочи 3,5% раствором соляной кислоты), этиловым спиртом, ацетоном. Ацетоновый раствор клеточных стенок M.luteus и C.minutissimum высушивали при комнатной температуре, затем ресуспендировали в МПБ до изначальной мутности (ОД=0,15 для M.luteus и 0,225 для C.minutissimum, при λ=492 нм, в 96-луночном планшете, объем пробы 200 мкл) и обеззараживали автоклавированием при 0,5 атм 30 минут.
Далее в опыте каждый из клеточных компонентов (экзометаболиты, клеточный экстракт и клеточные стенки) исследуемых культур M.luteus и C.minutissimum смешивали по отдельности в соотношении 1:2 со штаммами-антагонистами E.faecalis и L.casei, взвешенными в физиологическом 0,9% водном растворе хлорида натрия, (ОД=0,2, при λ=492 нм, что соответствовало 109 кл/мл, в 96-луночном планшете, объем пробы 200 мкл).
Параллельно готовили контроль 1 (контроль роста индикаторного штамма) из жидкой питательной среды, используемой для роста исследуемой культуры? и физиологического (0,9%) водного раствора хлорида натрия в соотношении 1:2, и контроль 2 (контроль антагонистической активности) из жидкой питательной среды, используемой для роста исследуемой культуры и взвеси штаммов-антагонистов E.faecalis и L.casei в физиологическом водном растворе хлорида натрия (ОД=0,2, при λ=492 нм, что соответствовало 109 клеток/мл, объем пробы 200 мкл) в соотношении 1:2.
Опытные и контрольные пробы инкубировали 1 час при 37°С, после чего их разбавляли в 4 раза жидкой питательной средой, пригодной для роста штамма-антагониста (МПБ для E.faecalis и МРС для L.casei) и вновь инкубировали сутки при 37°С в условиях, подходящих для каждой культуры антагониста (E.faecalis в обычных условиях, L.casei - в микроаэрофильных), отделяли супернатанты центрифугированием при 3000 об/мин 15 минут, обеззараживали их хлороформом из расчета 0,1 мл на 3 мл супернатанта жидкости 20 минут.
Затем определяли выживаемость индикаторных штаммов S.aureus и E.cloacae в опытных и контрольных пробах. Для этого готовили на физиологическом растворе взвеси S.aureus и E.cloacae из суточных агаровых культур (ОД=0,15, при λ=492 нм, что соответствовало 107 кл/мл, в 96-луночном планшете, объем пробы 200 мкл). Затем в соотношении 1:2 смешивали взвеси индикаторных штаммов S.aureus и E.cloacae с супернатантами опытных и контрольных проб.
Смеси инкубировали 1 час при 37°С, разбавляли в 4 раза жидкой питательной средой, пригодной для роста индикаторных штаммов S.aureus и E.cloacae (МПБ), и культивировали при 37°С. Производили высев индикаторных штаммов S.aureus и Е. cloacae на плотную среду, используя метод серийных разведении, сразу и через 8 часов роста, подсчитывали КОЕ и вели расчет антагонистической активности (АА) в опытных и контрольных пробах по формулам
где АА - антагонистическая активность микроорганизмов;
А - контроль роста индикаторного штамма, КОЕ t8/КОЕ t0 (контроль 1);
B1 - контроль антагонистической активности, КОЕ t8/КОЕ t0 (контроль 2);
B2 - степень прироста индикаторного штамма, КОЕ t8/КОЕ t0 (опыт).
Изменение антагонистической активности рассчитывают по формуле
ΔАА=ААопыт-ААконтроль.
О способности исследуемых культур микроорганизмов M.luteus и C.minutissimum регулировать антагонистическую активность бактерий судили по ее изменению в опыте по сравнению с контролем. При ΔАА, равной нулю регуляция, АА отсутствует, при ΔАА меньше нуля происходит снижение АА, а при ΔАА больше нуля происходит повышение АА.
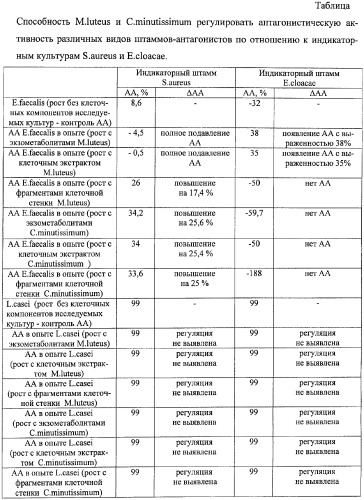
Результаты исследования приведены в таблице.
Как видно из таблицы, обработка E.faecalis экзометаболитами и клеточными экстрактами M.luteus приводила к появлению антагонизма по отношению к Е.cloacae с выраженностью 38 и 35% соответственно, а в отношении S.aureus наблюдали полное ингибирование признака. Действие клеточных стенок микрококка сводилось к повышению АА энтерококка по отношению к S.aureus на 17,4%.
Из описанных результатов следует, что регулирующим эффектом могут обладать различные клеточные компоненты исследуемой культуры микроорганизма, их действие проявляется по-разному, в зависимости от вида индикаторного штамма.
Изучение способности C.minutissimum регулировать АА E.faecalis выявило способность коринебактерии повышать АА энтерококка в отношении S.aureus, причем различные клеточные компоненты увеличивали выраженность антагонизма E.faecalis одинаково, в среднем на 25%. При использовании в качестве индикаторной культуры E.cloacae антагонизма со стороны энтерококка, обработанного компонентами коринебактерии, не наблюдали.
Изучение способности M.luteus и C.minutissimum регулировать АА L.casei выявило индифферентный характер влияния исследуемых культур. Антагонизм лактобациллы был на высоком уровне и его изменение при действии факторов микробной природы не определено.
Таким образом, экспериментально установлена способность различных видов микроорганизмов за счет действия их клеточных компонентов (экзометаболитов, клеточного экстракта и клеточной стенки) регулировать антагонистическую активность различных видов штаммов-антагонистов по отношению к различным видам индикаторных культур бактерий.
Способ осуществляют следующим образом.
Выбирают исследуемую культуру микроорганизмов, у которой будет изучаться способность регулировать антагонистическую активность штамма-антагониста; штамм-антагонист, у которого будет изучаться регуляция антагонистической активности и индикаторный штамм, по отношению к которому будет изучаться регуляция антагонистической активности штамма-антагониста.
Используя общепринятые в микробиологии и химии методы (Методы химии углеводов. М.: Мир. 1967, Лизоцим. / Составитель У.Я.Каульньи. Рига: Авотс. 1982, Методы общей бактериологии. Т.2. / Под ред. Ф.Герхардта. М.: Мир. 1984) получают клеточные компоненты: экзометаболиты, клеточный экстракт и клеточые стенки исследуемой культуры.
В опыте каждый из клеточных компонентов (экзометаболиты, клеточный экстракт и клеточные стенки) исследуемой культуры смешивают по отдельности в соотношении 1:2 со штаммом-антагонистом, взвешенным в физиологическом 0,9% водном растворе хлорида натрия (ОД=0,2, при λ=492 нм, что соответствовало 109 кл/мл, в 96-луночном планшете, объем пробы 200 мкл).
Параллельно готовят контроль 1 (контроль роста индикаторного штамма) из жидкой питательной среды, используемой для роста исследуемой культуры и физиологического (0,9%) водного раствора хлорида натрия в соотношении 1:2, и контроль 2 (контроль антагонистической активности) из жидкой питательной среды, используемой для роста исследуемой культуры и взвеси штамма-антагониста в физиологическом водном растворе хлорида натрия (ОД=0,2; при λ=492 нм, что соответствовало 109 клеток/мл, объем пробы 200 мкл) в соотношении 1:2.
Опытные и контрольные пробы инкубируют 1 час при 37°С, после чего разбавляют в 4 раза жидкой питательной средой, пригодной для роста штамма-антагониста, вновь инкубируют сутки при 37°С, отделяют супернатант центрифугированием при 3000 об/мин 15 минут, обеззараживают его хлороформом из расчета 0,1 мл на 3 мл культуральной жидкости 20 минут.
Далее в опытных и контрольных пробах определяют выживаемость индикаторного штамма. Для этого готовят на физиологическом растворе взвесь индикаторного штамма из суточной агаровой культуры (ОД=0,15, при λ=492 нм, что соответствовало 107 кл/мл, в 96-луночном планшете, объем пробы 200 мкл). Затем в соотношении 1:2 смешивают взвеси индикаторного штамма с супернатантами опытных и контрольных проб.
Смеси инкубируют 1 час при 37°С, разбавляют в 4 раза жидкой питательной средой, пригодной для роста индикаторного штамма, и культивируют при 37°С.
Производят высев индикаторного штамма на плотную среду, используя метод серийных разведении, сразу и через 24 часа роста индикаторной культуры (для быстрорастущих видов - 6-8 часов), подсчитывают КОЕ и ведут расчет антагонистической активности (АА) в опытных и контрольных пробах по формулам:
где АА - антагонистическая активность микроорганизмов;
А - контроль роста индикаторного штамма, КОЕ t8/КОЕ t0 (контроль 1);
B1 - контроль антагонистической активности, КОЕ t8/КОЕ t0 (контроль 2);
B2 - степень прироста индикаторного штамма, КОЕ t8/КОЕ t0 (опыт).
О способности исследуемых культур микроорганизмов регулировать антагонистическую активность штамма-антагониста судят по ее изменению в опыте по сравнению с контролем. Изменение антагонистической активности рассчитывают по формуле
ΔАА=ААопыт-ААконтроль
При ΔАА, равной нулю регуляция, АА отсутствует, при ΔАА меньше нуля считают исследуемую культуру микроорганизмов способной снижать АА у исследуемого штамма-антагониста, а при ΔАА больше нуля повышается АА.
Таким образом судят о способности исследуемой культуры микроорганизмов регулировать антагонистическую активность бактерий.
Примеры конкретного выполнения.
Пример 1. У исследуемой культуры M.luteus определяли способность регулировать антагонистическую активность E.faecalis по отношению к S.aureus.
Получали клеточные компоненты исследуемой культуры: экзометаболиты, клеточный экстракт и клеточные стенки.
Для получения экзометаболитов суточную бульонную культуру M.luteus центрифугировали при 3000 об/мин 15 минут, отбирали супернатант, обеззараживали его хлороформом 20 минут (на 3 мл супернатанта 0,1 мл), центрифугировали при 3000 об/мин 15 минут и снова отбирали супернатант.
Для получения клеточного экстракта осадок, полученный после центрифугирования суточной бульонной культуры M.luteus, дважды отмывали физ.раствором, доводили МПБ до изначальной мутности (ОД=0,15, при λ=492 нм, в 96-луночном планшете, объем пробы 200 мкл), подвергали однократной заморозке
(-20°С) - отморозке (37°С), обеззараживали хлороформом 20 минут (на 3 мл супернатанта 0,1 мл), центрифугировали при 3000 об/мин 15 минут и отбирали супернатант.
Клеточную стенку получали путем последовательной обработки биомассы исследуемой культуры M.luteus смесью этилового спирта и хлороформа (3:1), 2М водным раствором гидроксида натрия, кислым раствором трипсина в концентрации 100 мкг/мл (после нейтрализации щелочи 3,5% раствором соляной кислоты), этиловым спиртом, ацетоном. Ацетоновый раствор клеточной стенки M.luteus высушивали при комнатной температуре, затем ресуспендировали в МПБ до изначальной мутности (ОД=0,15, при λ=492 нм, в 96-луночном планшете, объем пробы 200 мкл) и обеззараживали автоклавированием при 0,5 атм 30 минут.
Затем клеточные компоненты (экзометаболиты, клеточный экстракт и клеточные стенки) M.luteus смешивали в соотношении 1:2 (0,5 мл: 1 мл) с штаммом-антагонистом E.faecalis, взвешенным в физиологическом 0,9% водном растворе хлорида натрия (ОД=0,2, при λ=492 нм, что соответствовало 109 кл/мл, в 96-луночном планшете, объем пробы 200 мкл). Параллельно готовили контроль 1 (контроль роста индикаторного штамма) из жидкой питательной среды (МПБ), используемой для роста исследуемой культуры M.luteus и физиологического (0,9%) водного раствора хлорида натрия в соотношении 1:2, и контроль 2 (контроль антагонистической активности) из жидкой питательной среды, используемой для роста исследуемой культуры M.luteus и взвеси штамма-антагониста E.faecalis в физиологическом водном растворе хлорида натрия (ОД=0,2, при λ=492 нм, что соответствовало 109 клеток/мл, объем пробы 200 мкл) в соотношении 1:2.
Опытные и контрольные пробы инкубировали 1 час при 37°С, после чего разбавляли в 4 раза МПБ (6 мл) и вновь инкубировали сутки при 37°С, отделяли супернатант центрифугированием при 3000 об/мин 15 минут, обеззараживали его хлороформом из расчета 0,1 мл на 3 мл культуральной жидкости.
Далее в опытных и контрольных пробах определяли выживаемость индикаторного штамма S.aureus. Для этого готовили на физиологическом растворе взвесь индикаторного штамма S.aureus из суточных агаровых культур (ОД=0,15, при λ=492 нм, что соответствовало 107 кл/мл, в 96-луночном планшете, объем пробы 200 мкл).
Затем смешивали 0,5 мл взвеси индикаторного штамма S.aureus с 1 мл супернатантов опытных и контрольных проб.
Расчет антагонистической активности (АА) в опытных и контрольных пробах вели по формулам
где АА - антагонистическая активность микроорганизмов;
А - контроль роста индикаторного штамма S.aureus, КОЕ t8/КОЕ t0 (контроль 1);
B1 - контроль антагонистической ативности, КОЕ t8/КОЕ t0, (контроль 2) при действии культуральной жидкости исследуемого штамма-антагониста E.faecalis, обработанного МПБ;
В2 - степень прироста индикаторного штамма S.aureus, КОЕ t8/КОЕ t0 (опыт) при действии культуральной жидкости исследуемого штамма-антагониста E.faecalis, обработанного одним из компонентов исследуемой культуры M.luteus.
О способности исследуемой культуры M.luteus регулировать антагонистическую активность E.faecalis судили по ее изменению в опыте по сравнению с контролем антагонистической активности. Изменение антагонистической активности рассчитывают по формуле
ΔАА-ААопыт-ААконтроль
Результаты выполнения и расчеты антагонистической активности E.faecalis по отношению к S.aureus под действием клеточных компонентов М. luteus следующие.
КОЕ t0 (S.aureus) в контроле роста индикаторного штамма (контроль 1) равно 244·104.
КОЕ t8 (S.aureus) в контроле роста индикаторного штамма (контроль 1) равно 480·106.
Контроль роста индикаторного штамма S.aureus (контроль 1):
А=КОЕ t8/КОЕ t0=(480·106)/(244·104)=197·102.
КОЕ t0 (S.aureus) в контроле антагонистической активности E.faecalis (контроль 2) равно 272·104.
КОЕ t8 (S.aureus) в контроле антагонистической активности E.faecalis (контроль 2) равно 490·106.
Контроль антагонистической активности E.faecalis (контроль 2):
B1=КОЕ t8/КОЕ t0=(490·106)/(272·104)=180·102;
КОЕ t0 (S.aureus) степени прироста индикаторного штамма (опыт) (рост E.faecalis с экзометаболитами M.luteus) равно 256·104.
КОЕ t8 (S.aureus) степени прироста индикаторного штамма (опыт) (рост E.faecalis с экзометаболитами M.luteus) равно 520·106.
Степень прироста индикаторного штамма S.aureus (опыт) (рост E.faecalis с экзометаболитами M.luteus)
В2=КОЕ t8/КОЕ t0=(520·106)/(256·104)=203·102;
При отрицательном значении ААопыт судят об отсутствии антагонистической активности, что говорит о полном ингибировании антагонистической активности, наблюдаемой в контроле.
КОЕ t0 (S.aureus) степени прироста индикаторного штамма (опыт) (рост E.faecalis с клеточным экстрактом M.luteus) равно 252·104.
КОЕ t8 (S.aureus) степени прироста индикаторного штамма (опыт) (рост E.faecalis с клеточным экстрактом M.luteus) равно 500·106.
Степень прироста индикаторного штамма S.aureus (опыт) (рост E.faecalis с клеточным экстрактом M.luteus)
B2=КОЕ t8/КОЕ t0=(500·106)/(252·104)=198·102;
При отрицательном значении ААопыт судят об отсутствии антагонистической активности, что говорит о полном ингибировании антагонистической активности, наблюдаемой в контроле.
КОЕ t0 (S.aureus) степени прироста индикаторного штамма (опыт) (рост E.faecalis с фрагментами клеточной стенки M.luteus) равно 240·104. КОЕ t8 (S.aureus) степени прироста индикаторного штамма (опыт) (рост E.faecalis с фрагментами клеточной стенки M.luteus) равно 350·106.
Степень прироста индикаторного штамма S.aureus (опыт) (рост E.faecalis с фрагментами клеточной стенки M.luteus)
В2=КОЕ t8/КОЕ t0=(350·106)/(240·104)=146·102;
ΔАА=ААопыт-ААконтроль=26-8,6=17,4;
ΔАА равно 17,4, что больше нуля и означает повышение АА на 17,4%.
Установлено регулирующее действие M.luteus на антагонистическую активность E.faecalis по отношению к S.aureus. Влияние фрагментов клеточной стенки M.luteus на антагонистическую активность E.faecalis сводилось к ее увеличению по отношению к S.aureus, в то время как под действием экзометаболитов и клеточного экстракта M.luteus наблюдали снижение АА E.faecalis, вплоть до ее полного ингибирования.
Предлагаемый способ позволяет определять способность исследуемых культур микроорганизмов регулировать антагонистическую активность бактерий, в частности роль отдельных клеточных компонентов исследуемых культур микроорганизмов (экзометаболитов, клеточного экстракта и клеточной стенки) в ее регуляции, что дает возможность подбирать потенциальные препараты или их источник для стимулирования колонизационной резистентности организма и подбирать биологические условия для увеличения выхода антимикробных факторов.
Способ определения способности микроорганизмов регулировать антагонистическую активность бактерий, заключающийся в том, что из исследуемой культуры микроорганизмов получают экзометаболиты, клеточный экстракт и клеточные стенки, обеззараживают их хлороформом из расчета 0,1 мл на 3 мл клеточных компонентов, смешивают каждый из выделенных клеточных компонентов со штаммом-антагонистом в соотношении 1:2, параллельно готовят две контрольные пробы, при этом контроль 1 готовят из жидкой питательной среды и физиологического раствора, а в контроль 2 - из жидкой питательной среды и штамма -антагониста, опытные и контрольные пробы инкубируют, разбавляют жидкой питательной средой, инкубируют, отделяют супернатанты центрифугированием, обеззараживают их хлороформом из расчета 0,1 мл на 3 мл супернатанта, затем смешивают с взвесью индикаторного штамма, инкубируют, разбавляют жидкой питательной средой, высевают индикаторный штамм на плотную питательную среду, культивируют, затем подсчитывают КОЕ в опытных и контрольных пробах, рассчитывают антагонистическую активность штамма-антагониста и по изменению антагонистической активности в опытных пробах по сравнению с контролем судят о способности исследуемой культуры микроорганизмов регулировать антагонистическую активность бактерий.