Применение окиси углерода для улучшения результата тканевой и органной трансплантации и подавления апоптоза
Иллюстрации
Показать всеНастоящее изобретение относится к способам трансплантации органов, тканей и индивидуальных клеток, а также к способам поддержания клеток in vitro и повышения выживаемости и/или функциональности донорского органа, ткани или клетки после трансплантации. Указанные способы включают в себя введение окиси углерода в эффективном количестве, достаточном для повышения выживаемости и/или функциональности клетки. Изобретение также относится к применению окиси углерода для поддержания животной клетки перед трансплантацией и для лечения или предупреждения отторжения трансплантированного органа или ткани. 19 н. и 50 з.п. ф-лы, 4 табл., 12 ил.
Реферат
Заявлено в качестве исследования, получившего финансовую поддержку федеральных властей
Настоящее изобретение осуществлено в Национальном Институте Здоровья при Правительственной поддержке, Грант № HL586688. Указанное Правительство обладает определенными правами на данное изобретение.
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к области повышения клеточной жизнеспособности.
Предпосылки изобретения
Газ окись углерода (СО) в высоких концентрациях обладает губительным действием. Вместе с тем, в настоящее время он известен в качестве важной сигнальной молекулы (Verma et al., Science 259:381-384, 1993). Предполагается также, что окись углерода действует в головном мозге в качестве молекулы-посредника (там же) и в качестве нейроэндокринного модулятора в гипоталамусе (Pozzoli et al., Endocrinology 735:2314-2317, 1994). Подобно окиси азота (NO), окись углерода является релаксантом гладких мышц (Utz et al., Biochem. Pharmacol. 47:195-201, 1991; Christodoulides et al., Circulation 97:2306-9, 1995) и подавляет агрегацию тромбоцитов (Mansouri et al., Tromb. Haemost. 48:286-8, 1982). Ингаляция малым количеством СО оказывает противовоспалительное действие, как показано на некоторых животных моделях.
Трансплантация клеток-островков стимулирует эффективное лечение диабета I типа (Lacy et al., Annu. Rev. Immunol. 2:183-98; Weir et al., J. Am. Optom. Assoc. 69:727-32, 2000; Berney et al., Langenbechs Arch. Surg. 385:378-8, 2000; Shapiro et al., N. Engl. J. Med. 343:230-8, 2000). Но осуществить способы клинической трансплантации островков по ряду причин трудно. Одной из таких причин является первичная нефункциональность (PNF) данного трансплантата. Другая причина заключается в том, что для успешного лечения диабета требуется большое количество донорских островков (Shapiro et al., N. Engl. J. Med. 343:230-8, 2000). Обе ситуации отражают одну и ту же патофизиологию: в основном потеря клеток в трансплантате происходит в первые недели после трансплантации. После трансплантации островки подвергаются воздействию различных стрессовых факторов, таких, например, как гипоксия перед вторичной васкуляризацией (Carlsson et al., Diabetes 47:1027-32, 1998), и подвергаются воздействию предвоспалительных цитокинов, а также свободных радикалов, высвобождаемых из макрофагов в микроокружение трансплантата (Rabinovitch et al., Diabetes 48:1223-9, 1999; Kaufman et al., J. Exp. Med. 772:291-302, 1990; Corbett et al., Proc. Natl. Acad. Sci. USA 90:1731-5, 1993) и из макрофагов резидентных островков (Mandrup-Poulsen et al., J. Immunol. 739:4077-82, 1987; Arnush et al., J. Clin. Invest. 702:516-26, 1998). Токсические эффекты иммунодепрессивных лекарственных средств, и, кроме того, отторжение (Weir et al., Diabetes 46:1247-56, 1997) также содействуют потере клеток-островков. Существование PNF после экспериментальной трансплантации сингенных островков (Nagata et al., Transplant Proc. 22:855-6, 1990; Arita et al., Transplantation 65:1429-33, 1998) свидетельствует о том, что неспецифическое воспаление играет главную роль в данном сценарии.
Считается, что жизнеспособность трансплантируемого органа связана, главным образом, с успешной иммуносупрессией в виде блокирования иммунного ответа, который ведет к отторжению трансплантата. Однако ранее было показано, что трансплантируемые органы могут сами защищать себя от васкулярного повреждения, приводящего к отторжению в результате экспрессии "протективных генов" (см., например, Bach et al., Nature Med. 3:196-202 (1997); и Soares et al., Nature Med. 4:1073-1077, 1998). Один из таких генов, ген гемоксигеназы-1 (HO-1), катаболизирует гем на биливердин, свободное железо и СО (Tenhunen et al., Proc. Natl. Acad. Sci. USA 61:748-755, 1968).
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩЕСТВА НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение основано отчасти на том наблюдении, что СО способствует выживаемости и/или функциональности органа, ткани и индивидуальных клеточных трансплантатов.
В соответствии с этим, первой целью настоящего изобретения является создание способа введения донору трансплантата фармацевтической композиции, содержащей окись углерода, получение органа, ткани или клеток у этого донора и трансплантацию указанного органа, ткани или клеток реципиенту, причем количество окиси углерода, вводимой донору, является достаточным для повышения жизнеспособности или функции данного органа, ткани или клеток после их трансплантации реципиенту.
Указанную фармацевтическую композицию можно вводить живому донору, донору, мозг которого утратил биологическую активность, или же донору перед или после утраты мозгом биологической активности.
Необязательно орган донора можно in situ и/или ex vivo обработать фармацевтической композицией, содержащей окись углерода.
Способ может также включать или альтернативно включать в себя стадию введения реципиенту второй фармацевтической композиции, которая содержит окись углерода, до и/или во время и/или после стадии трансплантации органа или ткани реципиенту.
В данном или в любом из описанных здесь способов, орган или ткань могут представлять собой любой орган или ткань, которые можно трансплантировать, например, печень, почку, сердце, поджелудочную железу, легкое, тонкую кишку и/или кожу, а используемый донор может по видовой принадлежности отличаться от реципиента, либо донор и реципиент могут относиться к одному и тому же виду. Донор и реципиент могут относиться либо к животным, не являющимся человеком, либо являться человеком. Альтернативно, донор может относиться к животным, которые не принадлежат человеческому роду, таким как свинья, а реципиент может быть человеком.
В другом аспекте настоящее изобретение заключается в создании способа трансплантации органа, ткани или клеток, который подразумевает получение от донора органа, ткани или клеток, введение ex vivo или in situ в орган, ткань или клетки фармацевтической композиции, которая содержит окись углерода, и трансплантацию обработанных органа, ткани, или клеток реципиенту, причем количество окиси углерода является достаточным для повышения жизнеспособности или функции этих органа, ткани или клеток у реципиента. В одном из вариантов осуществления настоящего изобретения данную фармацевтическую композицию вводят путем перфузии органа или ткани in situ, пока этот орган или эта ткань находятся у донора.
Факультативно, данный способ может включать в себя стадию введения реципиенту второй фармацевтической композиции, содержащей окись углерода, перед и/или во время и/или после трансплантации данного органа или ткани реципиенту.
Еще один аспект настоящего изобретения связан с созданием способа трансплантации органа, ткани или клеток, который включает в себя стадии получения органа, ткани или клеток донора, трансплантацию полученного органа, ткани или клеток реципиенту, и перед и/или во время и/или же после стадии трансплантации указанного органа, ткани или клеток реципиенту, введение этому же реципиенту количества фармацевтической композиции, содержащей окись углерода, достаточного для повышения выживаемости и/или функциональности трансплантируемого органа, ткани или клеток у реципиента.
В одном из вариантов осуществления настоящего изобретения фармацевтическую композицию можно вводить реципиенту в интервале от 0 до 20 дней, например, в 1, 2, 4, 6, 8, 10, 12, 14, 18, или 20-й день, после того, как указанному реципиенту трансплантировали указанный орган. В другом варианте осуществления настоящего изобретения фармацевтическую композицию вводят реципиенту по меньшей мере единовременно, например, несколько раз или непрерывно, начиная с 21-го дня после стадии трансплантации органа или ткани реципиенту до тех пор, пока будет обеспечена выживаемость трансплантата. Фармацевтическую композицию можно вводить реципиенту для выяснения того, подвергается ли трансплантированный орган или ткань отторжению или же трансплантат близок к отторжению, например, хроническому отторжению или острому отторжению.
Факультативно, способ согласно изобретению может дополнительно включать в себя стадию введения донору второй фармацевтической композиции, содержащей окись углерода, перед получением органа, ткани или клеток этого донора. Вторую фармацевтическую композицию можно вводить живому донору или донору, мозг которого утратил биологическую активность.
Способ согласно изобретению может включать в себя стадию введения в орган донора in situ и/или ex vivo второй фармацевтической композиции, содержащей окись углерода.
В другом аспекте настоящее изобретение связано с созданием способа повышения жизнеспособности и/или функционирования донорского органа, ткани или клетки, который включает в себя получение органа, ткани или клетки от донора, находящегося в маргинальном состоянии, и экспонирование полученного органа, ткани или клетки с количеством, содержащей окись углерода фармацевтической композиции, достаточным для повышения жизнеспособности и/или функционирования полученного донорского органа, ткани или клетки.
В другом аспекте настоящее изобретение связано со способом поддержания животной клетки in vitro, который включает в себя обеспечение сосуда, содержащего герметизированный газ, который содержит газ окись углерода, получение выделенной клетки in vitro, где клетка представляет собой первичную клетку или стволовую клетку, высвобождение сжатого газа из указанного сосуда для образования атмосферы, которая включает в себя газ окись углерода, и поддержание указанной животной клетки in vitro в присутствии атмосферы, которая включает в себя газ окись углерода.
При необходимости клетку можно затем трансплантировать реципиенту. Клетка может быть получена у донора, который не является реципиентом, либо ее можно получить у указанного реципиента. Кроме того, композицию окиси углерода можно вводить реципиенту перед и/или во время, и/или после стадии трансплантации. Такая композиция обычно представлена в виде вдыхаемого газа.
В другом варианте осуществления настоящего изобретения указанную животную клетку получают у донора способом, который включает в себя введение донору композиции, содержащей окись углерода, и получение клетки из ткани этого донора.
В настоящем изобретении создан также способ поддержания in vitro животной клетки, который включает в себя создание культуральной среды, содержащей эффективное количество окиси углерода, например, по меньшей мере 0,0001 г СО/100 г среды, и поддержание выделенной клетки в среде. Эта среда может содержать, например, по меньшей мере 0,0002, 0,0004, 0,0006, 0,0008, 0,0010, 0,0013, 0,0014, 0,0015, 0,0016, 0,0018, 0,0020, 0,0021, 0,0022, 0,0024, 0,0026, 0,0028, 0,0030, 0,0032, 0,0035, 0,0037, 0,0040, 0,0042, или 0,0044 г СО/100 г среды.
Кроме того, в настоящем изобретении создан способ повышения выживаемости животной клетки после изъятия ее у донора, который включает в себя введение живому донору или донору после смерти его мозга, фармацевтической композиции, содержащей окись углерода, и получение выделенной у донора клетки. Фармацевтическая композиция может быть представлена, например, в виде герметизированного газа, пригодного для вдыхания донором.
Способ может дополнительно включать в себя стадию поддержания in vitro указанной клетки в присутствии второй композиции, содержащей окись углерода.
Вместе с тем, клетка in vitro может быть помещена в жидкую среду. В таком случае стадию экспонирования этой клетки со второй композицией, содержащей окись углерода, можно осуществить путем обеспечения источника герметизированного газа окиси углерода и контактирования жидкой среды с газом окисью углерода, высвобождаемого из этого источника. Сама жидкая среда может быть также получена в виде композиции окиси углерода, т.е. растворенной в ней окиси углерода.
Далее, в настоящем изобретении создан способ трансплантирования животной клетки, который включает в себя стадии введения живому донору или донору после смерти мозга, фармацевтической композиции, содержащей окись углерода, получения выделенной у донора клетки и трансплантирования этой клетки реципиенту. Животную клетку можно получить от донора, который не является реципиентом, или ее можно получить от реципиента. При необходимости, композицию окиси углерода можно вводить реципиенту перед и/или во время и/или после стадии трансплантации.
В настоящем изобретении создан также способ повышения выживаемости или функциональности животной клетки, трансплантируемой реципиенту, который включает в себя стадии трансплантации животной клетки реципиенту перед, во время и/или после стадии трансплантации, при этом реципиент должен вдыхать объем газа окиси углерода, достаточный для повышения у данного реципиента выживаемости или функциональности трансплантированной клетки. Газ окись углерода может поставляться в емкости, содержащей герметизированный газ, который содержит окись углерода. В одном из вариантов осуществления настоящего изобретения выделенную клетку перед стадией трансплантации поддерживают in vitro в газовой среде, содержащей окись углерода. Например, выделенную животную клетку можно поддерживать в жидкой среде, которая включает в себя по меньшей мере 0,0001 г окиси углерода/100 г среды (например, по меньшей мере, около 0,0002, 0,0004, 0,0006, 0,0008, 0,0010, 0,0013, 0,0014, 0,0015, 0,0016, 0,0018, 0,0020, 0,0021, 0,0022, 0,0024, 0,0026, 0,0028, 0,0030, 0,0032, 0,0035, 0,0037, 0,0040, 0,0042, или 0,0044 г СО/100 г среды).
Способ может необязательно включать в себя перед стадией трансплантации, стадию экспонирования выделенной клетки с композицией окиси углерода ex vivo.
Газ окись углерода можно вводить реципиенту перед и/или во время и/или после стадии трансплантации. Данную животную клетку можно получить от донора, который не является реципиентом, либо ее можно получить от реципиента. Фармацевтическую композицию, включающую в себя окись углерода, можно вводить донору перед и/или во время удаления указанной клетки из донора.
Другой аспект настоящего изобретения связан со способом, улучшающим выживаемость трансплантированной клетки у реципиента, включающим в себя введение реципиенту перед и/или во время, и/или после трансплантации указанной клетки эффективного количества фармацевтической композиции, содержащей газ окись углерода.
В любом из вышеуказанных способов согласно изобретению эффект выживаемости можно усилить путем индукции у донора или у реципиента фермента гемоксигеназы-1 (HO-1), например, индуцированной гемом, тяжелыми металлами, цитокинами, гормонами, окисью азота, эндотоксинами, УФ-облучением, истощением глутатиона; или с помощью теплового шока. У донора такая индукция может происходить перед или во время удаления органа, ткани, или клеток. У реципиента такая индукция может происходить перед, во время или после трансплантации. Альтернативно, указанный фермент может быть индуцирован в органе, ткани, или в клетках ex vivo перед их трансплантацией реципиенту.
В настоящем изобретении создано также промышленное изделие, которое включает в себя емкость, содержащую герметизированный газ, который содержит по меньшей мере 0,001 ppm, например, по меньшей мере, около 1, 10, 50, 100, 150, 200, 250, 300, 500, 1000, 2000, 5000, 10000, 100000, 200000, 300000, 400000, 500000 и вплоть до 1000000 ppm окиси углерода, и этикетку, на которой описано применение газа для повышения жизнеспособности выделенных животных клеток, тканей или островков перед, во время или после трансплантации пациенту указанных клеток, тканей или островков.
Кроме того, в настоящем изобретении представлена стерильная клеточная среда, которая содержит питательные вещества, пригодные для поддержания животной клетки в культуре, и по меньшей мере около 0,0001 г окиси углерода/100 г среды, например, по меньшей мере 0,0002, 0,0004, 0,0006, 0,0008, 0,0010, 0,0013, 0,0014, 0,0015, 0,0016, 0,0018, 0,0020, 0,0021, 0,0022, 0,0024, 0,0026, 0,0028, 0,0030, 0,0032, 0,0035, 0,0037, 0,0040, 0,0042, или 0,0044 г СО/100 г среды. Она может содержать также животные клетки.
Создан также способ поддержания животной клетки in vitro и последующей ее трансплантации. Данный способ включает в себя стадии обеспечения емкости, содержащей герметизированный газ, содержащий газ окись углерода; получение отдельной животной клетки in vitro, причем указанную клетку помещают в среду, которая содержит растворенную окись углерода; высвобождение герметизированного газа из данной емкости с образованием газовой атмосферы, содержащей газ окись углерода; поддержание животной клетки в присутствии газовой среды и трансплантацию этой клетки реципиенту.
В любом из вышерассмотренных аспектов или вариантов осуществления настоящего изобретения рассматриваемая клетка может представлять собой любую клетку. Например, клетка может быть животной клеткой, такой как первичная, клетка, вторичная клетка или клеточная линия. В качестве другого примера, рассматриваемая клетка может быть частью островка поджелудочной железы, например, β-клетку. Рассматриваемая клетка может также быть, например, печеночной клеткой, фибробластом, клеткой костного мозга, нейронной клеткой, миоцитом, лимфоцитом, или стволовой клеткой. В каждом из ех vivo-способов согласно изобретению ткань предпочтительно не является кровью и содержит незначительное количество, если вообще содержит, цельной крови, а клетки предпочтительно не являются эритроцитами и не содержат существенное количество эритроцитов.
Если не оговорено особо, все используемые здесь технические и научные термины имеют то же значение, что и общепринятые специалистами в данной области, к которой относится настоящее изобретение. Хотя в настоящем изобретении могут быть практически использованы и опробованы способы и материалы, аналогичные или эквивалентные описанным здесь способам и материалам, использованные здесь способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие упомянутые здесь ссылки считаются включенными в настоящее описание во всей их полноте. В случае конфликтной ситуации настоящее описание, в том числе и определения, будут обоснованы. Представленные материалы, способы и примеры служат только для иллюстрации изобретения и не подразумевают его ограничения.
Другие характерные особенности и преимущества настоящего изобретения очевидны из нижеследующего подробного описания, а также из формулы изобретения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
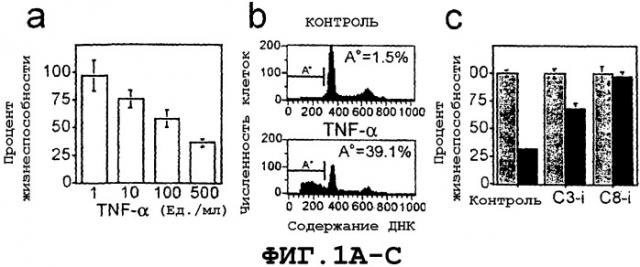
На Фиг.1А представлена гистограмма, которая иллюстрирует эффект обработки клеток βТС3 увеличивающимися концентрациями TNF-α.
На Фиг.1В представлена графическая иллюстрация FACScanTM-анализа фрагментации ДНК в βТС3-клетках после обработки TNF-α.
На Фиг.1С представлена гистограмма, которая иллюстрирует эффект котрансфекции βТС3-клеток вектором экспрессии β-gal (pcDNA3/β-gal), и контроль (pcDNA3), а также их обработку либо ингибитором каспазы-3 Z-DEVD-FMK (C3-i), либо ингибитором каспазы-8 IETD-CHO (C8-i). Гистограммы серого цвета соответствуют необработанным β-клеткам, а гистограммы черного цвета соответствуют β-клеткам, обработанным в течение 24 часов TNF-α. Полученные результаты представляют собой средние значения для повторных лунок ± стандартное отклонение, соответствующие одному из трех репрезентативных экспериментов.
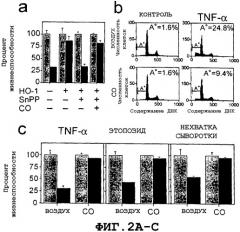
На Фиг.2А представлена гистограмма, показывающая, что экзогенной окисью углерода можно заменить HO-1 (гемоксигеназу-1) в тех случаях, когда активность HO-1 блокируется. Гистограммы серого цвета соответствуют необработанным β-клеткам, а гистограммы черного цвета соответствуют β-клеткам, обработанным TNF-α или этопозидом, либо подвергнуты сывороточной депривации. Полученные результаты представляют собой средние значения для повторных лунок ± стандартное отклонение, соответствующие одному из трех репрезентативных экспериментов.
На Фиг.2В графически представлен FACScanTM-анализ фрагментации ДНК в клетках βТС3 после 24-часовой обработки окисью углерода после обработки TNF-α.
На Фиг.2С представлена гистограмма, показвающая, что экзогенная окись углерода защищает β-клетки от апоптоза в отсутствие HO-1. βТС3-клетки трансфицировали векторами экспрессии β-gal и экспонировали с экзогенной окисью углерода. Гистограммы серого цвета соответствуют необработанным β-клеткам, а гистограммы черного цвета соответствуют β-клеткам, обработанным TNF-α или этопозидом, либо подвергнутым, как указано, сывороточной депривации. Полученные результаты представляют собой средние значения, полученные в повторных лунках ± стандартное отклонение, соответствующие одному из трех репрезентативных экспериментов.
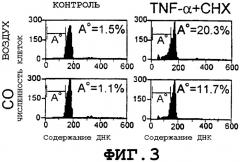
На Фиг.3 представлены результаты анализа фрагментации ДНК с помощью FACScanTM, которые свидетельствуют о том, что экзогенная окись углерода защищает островки Лангерганса у мышей от апоптоза. CHX = циклогексимид.
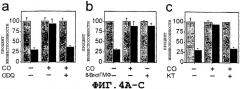
На Фиг.4А представлена гистограмма, показывающая, что антиапоптозный эффект экзогенной окиси углерода опосредован активацией гуанилатциклазы. ODQ = гуанилилциклазный ингибитор ODQ.
На Фиг.4В представлена гистограмма, показывающая, что аналог цГМФ можно заменить окисью углерода для защиты клеток от апоптоза. 8-Br-цГМФ = аналог 8-Br-цГМФ.
На Фиг.4С представлена гистограмма, поясняющая, что цГМФ-зависимая протеинкиназа (cGK) опосредует антиапоптотический эффект окиси углерода. Клетки βТС3 котрансфицировали вектором экспрессии β-gal. На Фигурах 4А-С гистограммы серого цвета соответствуют необработанным β-клеткам, гистограммы черного цвета соответствуют β-клеткам, обработанным TNF-α. Полученные результаты представляют собой средние значения для повторных лунок ± стандартное отклонение, соответствующие одному из трех репрезентативных экспериментов. KT=KT5823, ингибитор протеинкиназы G.
На Фиг.5А представлена гистограмма, показывающая, что экспонирования в течение одного часа окиси углерода достаточно для предотвращения апоптоза.
На Фиг.5В представлена гистограмма, показывающая, что окись углерода защищает β-клетки после индукции апоптоза.
На Фиг.5С представлена гистограмма, показывающая, что преинкубация с окисью углерода предотвращает апоптоз β-клеток. На Фигурах 5А-С гистограммы серого цвета соответствуют необработанным β-клеткам, а гистограммы черного цвета соответствуют β-клеткам, обработанным TNF-α. Полученные результаты представляют собой средние значения для повторных лунок ± стандартное отклонение, соответствующие одному из трех репрезентативных экспериментов.
На Фиг.6 представлен линейный график, свидетельствующий о том, что экспонирование мышиных островков окиси углерода повышает их выживаемость и функциональность после трансплантации.
На Фиг.6В представлен линейный график, который показывает вероятность выздоровления (уровень глюкозы крови ниже 200 мг/дл) животных, получивших предварительно экспонированные окиси углерода островки или контрольные островки. *Р=0,001 против контроля.
На Фиг.7 представлена гистограмма, которая иллюстрирует экспрессию HO-1 в мышиных сердцах, трансплантированных крысам, обработанным CVF и CsA. Мышиные сердца трансплантировали крысам, обработанным во время трансплантации фактором яда кобры (CVF), и после трансплантации ежедневно обрабатываемым циклоспорином А (CsA). Экспрессию мРНК HO-1 и β-актина определяли с помощью RT-PCR. Символом -/- обозначена РНК HO-1 мышиных сердец, используемых в качестве негативного контроля. Гистограммы соответствуют относительному уровню экспрессии мРНК HO-1 по отношению к экспрессии мРНК β-актина.
На Фиг.8 представлена группа гистограмм, свидетельствующих о том, что SnPPIX ингибирует in vivo ферментативную активность HO-1. Мышиные сердца трансплантировали необработанным крысам (II) или крысам, обработанным CVF и CsA (III) плюс FePPIX (IV) или SnPPIX (V). Общую активность HO измеряли в сердечной ткани донора и реципиента через 2 дня после трансплантации и сравнивали с исходной активностью HO в сердечной ткани, соответственно, нормальной мыши и нормальной крысы (I). Полученные результаты представляют собой средние значения по трем животным на каждую обработку ± стандартное отклонение (SD). Статистический анализ осуществляли с использованием непарного t-критерия Вэлша.
На Фиг.9 представлена серия кривых, свидетельствующих о том, что SnPPIX и FePPIX не препятствуют образованию антител к трансплантатам (AT). Мышиные сердца трансплантировали крысам, обработанным CVF и CsA, как указано выше. Уровень антисыворотки с IgM к трансплантату оценивали с помощью клеточного ELISA. Связывание С3-компонента комплемента с мышиными эндотелиальными клетками оценивали с помощью клеточного ELISA. Гемолитическую активность комплемента (CH50) оценивали с помощью стандартного анализа гемолиза. Полученные результаты представляют собой среднее ± SD (n=3).
На Фиг.10А представлена серия гистограмм, свидетельствующих о том, что экзогенная СО не влияет на способность SnPPIX вызывать супрессию ферментативной активности HO-1. Мышиные сердца трансплантировали крысам, обработанным CVF плюс CsA плюс SnPPIX (II) или SNPPIX и CO (III). Общую активность HO измеряли в сердечной ткани доноров и реципиентов, а также в печени реципиентов через 2 дня после трансплантации. Активность HO разных образцов сравнивали с исходной активностью HO нормальных мышиных сердец (I), крысиных сердец (I) или печени (I), в соответствии с анализируемым образцом. Полученные результаты представляют собой среднее по трем животным при каждой обработке ± SD. Статистический анализ осуществляли с помощью t-критерия Вэлша.
На Фиг.10В представлена гистограмма, свидетельствующая о том, что экзогенная СО не влияет на способность SnPPIX вызвать супрессию активности HO-1. У животных, используемых для получения данных Фиг.10А, определяли содержание карбоксигемоглобина через 2 дня после трансплантации. Полученные результаты представляют собой средние значения ± SD (n=3).
На Фиг.11 представлен линейный график, свидетельствующий о том, что повышенное содержание HO-1 в эндотелиальных клетках подавляет активацию тромбоцитов. Эндотелиальные клетки мышей 2F-2B оставляли необработанными (NT) или обрабатывали CoPPIX (50 мкМ, 16 ч) для повышения активности HO-1, SnPPIX - для супрессии активности HO-1 (50 мкМ, 16 ч) или CoPPIX (50 мкМ, 12 ч) плюс SnPPIX (50 мкМ, 4 ч) - для контроля специфичности CoPPIX в повышении активности HO-1. Крысиные тромбоциты выделяли, накладывали на мышиные эндотелиальные клетки на 5 мин, и тестировали агрегацию после стимуляции под действием 2 мкМ аденозиндифосфата (AДФ).
На Фиг.12 представлена гистограмма, свидетельствующая о том, что окись углерода вызывает супрессию апоптоза эндотелиальных клеток. Гистограммы серого цвета соответствуют клеткам, обработанным одним лишь Act.D, а гистограммы черного цвета соответствуют клеткам, обработанным Act.D плюс TNF-α. Где указано, эндотелиальные клетки обрабатывали SnPPIX (50 мкМ) и экспонировали с экзогенной СО (10000 частей на миллион (ppm)).
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Используемый здесь термин "окись углерода" (или "СО") относится к молекулярной окиси углерода в ее газообразном состоянии, сжатой до жидкой формы, или растворенной в водном растворе. Используемые во всем описании термины "композиция окиси углерода" и "фармацевтическая композиция, содержащая окись углерода" относятся к газообразной, жидкой, твердой или полужидкой композиции, содержащей окись углерода, которую можно ввести донору-пациенту, трупу или животному; в любой орган; или в часть органа, например, в ткани органа или в отдельную клетку(и), составляющую данный орган, например, нейроны, гепатоциты, миоциты, островки, или островковую клетку, такую как β-клетка поджелудочной железы. Практикующим специалистам очевидно, какая из форм фармацевтической композиции, например, газообразная, жидкая, или и газообразная, и жидкая формы, предпочтительна для конкретного применения.
Используемые здесь термины "эффективное количество" и "эффективное для обработки" относятся к количеству или к концентрации окиси углерода, используемой в течение периода времени (включая острое или хроническое введение, а также периодическое или непрерывное введение), которое эффективно при ее введении для получения предполагаемого эффекта или физиологического результата. Эффективные количества окиси углерода для использования в настоящем изобретении включают в себя, например, количества, которые эффективны для повышения выживаемости и/или улучшения функции органов или клеток in vivo и/или in vitro. В случае трансплантации индивидуальных клеток или совокупности клеток, например, трансплантата доноров и/или реципиентов, эффективное количество окиси углерода представляет собой количество, вводимое в трансплантат донора и/или реципиента, достаточное для повышения жизнеспособности данной клетки или совокупности клеток, например, для снижения потерь клеток, или совокупности клеток, и/или для улучшения эксплуатационных качеств трансплантируемой клетки или совокупности клеток. В случае обработки клеток вне организма, например культивируемых и/или используемых для трансплантации островковых клеток, эффективное количество окиси углерода соответствует такому количеству, в присутствии которого данные клетки инкубируются или хранятся в целях повышения сохранности клеток и/или уменьшения потери клеток, например, потери при апоптозе, и/или для усиления функции. В случае трансплантации органов или тканей, например, трансплантатов доноров и/или реципиентов, эффективное количество окиси углерода соответствует такому количеству, которого при введении в трансплантат донора и/или реципиента достаточно для повышения жизнеспособности органа, ткани или представляющих интерес клеток, например, для уменьшения потерь клеток, из которых состоит орган или ткань, и/или улучшения функциональных свойств любого органа. В случае обработки органов, тканей или клеток ex vivo для их хранения или использования для трансплантации эффективное количество окиси углерода соответствует количеству, достаточному для повышения жизнеспособности и/или функциональности органа или тканей. Используемый здесь термин "ингибирование" включает в себя отсрочку запуска, уменьшение, предотвращение или ослабление биологического процесса, например, апоптоза. В случае газов эффективное количество окиси углерода заключено в основном в диапазоне от приблизительно 0,0000001 масс.% до 0,3 масс.%, например, примерно от 0,0001 масс.% до 0,25 масс.%, предпочтительно по меньшей мере около 0,001%, например, по меньшей мере 0,005%, 0,010%, 0,02%, 0,025%, 0,03%, 0,04%, 0,05%, 0,06%, 0,08%, 0,10%, 0,15%, 0,20%, 0,22%, или 0,24% масс. окиси углерода. Предпочтительные диапазоны окиси углерода составляют примерно от 0,001% до 0,24%, примерно от 0,005% до 0,22%, примерно от 0,01% до 0,20% и примерно от 0,01% до 0,1% по массе. Другие предпочтительные диапазоны составляют примерно от 0,005% до 0,24%, примерно от 0,01% до 0,22%, примерно от 0,15% до 0,20% и примерно от 0,025% до 0,1% по массе. В случае жидких растворов СО эффективные количества обычно составляют примерно от 0,0001 до 0,0044 г СО/100 г жидкости, например, по меньшей мере 0,0002, 0,0004, 0,0006, 0,0008, 0,0010, 0,0013, 0,0014, 0,0015, 0,0016, 0,0018, 0,0020, 0,0021, 0,0022, 0,0024, 0,0026, 0,0028, 0,0030, 0,0032, 0,0035, 0,0037, 0,0040, или 0,0042 г СО/100 г водного раствора. Предпочтительные диапазоны составляют, например, примерно от 0,0010 до 0,0030 г СО/100 г жидкости, примерно от 0,0015 до 0,0026 г СО/100 г жидкости или примерно от 0,0018 до 0,0024 г СО/100 г жидкости. Практикующие специалисты должны принимать во внимание, что, в зависимости от применения, могут использоваться и количества, выходящие за пределы этих диапазонов.
Используемый в данном описании термин "пациент" относится к животному, являющемуся, или не являющемуся человеком, которое обрабатывают в соответствии со способами согласно изобретению. Настоящее изобретение подразумевает применение этого термина также и в ветеринарии. Данный термин включает в себя, не ограничиваясь перечисленным, птиц, рептилий, амфибий и млекопитающих, например, человека, других приматов, свиней, грызунов, таких как мыши и крысы, кроликов, морских свинок, хомяков, коров, лошадей, кошек, собак, овец и коз. Используемый здесь термин "донор" или "донорный пациент" относится к животному (человеку или не человеку) от которого получают орган, ткань или индивидуальные клетки с целью хранения и/или трансплантации пациенту-реципиенту. Используемый здесь термин "реципиент" или "реципиентный пациент" относится к животному (человеку или не человеку), в организм которого могут быть перенесены орган, ткань, совокупность клеток или отдельные клетки.
Термин "диабет" является общим термином, которым обозначает связанные с диабетом нарушения, распознаваемые в данной области, например, сахарный диабет. Сахарный диабет характеризуется неспособностью регулировать уровень глюкозы крови. Два наиболее преобладающих типа диабета известны как диабет типа I и диабет типа II. В случае типа I, или инсулинозависимого диабета (IDDM), поджелудочная железа вырабатывает мало инсулина или вообще его не вырабатывает из-за разрушения продуцирующих инсулин бета-клеток. В случае диабета типа II, или инсулиннезависимого диабета (NIDDM), поджелудочная железа вырабатывает некоторое количество инсулина, но этот инсулин неэффективен. Данный термин включает в себя также бессчетное количество вторичных нарушений, обусловленных диабетом, как острым, так и хроническим, например, связанных с диабетом осложнений, например, гипогликемии и гипергликемии, ретинопатии, ангиопатии, невропатии и нефропатии.
Используемый здесь термин "клетка(и)" или "животная(ые) клетка(и)" относится к любому типу животных клеток, включая клетки, пригодные для трансплантации. Эти клетки, как правило, представляют собой клетки, получаемые от животного-донора, но могут представлять собой и производные от них (вторичные) клетки или даже клетки установленной клеточной линии. Они необязательно трансфицированы ex vivo экспрессирующим вектором, который в некотором отношении изменяет их функцию. Указанные клетки включают в себя, не ограничиваясь перечисленным, островковые клетки, например, клетки, которые составляют часть панкреатического островка, а также клетки печени, фибробласты, клетки костного мозга, миоциты, а также стволовые клетки, и клетки (например, нейроны) центральной нервной системы, включая спинной мозг. Используемый в настоящем описании термин "островковая(ые) клетка(и)" в качестве общего термина подразумевает группы клеток в поджелудочной железе, известных как островки Лангерганса. Островки Лангерганса содержат несколько типов клеток, которые включают в себя, например, β-клетки (которые вырабатывают инсулин), α-клетки (которые производят глюкагоны), γ-клетки (которые вырабатывают соматостатин), F-клетки (которые производят панкреатический полипептид), кишечные аргентаффиноциты (которые продуцируют серотонин), РР-клетки и D1-клетки. Термин "стволовая клетка" является общепринятым термином, который относится к клеткам, обладающим способностью к неограниченному делению в культуре и дающим начало специализированным клеткам. В этот термин включены, например, тотипотентные, плюрипотентные, мультипотентные и унипотентные стволовые клетки, например, нейронные, печеночные, мышечные и гемопоэтические стволовые клетки.
Под "выделенной клеткой" подразумевают клетку, которая удалена из определенной ткани или органа, в которых она (или ее предшественница) встречается в природе. Любую клетку можно лишь частично очистить от ее природного окружения, считая "выделенной". Например, интактный островок Лангерганса считают слагаемым из "выделенных" клеток после того, как островок удаляют из поджелудочной железы и он физически отделяется от других островков. Клетки любого интактного органа, такого как почка или сердце, или неполного органа, такого как фрагмент кровеносного сосуда, не считают "выделенными клетками", поскольку они по-прежнему являются частью данного органа.
Термин "орган(ы)" используется в настоящем описании как общий термин для описания любого анатомического участка или члена, обладающего у животного специфичной функцией. Дополнительно включенными в данное значение этого термина являются существенные части органов, например, когезионные ткани, полученные из любого органа. Такие органы включают в себя, не ограничиваясь перечисленным, почки, печень, сердце, кишечник, например, толстый или тонкий кишечник, поджелудочную железу и легкие. Дополнительно включенными в данное определение являются кости и кровеносные сосуды, например, трансплантаты аорты.
В настоящем описании термин "трансплантация" используется в качестве общего термина для обозначения процедуры имплантации пациенту органа, ткани, совокупности клеток или индивидуальных клеток. Термин "трансплантация" определяют в данной области как перенос живых тканей или клеток от донора реципиенту, с целью сохранения у реципиента функциональной целостности трансплантируемой ткани или клеток (см., например, The Merck Manual, Berkow, Fletcher, and Beers, Eds., Merck Research Laboratories, Rahway, N.J., 1992). В настоящем описании термин "клеточная трансплантация" использ