Молекулярный конъюгат на основе синтетических аналогов люлиберина и его применение в качестве средства доставки днк в клетки гормон-чувствительных опухолей (варианты)
Иллюстрации
Показать всеИзобретение относится к области медицины и может быть использовано как эффективное средство адресной доставки комплексов ДНК с молекулярными конъюгатами в определенные органы и ткани млекопитающих. Техническим результатом изобретения является повышение эффективности воздействия на клетки опухоли, который достигается за счет введения модифицированного сигнала ядерной локализации (NLS), что позволит конъюгатам образовывать комплексы с плазмидной ДНК, содержащей суицидный ген, а также обеспечит более высокую концентрацию конъюгата в ядрах опухолевых клеток, что приводит к усилению цитотоксических свойств доксорубицина. 2 н. и 1 з.п. ф-лы, 5 ил.
Реферат
Изобретение относится к области медицины и может быть использовано как эффективное средство адресной доставки комплексов ДНК с молекулярными конъюгатами в определенные органы и ткани млекопитающих. Основной проблемой генотерапии опухолевых заболеваний является разработка эффективных средств доставки (СД) генетических конструкций в клетки-мишени. Важно, чтобы СД обладали адресованным действием, не были токсичны и иммуногенны для организма, а также не вызывали побочных эффектов. На данный момент не существует оптимальных СД «лечащих» генов, полностью соответствующих выше перечисленным требованиям. Удачным может явиться использование для доставки в клетки чужеродных генетических конструкций невирусных носителей, которые могут применяться неоднократно, поскольку в отличие от вирусных СД они менее токсичны и практически не вызывают иммунного ответа.
Наиболее популярным подходом в этой области является использование молекулярных конъюгатов, состоящих из катионного носителя для конденсации ДНК за счет электростатических взаимодействий и лигандной части, взаимодействующей с клеточными рецепторами и обеспечивающей адресность доставки комплексов ДНК с молекулярными конъюгатами в определенные органы и ткани млекопитающих [1].
Рецепторы к люлиберинам представлены в норме на очень ограниченном числе тканей человека (гипофиз, гонады). Вместе с тем показано, что целый ряд опухолей человека, преимущественно карцином, синтезируют значительное количество рецепторов люлиберина. Данное обстоятельство делает эти рецепторы привлекательными для адресной доставки биологически активных молекул в клетки опухолей [2]. Использование люлиберинов для направленной химиотерапии гормон-чувствительных опухолей широко применяется в клинической практике ряда стран.
Известно использование конъюгатов аналогов люлиберина с различными цитотоксическими агентами (мелфалан, дауномицин, ингибиторы рибосом) для стерилизации животных и борьбы с гормон-зависимыми заболеваниями человека (в том числе гормон-чувствительными опухолями) [3].
Описываемое в данном патенте техническое решение состоит в использовании аналогов люлиберина для адресной доставки биологически активных молекул в клетки с высоким уровнем рецепторов GnRH. К недостаткам описанного решения следует отнести невозможность формирования комплексов плазмидной ДНК с молекулярными конъюгатами на основе аналогов люлиберина и их адресной доставки в опухолевые клетки.
Известно изобретение [4], в котором рассматриваются вопросы разработки структур аналогов люлиберина - агонистов и антагонистов рецепторов люлиберинов, ковалентно сцепленных с различными цитотоксическими агентами, в том числе с доксорубицином. В рамках данного подхода оказались нереализованными возможности, связанные с осуществлением синтеза молекулярных конъюгатов NLS-GnRH, способных формировать комплексы с плазмидной ДНК и адресно доставлять ее в опухолевые клетки, экспрессирующие рецепторы люлиберина.
Известен конъюгат аналогов люлиберина [5], наиболее близкий к предлагаемому изобретению, который используется совместно с цитотоксическим агентом доксирубицином и его производным в целях терапии гормон-чувствительных опухолей.
Недостатком известного конъюгата с агентами является сравнительно невысокая эффективность воздействия на клетки опухоли.
Техническим результатом заявленного изобретения является повышение эффективности воздействия на клетки опухоли.
Указанный технический результат в предлагаемом изобретении достигается за счет введения модифицированного сигнала ядерной локализации (NLS), что позволит конъюгатам образовывать комплексы с плазмидной ДНК, содержащей суицидный ген, а также обеспечит более высокую концентрацию конъюгата в ядрах опухолевых клеток, что, как показывают результаты многочисленных исследований, проведенных в лабораторных условиях Санкт-Петербургского государственного университета, приводит к усилению цитотоксических свойств доксорубицина. Указанный технический результат достигается двумя вариантами заявляемого молекулярного конъюгата.
Указанный технический результат по первому варианту достигается тем, что в молекулярном конъюгате на основе синтетических аналогов люлиберина, включающем катионную составляющую, представляющую собой модифицированный сигнал ядерной локализации Т-антигена вируса SV40, используемый для конденсации плазмидной ДНК, и лигандную составляющую для взаимодействия с опухоль-специфическими рецепторами, в соответствии с заявленным изобретением в качестве лигандной составляющей используют синтетические аналоги люлиберина с формулой X-R1-His-R3-Ser-R5-D-Lys-Leu-Arg-Pro-R10, где R1 - pGlu; R3 - Trp, D-Trp, Pro или D-Pal(3); R5 - Tyr или Arg; R10 - Gly-NH2, D-Ala-NH2 или NH-СН2-СН3; Х - атом водорода или низшая алканоильная группа (С2-С3), обладающие активностью агонистов люлибериновых рецепторов, а катионная составляющая конъюгата имеет структуру H-Pro-Lys-Lys-Lys-Arg-Lys-Val и присоединена к лигандной составляющей через е-аминогруппу D-Lys (R6).
Помимо этого, указанный технический результат достигается тем, что полученную систему молекулярного конъюгата применяют в качестве средства доставки ДНК в клетки гормон-чувствительных опухолей.
Указанный технический результат по второму варианту достигается тем, что в молекулярном конъюгате на основе синтетических аналогов люлиберина, включающем катионную составляющую, представляющую собой модифицированный сигнал ядерной локализации Т-антигена вируса SV40, используемый для конденсации плазмидной ДНК, и лигандную составляющую для взаимодействия с опухоль-специфическими рецепторами, в соответствии с заявленным изобретением в качестве лигандной составляющей используют синтетические аналоги люлиберина с формулой H-D-Lys-Pro-Gly-R2-R3-Ser-Tyr-R6-Leu-Arg-Pro-R10-NH2, где R2 - ароматическая D-аминокислота; R3 - Trp, D-Trp, Pro или D-Pal(3); R6 - D-аминокислота; R10 - Gly-NH2 или D-Ala-NH2, обладающие активностью антагонистов люлибериновых рецепторов, а катионная составляющая конъюгата имеет структуру H-Pro-Lys-Lys-Lys-Arg-Lys-Val и присоединена к лигандной составляющей через s-аминогруппу N-концевого D-Lys.
Кроме того, указанный технический результат достигается тем, что полученную систему молекулярного конъюгата применяют в качестве средства доставки ДНК в клетки гормон-чувствительных опухолей.
Заявляемое изобретение было апробировано в Санкт-Петербургском государственном университете в лаборатории эмбриологии, и по результатам проведенных испытаний ниже приведены конкретные примеры реализации по первому и второму предлагаемым вариантам изобретения.
Примеры конкретной реализации.
Синтезированы молекулярные конъюгаты NLS-LHRH:
а также их флюоресцентно меченные производные.
Примеры по первому варианту
Пример 1
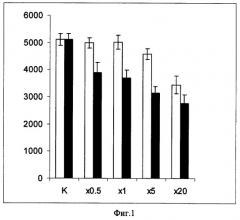
В опытах по конкурентному вытеснению меченых конъюгатов с поверхности клеток гепатомы человека HepG2 молярными избытками немеченых аналогов люлиберина показан рецептор-опосредованный характер взаимодействия данных молекулярных конъюгатов с опухолевыми клетками (Фиг.1, на которой показано влияние избытков синтетических аналогов люлиберина (V-7 и аларелина) на связывание флюоресцентно меченного NLS-LHRH с клетками HepG2). К клеткам HepG2 (30 мм чашки) добавляли 5 мкг NLS-LHRH-F и указанные молярные избытки немеченого V7 или аларелина. Инкубацию проводили 4 ч при 4°С. Отмывали 5 раз холодным PBS, оставляли на 10 мин в 0.5% альбумине на PBS при 4°С, лизировали и измеряли флюоресценцию. Значения флюоресценции выравнивали по концентрации клеточного белка. Белые столбцы соответствуют конкуренции с пептидом V7, а темные соответствуют конкуренции с пептидом аларелином.
Пример 2
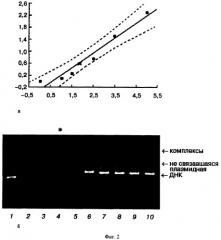
Стехиометрию комплексов ДНК/NLS-LHRH исследовали путем очистки комплексов, приготовленных в присутствии насыщающих количеств NLS-LHRH (десятикратный избыток по зарядам), от не связавшегося пептида методом ультрафильтрации. В результате был выделен комплекс, содержащий в своем составе насыщающие количества пептида. Известно, что гепарин, являясь более сильным полианионом, чем ДНК, способен вытеснять ее из комплекса с поликатионами [8, 9]. Определение содержания ДНК в выделенном комплексе проводили спектрофотометрически после его полного разрушения избытком гепарина. Содержание пептида в исследуемом комплексе определяли обратным титрованием гепарином. С этой целью построили калибровочную кривую (Фиг.2а) зависимости количества гепарина, достаточного для полного разрушения комплекса ДНК/NLS-LHRH, от содержания пептида в реакционной среде при формировании комплексов. По оси абсцисс приведен избыток положительных зарядов в комплексе относительно отрицательных зарядов ДНК, а по оси ординат отложено количество гепарина (мкг), необходимого для полного разрушения комплекса, содержащего 1 мкг ДНК. На Фиг.2(б) приведены результаты титрования NLS-LHRH в комплексе ДНК/NLS-LHRH
(1 мкг ДНК), приготовленном с насыщающими количествами NLS-LHRH и очищенным от не связавшегося пептида ультрафильтрацией гепарином методом гель-ретардации. 1 - pCMVluc; 2 - без гепарина; 3-е 0,292 мкг гепарина; 4 - с 0,4 мкг гепарина; 5 - с 0,52 мкг гепарина; 6 - с 0,65 мкг гепарина; 7 - с 0,975 мкг гепарина; 8 - с 1,46 мкг гепарина; 9 - с 2,19 мкг гепарина; 10 - с 3,29 мкг гепарина. Звездочками на Фиг.2а и 2б отмечены позиция на калибровочной кривой, соответствующая полному разрушению комплекса гепарином (а), и экспериментальная точка, соответствующая полному разрушению комплекса гепарином, выявленная гель-ретардацией (б). Установлено, что максимально возможное содержание NLS-LHRH в комплексах соответствует 1.5-кратному избытку положительных зарядов NLS-LHRH относительно отрицательных зарядов ДНК. Аналогичные результаты были получены нами ранее для комплексов ДНК с ТАТ-пептидом [8] и К8 [9].
Нижеприведенные примеры 3, 4, 5 являются общими для первого и второго вариантов заявленного изобретения.
Пример 3
Интернализацию комплексов ДНК с флюоресцентно меченными молекулярными конъюгатами NLS-LHRH (вариант 1) и Nuk-1 (вариант 2) исследовали методом конфокальной микроскопии. Клетки инкубировали с комплексами, приготовленными при соотношении зарядов ДНК : пептид 1:1 (10 мкМ) в течение 2 ч, фиксировали 4% формальдегидом, проводили дополнительную окраску DAPI и анализировали методом конфокальной лазерной флюоресцентной микроскопии. Результаты представлены на Фиг.3: а - клетки HepG2 после инкубации с комплексами ДНК с молекулярным конъюгатом NLS-LHRH (вариант 1); б - клетки HepG2 после инкубации с комплексами ДНК с молекулярным конъюгатом Nuk-1 (вариант 2); в - фибробласты человека после инкубации с комплексами ДНК с молекулярным конъюгатом NLS-LHRH (вариант 1); г - фибробласты человека после инкубации с комплексами ДНК с молекулярным конъюгатом Nuk-1 (вариант 2). Оба комплекса (ДНК/NLS-LHRH и ДНК/Nuk-l) выявлялись в эндосомах клеток гепатомы человека HepG2 ((содержат рецепторы люлиберинов), но не в фибробластах человека (не содержат люлибериновых рецепторов). Полученные результаты свидетельствуют в пользу рецептор-опосредованного эндоцитоза как основного пути проникновения в клетки комплексов ДНК с молекулярными конъюгатами NLS-LHRH и Nuk-1.
Пример 4
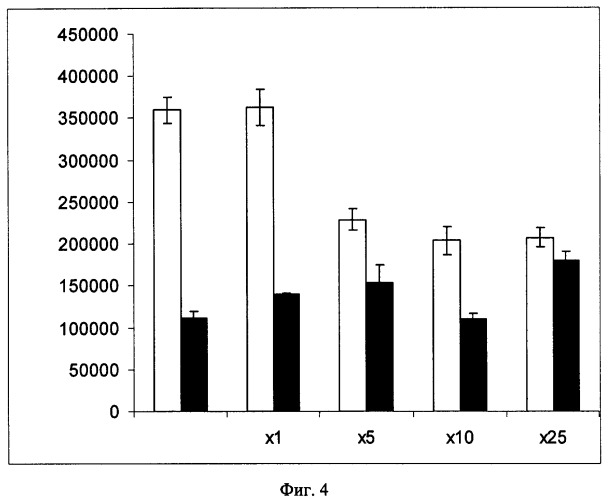
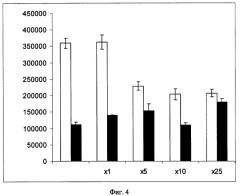
Способность NLS-LHRH (вариант 1) и Nuk-1 (вариант 2) доставлять ДНК в клетки HepG2 была проверена с помощью люциферазного теста. Клетки трансфецировали комплексами плазмиды pCMVluc, содержащей ген-репортер, кодирующий люциферазу, под контролем промотора ранних генов цитомегаловируса человека, с конъюгатами NLS-LHRH и Nuk-1. Оба комплекса оказались трансфекционно активными. На Фиг.4 показано влияние избытков аларелина на эффективность трансфекции клеток HepG2 комплексами pCMVluc/NLS-LHRH и pCMVluc/Nuk1 (люциферазный тест). Светлые столбцы соответствуют NLS-LHRH (вариант 1), темные столбцы - Nuk-1 (вариант 2). По оси абсцисс указаны молярные избытки аларелина, по оси ординат - активность люциферазы в относительных световых единицах. Добавление во время инкубации клеток с комплексами избытка аларелина приводило к снижению уровня экспрессии перенесенного гена при использовании NLS-LHRH, но не оказывало влияния на трансфекцию клеток комплексом pCMVluc/Nuk-1. На основании полученных данных можно заключить, что проникновение в клетки комплексов ДНК с NLS-LHRH происходит по тому же механизму, что и интернализация свободного LHRH - рецептор-опосредованным эндоцитозом.
На основании полученных данных можно заключить, что оба варианта молекулярного конъюгата способны эффективно доставлять ДНК в клетки гепатомы человека HepG2. Проникновение в клетки комплексов ДНК с NLS-LHRH происходит по тому же механизму, что и интернализация свободного LHRH - рецептор-опосредованным эндоцитозом.
Пример 5
Полученные данные о рецептор-опосредованном характере проникновения комплексов ДНК с молекулярным конъюнатом в клетки HepG2 позволили перейти к моделированию «суицидной» генотерапии опухолей путем переноса в клетки вектора экспрессии гена тимидин-киназы вируса HSV1 (рРТК1) с последующей обработкой трансфецированных клеток ацикловиром. Клетки HepG2 трансфецировали комплексами pPTK1/NLS-LHRH (первый вариант) и pPTK1/Nuk1 (второй вариант), приготовленными при соотношении зарядов 1:1. Через 2 ч после трансфекции в среду добавляли ацикловир до концентрации 50 мкг/мл. Через 24 ч клетки отмывали фосфатно-солевым буфером, фиксировали холодным 70% этанолом, окрашивали пропидий-йодидом (70 мкМ в 40 мМ цитрате натрия (рН 7.4)) 1 ч при 37°С в присутствии РНКазы А (500 мкг/мл). На Фиг.5 приведен анализ распределения клеток HepG2 по фазам клеточного цикла методом проточной цитофлюорометрии: а - интактные клетки (контроль); б - клетки после обработки ацикловиром (50 мкг/мл) в течение 24 ч; в - клетки, трансфецированные комплексами pPTK1/NLS-LHRH после обработки ацикловиром (50 мкг/мл) в течение 24 ч; г - клетки, трансфецированные комплексами pPTK1/Nuk1 после обработки ацикловиром (50 мкг/мл) в течение 24 ч. Обработка клеток, трансфецированных комплексами pPTKl/NLS-LHRH, ацикловиром приводила к полному исчезновению клеток в фазах G2 и S клеточного цикла и практически полному исчезновению клеток в фазе G1. Более 90% клеточной популяции ушли в апоптоз (Фиг.5в). В случае использования конъюгата Nuk1 (Фиг.5г) также наблюдалась массовая гибель клеток, однако эффект был менее выражен, так как около 15% клеток оставались в фазе G1. Клетки в фазах S и G2 также отсутствовали. Апоптоз клеток обусловлен именно экспрессией «суицидного» гена, так как обработка интактных клеток HepG2 ацикловиром (Фиг.5б) не приводила к существенным отклонением клеточного цикла по сравнению с контролем (Фиг.5а).
Пример 6
Синтез молекулярного конъюгата (первый и второй варианты).
Синтез
Молекулярный конъюгат NLS-LHRH (первый вариант) и Nuk1 (второй вариант) синтезировали на 4-метилбензгидриламино-полимере с содержанием аминогрупп 0.62 ммоль/г. До присоединения остатка Fmoc-D-Lys(BOC)-OH наращивание пептидной цепи проводили при использовании стандартного протокола Boc/Bzl стратегии (Протокол 1). После удаления ВОС-защиты с s-аминогруппы D-лизина проводили синтез последовательности ядерной локализации. При этом на стадии нейтрализации применяли 5%-ный раствор DIEA в DMF, а для присоединения N-концевого аминокислотного остатка использовали ВОС-Рerо-ОН. Затем удаляли Fmoc-защиту с α-аминогруппы D-лизина и продолжали наращивание пептидной цепи с применением Fmoc/Вut-стратегии (Протокол 2).
Отщепление синтезированных пептидов от полимера с одновременным деблокированием проводили с помощью TFMSA (Протокол 3). Деблокированные пептиды обессоливали на колонке 15×500 мм с сефадексом G-15 в 50% уксусной кислоте. Дальнейшую очистку проводили с помощью обращенно-фазовой ВЭЖХ.
ВЭЖХ проводили с использованием хроматографа System Gold (Beckman, США) на колонках Vydac С 18; Zorbax ODS С 18; Zorbax 300SB-C18 (4.6×150 мм, 5 мкм) для аналитической хроматографии и Vydac C18 (22×250 мм); Delta Pak C18 (19×300 мм); Discovery C18 (10×250 мм, 5 мкм) для препаративной. Условия хроматографии: УФ-детекция при 230 нм, градиент ацетонитрила в 0.1% TFA или 0.1% Н2РO4 при скорости потока 1 мл/мин для аналитической и градиент ацетонитрила в 0.1% TFA при скорости потока 5 мл/мин для препаративной хроматографии.
Полученные соединения охарактеризованы данными аналитической ВЭЖХ, аминокислотного анализа и масс-спектрометрии.
NLS-LH-RH. Масс-спектр, найдено: m/z: 2117.28 [М+H]+.
Вычислено: М 2117.25.
Nuk-1. Масс-спектр, найдено: m/z: 2209.40 [М+Н]+. Вычислено: М 2209.37.
Протокол 1. Синтез пептидов с помощью BOC/Bzl стратегии.
При проведении твердофазного пептидного синтеза использовали следующую комбинацию защитных групп в боковых цепях аминокислотных остатков: Ser - Bzl; Туr - Bzl(Cl2), Bzl(Br); Trp - For; Arg - Mts; Lys - Z(Cl). В качестве временной Nα-защиты служила ВОС-группировка.
Наращивание пептидной цепи проводили на полуавтоматическом пептидном синтезаторе или в ручном варианте по следующему протоколу для каждого цикла:
1) СН2Сl2 (1 мин); 2) 65% TFA/CH2Cl2 (1 и 15 мин); 3) CH2Cl2 (2х0 мин); 4) CH2Cl2 (2×1 мин); 5) DMF (1 мин); 6) 5% TEA/DMF (1 и 2 мин); 7) DMF (3×1 мин); 8) реакция конденсации (2 ч); 9) DMF (2×1 мин); 10) СН2Сl2 (1 мин).
Для конденсации использовали четырехкратные избытки активированных 1-оксибензотриазоловых эфиров соответствующих ВОС-аминокислот, полученных in situ (по 1 экв. ВОС-аминокислоты, DIC и HOBt, перемешивание в DMF при 0°С, 30 мин). По окончании реакции проводили тест на полноту ацилирования. При необходимости стадии 5)-10) повторяли.
В случае неполного прохождения реакции конденсации при ее повторении 1-2 раза непрореагировавшие группировки ацетилировали (после промывки СН2Сl2 к пептидил-полимеру добавляли 10 экв. уксусного ангидрида, 10 экв. 10% ТЕА/СН2Сl2 и перемешивали в течение 10 мин).
Протокол 2. Синтез пептидов с помощью Fmoc/But стратегии.
При проведении пептидного синтеза использовали следующую комбинацию защитных групп в боковых цепях аминокислотных остатков: Ser и Тyr - Вut; Lys - ВОС; His - Trt; Trp - ВОС. В качестве временной Nα-защиты служила Fmoc-группировка.
Наращивание пептидной цепи проводили на полуавтоматическом пептидном синтезаторе или в ручном варианте по следующему протоколу для каждого цикла: 1) СН2Сl2 (1 мин); 2) DMF (1 мин); 3) 20% пиперидин/DMF (2 и 8 мин); 4) DMF (3×1 мин); 5) Изопропиловый спирт (3×1 мин); 6) DMF (3×1 мин); 7) реакция конденсации (2 ч); 8) DMF (2×1 мин); 9) СН2Сl2 (1 мин).
Для конденсации использовали четырехкратные избытки активированных 1-оксибензотриазоловых эфиров соответствующих Fmoc-аминокислот, полученных in situ (по 1 экв. Fmoc-аминокислоты, DIC и HOBt, перемешивание в DMF при 0°С, 30 мин). По окончании реакции проводили тест на полноту ацилирования по методике, описанной в предыдущей главе. При необходимости повторной конденсации использовали следующий протокол:
а) DMF (1 мин); б) 5% DIEA/DMF (1 и 2 мин), после чего стадии 6)-9) повторяли.
В случае неполного прохождения реакции конденсации при ее повторении 1-2 раза непрореагировавшие группировки ацетилировали (после промывки СН2Сl2 к пептидилполимеру добавляли 10 экв. уксусного ангидрида, 10 экв. 10% DIEA/СН2Сl2 и перемешивали в течение 10 мин).
Протокол 3. Отщепление пептидов от полимерного носителя под действием TFMSA.
К 100 мг пептидил-полимера добавляли 100 мкл тиоанизола и 50 мкл этандитиола и перемешивали в течение 10 мин, после чего добавляли 1 мл TFA и перемешивали в течение 5-10 мин. К полученной суспензии при охлаждении на ледяной бане и перемешивании по каплям добавляли 100 мкл TFMSA. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре, затем разбавляли безводным диэтиловым эфиром. Выпавший осадок вместе с частицами полимера отфильтровывали и промывали на фильтре диэтиловым эфиром. Фильтрат отбрасывали, после чего осадок растворяли в TFA и полученный раствор фильтровали от частиц полимерного носителя в колбу, содержащую 25 мл безводного диэтилового эфира. Выпавший осадок выдерживали в холодильнике в течение 10-15 мин, после чего отфильтровывали, промывали на фильтре диэтиловым эфиром и высушивали. Полученный продукт растворяли в 50%-ной уксусной кислоте и отделяли от избытка солей и скавэнджеров с помощью гель-фильтрации.
Как показывают результаты проведенных исследований, заявленное изобретение по первому и второму вариантам имеет высокую эффективность в «суицидной» генотерапии культивируемых клеток гепатомы человека HepG2 и относится к системе невирусного переноса генов в клетки гормон-чувствительных опухолей млекопитающих.
Заявленные молекулярные конъюгаты на основе агонистов рецепторов люлиберина позволяют добиться существенно лучших результатов по сравнению с конъюгатами на основе антагонистов люлибериновых рецепторов по применению их в качестве средства доставки ДНК в клетки гормон-чувствительных опухолей. Вместе с тем, стоит отметить, что в условиях in vivo предпочтительными могут оказаться конъюгаты на основе антагонистов, так как они не вызывают активацию специфичных для люлиберина сигнальных путей.
На основании полученных результатов можно заключить, что заявленное изобретение (в двух вариантах) позволяет эффективно и адресно доставлять гены в клетки гормон-чувствительных опухолей. Кроме того, высокая специфичность проникновения люлиберинов в опухолевые клетки предполагает перспективность их использования и в целях генотерапии опухолей.
Результаты подобного рода исследований, которые приведены в примерах заявленного изобретения, отсутствуют в литературе и неизвестны заявителю и авторам на день подачи материалов заявки.
Список использованной литературы
1. Molas М., Gomez-Valades A. G., Vidal-Alabro A., Miguel-Turu M., Bermudez J., Bartrons R., Perales J. C. Receptor-mediated gene transfer vectors: progress towards genetic pharmaceuticals (2003) Curr. Gene Ther. 3(5):468-485.
2. Schally A.V. Luteinizing hormone-releasing hormone analogs: their impact on the control of tumorigenesis (1999) Peptides 20(10):1247-1262.
3. Патент US 5,378,688.
4. Патент US 6,214,969.
5. Международная заявка РСТ/ЕР96/05029 (номер международной публикации W097/19954); патент US 6,184,374 В.
6. Xu Y., Szoka Jr. F. C. Mechanism of DNA release from cationic liposome/DNA complexes used in cell transfection (1996) Biochemistry 35:5616-5623.
7. Ramsay E., Gumbleton M. Polylysine and polyomithine gene transfer complexes: a study of complex stability and cellular uptake as a basis for their differential in-vitro transfection efficiency (2002) J. Drug Target. 10(1): 1-9.
8. Ignatovich I.A., Dizhe E. В., Pavlotskaya A. V., Akifiev B. N., Burov S. V., Orlov S. V., Perevozchikov A. P. Complexes of plasmid DNA with basic domain 47-57 of the HIV Tat protein are transferred to mammalian cells by endocytosis-mediated pathways (2003). J. Biol. Chem. 278(24):42625-42636.
9. Диже Э.Б., Игнатович И.А., Буров С.В., Акифьев Б.Н., Ефремов А.М., Перевозчиков А.П., Орлов С.В. Комплексы ДНК с катионными пептидами: условия формирования и факторы, влияющие на эффективность проникновения в клетки млекопитающих (2006). Биохимия 71(12):1659-1667.
Молекулярный конъюгат состоит из катионной составляющей, ответственной за электростатическое взаимодействие с плазмидной ДНК, и лигандной составляющей, представляющей собой синтетический аналог люлиберина. Во всех вариантах в качестве катионной составляющей использован модифицированный сигнал ядерной локализации Т-антигена вируса SV40. Последовательность катионной составляющей:
Н-Рrо-Lys-Lys-Lys-Arg-Lys-Val
Первый вариант молекулярного конъюгата содержит в качестве лигандной составляющей следующую последовательность:
Glu-His-Trp-Ser-Tyr-D-Lys-Leu-Arg-Pro-Gly-NH2
Катионная составляющая присоединена через ε-аминогруппу 6-го D-Lys. Последовательность лигандной составляющей является частным случаем множества пептидов, описываемых следующей формулой:
X-R1-His-R3-Ser-R5-D-Lys-Leu-Arg-Pro-R10-NH2, где R1 - pGlu; R2 - His или D-Phe(4Cl); R3-Trp, D-Trp или D-Pal(3); R5 - Тyr или Arg; R10-Gly или D-Ala; Х - атом водорода или низшая алкильная группа (С2-С5).
Второй вариант молекулярного конъюгата содержит в качестве лигандной составляющей следующую последовательность:
D-Lys-Pro-Gly-D-Phe-Pro-Ser-Tyr-D-Lys-Leu-Arg-Pro-Gly-NH2. Катионная составляющая присоединена через ε-аминогруппу первого D-Lys.
1. Молекулярный конъюгат, представляющий собой синтетический аналог люлиберина формулыX-R1-His-R3-Ser-R5-D-Lys-Leu-Arg-Pro-R10,где R1 - pGlu;R3 - Trp, D-Trp, Pro или D-Pal(3);R5 - Tyr или Arg;R10 - Gly-NH2, D-Ala-NH2 или NH-CH2-CH3;X - атом водорода или низшая алканоильная группа (C2-C5),в котором через ε-аминогруппу D-Lys в положении 6 присоединен H-Pro-Lys-Lys-Lys-Arg-Lys-Val-.
2. Молекулярный конъюгат по п.1, отличающийся тем, что его применяют в качестве средства доставки ДНК в клетки гормон-чувствительных опухолей.
3. Молекулярный конъюгат для доставки ДНК в клетки гормон-чувствительных опухолей, содержащих рецепторы люлиберинов, в котором катионная составляющая, конденсирующая плазмидную ДНК, представляет собой модифицированный сигнал ядерной локализации Т-антигена вируса SV40 формулы H-Pro-Lys-Lys-Lys-Arg-Lys-Val- и присоединена через ε-аминогруппу N-концевого D-Lys лигандной составляющей, а лигандная составляющая, взаимодействующая с опухоль-специфическими рецепторами, представляет собой синтетический аналог люлиберина (антагонист) формулыD-Lys-Pro-Gly-R2-R3-Ser-Tyr-R6-Leu-Arg-Pro-R10-NH2,где R2 - ароматическая D-аминокислота;R3 - Trp, D-Trp, Pro или D-Pal(3);R6 - D-аминокислота;R10 - Gly, D-Ala.