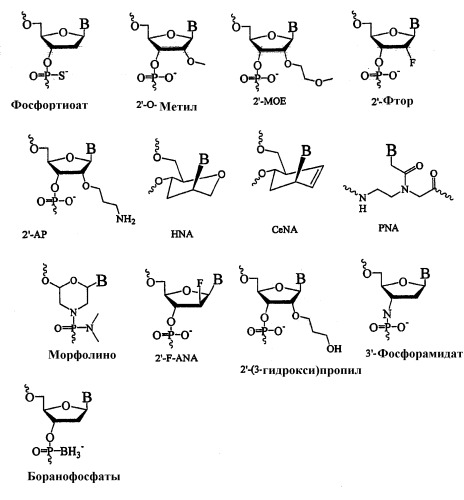
Олигомерное соединение, понижающее экспрессию человеческого гена bcl-2, конъюгат, фармацевтическая композиция и применение олигомерного соединения для лечения рака
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к олигомерному соединению, длиной 10-30 нуклеиновых оснований, и может быть использовано в медицине. Олигомерное соединение представляет собой мишень-связывающий домен, комплементарный отрезку из 10-18 последовательных нуклеотидов области от положения основания 1459 (5') до 1476 (3') мРНК человеческого Bcl-2 (HUMBcl2A (номер доступа М13994) в базе данных GenBank), кроме максимум одного ошибочного спаривания с указанным участком мРНК человеческого Bcl-2, где указанный связывающийся с мишенью домен имеет формулу: 5'-[(ДНК/РНК)0-1-(LNA/LNA*)2-7-(ДНК/РНК/LNA*)4-14-(LNA/LNA*)2-7-(WK/PHK)0-1]-3'. Изобретение позволяет получить олигомерное соединение, которое эффективно понижает экспрессию человеческого гена Bcl-2. 4 н. и 21 з.п. ф-лы, 20 ил., 3 табл.
Реферат
Настоящее изобретение относится к олигомерному соединению с улучшенными свойствами и к способам модуляции экспрессии гена Bcl-2 у человека. В частности, настоящее изобретение относится к олигомерным соединениям, имеющим длину 10-30 нуклеиновых оснований, и содержащим домен, связывающийся с мишенью, который специфически гибридизуется с областью от положения основания 1459 (5') до 1476 (3') мРНК человеческого Bcl-2, где указанный связывающийся с мишенью домен содержит, по меньшей мере, два нуклеотида LNA или нуклеотидных аналога LNA, связанных посредством фосфортиоатной группы (-О-Р(O,S)-O-).
Кроме того, настоящее изобретение относится к антисмысловым олигомерным соединениям, направленным против мРНК человеческого Bcl-2, и способным модулировать биосинтез человеческого белка Bcl-2. Настоящее изобретение также относится к фармацевтической композиции, содержащей такие олигомерные соединения, к ее применению и к способам лечения и диагностики с применением таких олигомерных соединений.
Предшествующий уровень техники
Человеческий Bcl-2 представляет собой белок, который тесно ассоциируется с механизмом запрограммированной клеточной гибели (апоптозом). Апоптоз представляет собой активный, жестко регулируемый физиологический процесс, участвующий в развитии клеток, в метаболизме клеток, в функциональном цикле нормальных клеток и в индуцированной гормонами атрофии ткани. Отсутствие запрограммированной клеточной гибели играет важную роль в развитии рака и других гиперпролиферативных заболеваний, таких как рестеноз, фиброз, псориаз или аллергические заболевания некоторых типов, в частности, в прогрессировании развития опухоли, и, что самое важное, может создавать проблемы, связанные с резистентностью к противоопухолевым курсам лечения, в частности курсам лечения стандартными химиотерапевтическими соединениями. В отличие от большинства нормальных тканей, в злокачественных опухолях, таких как мелкоклеточный рак легких (SCLC) и не-мелкоклеточный рак легких (NSCLC), часто ко-эпрессируется Вcl-2.
В заявке WO 95/08350 описаны антисмысловые олигомеры и способы с использованием этих олигомеров для предотвращения роста раковых клеток, экспрессирующих ген Bcl-2.
В публикации Klasa et al., Antisense & Nucleic Acid Drug Development 12:1993-213 (2002) (обзор) обсуждаются биологические эффекты соединения облимерсен-натрия (G3139) и его потенциальная эффективность как антисмыслового лекарственного средства. Указанное соединение имеет структуру 5'-d(P-тио)TCT-CCC-AGC-GTG-CGC-CAT-3'. Организация Genta Incorporated сделала заявление в Департамент по контролю за качеством пищевых продуктов, медикаментов и косметических средств о разрешении использования нового лекарственного средства (NDA) “облимерсен-натрий (G3139) + дакарбазин (DTIC)”. Во многих Научно-исследовательских центрах были проведены рандомизированные испытания на фазе 3 по использованию облимерсен-натрия (G3139) + дакарбазина (DTIC) и одного DTIC как химиотерапию первого ряда, проводимую через каждые три недели для лечения меланомы с метастазами. В мае 2004 г. было сделано сообщение о том, что данное исследование не давало положительного результата в отношении выживаемости пациентов после лечения G3139 + DTIC. Комбинация лекарственных средств ассоциировалась с повышенной токсичностью и с прерыванием курса лечения из-за побочных эффектов (AE) у пациентов, а именно, 69 (18,6%) пациентов прервали курс лечения препаратом G3139 из-за побочных эффектов, и 39 пациентов (10,8%) прервали курс лечения препаратом DTIC. Серьезные побочные эффекты (СПЭ) наблюдались у 40% пациентов, проходивших курс лечения препаратом G3139, и только у 27% пациентов, проходивших курс лечения препаратом DТIC. Поскольку доза DТIC в двух комбинациях была идентичной, то увеличение токсичности, вероятно, было обусловлено добавлением G3139. При этом, уровень выживаемости не увеличивался, а токсичность повышалась. Поэтому от применения этого нового лекарственного средства (NDA) пришлось отказаться. Однако, конечный результат второго анализа, проведенного спонсором, показал статистически значимое увеличение выживаемости пациентов без прогрессирования у них заболевания в среднем от 49 дней, при лечении препаратом DТIC, и до 74 дней при лечении комбинацией лекарственных средств, с разницей 25 дней (р=0,0003, НR=0,73). Кроме того, спонсор сообщил о значительном различии в показателях отклика, который в случае приема лишь одного DТIC составлял 6,8%, а в случае применение комбинации, составлял 11,7% (р=0,019). Тот факт, что облимерсен-натрий давал удовлетворительный конечный результат во втором исследовании, указывает на то, что он должен быть эффективным соединением для лечения меланомы с метастазами. Повышенная токсичность, выбор первичных конечных результатов и программы общих клинических испытаний являются теми факторами, которые могут приводить к неблагоприятному исходу лечения.
LNA-содержащие олигонуклеотиды, нацеленные на 6 первых кодонов мРНК человеческого Bcl-2, были исследованы в публикации Ph.D., диссертации, защищенной Jan Stenvang Jepsen (Май, 2003, Копенгагенский Университет). Полностью модифицированные последовательности LNA-фосфодиэфира (РО), фосфордиэфирные хэдмеры (LNA/PO у 5'-конца и ДНК/PS-фосфортиоат у 3'-конца), полностью фосфордиэфирные гэпмеры (размеры гэпа 8, 10, 12, 14) и гэпмеры с исключительным тиолированием в гэпе (размеры гэпа 8, 10, 12, 14) анализировали на in vitro поглощение различными трансфицирующими агентами, и на ингибирование белка Bcl-2. Исследование поглощения проводили в клетках МСF-7, и результаты анализировали с помощью микроскопии и проточной цитометрии. Для всех РО- и РО/PS-содержащих конструкций была достигнута одинаково эффективная доставка. Хотя было проведено исследование различных LNA-содержащих олигонуклеотидов и конструкций, однако в работе Stenvang Jepsen не сообщается и не высказывается каких-либо предположений о LNA-содержащих олигонуклеотидных гэпмерах, в которых значительное число нуклеотидных связей в мишень-связывающем домене, включая LNA-концы, представляют собой фосфортиоатные группы (-О-Р(О,S)-О-), вероятно, обусловлено тем известным фактом, что фосфортиолирование должно приводить к снижению аффинности, и потому, оно должно приводить к нестабильности.
В публикации Frieden et al., Nucleic Acid Research, 2003, Vol. 31, № 21, 6365-6373 и в WO 2004/046160 A2 приводятся различные обсуждения, касающиеся конструирования антисмысловых олигонуклеотидов, проводимого в in vitro экспериментах.
В публикации Fluiter et al., Nucleic Acid Research, 2003, Vol. 3, 953-962 описаны исследования по in vivo ингибированию роста опухоли и биологического распределения антисмысловых LNA-олигонуклеотидов.
Описание сущности изобретения
Исходя из вышеописанного, и в частности, принимая во внимание проблемы, связанные с эффективностью применения соединения облимерсен-натрия, очевидно, что необходимость в улучшении свойств олигомерного соединения, ингибирующего Bcl-2, остается актуальной. Такое соединение, предпочтительно, должно иметь подходящий in vivo профиль распределения в тканях и ингибирования Bcl-2, а следовательно, и более высокую терапевтическую эффективность при лечении различных Bcl-2-ассоциированных состояний, в частности рака.
В этой связи следует сказать, что авторами настоящего изобретения было обнаружено, что некоторые новые LNA-олигомерные соединения типа гэпмера обладают биологическим действием, которое сравнимо или превышает действие облимерсен-натрия, и, при исследовании этого средства в фармакологически релевантных дозах не было обнаружено побочных эффектов.
Более конкретно, авторами настоящего изобретения было обнаружено, что олигомерные соединения, имеющие длину 10-30 нуклеиновых оснований и содержащие домен, связывающийся с мишенью, который специфически гибридизуется с областью от положения основания 1459 (5') до 1476 (3') мРНК человеческого Bcl-2, где указанный связывающийся с мишенью домен имеет формулу:
5'-[(ДНК/РНК)0-1-(LNA/LNA*)2-7-(ДНК/РНК/LNA*)4-14-(LNA/LNA*)2-7-
(ДНК/РНК)0-1]-3',
где “LNA” означает нуклеотид LNA, и “LNA*” означает аналог нуклеотида LNA; и где указанный мишень-связывающий домен содержит, по меньшей мере, два нуклеотида LNA или нуклеотидного аналога LNA, связанных фосфортиоатной группой, и обладают представляющими интерес биологическими свойствами.
Краткое описание графического материала
На фиг.1 проиллюстрировано ингибирование Bcl-2 в клетках 15PC3, трансфицированных олигомерными соединениями LNA, и проанализированных с помощью Вестерн-блот-анализа. Последовательности SEQ ID NO:2, 4, 15, 21 и 24 (см. таблицу 1) оказались более сильными ингибиторами Bcl-2, как было измерено на уровне белка, по сравнению с облимерсен-натрием, то есть соединением, имеющим последовательность SEQ ID NO:56 (эталон). Белок сурвивин служил в качестве контроля.
На фиг.2А проиллюстрировано ингибирование Bcl-2 в клетках 15PC3, трансфицированных олигомерными соединениями LNA, проанализированных с помощью Вестерн-блот-анализа и визуализированных с помощью хемилюминесцентной системы детекции. Последовательность SEQ ID NO:2 оказалась более эффективной, чем SEQ ID NO:56 (эталон). Белок сурвивин служил в качестве контроля.
На фиг.2В представлен Вестерн-блот-анализ. Клетки 518А2 были подвергнуты липофекции 5 нМ SEQ ID NO:56 (эталон), SEQ ID NO:8 и SEQ ID NO:15, соответственно. Белок анализировали через 48 часов. Последовательность SEQ ID NO:15 сохраняла активность на протяжении всего этого времени. На графике представлены данные, нормализованные к тубулину.
На фиг.2С представлен Вестерн-блот-анализ. Клетки 518А2 были подвергнуты липофекции 5 нМ SEQ ID NO:56, SEQ ID NO:8, SEQ ID NO:15 и SEQ ID NO:35, соответственно, которая представляет собой n-1-вариант 15-мера SEQ ID NO:15. Белок анализировали через 48 часов. Последовательность SEQ ID NO:35 была такой же эффективной, как и последовательность SEQ ID NO:15. Данные были нормализованы к тубулину.
На фиг.3А проиллюстрировано индуцирование апоптоза, измеренное по активности каспазы 3/7, LNA-содержащим соединением в клетках 518А2, через 24, 48 и 72 ч. LNA-олигомеры SEQ ID NO:2, 4, 12, 15, 21, 24 и 57 индуцировали апоптоз более эффективно, чем SEQ ID NO:56 (эталон) и соответствующее метилированное соединение цитозина, обозначаемое SEQ ID NO:59. Более низкие уровни каспазы 3/7 в более поздние промежутки времени (например, через 72 часа) обусловлены клеточной гибелью в результате апоптоза при более ранней активации каспазы 3/7. Таким образом, максимальная активация была достигнута еще до проведения мониторинга.
На фигуре 3В проиллюстрировано индуцирование апоптоза, измеренное по активности каспазы 3/7, LNA-содержащим соединением в клетках 518А2, через 13, 24, 48 и 72 ч. LNA-олигомеры SEQ ID NO:8, 9, 15 и 16 индуцировали апоптоз более эффективно, по сравнению с SEQ ID NO:58, то есть контрольным олигонуклеотидом с противоположной полярностью, также содержащим LNA.
На фиг.3С проиллюстрировано индуцирование поздней фазы клеточного апоптоза, измеренное с помощью проточного цитометрического анализа с использованием аннексина V-FITC. Клетки НеLa, обработанные олигомерным соединением LNA SEQ ID NO:15, были классифицированы как клетки “с более поздним апоптозом” или “поврежденные” клетки по сравнению с ложнообработанными клетками и клетками, обработанными SEQ ID NO:56 (эталон).
На фиг.3D проиллюстрирована обработка клеток 5 нМ и 12,5 нМ SEQ ID NO:8 и SEQ ID NO:15, которая приводит к индуцированию апоптоза на ранней и поздней стадии, измеренному с помощью проточного цитометрического анализа с использованием аннексина V-FITC, по сравнению с ложнообработанными клетками.
На фиг.4 проиллюстрировано ингибирование Bcl-2 в пролиферирующихcя раковых клетках (анализ MTS), клетках 518А2, измеренное через 48 часов после обработки LNA-олигомерным соединением, ингибирующим Bcl-2. Все соединения SEQ ID NO:2, 4, 12, 15, 21, 24 и 57 были более сильными ингибиторами пролиферации по сравнению с соединением SEQ ID NO:56 (эталон) и соответствующим метилированным соединением цитозина SEQ ID NO:59 (эталон). Данные были скорректированы на ложнообработанный контроль. Эксперимент 1 и эксперимент 2 представляют собой два отдельных эксперимента.
На фиг.5 проиллюстрировано ингибирование Bcl-2 в пролиферирующих раковых клетках, клетках 518А2, измеренное во время действия 0-48 часов после обработки олигомерным соединением LNA, ингибирующим Bcl-2. Все соединения SEQ ID NO:2, 4, 12, 15, 21, 24 и 57 являются более сильными ингибиторами пролиферации по сравнению с соединением SEQ ID NO:56 (эталон) и соответствующим метилированным соединением цитозина SEQ ID NO:59 (эталон). Данные были скорректированы на ложнообработанный контроль.
На фиг.6 представлен Вестерн-блот-анализ. Клетки 518А2 были подвергнуты липофекции 10 нМ SEQ ID NO:56 (эталон) и SEQ ID NO:15, соответственно. Белок анализировали через 24 часа, 48 часов и 72 часа. Последовательность SEQ ID NO:15 сохраняла активность на протяжении всего этого времени. Через 24 часа белок Bcl-2 еще наблюдался благодаря своему продолжительному времени полужизни.
На фиг.7А проиллюстрировано эффективное in vivo уменьшение объема опухоли под действием соединения SEQ ID NO:15 по сравнению с соединением SEQ ID NO:56 (эталон) в предстательной железе бестимусных (“голых”) мышей с моделью ксенотрансплантата PC3. Соединения вводили внутрибрюшинно в дозе в течение 14 дней. Митомицин С, вводимый внутрибрюшинно в дозе 2 мг/кг в течение 14 дней, использовали в качестве позитивного контроля. Мониторинг роста опухоли проводили еще 8 дней после обработки.
На фиг.7В показано, что при введении соединения SEQ ID NO:15 в предстательную железу бестимусных (“голых”) мышей с моделью ксенотрансплантата PC3, какой-либо значимой потери веса у этих мышей не наблюдалось. SEQ ID NO:56 (эталон) в дозе 10 мг/кг и митомицин С, используемый в качестве позитивного контроля и вводимый в дозе 2 мг/кг, давал аналогичный эффект.
На фиг.7С проиллюстрировано эффективное in vivo уменьшение объема опухоли под действием SEQ ID NO:8 по сравнению с физиологическим раствором, используемым в качестве контроля, в модели ксенотрансплантата PC3 предстательной железы у бестимусных (“голых”) мышей. Соединения вводили внутрибрюшинно в дозе 10 мг/кг в течение 14 дней (дни 5-19).
На фиг.7D проиллюстрировано эффективное in vivo уменьшение объема опухоли под действием SEQ ID NO:15, вводимого в предстательную железу бестимусных (“голых”) мышей с моделью ксенотрансплантата PC3 ежедневно в дни 7-15 или в дни 8, 11, 13, 15, 18, 20, по сравнению с контрольным физиологическим раствором в модели ксенотрансплантата PC3 предстательной железы у бестимусных (“голых”) мышей. Соединения вводили внутрибрюшинно в дозе 10 мг/кг в течение 14 дней. Мониторинг роста опухоли проводили еще 8 дней после обработки.
На фиг.8А проиллюстрировано сравнимое in vivo уменьшение массы опухоли (граммы) после внутрибрюшинного введения SEQ ID NO:15 в дозе 1,75 мг/кг в течение 14 дней мышам SCID с моделью 518А2 ксенотрансплантата меланомы по сравнению с уменьшением массы опухоли после введения соединения SEQ ID NO:56 (эталон) в дозе, которая в 4 раза превышала дозу соединения SEQ ID NO:15.
На фиг.8В представлены результаты эксперимента, проиллюстрированного на фиг.8А, за исключением того, что эти результаты представлены, не в граммах, а в % уменьшения массы опухоли.
На фиг.9 проиллюстрировано сравнимое in vivo уменьшение объема опухоли после внутрибрюшинного введения SEQ ID NO:15 в дозе 1,75 мг/кг в течение 14 дней мышам SCID с моделью ксенотрансплантата меланомы 518А2 по сравнению с уменьшением объема опухоли после введения соединения SEQ ID NO:56 (эталон) в дозе, которая в 4 раза превышала дозу соединения SEQ ID NO:15.
На фиг.10А проиллюстрировано отсутствие увеличения размера печени после внутрибрюшинного введения SEQ ID NO:15 в дозе 1,75 мг/кг в течение 14 дней мышам SCID с моделью ксенотрансплантата меланомы 518А2 по сравнению с эффектом, достигаемом после введения физиологического раствора, используемого в качестве контроля. Соединение SEQ ID NO:56 (эталон), вводимое в дозе 7 мг/кг, приводило к увеличению размера печени.
На фиг.10В проиллюстрировано отсутствие увеличения размера селезенки после внутрибрюшинного введения SEQ ID NO:15 в дозе 1,75 мг/кг в течение 14 дней мышам SCID с моделью ксенотрансплантата меланомы 518А2 по сравнению с эффектом, достигаемом при введении физиологического раствора, используемого в качестве контроля. Соединение SEQ ID NO:56 (эталон), вводимое в дозе 7 мг/кг, приводило к увеличению размера селезенки. Это указывает на то, что соединение SEQ ID NO:15 в активной дозе обладает более низкой токсичностью, чем соединение SEQ ID NO:56 (эталон).
На фиг.10С показано, что обработка не приводит к уменьшению массы тела мыши при внутрибрюшинном введении SEQ ID NO:15 в дозе 1,75 мг/кг в течение 14 дней мышам SCID с моделью ксенотрансплантата меланомы 518А2 по сравнению с эффектом, достигаемым при введении физиологического раствора, используемого в качестве контроля, и SEQ ID NO:56 (эталон), вводимого в дозе 7 мг/кг. Это указывает на то, что соединение SEQ ID NO:15 в активной дозе обладает более низкой токсичностью, чем соединение SEQ ID NO:56 (эталон).
На фиг.11 показано значительное уменьшение in vivo массы опухоли у мышей SCID с моделью ксенотрансплантата меланомы 518А2 при внутрибрюшинном введении SEQ ID NO:8 в дозе 7 мг/кг в течение 14 дней по сравнению с эффектом, достигаемом при введении соединения SEQ ID NO:56 (эталон) в той же самой дозе. SEQ ID NO:8 обнаруживает такую же противоопухолевую активность при введении в дозе в 7 раз более низкой дозе, чем SEQ ID NO:56 (эталон).
На фиг.12А проиллюстрирована повышенная стабильность SEQ ID NO:15, 16 и 20 в плазме крыс (самцов крыс NtacSD, Li-гепарин (Taconic, M&B)) по сравнению с соединением SEQ ID NO:56 (эталон). Олигонуклеотиды инкубировали при концентрациях 20 мкМ при 37°С в течение 0, 4, 24 и 48 часов, соответственно. Фрагментом расщепления, присутствующим в образце, является лишь олигонуклеотид, соответствующий n-1 (15-мер), в котором у 3'-конца отсутствует остаток ДНК. Каких-либо других фрагментов расщепления, даже после проведения 48-часового гидролиза, не обнаруживалось.
На фиг.12В показано, что SEQ ID NO: 8 и 9 обладают высокой стабильностью в плазме крыс по сравнению со стабильностью SEQ ID NO:56 (эталон). Олигонуклеотиды инкубировали при концентрациях 20 мкМ при 37°С в течение 0, 4, 24 и 48 часов, соответственно. Фрагментом расщепления, присутствующим в образце, является лишь олигонуклеотид, соответствующий n-1 (15-мер), в котором, у 3'-конца отсутствует остаток ДНК. Каких-либо других фрагментов расщепления, даже после проведения 48-часового гидролиза, не обнаруживалось.
На фиг.13 показаны уровни SEQ ID NO:15 в печени и в почках мышей NMRI после внутривенного введения разовой дозы (25 мг/кг). Было установлено, что время полужизни (Т1/2) активного соединения SEQ ID NO:15 как в печени, так и в почках составляет примерно 3 дня. Это указывает на то, что схемы введения оптимальных биологических доз SEQ ID NO:15 могут быть составлены с меньшей частотой, чем непрерывное вливание и введение суточной дозы.
Описание изобретения
Как было упомянуто выше, авторами настоящего изобретения было обнаружено, что олигомерные соединения, имеющие длину 10-30 нуклеиновых оснований, и содержащие домен, связывающийся с мишенью, который специфически гибридизуется с областью от положения основания 1459 (5') до 1476 (3') мРНК человеческого Bcl-2, где указанный связывающийся с мишенью домен имеет формулу:
5'-[(ДНК/РНК)0-1-(LNA/LNA*)2-7-(ДНК/РНК/LNA*)4-14-(LNA/LNA*)2-7-
ДНК/РНК)0-1]-3',
где “LNA” означает нуклеотид LNA, а “LNA*” означает аналог нуклеотида LNA; и где указанный мишень-связывающий домен содержит, по меньшей мере, два нуклеотида LNA или аналога нуклеотида LNA, связанных фосфортиоатной группой, и обладает представляющими интерес биологическими свойствами.
В общих чертах, описанные здесь олигомерные соединения, очевидно, обладают улучшенными свойствами по сравнению со свойствами известных олигомерных соединений. Термин “улучшенные свойства” следует понимать как один или несколько параметров, благодаря которым олигомерные соединения обладают общей эффективностью, которая превышает или равна эффективности их фосфотиоатных аналогов.
Примерами таких улучшенных параметров являются более длительный срок хранения лекарственного средства, более высокая константа связывания с мишенью (промежуточным комплементом в олигомерном соединении или мРНК-мишень), хорошая резистентность к внеклеточным и внутриклеточным нуклеазам, более высокая эффективность в данном механизме действия, лучший фенотипический ответ, более продолжительное действие, более высокий уровень хемосенситизации и более удобное применение лекарственного средства пациентом. Примерами параметров, сообщающих такую же эффективность, являются легкость получения лекарственных средств, легкость приготовления фармацевтических композиций, распределение в тканях и хороший профиль безопасности.
В целом, описанные здесь олигомерные соединения имеют величины IC50 в очень низком наномолярном интервале (5 нМ) в отношении ингибирования мРНК Bcl-2, в отношении ингибирования белка (отношение Bcl-2/Вах изменяется от 1 нМ) и ингибирования пролиферации клеток. Эти величины значительно превышают величины, наблюдаемые для облимерсена и для соединений Jepsen (при 400 нМ могут наблюдаться значительные уровни ингибирования). Кроме того, клеточная гибель значительно коррелирует с индуцированием апоптоза, и было показано, что эти уровни индуцирования апоптоза значительно превышают уровни индуцирования, обеспечиваемые облимерсеном. Кроме того, описанные здесь олигомерные соединения обнаруживают значительно более высокую стабильность в плазме крыс и более длительное время полужизни в ткани по сравнению с облимерсеном. Повторный противоопухолевый ответ наблюдался в предстательной железе и в модели меланомы, даже при дозе 1 мг/кг/день. Кроме того, противоопухолевый ответ также наблюдался при менее частом введении доз указанного соединения по сравнению с обычной дозой, описанной в литературе для облимерсена. При этом каких-либо побочных эффектов при фармакологически релевантных дозах, таких как увеличение ASAT, ALAT, не наблюдалось. Результаты, полученные авторами настоящего изобретения, превосходили результаты, полученные для конструкций Jepsen, для которых не были проанализированы функциональный ответ, стабильность, время полужизни в ткани, in vivo ответ, клинические биохимические параметры или биологическое распределение.
Упоминаемая здесь последовательность человеческой мРНК Bcl-2 имеется в базе данных Genbank под названием HUMBcl2A и под регистрационным номером М13994. В контексте описания настоящей заявки, нумерация нуклеиновых кислот, в частности последовательностей мРНК или соответствующих кДНК, соответствует нумерации человеческой мРНК Bcl-2, имеющейся в указанной базе данных под указанным регистрационным номером. Соответствующая последовательность кДНК может быть выведена из последовательности мРНК, в частности, путем замены любого основания Т указанной последовательности кДНК основанием U в последовательности мРНК, и наоборот.
Олигомерные соединения
Олигомерные соединения характеризуются тем, что они в своем мишень-связывающем домене содержат, по меньшей мере, два нуклеотида LNA или нуклеотидных аналога LNA, связанных фосфортиоатной группой.
Используемый здесь термин “мишень-связывающий домен” означает домен олигомерного соединения (или даже само олигомерное соединение), который связывается с конкретной последовательностью-мишенью, а именно, с областью от положения основания 1459 (5') до 1476 (3') мРНК человеческого Bcl-2.
В одном из вариантов изобретения мишень-связывающий домен содержит, по меньшей мере, два нуклеотида LNA, связанных фосфортиоатной группой (-О-Р(О,S)-О-).
В другом варианте изобретения мишень-связывающий домен содержит, по меньшей мере, два нуклеотидных аналога LNA, связанных фосфортиоатной группой (-О-Р(О,S)-О-).
Используемый здесь термин “олигомерные соединения” означает LNA-олигонуклеотиды, т.е., рибонуклеиновую кислоту (РНК) или дезоксирибонуклеиновую кислоту (ДНК), модифицированную путем замены одного или нескольких (или всех) присутствующих в них нуклеотидов нуклеотидами LNA или нуклеотидными аналогами LNA, в частности, по меньшей мере, двумя нуклеотидами LNA, при этом возможна и другая замена нуклеотидов нуклеотидными аналогами LNA и производными/аналогами этих нуклеотидов.
Термин “олигонуклеотид” включает олигонуклеотиды, состоящие из природных нуклеиновых оснований, сахаров и межнуклеозидных (каркасных) связей, а также олигонуклеотиды, имеющие неприродные части с аналогичными функциями или с конкретными улучшенными функциями.
Олигомерные соединения, используемые в контексте описания изобретения, имеют длину в 10-30 нуклеиновых оснований, например 10-25, а именно 10-20, например 10-18, или 10-16 или 15-17 нуклеиновых оснований.
Используемый здесь термин “длина нуклеинового основания” означает число нуклеиновых оснований после их гибридизации с линейной комплементарной молекулой нуклеиновой кислоты, т.е., общее число нуклеиновых оснований комплементарной нуклеиновой кислоты в области, с которой гибридизовано указанное олигомерное соединение. Таким образом, длина олигомерного соединения включает любые промежуточные нуклеотиды, где отсутствует нуклеиновое основание.
В одном из основных вариантов изобретения олигомерные соединения (LNA-олигонуклеотиды) согласно изобретению включают, по меньшей мере, два нуклеотида LNA.
В другом варианте изобретения олигомерные соединения (LNA-олигонуклеотиды) согласно изобретению включают, по меньшей мере, два нуклеотидных аналога LNA, и возможно, один или несколько нуклеотидов LNA.
Термин “по меньшей мере, два” включает целое число, превышающее или равное 2, такое как 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 и т.д.
Термин “по меньшей мере, один” включает целое число, превышающее или равное 1, такое как 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 и т.д.
Артикль “а”, используемый по отношению к нуклеозиду, нуклеозидному аналогу, SEQ ID NO: и т.п. означает “один или более”. В частности, выражение “компонент (такой как нуклеозид, нуклеозидный аналог, SEQ ID NO: или т.п.), выбранный из группы, состоящей из…” означает, что могут быть выбраны один или несколько из указанных компонентов. Таким образом, выражение типа “компонент, выбранный из группы, состоящей из А, В и С”, включает все комбинации А, В и С, то есть, А, В, С, А+В, А+С, В+С и А+В+С.
Термин “LNA” (блокированная нуклеиновая кислота) (или “олигонуклеотид LNA”) означает олигонуклеотид, содержащий один или более бициклических нуклеозидных аналогов, что также относится к нуклеотидам LNA и нуклеотидным аналогам LNA.
Олигонуклеотиды LNA, нуклеотиды LNA и нуклеотидные аналоги LNA в общих чертах описаны в WO 99/14226 и в следующих заявках, WO 00/56746, WO 00/56748, WO 00/66604, WO 00/125248, WO 02/28875, WO 2002/094250 и РСТ/DK02/00488, каждая из которых включена в настоящее описание посредством ссылки.
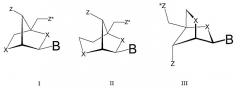
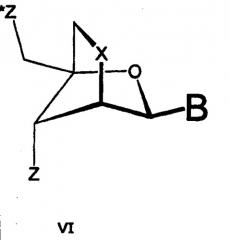
В контексте настоящей заявки и формулы изобретения авторы настоящего изобретения считают, что термины “нуклеотиды LNA” и “нуклеотидные аналоги LNA” отличаются друг от друга. Термин “нуклеотид LNA” означает нуклеотид формулы I:
Такие нуклеотиды LNA часто обозначаются "p-D-окси-LNA".
В формуле 1 В означает нуклеиновое основание. Нуклеиновые основания включают природные нуклеиновые основания, а также неприродные нуклеиновые основания. Репрезентативными нуклеиновыми основаниями являются нуклеиновые основания, выбранные из аденина, цитозина, 5-метилцитозина, изоцитозина, псевдоизоцитозина, гуанина, тимина, урацила, 5-бромурацила, 5-пропинилурацила, 5-пропинил-6-фторурацила, 5-метилтиазолурацила, 6-аминопурина, 2-аминопурина, инозина, диаминопурина, 7-пропин-7-деазааденина, 7-пропин-7-деазагуанина и 2-хлор-6-аминопурина. Предпочтительными примерами В являются аденин, цитозин, 5-метилцитозин, изоцитозин, псевдоизоцитозин, гуанин, тимин, урацил, 5-бромурацил, 5-пропинилурацил, 6-аминопурин, 2-аминопурин, инозин, диаминопурин и 2-хлор-6-аминопурин.
В формуле 1, Z* выбран из межнуклеозидной связи и концевой группы, а Z выбран из связи с межнуклеозидной связью предшествующего нуклеотида/нуклеозида и концевой группы, разумеется, при условии, что только один из Z и Z* может быть концевой группой.
Межнуклеозидная связь, как возможное значение Z*, означает межнуклеозидную связь с последующим нуклеотидом/нуклеозидом. Примерами межнуклеозидных линкеров являются -O-Р(O)2-O-, -O- Р(О,S)-О-, -О-Р(S)2-О-, -S-Р(О)2-О-, -S-Р(О,S)-О-, -S-Р(S)2-О-, -О-Р(О)2-S-, -О-Р(О,S)-S-, -S-Р(О)2-S-, О-РО(RН)-О-, O-PO(OСН3)-О-, -О-РО(NRН)-О-, -О-РО(ОСН2СН2S-R)-O-, -О-РО(ВH3)-О-, -О-РО(NHRН)-О-, -О-Р(О)2-NRН-, NRН-Р(О)2-О-, -NRН-СО-О-, -NRН-СО-NRН-, -О-СО-О-, -О-СО-NRН-, NRН-СО-СН2-, -О-СН2-СО-NRН-, -О-СН2-СН2-NRН-, -СО-NRН-СН2-, -СН2-NRН-СО-, -О-СН2-СН2-S-, -S-СН2-СН2-О-, -S-СН2-СН2-S-, -СН2-SО2-СН2-, -СН2-СО-NRН-,
-О-СН2-СН2-NRН-СО-, -СН2-NСН3-О-СН2-, где RН выбран из водорода и С1-4алкила. Предпочтительными межнуклеозидными связями являются -О-Р(О)2-О-, -О-Р(О,S)-О-, -О-Р(S)2-О-, -S-Р(О)2-О-, -S-P(O,S)-O-, -S-Р(S)2-О-, -О-Р(О)2-S-, -О-P(O,S)-S- и
-S-Р(О)2-S-. Отличительным признаком настоящего изобретения является то, что два нуклеотида LNA связаны посредством -О-Р(О,S)-О- (фосфортиоатной) группы, т.е., межнуклеозидной связью предпочтительно является фосфортиоатная группа.
В контексте настоящего изобретения термин “С1-4алкил” означает прямую или разветвленную насыщенную углеводородную цепь, имеющую от одного до четырех атомов углерода, такую как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил.
Если нуклеотид LNA представляет собой 5'-концевой нуклеотид олигомерного соединения, то Z* означает концевую группу, а если нуклеотид LNA представляет собой 3'-концевой нуклеотид олигомерного соединения, то Z означает концевую группу. Такие концевые группы обычно выбирают из водорода, азидо, галогена, циано, нитро, гидрокси, Prot-O, Асt-О, меркапто, Prot-S, Асt-S, С1-6алкилтио, амино, Prot-N(RН)-, Асt-N(RН)-, моно или ди(С1-6алкил)амино, необязательно замещенного
С1-6алкокси, необязательно замещенного С1-6алкила, необязательно замещенного С2-6алкенила, необязательно замещенного С2-6алкенилокси, необязательно замещенного С2-6алкинила, необязательно замещенного С2-6алкинилокси, монофосфата, монотиофосфата, дифосфата, дитиофосфата, трифосфата, тритиофосфата, ДНК-интекаляторов, фотохимически активных групп, термохимически активных групп, хелатообразующих групп, репортерных групп, лигандов, карбокси, сульфоно, гидроксиметила, Prot-О-СН2, Асt-О-СН2, аминометила, Prot-N(RН)-СН2, Асt-N(RН)-СН2, карбоксиметила и сульфонометила, где Prot представляет собой защитную группу для -ОН, -SН и -NН(RН), соответственно, Асt представляет собой активирующую группу для -ОН, -SН и -NН(RН), соответственно, а RН выбран из водорода и С1-6алкила. Предпочтительными примерами концевых групп являются водород, азидо, галоген, циано, нитро, гидрокси, Prot-O, Асt-О, меркапто, Prot-S, Асt-S, С1-6алкилтио, амино, Prot-N(RН)-, Асt-N(RН)-, моно или ди(С1-6алкил)амино, необязательно замещенный С1-6алкокси, необязательно замещенный С1-6алкил, необязательно замещенный монофосфат, монотиофосфат, дифосфат, дитиофосфат, трифосфат и тритиофосфат, где Prot представляет собой защитную группу для -ОН, -SН и -NН(RН), соответственно, Асt представляет собой активирующую группу для -ОН, -SН и -NН(RН), соответственно, а RН выбран из водорода и С1-6алкила.
Защитные группы (Prot) заместителей гидрокси (и серы) включают замещенный тритил, такой как 4,4'-диметокситритилокси (DМТ), 4-монометокситритилокси (ММТ) и тритилокси, необязательно замещенный 9-(9-фенил)ксантенилокси (пиксил), необязательно замещенный метокситетрагидропиранилокси (mthp), силилокси, такой как триметилсилилокси (ТМS), триизопропилсилилокси (TIPS), трет-бутилдиметилсилилокси (TBDMS), триэтилсилилокси и фенилдиметилсилилокси, трет-бутиловые эфиры, ацетали (включающие две гидроксигруппы), ацилокси, такой как ацетил или замещенные галогеном ацетилы, например хлорацетилокси или фторацетилокси, изобутирилокси, пивалоилокси, бензоилокси и замещенные бензоилы, метоксиметилокси (МОМ) и бензиловые эфиры или замещенные бензиловые эфиры, такие как 2,6-дихлорбензилокси (2,6-Cl2Bzl). Предпочтительные защитные группы заместителей гидрокси (и серы) включают замещенный тритил, такой как 4,4'-диметокситритилокси (DMT), 4-монометокситритилокси (ММТ), необязательно замещенный 9-(9-фенил)ксантенилокси (пиксил), необязательно замещенный метокситетрагидропиранилокси (mthp), силилокси, такой как триметилсилилокси (TMS), триизопропилсилилокси (TIPS), трет-бутилдиметилсилилокси (TBDMS), триэтилсилилокси и фенилдиметилсилилокси, трет-бутиловые эфиры, ацетали (включающие две гидроксигруппы) и ацилокси, такой как ацетил.
Репрезентативными примерами защитных групп амидо- и амидогрупп являются флуоренилметоксикарбониламино (Fmoc), трет-бутилоксикарбониламино (ВОС), трифторацетиламино, аллилоксикарбониламино (alloc, AOC), Z-бензилоксикарбониламино (Cbz), замещенные бензилоксикарбониламины, такие как 2-хлорбензилоксикарбониламино (2-CIZ), монометокситритиламино (ММТ), диметокситритиламино (DMT), фталоиламино и 9-(9-фенил)ксантениламино (пиксил). Предпочтительными примерами являются флуоренилметоксикарбониламино (Fmoc), трет-бутилоксикарбониламино (ВОС), трифторацетиламино, аллилоксикарбониламино (alloc, AOC), монометокситритиламино (ММТ), диметокситритиламино (DMT), фталоиламино.
Группа “Act” представляет собой активирующую группу для -ОН, -SH и -NH(RН), соответственно, для присоединения других нуклеотидов, твердофазных носителей, белков и т.п. В вышеуказанных вариантах изобретения, Act означает активирующую группу. Такие активирующие группы, например, выбирают из необязательно замещенного О-фосфорамидита, необязательно замещенного О-фосфотриэфира, необязательно замещенного О-фосфодиэфира, необязательно замещенного Н-фосфоната и необязательно замещенного О-фосфоната. В контексте настоящего изобретения, термин “фосфорамидит” означает группу формулы -Р(ОRх)-N(Ry)2, где Rх означает необязательно замещенную алкильную группу, например, метил, 2-цианоэтил или бензил, а каждый из Ry означает необязательно замещенные алкильные группы, например этил или изопропил, либо группа -N(Ry)2 образует морфолиногруппу (-N(СН2СН2)2О). Rх предпочтительно означает 2-цианоэтил, а два
Ry, предпочтительно, являются идентичными и означают изопропил. Так, например, особенно подходящим фосфорамидитом является N,N-диизопропил-О-(2-цианоэтил)фосфорамидит.
Как упоминалось выше, олигомерные соединения включают нуклеотиды LNA, возможно, в комбинации с нуклеотидами, которые не являются нуклеотидами LNA. Такими нуклеотидами являются дезоксирибонуклеотиды (нуклеотиды ДНК), рибонуклеотиды (нуклеотиды РНК), нуклеотидные производные, нуклеотидные аналоги LNA, нуклеотидные аналоги (соединения, отличающиеся от LNA) и компоненты РNA и т.п.
Нуклеотидные аналоги и нуклеотидные производные описаны, например, в публикациях Freier & Altmann (Nucl. Acid. Res., 1997, 25, 4429-4443) и Uhlmann (Curr. Opinion in Drug & Development (2000, 3(2):293-213). На схеме 1 проиллюстрированы их выбранные примеры:
Схема 1
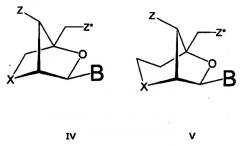
Термин “нуклеотидный аналог LNA” означает бициклические нуклеотидные аналоги, которые в общих чертах описаны в WO 99/14226 и в следующих заявках, WO 00/56746, WO 00/56748, WO 00/66604, WO 00/125248, WO 02/28875, WO 2002/094250 и WO 2003/006475 (РСТ/DK02/00488)(см. выше), за исключением, однако, уже описанных “нуклеотидов LNA”.
Примеры конкретной группы предпочтительных нуклеотидных аналогов LNA представлены формулой 2:
Формула 2 (нуклеотидный аналог LNA)
В формуле 2, Х и Y независимо выбраны из -О-, -S-, -N(Н)-, -N(R)-, -СН2- или -СН- (если они являются частью двойной связи), -СН2-О-, -СН2-S-, -СН2-N(Н)-, -СН2-N(R)-, -СН2-СН2- или -СН2-СН- (если они являются частью двойной связи), -СН=СН-, где R выбран из водорода и С1-4алкила. Ассиметирические группы могут присутствовать в любой ориентации. В предпочтительных вариантах изобретения, Х представляет собой кислород, а Y выбран из -О-, -S-, -N(Н)- и -N(R)-, но, при этом, не включаются “нуклеотиды LNA” (Х=О и Y=О).
Олигомерное соединение согла