Способ диагностики лейкоза крупного рогатого скота
Иллюстрации
Показать всеИзобретение относится к области ветеринарной биотехнологии. Способ включает проведение поэтапной иммобилизации на твердом носителе антигена вируса лейкоза в результате его специфического иммунологического связывания с адсорбированными моноклональными антителами мыши против гликопротеидного антигена вируса лейкоза, внесение и инкубацию контрольных и анализируемых образцов сыворотки крови или молока крупного рогатого скота, внесение и инкубацию антител к иммуноглобулинам крупного рогатого скота, меченных пероксидазой, внесение субстрата ферментативной реакции и учет результатов реакции по величине оптической плотности анализируемых образцов. При этом иммобилизацию антигена вируса лейкоза проводят в три этапа. Первый этап - неспецифическая адсорбция моноклональных антител мыши к глобулинам овцы 1Н8, не реагирующих с иммуноглобулинами крупного рогатого скота. Второй этап - специфическое иммунологическое связывание с указанными антителами моноклональных антител овцы к гликопротеидному антигену вируса лейкоза крупного рогатого скота 8С12. Третий этап - специфическое иммунологическое связывание гликопротеидного антигена вируса лейкоза с моноклональными антителами овцы к этому антигену и выявление антител к вирусу лейкоза в сыворотке крови и молоке крупного рогатого скота добавлением конъюгата с пероксидазой моноклональных антител мыши против глобулинов крупного рогатого скота 5А10, не реагирующих с иммуноглобулинами овцы. Способ обладает высокой чувствительностью и специфичностью. 4 табл.
Реферат
Предлагаемое изобретение относится к области ветеринарной биотехнологии, в частности к разработке способов диагностики лейкоза животных, и может быть использовано в ветеринарии.
Вирус лейкоза крупного рогатого скота вызывает злокачественное лимфопролиферативное заболевание крупного рогатого скота - лейкоз, который занимает первое место в структуре инфекционной патологии крупного рогатого скота в Российской Федерации. Инфекционный процесс характеризуется отсутствием виремии с одновременной продукцией антител к белкам вируса, среди которых преобладают антитела к гликопротеиду вирусной оболочки (gp51).
Диагностика лейкоза включает комплекс патоморфологических, гистологических, гематологических, вирусологических, молекулярно-биологических и серологических методов исследования, из которых последние применяются наиболее широко. Чувствительность серологических способов особенно высока в тех случаях, когда они направлены на выявление антител к гликопротеиду gp51.
Высокой чувствительностью и специфичностью при выявлении антител к вирусу лейкоза обладают способы на основе принципа иммуноферментного анализа (ИФА).
Известен способ диагностики лейкоза крупного рогатого скота путем определения антител к вирусу лейкоза крупного рогатого скота методом непрямого иммуноферментного анализа. Его проведение включает:
- сенсибилизацию лунок планшетов для микротитрования очищенным антигеном вируса лейкоза крупного рогатого скота;
- внесение и инкубацию контрольных и анализируемых образцов;
- внесение и инкубацию видоспецифических антител, меченных ферментом; после каждой стадии проведения анализа проводят отмывание лунок планшетов от несвязавшихся реагентов;
- внесение субстрата ферментативной реакции.
Учет результатов реакции проводят по величине оптической плотности анализируемых образцов (1).
Очистка антигена, входящего в состав тест-системы, представляет сложный и трудоемкий процесс. Антиген вируса лейкоза получают из культуральной жидкости перевиваемых культур клеток, в частности культуры клеток почки эмбриона овцы, хронически инфицированной вирусом лейкоза. Культивирование вируспродуцирующих культур осуществляют на ростовых питательных средах, дополненных чаще всего 10-20% сыворотки крови эмбрионов коровы, или реже - телят, ягнят, взрослых коров, лошадей и др. Продукция вируса чрезвычайно низкая. Многоэтапная процедура очистки вируса или его антигенов требует дорогостоящей сложной аппаратуры. Препарат антигена, даже полученный в условиях лаборатории, загрязнен примесями клеточного и сывороточного происхождения, что приводит к снижению специфичности анализа. Кроме того, очистка приводит к потере вирионами поверхностного гликопротеида и, как следствие, - снижению чувствительности анализа.
Использование моноклональных антител для иммобилизации антигена на пластике планшета для титрования позволяет избежать процедуры очистки антигена и при этом значительно повысить специфичность и чувствительность анализа по сравнению с тест-системами, в которых сенсибилизацию твердой фазы осуществляют непосредственной адсорбцией очищенного вируса лейкоза крупного рогатого скота.
Известен также способ диагностики лейкоза методом иммуноферментного анализа с использованием моноклональных антител к гликопротеидному антигену, характеризующийся высокой специфичностью и чувствительностью. Способ заключается в последовательной инкубации в лунках планшета компонентов тест-системы и анализируемого материала по следующей схеме:
- сенсибилизация поверхности лунок планшета для титрования специфическим антигеном, которую проводят в два этапа:
а) первый этап - неспецифическая адсорбция моноклональных антител мыши против гликопротеидного антигена крупного рогатого скота на поверхности лунок панелей для микротитрования;
б) второй этап - специфическое иммунологическое связывание неочищенного гликопротеидного антигена gp51 вируса лейкоза крупного рогатого скота с адсорбированными моноклональными антителами;
- внесение и инкубация контрольных образцов и анализируемых сывороток крови крупного рогатого скота (предпочтительное разведение последних - 1:60);
- внесение и инкубация конъюгата антител или Fab-фрагментов антител против глобулинов крупного рогатого скота с ферментом; после каждой стадии проведения анализа проводят отмывание лунок планшетов от не связавшихся реагентов;
- добавление субстратной смеси.
Учет результатов реакции проводят по величине оптической плотности анализируемых образцов.
При проведении сравнительных исследований 678 сывороток крови крупного рогатого скота методами РДП и ИФА было выявлено: РДП+/ ИФА+119; РДП-/ИФА- 552; ИФА+/РДП- 7; ИФА-/РДП+0 (2). Прототип.
Чувствительность и специфичность этого способа позволяют выявить вирусоносителей, продуцирующих антитела в титрах, не выявляемых в реакции диффузионной преципитации, и использовать в качестве материала для исследования как индивидуальные, так и сборные пробы сыворотки крови и молока крупного рогатого скота. Это позволяет повысить эффективность противолейкозных мероприятий и сократить сроки их проведения.
Вместе с тем, получение моноклональных антител к гликопротеидному антигену вируса лейкоза крупного рогатого скота встречает ряд препятствий. Так, иммунизация мышей, не являющихся чувствительным к вирусу лейкоза крупного рогатого скота видом, неэффективна. Мышь отвечает на иммунизацию недостаточно интенсивным образованием клеток, продуцирующих антитела; кроме того, содержание гликопротеидного антигена в препаратах очищенных вирионов очень низкое. Иммунизация мышей очищенным гликопротеидным антигеном более эффективна, однако сама процедура очистки довольно трудоемкая при низком выходе продукта.
В задачу наших исследований входило - разработать чувствительный и специфичный способ диагностики лейкоза крупного рогатого скота методом ИФА с использованием моноклональных антител к гликопротеидному антигену gp51, полученных методом межвидовой гибридизации с участием чувствительной лабораторной модели.
Нами разработан способ диагностики лейкоза крупного рогатого скота путем определения вирусоносительства методом непрямого иммуноферментного анализа с использованием моноклональных антител к гликопротеидному антигену вируса лейкоза крупного рогатого скота.
Сущность предложенного способа заключается в следующем.
На поверхности твердофазного носителя иммобилизуют антиген вируса лейкоза в 3 этапа, первый из которых - неспецифическая адсорбция моноклональных антител мыши к глобулинам овцы, не реагирующих с иммуноглобулинами крупного рогатого скота, второй - специфическое иммунологическое связывание с указанными антителами моноклональных антител овцы к гликопротеидному антигену вируса лейкоза и третий - специфическое иммунологическое связывание гликопротеидного антигена вируса лейкоза с моноклональными антителами овцы к этому антигену. Далее вносят и инкубируют испытуемый материал, вносят и инкубируют меченные пероксидазой моноклональные антитела мыши против глобулинов крупного рогатого скота, не реагирующих с иммуноглобулинами овцы. После проведения каждого этапа реакции отмывают несвязавшиеся реагенты. Добавляют субстрат ферментативной реакции для выявления связавшихся антител и определяют наличие антител по величине оптической плотности испытуемых образцов по сравнению с контролем.
Для осуществления способа используют тест-систему, в которую входят:
- сенсибилизированный антигеном вируса лейкоза крупного рогатого скота планшет для микротитрования;
- меченные пероксидазой моноклональные антитела против глобулинов крупного рогатого скота;
- контрольные положительные и отрицательные образцы сыворотки крови и молока.
Кроме того, используют субстратную смесь перекиси водорода и хромогена (донор протонов), разбавители компонентов реакции и раствор для промывки планшетов.
Получение компонентов тест-системы
Для изготовления сенсибилизированного антигеном вируса лейкоза твердофазного носителя используют моноклональные антитела 1Н8 против глобулина IgG крупного рогатого скота, моноклональные антитела 8С12 к гликопротеидному антигену вируса лейкоза крупного рогатого скота и антиген вируса лейкоза крупного рогатого скота.
Моноклональные антитела к IgG овцы продуцируют клетки штамма гибридомной линии клеток 1Н8, депонированного в 2007 г. в «Специализированной коллекции перевиваемых соматических культур сельскохозяйственных и промысловых животных» (СХЖ РАСХН) под №73.
Клетки штамма в дозе 2-10×106 клеток/мышь в 0,5 мл фосфатно-солевого буфера вводят в брюшную полость линейных мышей BALB/c, которым предварительно за 7 суток ввели 0,3 мл пристана. На 10-14 сутки получают асцитическую жидкость, титр специфических моноклональных антител к IgG овцы в которой составил в ИФА 1:640-1:5120. Препарат моноклональных антител получают из асцитической жидкости трехкратным осаждением раствором сульфата аммония 50% насыщения с последующим диализом против фосфатно-солевого буферного раствора, рН 7,2-7,4 и определяют концентрацию белка и активность антител.
Моноклональные антитела к гликопротеидному антигену gp51 вируса лейкоза крупного рогатого скота продуцируют клетки штамма межвидовой гибридной линии клеток 8С12, депонированного в 2007 г. в СХЖ РАСХН под №72.
Клетки штамма 8С12 культивируют в стеклянных матрасах при температуре 37°С в питательной среде, состоящей из среды RPMI-1640, 10% сыворотки крови эмбрионов коровы и антибиотиков (пенициллина и стрептомицина по 500000 ед/л). Оптимальная плотность посадки составляет 2×10 клеток/мл среды. Через 3-5 суток после образования суспензии культуральную жидкость частично удаляют и добавляют необходимое количество свежей питательной среды. Определяют титр антител к гликопротеидному антигену ВЛКРС в культуральной жидкости методом иммуноферментного анализа с очищенным антигеном ВЛКРС и видоспецифическими антителами кролика против глобулинов овцы, меченными пероксидазой. В культуральной жидкости он составил 1:32-1:64. Культуральную жидкость осветляют центрифугированием при 5-10 тыс.об/мин в течение 20-30 мин при 4°С.
Антиген вируса лейкоза крупного рогатого скота продуцирует хронически инфицированная перевиваемая культура клеток FLK-BLV (3).
Изготовление антигена вируса лейкоза крупного рогатого скота осуществляют по одному из следующих способов.
Культивирование культуры FLK-BLV в стационарном режиме проводят в стеклянных матрасах при температуре 37°С в питательной среде, состоящей из среды Игла базальной или MEM с двойной концентрацией аминокислот и витаминов, дополненной 10 объемными процентами сыворотки крови эмбрионов коров. Оптимальная плотность посадки клеток составляет 1-2×105 клеток/мл среды. На 6-7 сутки культивирования собирают культуральную жидкость, осветляют центрифугированием при 5-10 тыс. об/мин в течение 20-30 мин при 4°С и используют для изготовления сенсибилизированного антигеном ВЛКРС твердофазного носителя.
Культивирование культуры FLK-BLV в роллерном режиме проводят в стеклянных бутылях вместимостью 5 л на среде, содержащей 45 объемных процентов среды Игла, 45 объемных процентов гидролизата лактальбумина и 10 объемных процентов сыворотки эмбрионов коровы при температуре 37°С. Оптимальная плотность посадки клеток составляет 1-2×105 клеток на 1 мл среды. Монослой формируется в течение 3-4 суток. На 8-11 сутки культивирования собирают культуральную жидкость, осветляют фильтрованием и используют для изготовления сенсибилизированного антигеном вируса лейкоза твердофазного носителя.
Культивирование культуры FLK-BLV в ферментерах для монослойного культивирования клеток Girogen G300 и G600 (Нетар, Швейцария) осуществляют, согласно «Способу получения антигена вируса лейкоза крупного рогатого скота» (патент РФ №2020960, МКИ5 А61К 39/12 15.10.94 г.), с использованием ростовой среды, содержащей среду Игла, ФГМС, сыворотку крови лошадей или северных оленей и витаминно-солевые добавки (5). Посевная концентрация клеток составила 4×10 клеток/мл ростовой среды. Культуру выращивают при 37°С в течение 7-10 суток без смены среды. При формировании клеточного монослоя культуральную жидкость сливают. Полученную культуральную жидкость осветляют фильтрованием и используют в качестве источника антигена вируса лейкоза для изготовления сенсибилизированного твердофазного носителя для иммуноферментного анализа.
Контроль специфичности и активности антигена осуществляют в реакции диффузионной преципитации (РДП) после концентрирования культуральной жидкости в 10-100 раз. Антиген должен образовывать полосу преципитации с контрольной стандартной антисывороткой, идентичную полосе преципитации, образованной контрольным стандартным антигеном и контрольной стандартной антисывороткой. Активность гликопротеидного антигена должна быть не ниже, чем 1:16-1:64.
Изготовление сенсибилизированного гликопротеидным антигеном твердофазного носителя проводят в три этапа.
1 этап. Препарат моноклональных антител 1Н8 к иммуноглобулину IgG овцы разбавляют фосфатно-солевым буферным раствором рН 7,2-7,4 до концентрации белка 5 мкг/мл и вносят в 96-луночные планшеты для микротитрования по 100 мкл в каждую лунку. Инкубируют в течение 16 час при 2-8°С, отмывают от несвязавшихся антител промывочным раствором.
2 этап. Вносят в каждую лунку по 100 мкл культуральной жидкости, содержащей моноклональные антитела 8С12, инкубируют в течение 1,5 час при температуре 37°С, отмывают от несвязавшихся антител промывочным раствором.
3 этап. Вносят в каждую лунку по 100 мкл культуральной жидкости, содержащей вирус лейкоза крупного рогатого скота, инкубируют в течение 1,5 час при температуре 37°С, отмывают от несвязавшегося антигена промывочным раствором. Подсушивают планшет на воздухе при комнатной температуре (18-22°С) в течение 16 час. Упаковывают герметически в ламинированную фольгу или полиэтилен, удаляя излишки воздуха.
Изготовление контрольных сывороток и молока
Контрольной положительной сывороткой и молоком служат сыворотка крови и молоко коровы, инфицированной вирусом лейкоза крупного рогатого скота. Контрольная положительная сыворотка оттитрована по национальному стандарту чувствительности метода иммуноферментного анализа для выявления антител к вирусу лейкоза в биологических жидкостях крупного рогатого скота. Контрольными отрицательными сывороткой крови и молоком служат сборные сыворотка крови и молоко, полученные не менее чем от 10 коров, свободных от индуцированной вирусом лейкоза инфекции, из благополучного по лейкозу хозяйства.
Изготовление меченных пероксидазой моноклональных антител против иммуноглобулина IgG крупного рогатого скота поводят с использованием штамма гибридомной линии клеток 5А10, депонированного в 2007 г. в СХЖ РАСХН под №71. Клетки штамма линии 5А10 в дозе 2-10×106 клеток на мышь в 0,5 мл фосфатно-солевого буфера вводят в брюшную полость линейных мышей BALB/c, которым предварительно за 7 суток ввели 0,3 мл пристана. На 10-14 сутки получали асцитическую жидкость с активностью моноклональных антител в ИФА 1:640-1:5120, из которой затем выделяют антитела трехкратным осаждением раствором сульфата аммония 50% от насыщения с последующим диализом против 0,01 М натрий-карбонатного буфера, рН 9,5. Содержание антител в препарате (по белку) составило 10-12 мг/мл. Связывание антител с пероксидазой из корней хрена проводят методом, разработанным Wilson, Nakane, после активации фермента периодатом натрия (4). Полученный конъюгат титруют методом иммуноферментного анализа. Активность полученного конъюгата в иммуноферментном анализе для выявления антител к вирусу лейкоза крупного рогатого скота составила 1:5000-1:30000.
Проведение иммуноферментного анализа для выявления антител к вирусу лейкоза крупного рогатого скота состоит в следующем.
В планшеты для микротитрования, сенсибилизированные гликопротеидным антигеном вируса лейкоза крупного рогатого скота, вносят по 0,1 мл разбавителя для проб и конъюгата, 0,004 мл положительных и контрольных образцов сыворотки крови и/или молока, содержимое лунок тщательно перемешивают, планшет накрывают крышкой и инкубируют при 37°С в течение 1,5 час. Затем содержимое лунок удаляют и лунки трижды промывают промывочным раствором, внося его по 0,3 мл в каждую лунку. Затем вносят в каждую лунку по 0,1 мл рабочего раствора конъюгата моноклональных антител 5А10 против иммуноглобулинов IgG крупного рогатого скота с пероксидазой, планшет накрывают крышкой и инкубируют 1,5 часа при температуре 37°С. Содержимое лунок удаляют и четырежды промывают промывочным раствором. Далее вносят в каждую лунку по 0,1 мл субстратной смеси, содержащей хромоген и перекись водорода, и оставляют при температуре 18-22°С на 5-10 мин в защищенном от прямых солнечных лучей месте. Измеряют оптическую плотность раствора в лунках. Тест считают достоверным, если:
- значение оптической плотности положительного контроля превышает 0,5;
- отношение между величинами оптической плотности положительного и отрицательного контроля P/N не менее 2.
Реакцию считают положительной, если оптическая плотность раствора в лунке испытуемой пробы превышает оптическую плотность раствора в лунке отрицательного контроля (P/N) в 2 раза и более.
Осуществление способа диагностики отражено в конкретных примерах.
Пример 1. Изготовление тест-системы и оценка достоверности теста для определения антител к вирусу лейкоза крупного рогатого скота в сыворотках крови Изготовление тест-системы и проведение анализа с контрольными сыворотками и контролем уровня фоновой реакции тест-системы («холостая проба» с разбавителем сывороток и конъюгата) осуществляют, как описано выше. Установку нуля фотометра осуществляют против пустого планшета той же серии, которая была использована для изготовления тест-системы.
Результаты проведения измерений приведены в таблице 1.
Полученные в результате измерений значения оптической плотности составляют: для холостой пробы - менее 0,05(0,02-0,04); для отрицательной контрольной сыворотки 0,100-0,130; для положительной контрольной сыворотки ≥0,5.
| Таблица 1Оценка достоверности тест-системы с использованием антигена вируса лейкоза, полученного разными способами | ||||
| Способ получения антигена | Значения оптической плотности | Отношение P/N | ||
| Фоновое | отрицательного контроля | положительного контроля | ||
| FLK-BLV, стационарный режим, среда Игла MEM, ДМЕМ, 10% сыворотки эмбрионов коров | <0,05 | 0,118 | 0,648 | 5,5 |
| FLK-BLV, роллерный режим, 45%среды Игла MEM, 45%ГЛА, 10% сыворотка эмбрионов коров | <0,05 | 0,104 | 0,894 | 8,5 |
| FLK-BLV, ферментеры Girogen, Игла MEM, ФГМС, 10% сыворотки лошади | <0,05 | 0,125 | 0,536 | 4,3 |
Для всех испытанных препаратов антигена вируса лейкоза тест характеризовался низкой фоновой оптической плотностью и был высокодостоверным (P/N>2).
Пример 2. Оценка достоверности тест-системы при исследовании молока Тест-систему для выявления носителей вируса лейкоза крупного рогатого скота методом непрямого иммуноферментного анализа готовили, как описано выше, с использованием антигена вируса лейкоза, изготовленного путем роллерного культивирования линии клеток FLK-BLV. В качестве материала исследования применяли молоко инфицированной коровы. Контролем служило молоко коровы, свободной от вируса лейкоза крупного рогатого скота. Параллельно раститровывали контрольную положительную пробу сыворотки крови. Результаты исследования приведены в таблице 2.
| Таблица 2Достоверность использования тест-системы для выявления антител к вирусу лейкоза крупного рогатого скота при исследования молока | |||
| Разведение контрольных положительных проб | Оптическая плотность | Отношение P/N | |
| Положительной пробы | Отрицательной пробы | ||
| А) сыворотки крови | |||
| 1:100 | 1,077 | 0,107 | 10 |
| 1:200 | 0,564 | 0,124 | 4,5 |
| 1:400 | 0,362 | 0,104 | 3,5 |
| 1:800 | 0,143 | 0,130 | ≤2 |
| Б) молока | |||
| 1:500 | 0,704 | 0,099 | 7 |
| 1:1000 | 0,339 | 0,089 | 4 |
| 1:2000 | 0,211 | 0,088 | 2 |
| 1:4000 | 0,162 | 0,123 | ≤2 |
Титр антител в молоке составил 1:2000. Полученные результаты свидетельствуют о возможности применения и высокой достоверности предложенного способа для диагностики лейкоза крупного рогатого скота с использованием молока в качестве материала для исследования.
Пример 3. Сравнение чувствительности и специфичности серологических способов диагностики лейкоза - РДП и ИФА
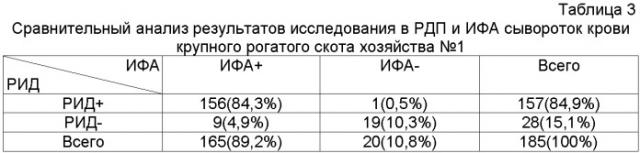
Тест-систему для выявления носителей вируса лейкоза крупного рогатого скота методом непрямого иммуноферментного анализа готовили, как описано выше, с использованием антигена вируса лейкоза, изготовленного путем стационарного культивирования линии клеток FLK-BLV. В 2006 г. проводили параллельное исследование 185 сывороток крови крупного рогатого скота из неблагополучного по лейкозу хозяйства №1 (закрытого типа) в данной тест-системе и реакции диффузионной преципитации. Результаты исследования приведены в таблице 3.
Совпадение результатов (РДП+/ИФА+ и РДП-/ИФА-) отмечено в 94,6% случаев, несовпадение (РДП+/ИФА- и РДП-/ИФА+) - в 5,4% случаев. В ИФА было выявлено 9 (4,9% от числа исследованных) положительных проб, отрицательных в РДП. Одна проба (0,5% от числа исследованных), положительная по РДП, дала отрицательный результат в ИФА. Как видно из таблицы, предложенный способ является более чувствительным, по сравнению с РДП.
Пример 4. Чувствительность и специфичность иммуноферментного анализа с использованием моноклональных антител для исследования сывороток крови Тест-систему для выявления носителей вируса лейкоза крупного рогатого скота методом непрямого иммуноферментного анализа готовили, как описано выше. В качестве антигена вируса лейкоза использовали препарат, полученный в режиме роллерного культивирования линии клеток FLK-BLV. В 2007 г. проводили параллельное исследование 662 сывороток крови крупного рогатого скота из неблагополучного по лейкозу хозяйства №2 (закрытого типа) в данной тест-системе и реакции диффузионной преципитации.
Совпадение результатов (РДП+/ИФА+; РДП-/ИФА-) отмечали в 560 или 84,6%, несовпадение (РДП+/ИФА-; РДП-/ИФА+) - в 15,4% случаев. Только 3 положительные по результатам РДП пробы прореагировали отрицательно в ИФА (0,5%). В ИФА было выявлено 190 (28,7%) положительных проб, тогда как в РДП - только 94 (14,2%), т.е. на 14,5% или в два раза больше.
Из таблицы 4 видно, что по чувствительности метод иммуноферментного анализа превосходил РДП с гликопротеидным антигеном в 2 раза и не уступал ей по специфичности.
Пример 5. Чувствительность и специфичность способа диагностики лейкоза крупного рогатого скота методом иммуноферментного анализа по сравнению с РДП и полимеразной цепной реакции (ПЦР)
Тест-систему для выявления носителей вируса лейкоза крупного рогатого скота методом непрямого иммуноферментного анализа готовили, как описано выше. В качестве антигена вируса лейкоза использовали препарат, полученный в режиме культивирования линии клеток FLK-BLV в ферментерах типа Girogen. Проводили исследование 116 телок из того же хозяйства №2 в 2007 г. Уровень инфицированности взрослого поголовья хозяйства превышает 60%. Группа животных была сформирована из отрицательно реагирующих по результатам РДП телок. Через 2 месяца после формирования группы методом РДП было вновь выявлено 4 серопозитивных животных (3,4% от числа исследованных). Отрицательно прореагировавших в РДП исследовали методом ИФА и выявили дополнительно 5 положительно реагирующих животных (4,5% от числа исследованных). Инфицированность в группе, по результатам серологических исследований (РДП+ИФА), составила 7,8%. Реагирующих отрицательно в двух тестах (РДП+ИФА) исследовали методом ПЦР и выявили 1 положительно реагирующую телку (0,9%).
Эти результаты свидетельствуют о том, что по чувствительности предложенный способ значительно превосходит РДП и приближается к прямому диагностическому тесту - полимеразной цепной реакции (ПЦР).
Приведенные примеры свидетельствуют о высокой специфичности и чувствительности предложенного способа диагностики лейкоза путем выявления носителей возбудителя болезни методом непрямого иммуноферментного анализа, независимо от способа получения вирусного антигена.
Технико-экономическое обоснование
Предложенный способ диагностики лейкоза крупного рогатого скота, индуцированного вирусом лейкоза крупного рогатого скота, методом непрямого иммуноферментного анализа характеризуется следующими полезными свойствами:
- обладает высокими чувствительностью и специфичностью вследствие использования при изготовлении тест-системы трех моноклональных антител;
- является методом экспресс-диагностики, позволяющим получить результаты анализа в течение одного рабочего дня;
- включает объективную оценку результатов и поддается автоматизации;
- позволяет использовать в качестве материала для исследования не только сыворотку крови, но и молоко, что выгодно экономически и снижает риск распространения инфекции при взятии крови.
Предложенный способ диагностики лейкоза апробирован с положительным результатом в лабораторных условиях лаборатории лейкозологии ГНУ Всероссийский институт экспериментальной ветеринарии им. Я.Р.Коваленко и Курской биофабрики с 2006 по 2007 гг.
Способ диагностики лейкоза крупного рогатого скота методом иммуноферментного анализа найдет применение в ветеринарии, что позволит повысить эффективность оздоровительных мероприятий, сократить сроки оздоровления неблагополучных по лейкозу животноводческих хозяйств и в итоге - резко снизить заболеваемость крупного рогатого скота лейкозом.
Источники информации
1. Ж. Aim. Rech. Vet. 1978. - 9(4). - 663-666.
2. Ж. J.Virol.Meth. - 1983 - v.6. - 19-29.
3. Ж. Bibliotheca Haematologica - 1976. - v.43. - 255-259.
4. Кн. "Immunofluorescence and related staining techniques" non ред. W Knapp. - Elsevier: North-Holland Biomedical Press. - 1978. - 215-221.
5. Патент РФ №2020960, МКИ5 А61К 39/12; 1994 г.
Способ диагностики лейкоза крупного рогатого скота, включающий проведение поэтапной иммобилизации на твердом носителе антигена вируса лейкоза в результате его специфического иммунологического связывания с адсорбированными моноклональными антителами мыши против гликопротеидного антигена вируса лейкоза, внесение и инкубацию контрольных и анализируемых образцов сыворотки крови или молока крупного рогатого скота, внесение и инкубацию антител к иммуноглобулинам крупного рогатого скота, меченных пероксидазой, внесение субстрата ферментативной реакции и учет результатов реакции по величине оптической плотности анализируемых образцов, отличающийся тем, что иммобилизацию антигена вируса лейкоза проводят в три этапа, первый из которых - неспецифическая адсорбция моноклональных антител мыши к глобулинам овцы 1Н8, не реагирующих с иммуноглобулинами крупного рогатого скота, второй - специфическое иммунологическое связывание с указанными антителами моноклональных антител овцы к гликопротеидному антигену вируса лейкоза крупного рогатого скота 8С12 и третий - специфическое иммунологическое связывание гликопротеидного антигена вируса лейкоза с моноклональными антителами овцы к этому антигену и выявление антител к вирусу лейкоза в сыворотке крови и молоке крупного рогатого скота добавлением конъюгата с пероксидазой моноклональных антител мыши против глобулинов крупного рогатого скота 5А10, не реагирующих с иммуноглобулинами овцы.