Комбинированные вакцины против бактериального менингита для введения через слизистую оболочку
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к изготовлению вакцин для интраназального введения. Предложена композиция для доставки через слизистую оболочку, включающая два или более из следующих агентов: антиген капсулярного олигосахарида, который индуцирует иммунный ответ против Haemophilus influenzae; и (b) антиген капсулярного олигосахарида, который индуцирует иммунный ответ против Neisseria meningitidis; причем указанные антигены конъюгированы с белком-носителем. Комбинация позволяет однократное введение для иммунизации против двух отдельных возбудителей общего заболевания, а именно, бактериального менингита. 3 н. и 16 з.п.ф-лы, 4 ил.
Реферат
Все документы, процитированные в настоящем документе, целиком включены в него в качестве ссылок.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данная заявка относится к вакцинам против менингита для введения через слизистую оболочку, особенно к вакцинам для интраназального введения.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Менингит представляет собой воспаление тканей, которые покрывают головной и спинной мозг. Он может иметь бактериальную или вирусную природу; бактериальный менингит является обычно более тяжелым.
Главным возбудителем бактериального менингита является Neisseria meningitidis (менингококк), однако существующие другие возбудители менингита включают в себя Streptococcus pneumoniae (пневмококк), Haemophilus influenzae (Hib) и Streptococcus agalactiae (GBS). N.meningitidis вызывает также менингококковую септицемию, которая представляет собой главную особенность инфекции, угрожающую жизни.
Вакцины для защиты от инфекции Hib существуют много лет. Вакцина, которая защищает от менингококка серогруппы С ("MenС"), была внедрена в нескольких европейских странах в 1999-2000 г.г. Пневмококковая вакцина вошла в обычную практику в Америке в 2000 г.
Вакцины против указанных трех возбудителей основаны на антигенных капсулярных полисахаридах, которые конъюгированы с белками-носителями для усиления иммуногенности полисахаридов. Данные вакцины вводят путем инъекции, хотя были описаны исследования на мышах по доставке через слизистую оболочку, например, ссылка 1 описывает интраназальное введение конъюгированных вакцин Hib, а ссылка 2 описывает интраназальное введение конъюгированных вакцин MenС (см. также ссылку 3). Доставка вакцин через слизистую оболочку является привлекательным подходом для преодоления проблемы большого количества инъекций, которые производят маленьким детям. Кроме того, поскольку большинство возбудителей сначала инфицируют поверхности слизистых оболочек, приобретение иммунитета слизистой оболочкой на месте инфицирования, возможно, внесет свой вклад в оптимальный защитный иммунитет.
Также описана интраназальная и орофарингеальная доставка вакцин против менингококка серогруппы В ("MenВ") [например, ссылка 4], а также интраназальная доставка бактерий В.pertussis, которые экспрессируют трансферрин-связывающий белок В N.meningitidis [5]. В публикации 6 описана интраназальная доставка пневмококковых конъюгированных вакцин [см. также ссылки 7 и 8].
Целью настоящего изобретения является разработка улучшенной доставки вакцин против менингита через слизистую оболочку.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композиции для доставки через слизистую оболочку, содержащей два или более из следующих агентов: (а) антиген, который индуцирует иммунный ответ против Haemophilus influenzae; (b) антиген, который индуцирует иммунный ответ против Neisseria meningitidis; и (с) антиген, который индуцирует иммунный ответ против Streptococcus pneumoniae.
Комбинирование различных антигенов сокращает количество различных доз, которые необходимо ввести с целью иммунизации против многочисленных возбудителей. Обычно это представляется как преимущество для вакцин, вводимых путем инъекции, когда количество болезненных инъекций уменьшается, но это является менее важным для вакцин, доставляемых через слизистую оболочку (например, интраназальных вакцин), в силу менее выраженного дискомфорта, связанного с доставкой. Однако комбинированные антигенные композиции являются выгодными даже для доставки через слизистую оболочку, поскольку улучшается соблюдение пациентом режима и схемы вакцинации, а также облегчается перевозка и хранение лекарственных средств.
Несмотря на то, что объединение антигенов в единую дозу является привлекательным [например, ссылки 9-12], оно представляет трудности в силу взаимодействий между различными компонентами после объединения, особенно в жидких композициях [13]. Возникающие проблемы включают в себя взаимодействие антигенов, конкуренцию антигенов [14, 15], деградацию антигенов, подавление эпитопов и совместимость с адъювантами. Контроль качества смесей также является более трудным. Кроме того, существующие знания в области объединения антигенов относятся к вакцинам, которые вводятся путем инъекции, а не через слизистую оболочку.
Несмотря на указанные трудности, заявители неожиданно установили, что антигены из Haemophilus influenzae, Neisseria meningitidis и/или Streptococcus pneumoniae можно объединять для доставки через слизистую оболочку без отрицательных последствий, которые можно было бы ожидать. Объединение антигенов из указанных трех микроорганизмов также является выгодным, поскольку это позволяет единой дозе бороться с тремя отдельными причинами общего заболевания, а именно, бактериального менингита. Сообщения о комбинированных менингитных вакцинах данного типа имелись ранее [16], но о доставке через слизистую оболочку не сообщалось.
Доставка через слизистую оболочку
Композиция согласно изобретению предназначена для доставки через слизистую оболочку.
Из всех доступных путей доставки через слизистую оболочку интраназальный путь является наиболее практичным, поскольку связан с легким доступом с использованием относительно простых устройств, которые уже производятся в промышленных масштабах. Кроме того, интраназальная иммунизация представляется более эффективной по сравнению с альтернативными путями. Таким образом, предпочтительным путем для доставки через слизистую оболочку является интраназальный путь, и композицию согласно изобретению предпочтительно адаптируют для интраназального введения, такого как введение посредством назального аэрозоля, назальных капель, геля или порошка [например, ссылки 17 и 18].
Альтернативными путями для доставки вакцины через слизистую оболочку являются пероральный, интрагастральный, легочный, интестинальный, ректальный, окулярный и вагинальный пути.
(а.) Антиген Haemophilus influenzae
Антиген H.influenzae в композиции обычно будет представлять собой капсулярный сахаридный антиген. Сахаридные антигены из H.influenzae b хорошо известны.
Выгодно, если сахарид Hib ковалентно конъюгирован с белком-носителем для усиления его иммуногенности, особенно для детей. Изготовление полисахаридных конъюгатов в общем и капсулярного полисахарида Hib, в частности, хорошо документировано [например, ссылки 19-27 и т.п.]. В настоящем изобретении можно использовать любой подходящий конъюгат Hib.
Сахаридная часть конъюгата может представлять собой полисахарид (например, полирибозилрибитолфосфат (PRP) полной длины), но предпочтительно осуществлять гидролиз полисахаридов (например, кислотный гидролиз) для получения олигосахаридов (например, с молекулярной массой от ~1 до ~5 кДа). Если осуществляется гидролиз, гидролизат можно сортировать по размеру, чтобы удалить слишком короткие олигосахариды, которые не являются полноценными иммуногенами. Разделенные по размеру олигосахариды являются предпочтительными сахаридными антигенами.
Предпочтительными белками-носителями являются бактериальные токсины или анатоксины, такие как дифтерийный или столбнячный анатоксины. Последние широко используются в конъюгированных вакцинах. Дифтерийный анатоксин CRM197 является особенно предпочтительным [28]. Другие подходящие белки-носители включают в себя белок наружной оболочки N.meningitidis [29], синтетические пептиды [30, 31], белки теплового шока [32, 33], коклюшные белки [34, 35], белок D из H.influenzae [36], цитокины [37], лимфокины [37], гормоны [37], факторы роста [37], токсин А или В из С.difficile [38], белки, захватывающие железо [39], и т.п. Возможно использование смесей белков-носителей.
Сахаридную часть можно непосредственно или через линкер конъюгировать с белком-носителем. Прямую связь можно осуществлять посредством окисления полисахарида с последующим восстановительным аминированием с использованием белка, как описано, например, в ссылках 40 и 41. Связь посредством линкерной группы можно осуществлять с использованием любой известной процедуры, например, процедур, описанных в ссылках 42 и 43. Подходящие линкеры включают в себя карбонил, адипиновую кислоту, В-пропионамидо [44], нитрофенилэтиламин [45], галогенацилгалогениды [46], гликозидные связи [47], 6-аминокапроновую кислоту [48], ADH [49], части от С4 до C12 [50] и т.п.
Перед конъюгированием сахарид обычно будет активирован или функционализирован. Активация может включать в себя, например, цианилирующие реагенты, такие как CDAP (например, тетрафторборат 1-циан-4-диметиламинпиридиния [51, 52]. В других подходящих методиках используются карбодиимиды, гидразиды, активные сложные эфиры, норборан, п-нитробензойная кислота, N-гидроксисукцинимид, S-NHS, EDC, TSTU; см. также введение к ссылке 53). Предпочтительной методикой является восстановительное аминирование.
Предпочтительный конъюгат включает сахарид Hib, ковалентно связанный с CRM197 посредством янтарного диэфира адипиновой кислоты [54, 55].
Композиции согласно изобретению могут включать более одного антигена Hib.
(b) Антиген Neisseria meningitidis
Антиген N.meningitidis в композиции обычно будет представлять собой капсулярный сахаридный антиген (например, из серогрупп А, С, W135 или Y). Сахаридные антигены из N.meningitidis хорошо известны. В случае антигена из серогруппы В, однако, предпочтительно, чтобы антиген представлял собой белковый антиген, поскольку нативный капсулярный полисахарид MenВ содержит аутоантигены. Если необходимо использовать сахаридный антиген из серогруппы В, предпочтительно использовать модифицированный сахаридный антиген [например, ссылки 56, 57, 58], например, антиген, модифицированный N-пропионилированием. Возможна также химическая модификация сахаридов из других серогрупп.
Сахарид предпочтительно представляет собой олигосахарид, т.е. фрагмент капсулярного полисахарида. Полисахариды можно обрабатывать с получением более коротких олигосахаридов, а последние можно получать путем очистки и/или сортировки по размеру нативных полисахаридов (например, гидролизом в слабой кислоте, нагреванием, хроматографией с сортировкой по размеру и т.п.). Предпочтительные олигосахариды MenС описаны в ссылках 59 и 60.
Сахарид предпочтительно конъюгируют с белком-носителем, как описано выше.
Композиции согласно изобретению могут включать в себя более одного менингококкового антигена. Предпочтительным может быть включение капсулярных сахаридных антигенов по меньшей мере из двух (т.е. 2, 3 или 4) из серогрупп А, С, W135 и Y N.meningitidis [61].
В случае, когда смесь включает в себя капсулярные сахариды из обеих серогрупп А и С, предпочтительно, чтобы соотношение (масс./масс.) сахарид MenА: сахарид MenС превышало 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или выше). Неожиданно наблюдалась улучшенная иммуногенность компонента MenА, когда он присутствовал в избытке (масса/доза) по отношению к компоненту MenС [61].
В случае, когда смесь включала в себя капсулярные сахариды из серогруппы W135 и по меньшей мере один из серогрупп А, С и Y, неожиданно было установлено, что иммуногенность сахарида MenW135 выше при введении в комбинации с сахаридом (сахаридами) из другой серогруппы (серогрупп), чем при введении в отдельности (в той же дозе и т.п.) [61]. Так, способность антигена MenW135 вызывать более интенсивный иммунный ответ, чем иммунный ответ, вызванный эквивалентным количеством того же антигена при доставке вне связи с антигенами из других серогрупп. Подобную усиленную иммуногенность можно определить путем введения антигена MenW135 контрольным животным, а смеси - экспериментальным животным, и сравнением титров антител против этих двух иммуногенов с помощью стандартных исследований, таких как титры бактерий, радиоиммунный анализ, ELISA и т.п. Вакцины, содержащие синергические комбинации сахаридов из серогруппы W135 и других серогрупп, имеют иммунологические преимущества, поскольку они усиливают анти-W135-ответы и/или понижают дозы W135.
В случае, когда используется белковый антиген из серогруппы В, предпочтительно использовать один из белков, описанных в ссылках с 62 по 71. Предпочтительные белковые, антигены включают в себя белок «287» или его производные (например, ΔG287).
Возможно также использовать антиген из наружной мембраны пузырьков (OMV) для серогруппы В [например, 72, 73].
Композиции согласно изобретению могут включать в себя более одного менингококкового антигена.
(с) Антиген Streptococcus pneumoniae
Антиген S.pneumoniae в композиции обычно будет представлять собой капсулярный сахаридный антиген, который предпочтительно конъюгирован с белком-носителем, как описано выше [например, 74, 75, 76].
Предпочтительно включать сахариды из более чем одного серотипа S.pneumoniae. Например, широко используются смеси полисахаридов из 23 различных серотипов, а также конъюгированные вакцины с полисахаридами из 5-11 различных серотипов [77]. Например, PrevNar™ содержит антигены из семи серотипов (4, 6В, 9V, 14, 18С, 19F и 23F), причем каждый сахарид отдельно конъюгирован с CRM197 посредством восстановительного аминирования.
Композиции согласно изобретению могут, таким образом, содержать более одного пневмококкового антигена.
Дополнительные компоненты - адъюванты
Композиции согласно изобретению обычно будут включать в себя адъюванты для слизистой оболочки. Адъюванты для слизистой оболочки содержат, без ограничения, (А) термолабильный энтеротоксин E.coli ("LT") или его детоксифицированные мутанты, такие как мутанты К63 или R72 [например, глава 5 ссылки 78]; (В) холерный токсин («СТ») или его детоксифицированные мутанты [например, глава 5 ссылки 78]; или (С) микрочастицы (т.е. частицы диаметром от ~500 нм до ~10 мкм), сформированные из материалов, которые являются биоразлагаемыми и нетоксичными (например, поли(α-гидроксикислота, полигидроксимасляная кислота, полиортоэфир, полиангидрид, поликапролактон и т.п.); (D) полиоксиэтиленовый эфир или полиоксиэтиленовый сложный эфир [79]; (Е) поверхностно-активный агент эфир полиоксиэтилена и сорбитана в комбинации с октоксинолом [80] или поверхностно-активный агент полиоксиэтиленалкиловый эфир или сложный эфир в комбинации по меньшей мере с одним дополнительным неионогенным поверхностно-активным агентом, таким как октоксинол [81]; (F) хитозан [например, 82]; (G) иммуностимулирующий олигонуклеотид (например, олигонуклеотид CpG), (Н) двунитевая РНК; (I) сапонин [83]; (J) миметики монофосфориллипида А, такие как производные аминоалкилглюкозаминидфосфата, например, RC-529 [84]; или (К) полифосфазин (РСРР). Доступными являются также другие адъюванты для слизистой оболочки [например, см. главу 7 ссылки 85].
Предпочтительными адъювантами для слизистой оболочки являются бактериальные АДФ-рибозилирующие токсины или их мутанты. Например, холерный токсин (СТ) или термолабильный токсин E.coli (LT) являются эффективными адъювантами для слизистой оболочки, как и их детоксифицированные двойники [86]. СТ и LT являются гомологичными и обычно взаимозаменяемыми.
Детоксикацию СТ или LT можно осуществлять химическими или, предпочтительно, генетическими средствами. Подходящие примеры включают в себя LT, имеющий остаток лизина в аминокислотном положении 63 ["LT-K63" - ссылка 87], и LT, имеющий остаток аргинина в аминокислотном положении 72 ["LT-R72" - ссылка 88]. Другие подходящие мутанты включают в себя LT с тирозином в положении 63 ["Y63" - ссылка 89] и различные другие мутанты, описанные в ссылке 90, а именно, D53, К97, К104 и S106, а также их комбинации (например, LT с мутациями D53 и К63).
Композиция может включать в себя биоадгезив [91, 92], такой как микросферы эстерифицированной гиалуроновой кислоты [93], или в предпочтительных вариантах осуществления, мукоадгезив, выбранный из группы, состоящей из сшитых производных поли(акриловой кислоты), поливинилового спирта, поливинилпирролидона, полисахаридов и карбоксиметилцеллюлозы.
Композиции согласно изобретению могут включать в себя более одного адъюванта для слизистой оболочки.
Дополнительные компоненты - антигены
Комбинация антигенов из H.influenzae, N.meningitidis и S.pneumoniae является выгодной, поскольку все указанные микроорганизмы вызывают бактериальный менингит. Антигены, которые индуцируют иммунные ответы против других организмов, также можно включать в композиции согласно изобретению, например,
- антигены из Helicobacter pylori, такие как CagА [94-97], VacA [98, 99], NAP [100, 101, 102], НорХ [например, 103], HopY [например, 103] и/или уреаза.
- антиген из вируса гепатита А, такой как инактивированный вирус [например, 104, 105];
- антиген из вируса гепатита В, такой как поверхностный и/или сердцевинный антигены [например, 105, 106];
- антиген из вируса гепатита С [например, 107];
- антиген из Bordetella pertussis, такой как коклюшный голотоксин (РТ) и нитчатый гемагглютинин (FHA) из В.pertussis, необязательно в комбинации с пертактином и/или агглютиногенами 2 и 3 [например, ссылки 108 и 109];
- дифтерийный антиген, такой как дифтерийный анатоксин [например, глава 3 ссылки 117], например, мутант CRM197 [например, 83];
- столбнячный антиген, такой как столбнячный анатоксин [например, глава 4 ссылки 114];
- антиген из Chlamydia pneumoniae [например, 110, 111, 112, 113, 114, 115, 116];
- антиген из Chlamydia trachomatis [например, 117];
- антиген из Porphyromonas gingivalis [например, 118];
- полиомиелитный антиген (антигены) [например, 119, 120], такой как IPV или OPV;
- антиген (антигены) бешенства [например, 121], такой как лиофилизированный инактивированный вирус [например, 122, RabAvert™];
- антигены кори, эпидемического паротита и/или краснухи [например, главы 9, 10 и 11 ссылки 123];
- антиген (антигены) гриппа [например, глава 19 ссылки 123], такой как гемагглютинин и/или поверхностные белки нейраминидазы;
- антиген (антигены) из парамиксовируса, такого как респираторно-синцитиальный вирус (RSV [124, 125]) и/или вирус парагриппа (PIV3 [126]);
- антиген из Moraxella catarrhalis [например, 127];
- антиген из Streptococcus agalactiae (стрептококк группы В) [например, 128, 129];
- антиген из Streptococcus pyogenes (стрептококк группы А) [например, 129, 130, 131];
- антиген из Staphylococcus aureus [например, 132].
Композиция может включать в себя один или более из указанных дополнительных антигенов.
В случае конъюгата композиция может также включать в себя свободный белок-носитель [133].
Предпочтительно, чтобы композиция не содержала бактерии целиком (не имеет значения, интактные или лизированные).
Композиции согласно изобретению могут включать в себя белки, которые имитируют сахаридные антигены, например, мимотопы [134] или антиидиотипические антитела. Они могут заменять отдельные сахаридные компоненты или дополнять их. В качестве примера, вакцина может содержать пептидный миметик капсулярного полисахарида MenС [135] или MenА [136] вместо самого сахарида.
Композиции согласно изобретению могут включать в себя нуклеиновую кислоту для "генетической иммунизации" [например, 137]. Нуклеиновая кислота будет кодировать белковый компонент композиции и может заменять отдельные белковые компоненты (включая те, которые упомянуты в предыдущем абзаце) или дополнять их. В качестве примера, вакцина может включать в себя ДНК, которая кодирует столбнячный токсин.
Дополнительные компоненты - композиция
Композиция согласно изобретению предпочтительно включает в себя фармацевтически приемлемый носитель.
«Фармацевтически приемлемые носители» включают в себя любой носитель, который сам по себе не индуцирует выработку антител, вредных для индивидуума, получающего композицию. Подходящие носители обычно представляют собой большие, медленно метаболизирующиеся макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, аминокислотные сополимеры, трегалоза [138], липидные агрегаты (такие как капельки масла или липосомы) и инактивированные вирусные частицы. Указанные носители хорошо известны специалистам. Вакцины могут также содержать разбавители, такие как вода, физиологический раствор, глицерин и т.п. Помимо этого, могут присутствовать вспомогательные вещества, такие как увлажняющие или эмульгирующие агенты, буферные вещества и т.п. Носитель будет совместимым с введением через слизистую оболочку. Подробное обсуждение фармацевтически приемлемых наполнителей можно найти в Remington's Pharmaceutical Sciences.
Композиция согласно изобретению предпочтительно является стерильной.
Композиция согласно изобретению предпочтительно содержит буфер.
Композиция согласно изобретению предпочтительно является апирогенной.
Композиция согласно изобретению может быть упакована с ее компонентами (а), (b) и/или (с) в смеси, или данные компоненты могут существовать отдельно друг от друга до тех пор, пока их не потребуется ввести пациенту, и на данной стадии их будут объединять. Когда индивидуальные компоненты существуют отдельно друг от друга, они могут находиться в лиофилизированной форме или в растворе/суспензии. Когда компоненты существуют в смеси, все они будут в лиофилизированной форме или в растворе/суспензии. Лиофилизированные компоненты будут ресуспендированы (например, в буфере) перед введением пациенту. Такие компоненты как адъюванты могут присутствовать в буфере или в лиофилизированном материале.
Иммуногенные композиции
Композиция согласно изобретению предпочтительно представляет собой иммуногенную композицию (например, вакцину). Составление вакцин на основе сахаридов или конъюгатов сахарид-белок хорошо известно специалистам.
Иммуногенные композиции включают в себя иммунологически эффективные количества антигенов, а также любые другие перечисленные компоненты, если это необходимо. Под «иммунологически эффективным количеством» подразумевается, что введение указанного количества индивидууму, как в виде однократной дозы, так и в виде части серии, является эффективным для лечения или профилактики. Данное количество варьирует в зависимости от состояния здоровья и физического статуса индивидуума, подвергаемого лечению, возраста, таксономической группы индивидуума, подвергаемого лечению (например, примат, не являющийся человеком, примат и т.п.), способности иммунной системы индивидуума синтезировать антитела, желательной степени защиты, состава вакцины, оценки лечащим врачом клинической ситуации и других факторов. Ожидается, что данное количество будет попадать в относительно широкие пределы, которые можно определить посредством обычных испытаний.
Способы лечения
После изготовления композиции согласно изобретению можно вводить непосредственно пациенту, обычно человеку. Человеком предпочтительно является ребенок или подросток. Другим предпочтительным классом пациентов являются взрослые женщины и особенно женщины детородного возраста или беременные женщины. Композиции согласно изобретению особенно подходят для пассивной иммунизации детей через организм матери.
Антигены в композиции индуцируют иммунные ответы против определенных бактерий. Указанные иммунные ответы являются предпочтительно защитными, т.е. они защищают пациента от последующего заражения бактериями. Таким образом, композиции согласно изобретению предпочтительно применяют для профилактики (т.е. для предупреждения инфекции), хотя их также можно использовать в терапевтических целях (т.е. для лечения заболевания после заражения). Иммунные ответы предпочтительно включают в себя выработку бактерицидных антител у пациента.
Настоящее изобретение относится к способу получения иммунного ответа у пациента, включающему в себя введение пациенту вакцины через слизистую оболочку (например, интраназально). Иммунный ответ предпочтительно является защитным в отношении бактериального менингита и/или бактериемии, вызванных Haemophilus influenzae, Neisseria meningitidis и/или Streptococcus pneumoniae. Отдельные антигенные компоненты композиций предпочтительно вводят одновременно и в комбинации. В других вариантах осуществления настоящего изобретения, однако, их можно вводить по отдельности, одновременно или последовательно. В случае введения по отдельности компоненты предпочтительно доставляют на одну и ту же поверхность слизистой оболочки.
Настоящее изобретение относится также к композиции согласно изобретению для применения в качестве лекарственного средства.
Настоящее изобретение относится также к применению (а) антигена, который индуцирует иммунный ответ против Haemophilus influenzae, (b) антигена, который индуцирует иммунный ответ против Neisseria meningitidis, и (с) антигена, который индуцирует иммунный ответ против Streptococcus pneumoniae, для изготовления лекарственного средства для иммунизации пациента.
Данные способы и применения согласно изобретению могут включать в себя первоначальный/бустерный режим. Способы и применения согласно изобретению могут представлять собой первоначальную дозу, за которой следует бустер-доза, причем бустер-доза может вводиться через слизистую оболочку или парентеральным путем. Подобно этому, способы и применения согласно изобретению могут вызывать бустерный ответ у пациента, который уже был иммунизирован первоначальной дозой, причем первоначальная доза может вводиться через слизистую оболочку или парентеральным путем. Бустер-дозы могут содержать меньшее количество антигенов, чем в первоначальных дозах, например, в них может использоваться единственный антиген.
Схема лечения при первичном воздействии антигена и/или ревакцинации может представлять собой однократную дозу или множественные дозы. Композиции согласно изобретению могут быть представлены в форме дозированных единиц.
Способы изготовления
Настоящее изобретение относится к способу изготовления композиции согласно изобретению, включающему в себя стадии смешивания двух или более из следующих агентов: (а) антигена, который индуцирует иммунный ответ против Haemophilus influenzae, (b) антигена, который индуцирует иммунный ответ против Neisseria meningitidis, и (с) антигена, который индуцирует иммунный ответ против Streptococcus pneumoniae, и изготовления из полученной смеси композиции для доставки через слизистую оболочку.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
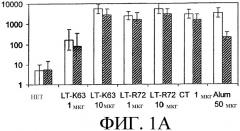
На фиг.1 показано геометрическое среднее титров антител IgG против MenС в сыворотке крови. Отметка на оси Х относится к адъюванту, который использовался. Не закрашенный столбик слева в каждой паре соответствует данным, полученным после введения сахаридного антигена в отдельности, в то время как закрашенный столбик справа соответствует данным, полученным после введения объединенных сахаридных антигенов. На фиг.1А показаны анти-MenС-ответы, а на фиг.1В показаны анти-Нib-ответы. Разброс ошибок сверху представляет собой стандартные отклонения в пределах одной стандартной ошибки.
На фиг.2 показаны титры бактерицидных антител против MenС. Как и на фиг.1, закрашенные данные были получены с использованием объединенных сахаридных антигенов.
На фиг.3 показаны титры IgA против MenС в смыве из полости носа. Как и ранее, закрашенные данные были получены с использованием объединенных сахаридных антигенов.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Комбинированная композиция Hib/MenC
Капсулярный олигосахарид серогруппы С Neisseria meningitidis получали путем избирательной активации концевой восстанавливающейся группы отсортированного по размеру олигосахарида. Тот же способ использовали для Haemophilus influenzae типа В. Сахариды конъюгировали с белком-носителем CRM197 через углеводородный спейсер [139] (Chiron Siena, Италия). Конъюгаты разбавляли физиологическим раствором с фосфатным буфером (PBS) и объединяли (i) с мутантным термолабильным энтеротоксином E.coli LTK63 или LTR72, (ii) с гидроксидом алюминия (Superfos Biosector a/s) или (iii) с холерным токсином (СТ) от компании Sigma. Для комбинированного введения указанные композиции смешивали перед применением.
Введение композиции через слизистую оболочку
Одновременно проводили два идентичных исследования по введению. Группы из 10 самок мышей BALB/C в возрасте 6-10 недель иммунизировали интраназально 10 мкг MenС или Hib no отдельности, в комбинации с СТ (1 мкг) или с мутантами LT (1 мкг и 10 мкг). Для сравнения дополнительную группу мышей иммунизировали в/м 10 мкг MenС или Hib, адсорбированных на Alum. Композиции изготавливали в день иммунизации, и мышей иммунизировали на 0, 21 и 35 день. 50 мкл композиций инъецировали в бедро или закапывали по очереди в разные ноздри мышам, не находящимся под наркозом. Образцы крови брали на 49 день вместе с образцами смывов из концевой части носовой полости (NW).
Для того чтобы оценить, не нарушается ли иммуногенность конъюгатов при смешивании двух вакцин, проводили одновременно третье исследование, в котором две вакцины вводили одновременно одной и той же группе мышей, в тех же дозах и согласно той же схеме, как описано выше.
Иммунологические ответы на композиции
Антительные ответы против конъюгата MenС определяли посредством ELISA с использованием модифицированной методики, как было описано ранее [140]. Кратко, планшеты для ELISA покрывали сахаридом MenС, дериватизированным адипиновым дигидразидом, в течение ночи при 4°С. Специфические антитела обнаруживали с помощью конъюгатов козьих антимышиных IgG и пероксидазы хрена. Титры антител IgG против MenС для тест-образцов и внутреннего контроля выражали как обратную величину сывороточного разведения, дающего ОП=1,0. Каждый образец сыворотки анализировали в двух повторностях, и использовали среднюю величину для расчета геометрической средней и стандартного отклонения в пределах стандартной ошибки. Антительные ответы против PRP Hib определяли сходным с ELISA для MenС образом, за исключением того, что планшеты покрывали PRP, конъюгированным с BSA (PRP-BSA). Титры выражали как ОП450нм для сыворотки, разведенной 1:50.
Проводили анализ смывов из носовой полости на IgA против MenС с использованием биолюминесцентного анализа (BIA) [141]. Кратко, использовали идентичные реагенты и процедуру покрытия для измерения IgG против MenС в сыворотке крови. Затем в качестве первого антитела добавляли специфичные биотинилированные козьи антимышиные IgA. Титры представляют величины логарифмического разведения, экстраполированные с данных log RLU на отсекающую величину, рассчитанную по меньшей мере по двум стандартным отклонениям свыше среднего фона.
Опосредованную системой комплемента бактерицидную активность против бактерий MenС измеряли в объединенных образцах сыворотки, как было описано ранее [140]. Титры определяли расчетом сывороточного разведения, при котором достигается 50% уменьшение числа КОЕ после инкубации в течение 1 часа.
На фиг.1А показаны геометрические средние титров сывороточных антител IgG против MenС, как в отдельности (не закрашенные столбики), так и в комбинации с антигеном Hib (закрашенные столбики). Сывороточные антительные ответы, вызванные обоими мутантами LT, были значимо выше ответов, полученных на антиген в отдельности. LTR72 продемонстрировал более выраженные адъювантные свойства, чем LTK63, в более низких дозах. Наиболее примечательно, что антительные ответы, вызванные интраназальной иммунизацией обоими мутантами LT, были сравнимы с ответами, полученными при использовании СТ дикого типа, или с ответами, индуцированными внутримышечной иммунизацией вакциной с использованием адъюванта alum. Важно, что добавление второго конъюгированного сахаридного антигена не оказывало неблагоприятного влияния на антительные ответы против каждого из антигенов.
На фиг.1В показаны геометрические средние титров сывороточных антител IgG против сахарида PRP Hib. Как и в случае MenС, антительные ответы, вызванные обоими мутантами LT, были выше ответов, полученных на антиген в отдельности. И снова, LTR72 продемонстрировал более выраженные адъювантные свойства. Сравнимые титры были индуцированы у мышей, иммунизированных интраназально мутантами LT, и вакциной с использованием адъюванта alum при внутримышечной иммунизации. Кроме того, не было данных о конкуренции после комбинированной интраназальной иммунизации двумя сахаридными конъюгированными вакцинами;
ответы, индуцированные против Hib в комбинации с MenС, были сравнимы с ответами, индуцированными иммунизацией Hib в отдельности.
Уровни бактерицидных антител, индуцированные интраназальной иммунизацией мутантами LT, тесно коррелировали с ответами сывороточных IgG по результатам ELISA, и снова были сравнимы с ответами, индуцированными СТ, или внутримышечной иммунизацией вакциной, адсорбированной на alum (фиг.2).
Образцы, полученные из смывов из полости носа после интраназальной иммунизации MenС с обоими мутантами LT, показали более высокие титры IgA, чем образцы, полученные интраназальной иммунизацией в отсутствие адъювантов (фиг.3). Как и ожидалось, внутримышечная иммунизация вызывала очень низкие титры IgA.
Заключение
Мощные сывороточные антительные ответы против N.meningitidis и H.influenzae могут быть индуцированы интраназальной иммунизацией конъюгированными вакцинами в комбинации с адъювантами для введения через слизистую оболочку. Помимо этого, в случае антигена MenС, антитела, индуцированные интраназальной иммунизацией, обладают мощной бактерицидной активностью, которая, как известно, коррелирует с защитным иммунитетом [142]. Кроме того, ответы IgA в полости носа были индуцированы только у животных, иммунизированных интраназальным путем. Индуцирование секреторного иммунитета является важным, поскольку верхние отделы дыхательных путей являются входными воротами для нескольких патогенов, включая N.meningitidis и Н.influenzae.
На основе титров антител, полученных с использованием конъюгированных вакцин, вводившихся в отдельности или в комбинации, и на основе бактерицидной активности, измеренной против MenС, можно заключить, что комбинация двух вакцин, введенных совместно с адъювантом для слизистой оболочки, не оказывает негативного влияния на антительные ответы против MenС или Hib. Таким образом, полученные результаты предполагают, что интраназальная иммунизация представляет собой эффективный путь иммунизации для конъюгированных вакцин полисахарид-белок в комбинации с адъювантами для слизистой оболочки, такими как мутанты LT.
Для достоверного повышения иммуногенности обеих конъюгированных вакцин, вводившихся одновременно, было достаточно одной и той же дозы мутантов LT. Это особенно важно, поскольку это должно уменьшить количество требующегося адъюванта и риск, связанный с потенциальной токсичностью. Важно, что уже существующий иммунитет против мутанта LTK63 не влияет на способность мутанта действовать в качестве адъюванта для второго антигена [2]. Кроме того, эффективность вакцин, доставленных через слизистую оболочку, можно дополнительно улучшить путем составления вакцин в биоадгезивных системах доставки [91].
В заключение можно сказать, что комбинирование конъюгированных вакцин полисахарид-белок с мутантами LT для интраназальной иммунизации представляет собой эффективный подход к иммунизации через слизистую оболочку для педиатрических целей.
1. Композиция для введения через слизистую, содержащая адъювант для введения через слизистую, а также (а) антиген капсулярного олигосахарида, который индуцирует иммунный ответ против Haemophilus influenzae; и (b) антиген капсулярного олигосахарида, который индуцирует иммунный ответ против Neisseria meningitidis; причем указанные антигены конъюгированы с белком-носителем.
2. Композиция по п.1, адаптированная для интраназального введения.
3. Композиция по п.2 в форме назального аэрозоля, назальных капель, геля или порошка.
4. Композиция по п.1, в которой антиген H.influenzae представляет собой капсулярный сахаридный антиген, конъюгированный с белком-носителем.
5. Композиция по п.4, в которой сахаридный антиген представляет собой олигосахарид.
6. Композиция по п.1 в которой антиген N.meningitidis представляет собой капсулярный сахаридный антиген из серогрупп А, С, W135 или Y, конъюгированный с белком-носителем.
7. Композиция по п.6, в которой сахаридный антиген представляет собой олигосахарид.
8. Композиция по п.1, содержащая антигены N.meningitidis по меньшей мере из двух серогрупп А, С, W135 и Y.
9. Композиция по любому из пп.4-8, в которой белок-носитель представляет собой дифтерийный или столбнячный анатоксин.
10. Композиция по п.9, в которой белок-носитель представляет собой CRM197.
11. Композиция по п.1, в которой каждый из антигенов: антиген H.influenzae и антиген N.meningitidis представляет собой олигосахаридный фрагмент капсулярного полисахарида, конъюгированный с белком-носителем.
12. Композиция по п.11, в которой антиген H.influenzae конъюгирован