Субстраты из класса олигосахаридов для детектирования эндо-гликозидгидролаз в присутствии экзо-действующих ферментов
Иллюстрации
Показать всеИзобретение относится к субстратам из класса олигосахаридов для детектирования эндо-гликозидгидролаз в присутствии экзо-действующих ферментов общей формулы, приведенной ниже, в которой Х - это атом кислорода или атом серы, а концевой невосстанавливающий сахарный остаток связан с гликоновой частью молекулы субстрата тио-связью, причем n≥0. При этом агликоновая часть указанных субстратов обеспечивает детектирование на твердых (агаризованных) средах и представляет собой нерастворимую флуоресцентную метку. 1 табл.
Реферат
Изобретение относится к биотехнологии и касается получения новых высокочувствительных субстратов для направленного поиска на твердых (агаризованных) средах микробных продуцентов эндо-действующих гликозидгидролаз в присутствии экзо-действующих ферментов.
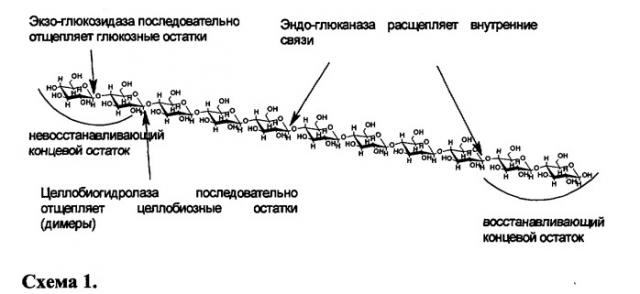
Определение ферментативной активности гликозидгидролаз в реальных биологических объектах сопряжено с проблемой одновременного присутствия в среде ферментов, обладающих разными типами действия (эндо- и экзо-) по отношению к одному и тому же субстрату. Например, целлюлазные комплексы, продуцируемые различными микроорганизмами, представляют собой многокомпонентные системы, состоящие из ферментов, различающихся по молекулярному строению и способу действия на целлюлозу. Так, ферменты целлюлазного комплекса разделяют на эндо-действующие целлюлазы, к которым относятся эндо-глюканазы, и экзо-целлюлазы, к которым относятся целлобиогидролазы и β-глюкозидазы. Эндоглюканазы расщепляют внутренние связи в молекулах целлюлозы, действуя, главным образом, на аморфные участки (или микродефекты) целлюлозных волокон. Целлобиогидролазы атакуют молекулы целлюлозы с невосстанавливающего концевого остатка поли- или олигосахаридной цепи, последовательно отщепляя целлобиозные остатки (димеры). Наконец, β-глюкозидазы отщепляют только концевые глюкозные остатки (мономеры) при гидролизе молекул целлобиозы и растворимых целлоолигосахаридов. Гидролиз целлюлозы эндо- и экзо-гликозидгидролазами целлюлазного комплекса приведен на схеме 1.
В ряде случаев для решения узкоспецифичных задач в биотехнологии, фармацевтике или медицине необходимо использование гликозидгидролаз со строго заданными свойствами. Например, в текстильной промышленности существует потребность в эффективных эндо-целлюлазах для удаления ворсинок и микродефектов при биополировке хлопчатобумажных тканей. Поскольку в микробных целлюлазных комплексах присутствуют, как правило, все вышеперечисленные ферменты, детектирование ферментов эндо-действия при поиске их продуцентов на твердых (агаризованных) средах затруднено наличием экзо-действующих β-глюкозидаз и целлобиогидролаз.
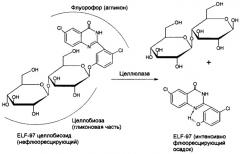
Известен субстрат из класса олигосахаридов, модифицированных флуоресцентной меткой, для детектирования гликозидгидролаз целлюлазного комплекса на твердых средах, так называемый ELF-97 целлобиозид [1]. В основе метода с использованием ELF-97 целлобиозида лежит применение в качестве флуорофорной группы 2-(2'-гидроксифенил)-4(3Н)-хиназолинона. Предложенный субстрат является бесцветным и нефлуоресцентным. При его гидролизе ферментами целлюлазного комплекса непосредственно в месте проявления ферментативной активности образуются интенсивно флюоресцирующий и фотостабильный, не растворимый в воде осадок. Реакция ферментативного расщепления ELF-97 β-D-целлобиозида приведена на схеме 2.
Схема 2.
Этот субстрат применим для детектирования на твердых средах, но всего набора гликозидгидролаз целлюлазного комплекса как эндо-, так и экзо-действия. Кроме того, подобный субстрат является нерастворимым в воде, поэтому при его применении для определения целлюлазной активности на твердых средах необходимо использование таких растворителей, как диметилсульфоксид, диметиформамид или ацетонитрил. Уже 15%-ная концентрация этих растворителей приводит к частичной или полной денатурации фермента, что значительно уменьшает эффективность поиска микробных продуцентов искомых целлюлаз.
Устойчивость субстрата к гликозидгидролазам экзо-действия традиционно достигается химической модификацией невосстанавливающего концевого сахарного остатка (см. схему 1). Для этого в концевую молекулу субстрата вводят дополнительные группы (бензилиденовая [2], бензильная [3], оксобутилиденовая [4], этилиденовая [5] и др.), предотвращающие связывание полученного субстрата с гликозидгидролазой экзо-действия.
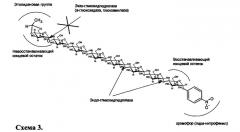
Наиболее близким к заявляемым субстратам является субстрат из класса олигосахаридов, пригодный для детектирования эндо-гликозидгидролаз в присутствии экзо-действующих ферментов, а именно этилиден-пара-нитрофенил-α-D-мальтогептаозид (коммерческое название EPS) [5]. Он модифицирован хромофорной группой пара-нитрофенол, растворим в воде и широко используется для определения активности амилаз в биологических жидкостях в присутствии экзо-действующих α-глюкозидаз или глюкоамилаз. Гидролиз подобного субстрата происходит только под воздействием эндо-действующих гликозидгидролаз (α- и β-амилаз), т.к. модификация концевого глюкозного остатка олигосахаридной части субстрата этилиденовой группой не позволяет экзо-гликозидгидролазам связываться с молекулой субстрата и соответственно расщеплять его. Реакция гидролиза этилиден-пара-нитрофенил-α-D-мальтогептаозида приведена на схеме 3. Стрелками указаны места расщепления олигосахаридной цепи.
К недостаткам прототипа относятся следующие факторы. Хотя данный субстрат, EPS [5], растворим воде, но будучи разработанным для измерения активности гликозидгидролаз в биологических жидкостях, совершенно непригоден для in situ определения ферментативной активности на твердых (агаризованных) средах, т.к. детектируемый продукт гидролиза (агликон в виде хромофорной метки) растворим и легко диффундирует из точки проявления активности.
В случае же использования водонерастворимых меток, как в субстрате ELF-97 β-D-целлобиозид [1], проблема низкой растворимости субстратов в воде диктует поиск методов такой модификации невосстанавливающего концевого остатка олигосахаридной части субстрата, которая не приведет к снижению растворимости исходного субстрата.
Задачей предлагаемого изобретения является создание такого растворимого в воде субстрата из класса олигосахаридов для детектирования эндо-действующих гликозидгидролаз, который будет пригоден для использования на твердых (агаризованных) средах, т.е. детектируемый продукт гидролиза (флуоресцирующий агликон) не должен быть растворим в воде.
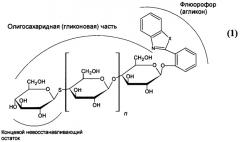
Поставленная задача достигается тем, что предлагаются субстраты из класса олигосахаридов для детектирования эндо-гликозидгидролаз в присутствии экзо-действующих ферментов общей формулы (I):
где агликоновая часть обеспечивает возможность детектирования на твердых средах и представляет собой нерастворимую флуоресцентную метку, в которой Х - это атом кислорода или атом серы, а концевой невосстанавливающий сахарный остаток связан с остальной (гликоновой) частью молекулы субстрата тио-связью, причем n≥0.
Новым в изобретении является использование новых флуоресцентных меток, 2-(2'-гидроксифенил)-бензотиазола или 2-(2'-гидроксифенил)-бензоксазола, выпадающих в осадок после гидролиза исходного субстрата гликозидгидролазами целлюлазного комплекса (в прототипе использована растворимая хромофорная метка). Поскольку, как правило, спектрофлуорометрическое детектирование гидролиза субстратов, модифицированных флуоресцентными группами, дает на порядок большую чувствительность, чем при использовании хромофорных групп, предлагаемая метка дает возможность детектировать действие эндо-гликозидгидролаз с большей чувствительностью и на твердых средах. Использование в качестве гликоновой части целлоолигосахаридов со степенью полимеризации (с.п.) больше 2 увеличивает растворимость субстратов в воде (улучшены свойства аналога ELF-97). Новым в структуре субстрата является замена его гликозидного кислорода на серу для модификации концевого сахарного остатка, что обуславливает устойчивость соединения к ферментам экзо-действия.
В пользу неочевидности такого подхода говорит то, что замещение гликозидного кислорода во всей молекуле олигосахарида на серу приводит к потере молекулой свойств субстрата, но ее конформация и растворимость практически не меняются [6-9]. Замена кислорода на серу только в концевом остатке гликоновой части позволила сделать молекулу ингибитором для гликозидгидролаз экзо-действия и субстратом для эндо-гликозидгидролаз. При этом растворимость исходных субстратов в воде не меняется, что особенно важно в случае осадкообразующих субстратов.
Использование вышеописанного подхода к модификации невосстанавливающего конца одновременно с применением в качестве агликона 2-(2'-гидроксифенил)-бензоксазола позволило преодолеть ограничения, свойственные субстрату EPS [5], где в качестве агликона был использован хромофор пара-нитрофенол, а невосстанавливающий конец модифицирован этилиденовой группой. При этом сохранились все его положительные характеристики, а именно устойчивость по отношению к ферментам экзо-действия и достаточная растворимость в воде. Но в отличие от EPS заявляемые субстраты пригодны для детектирования гликозидгидрлаз на твердых средах, т.к. при их гидролизе эндо-гликозидгидролазами образуется интенсивно флюоресцирующий и фотостабильный, не растворимый в воде осадок непосредственно в месте проявления ферментативной активности.
Заявленная совокупность признаков не обнаружена в научно-технической и патентной литературе и выявлена опытным путем.
Были синтезированы 2-(2'-бензоксазолил)-фенил-4'-S-β-D-глюкопиранозил-4'-тиоглюкозид (2), 2-(2'-бензоксазолил)-фенил-4"-S-β-D-глюкопиранозил-4"-тиоцеллобиозид (3), 2-(2'-бензоксазолил)-фенил-4"'-S-β-D-глюкопиранозил-4"'-тиоцеллотриозид (4) и 2-(2'-бензотиазолил)-фенил-4'-S-β-D-глюкопиранозил-4'-тиоглюкозид (5).
2-(2'-бензотиазолил)-фенил-4'-S-β-D-глюкопиранозил-4-тиоглюкозид
Синтез 2-(2'-бензоксазолил)-фенил-4n-S-β-D-глюкопиранозчл-4n-тиоцеллоолигосахаридов со с.п. 2-4
Общая схема синтеза патентуемых субстратов имеет две основные стадии:
- получение соответствующего углеводного блока (гликона);
- реакция гликозилирования с образованием субстрата.
Углеводные блоки для соединений, соответствующих общей формуле (1), где Х представляет собой атом кислорода, были синтезированы химически из лактозы и глюкозы. Ключевым моментом синтеза является создание β-1,4-тиогликозидной связи между двумя концевыми молекулами глюкозы требуемого субстрата. Для этого 4'-трифлильный эфир 1,2,3,6,2',3'-O-ацетил-6'-O-бензоил-лактозы обрабатывали ацетилированной 1-тиоглюкозой [10]. Полученный защищенный трисахарид активировали переводом в галогенированную форму, которую обрабатывали либо флуорофором с образованием 2-(2'-бензоксазолил)-фенил-4"-S-β-D-глюкопиранозил-4"-тиоцеллобиозида, либо 2-(2'-бензоксазолил)-фенил-2,3,6-O-ацетил-глюкопиранозидом для получения 2-(2'-бензоксазолил)-фенил-4'"-S-β-O-глюкопиранозил-4'"-тиоцеллотриозида.
Следует отметить, что реакции гликозилирования по Кенигсу-Кнорру с участием 2-(2'-гидроксифенил)-бензотиазола сопровождются побочной реакцией образования нежелательной примеси, сульфониевой соли из гликозилгалогенида (6), что приводит к снижению выхода требуемого гликозида и значительному усложнению процесса хроматографической очистки продуктов реакции гликозилирования.
Поэтому в качестве основного флуорофора нами был выбран 2-(2'-гидроксифенил)-бензоксазол (7), реакции с которым лишены вышеописанных осложнений.
Получение соединений по общей формуле (1), где Х представляет собой атом кислорода, иллюстрируется следующим примером синтеза 2-(2'-бензоксазолил)-фенил-4"-S-β-D-глюкопиранозил-4"-тиоцеллобиозида, где (а) уксусный ангидрид, ацетат натрия; (b) НВr/ АсОН; (с) тиомочевина; (d) бензальдегиддиметилацеталь, TosOH; (e) уксусный ангидрид, пиридин; (f) AcOH/ вода, 80%; (g) бензоил хлорид, пиридин; (h) трифторметансульфоновый ангидрид; (i) триэтиламин; (j) 2-(2'-гидроксифенил)-бензоксазол, карбонат серебра; (k) метилат натрия (схема 4).
Пример действия ферментов целлюлазного комплекса (экзо- и эндо-гликозидгидролаз) на один из заявляемых субстратов, 2-(2'-бензоксазолил)-фенил-4"-S-β-D-глюкопиранозил-4"-тиоцеллобиозид, приведен на схеме 5.
Определение структуры субстратов
Все 1Н и 13С ЯМР спектры регистрировали с использованием спектрометра АМХ-500 Broker (1Н при 500.13 МГц, 13С при 125.13 МГц) при комнатной температуре для растворов в различных растворителях. В качестве внешнего стандарта использовали тетраметилсилан, калибровали с использованием сигналов остаточных протонов растворителей. Химические сдвиги (δ в ppm) даны относительно сдвигов для СDСl3 (δH 7.25), 30% раствор CD3CN в D2O (δH 2.21), 30% раствор (СD3)2СО в D2O (δH 2.19); значения J даны в Гц. Одномерные 1Н, одномерные спектры эффекта Оверхаузера, 13С и фазово-чувствительные двумерные спектры (COSY-DQF, NOESY и протон-углеродные корреляционные спектры) регистрировали с использованием стандартных импульсных программ при 20°С и 50°С. Результаты анализировали с использованием пакета программ XWINNMR (Bruker). Соотнесение сигналов индивидуальных сахарных остатков основывалось на двумерной фазово-чувствительной спектроскопии COSY. Определение последовательности остатков основывалось на кросс-пиках эффекта Оверхаузера в двумерном NOESY эксперименте (время смешения 180 мс) и наблюдении эффекта Оверхаузера между аномерными протонами и протоном при замещенном положении.
Данные ЯМР и масс-спектрометрического анализа полученных субстратов 2-(2'-бешоксазолил)-фенил-4'-S-β-D-глюкопиранозил-4'-тиоглюкозид, 13С ЯМР (126 МГц, ДМСOd6) δ ппм: 103.35 (С1), 72.67 (С5), 78.20 (С4), 73.17 (С3), 72.3 (С2), 61.21 (С6), 102.87 (С1'), 76.05 (С5'), 70.68 (С4'), 76.20 (С3'), 74.01 (С2'), 61.78 (С6'); 1Н ЯМР (400 МГц, ДМСОd6), δ ппм: 4.89 (1Н, d, J 7.5 Hz, H1), 4.09 (1H, J 7.8 Hz, H1').
2-(2'-бензоксазолил)-фенил-4''-S-β-D-глюкопираиозил-4''-тиоцеллобиозид, 13С ЯМР (126 МГц, ДМСОd6) δ ппм: 103.35 (С1), 72.67 (С5), 78.20 (С4), 73.17 (С3), 72.3 (С2), 61.21 (С6), 101.10 (С1'), 72.70 (С5'), 78.50 (С4'), 74.70 (С3'), 73.10 (С2'), 62.40 (С6'), 101.10 (С1"), 73.40 (С5"), 71.20 (С4"), 75.11 (С3"), 74.30 (С2"), 62.40 (С6"); 1H ЯМР (400 МГц, ДМСОd6), δ ппм: 4.87 (1H, d J 7.8 Hz, H1), 4.33 (1H, d J 7.8 Hz, H1'), 4.07 (1H, d J 7.8 Hz, H1").
2-(2'-бензоксазолил)-фенил-4"'-S-β-D-глюкопиранозил-4"'-тиоцеллотриозид, 13С ЯМР (126 МГц, ДМСОd6) δ ппм: 103.35 (С1), 72.67 (С5), 78.20 (С4), 73.17 (С3), 72.3 (С2), 61.21 (С6), 101.10 (С1'), 72.70 (С5'), 78.50 (С4'), 74.70 (С3'), 73.10 (С2'), 62.40 (С6'), 101.10 (С1"), 72.70 (С5"), 78.50 (С4"), 74.70 (С3"), 73.10 (С2"), 62.40 (С6"), 101.10 (С1"'). 73.40 (С5"'), 71.20 (С4"'), 75.11 (С3'"), 74.30 (С2'"), 62.40 (С6"'); 1H ЯМР (400 МГц, ДМСОd6), δ ппм: 4.87 (1Н, d J 7.8 Hz, H1), 4.34 (1H, d J 7.8 Hz, H1'), 4.34 (1H, d J 7.8 Hz, H1"), 4.09 (1H, d J 7.8 Hz, H1'").
2-(2'-бензотиазолил)-фенил-4'-S-β-D-глюкопиранозил-4'-тиоглюкозид, 1Н ЯМР (500 МГц, ДМСОd6), δ ппм: 8.07 (1H, d J 7.8 Hz), 7.81 (1H, d J 7.8 Hz), 7.77 (1H, d J 7.6 Hz), 7.62 (1H, t J 7.9 Hz), 7.49 (1H, d J 8.4 Hz), 7.45 (1H, t J 7.7 Hz), 7.43 (1H, t J 7.7 Hz), 7.28 (1H, t J 7.5 Hz). 5.08 (1H, d J 7.6 Hz), 4.40 (1H, d J 9.6 Hz), 4.37 (1H, d J 8.0 Hz), 3.90 (1H, d J 10.5 Hz), 3.83 (1H, d J 10.7 Hz), 3.69 (2H, d J 12.4 Hz), 3.68 (1H, d J 11.8 Hz), 3.65 (1H, d J 10.8 Hz), 3.63 (1H, d J 9.7, 6.7 Hz), 3.09 (2H, t J 9.3 Hz), 3.06 (1H, t J 9.2 Hz), 2.64 (1H, t J 10.7 Hz). 13C ЯМР (126 МГц, ДМСОd6), δ ппм: 102.43 (1C, С1'), 69.50 (1C. С2'), 73.11 (1C, С3'), 45.50 (1С, С4'), 74.10 (1C, С5'), 60.94 (1C, С6'), 83.34 (1С, С1'), 72.31 (1C, С2"), 77.29 (1C, С3"), 80.31 (1C, С4"), 76.25 (1C, С5"), 60.82 (1C, С6"), 101.51 (1C, С1), 72.97 (1C, С2), 74.03 (1C, С3), 59.87 (1C, С6), 75.11 (1С,С4), 76.28 (1C, С5).
Апробирование заявляемых субстратов
В лаборатории энзимологии отделения молекулярной и радиационной биофизики Петербургского института ядерной физики им. Б.П. Константинова РАН была проведена проверка заявляемых субстратов из класса олигосахаридов, модифицированных флуоресцентной меткой, при поиске ферментов целлюлазного комплекса на твердых средах. Флуорогенные субстраты, соответствующие формулам (2-5), оказались нефлуоресцентны и растворимы в воде, однако образуют высокофлуоресцентный нерастворимый в воде продукт при реакции со специфическим ферментом (эндо-целлюлазой).
Для детектирования эндо-ферментов целлюлазного комплекса на твердой среде раствор 2-(2'-бензоксазолил)-фенил-4'"-S-β-D-глюкопиранозил-4'"-тиоцеллотриозида и 4-метилумбеллиферил целлотриозида были добавлены к агаризованной среде, содержащей карбоксиметилцеллюлозу и неорганические соли. Конечная концентрация флуоресцентных субстратов составляла 60 микромоль. Значение рН среды составило 5.0. Чашки с нанесенной культурой инкубировали при 30°С и визуально инспектировали с помощью УФ-света ежедневно в течение 3 дней. Было показано, что использование 2-(2'-бензоксазолил)-фенил-4"'-S-β-D-глюкопиранозил-4"'-тиоцеллотриозида приводит к точной локализации ферментативной активности на чашке, т.к. высвобождаемый продукт (флуорофор) не диффундирует в среде в течение времени в отличие от уже известного субстрата, 4-метилумбеллиферил целлотриозида, который был протестирован для сравнения. Кроме того, заявляемые субстраты были протестированы при поиске ферментов целлюлазного комплекса среди коллекции дрожжевых штаммов из собственной коллекции ПИЯФ. Из 30 проверенных культур 18 штаммов показали наличие целлюлазной активности при использовании 4-метилумбеллиферил целлотриозида в качестве субстрата. Однако только 3 штамма продемонстрировали способность гидролизовать 2-(2'-бензоксазолил)-фенил-4"'-S-β-D-глюкопиранозил-4"'-тиоцеллотриозида, что выразилось в появлении желтого флуоресцентного осадка на поверхности агаризованной среды, который не диффундировал со временем. Для проверки наличия эндо-гликозидгидролаз целлюлазного комплекса в этих культурах все 3 культуры и две дополнительные культуры, не показавшие действие эндо-гликозидгидролаз, были выращены в жидкой среде, и удельные активности всех ферментов, входящих в целлюлазный комплекс, были определены с помощью традиционных субстратов (см. таблицу).
| Результаты сравнения удельных активностей ферментов целлюлазного комплекса с помощью традиционных субстратов | ||||||
| Микроорганизм | Детектирование на твердой среде с помощью | Удельная активность, ед/мл | ||||
| № п/п | Эндо-целлюлаза1 | Целлобио-гидролаза2 | β-Глюкозидаза3 | |||
| А | Б | |||||
| 1 | Debaryomyces hansenii | +++4 | ++5 | 0.65 | 0.09 | 0.02 |
| 2 | Rhodotorula mucilaginosa | ++ | ―6 | 0.15 | 0.07 | 0.03 |
| 3 | Candida sace | +++ | +++ | 0.88 | 0.18 | 0.05 |
| 4 | Candida albidus | +++ | +++ | 1.05 | 0.25 | 0.08 |
| 5 | Rhodotorula aurentia | +++ | ― | 0.28 | 0.12 | 0.08 |
| А: 4-метилумбеллиферил целлотриозид;Б: 2-(2'-бензоксазолил)-фенил-4'"-S-β-D-глюкопиранозил-4'"-тиоцеллотриозид; 1 Измерено по стандартному методу с использованием фильтровальной бумаги [11]. 2 Измерено с помощью n-нитрофенил-β-D-целлобиозида [12]. 3 Измерено с помощью n-нитрофенил-β-D-глюкопиранозида [13]. 4 Осадок флуоресцировал с сильной интенсивностью. 5 Осадок флуоресцировал со слабой интенсивностью. 6 Флуоресценции не было. |
Таким образом, показано, что заявляемые субстраты позволяют эффективно проводить направленный поиск новых микробных продуцентов эндо-действующих гликозидгидролаз целлюлазного комплекса при физиологических значениях pH непосредственно на агаризованных средах и предварительно оценивать уровень продукции ферментов в культуре.
Литература
1. Enzymatic analysis using substrates that yield fluorescent precipitates. (1994) US Patent 5316906.
2. G Dupuy, G Hilaire, and С Aubry Rapid determination ofalpha-amylase activity by use of a new chromogenic substrate Clin. Chem., Apr 1987; 33: 524-528.
3. S. Satomura, T Iwata, Y. Sakata, К. Omichi, and T.Ikenaka, Synthesis of p-nitrophenyl 6-benzyl-α-maltopentaoside, a substrate for α-amylases Carbohydrote Research, 176 (1988) 107-115.
4. S.Teshima, Y.Hayashi, S.Emi, and K.Ishimaru, Determination of α-amylase using a new blocked substrate (3-ketobutylidene β-2-chloro-4-nitrophenyl-maltopentaoside) Clin. Chim. Acta, 199 (1991) 23-32.
5. E.O.Haegele, M.Kratzer, E.Schaich, and E.Rauscher. Mechanism of action of human pancreatic and salivary alpha-amylase on 4,6-ethylidene-alpha-4-nitrophenyl-maltoheptaoside substrate Clin Chem 1989 35: 188-189.
6. Driguez H. Thiooligosaccharides as tools for structural biology. Chembiochem. 2001 May 4; 2(5):311-8. Review.
7. Varrot A, Frandsen TP, Driguez H, Davies GJ. Structure of the Humicola insolens cellobiohydrolase Cel6A D416A mutant in complex with a non-hydrolysable substrate analogue, methyl cellobiosyl-4-thio-beta-cellobioside, at 1.9 A. Acta Crystallogr D Biol Crystallogr. 2002 Dec; 58(Pt 12):2201-4. Epub 2002 Nov 23.
8. Fort S, Varrot A, Schulein M, Cottaz S, Driguez H, Davies GJ. Mixed-linkage cellooligosaccharides: a new class ofglycoside hydrolase inhibitors. Chembiochem. 2001 May 4; 2(5):319-25.
9. Parsiegia G, Juy M, Reverbel-Leroy C, Tardif C, Belai'ch JP, Driguez H, Haser R. The crystal structure of the processive endocellulase CelF of Clostridium cellulolyticum in complex with a thiooligosaccharide inhibitor at 2.0 A resolution. EMBO J. 1998 Oct 1;17(19):5551-62.
10. Ibatullin, P.M., Shabalin, K.A., Janis J.V., Shawa A.G. Reaction of 1,2-trans-glycosyl acetates with thiourea: a new entry to 1-thiosugars. Tetrahedron Lett. 44 (2003): 7961-7964.
11. Т.К.Ghose. Measurement of cellulose activities. Pure Appl. Chem. 59 (1987):257-268.
12. M.G.Tuohy, D.J.Walsh, P.G.Murray, M.Claeyssens, M.M.Cuffe, A.V.Savage, etal. Kinetic parameters and mode of action of the cellobiohydrolases produced by Talaromyces emersonii. Biochim. Biophys. Acta. 1596 (2002): 366-380.
13. M.J.Arrizubieta, J.Polaina. Increased thermal resistance and modification of the catalytic properties of a beta-glucosidase by random mutagenesis and in vitro recombination. J. Biol. Chem. 275 (2000): 28843-28848.
Субстраты из класса олигосахаридов для детектирования эндо-гликозидгидролаз в присутствии экзо-действующих ферментов общей формулы где агликоновая часть обеспечивает детектирование на твердых средах и представляет собой нерастворимую флуоресцентную метку, в которой Х - это атом кислорода или атом серы, а концевой невосстанавливающий сахарный остаток связан с гликоновой частью молекулы субстрата тио-связью, причем n≥0.