Рекомбинантная днк, обеспечивающая получение рекомбинантного белка pb1, обладающего протективными свойствами в отношении streptococcus pyogenes и streptococcus agalactiae
Иллюстрации
Показать всеИзобретение относится к области микробиологии и молекулярной генетики и может быть использовано при производстве вакцин против Streptococcus pyogenes - стрептококков группы А (СГА) и Streptococcus agalactiae - стрептококков группы В (СГВ). Сущностью изобретения является создание рекомбинантной ДНК рВ1, полученной в результате ПЦР с использованием хромосомной ДНК штамма 090R Ia серотипа СГВ, праймеров Pb1 и Pb2 и последующего клонирования с использованием экспрессионной плазмиды pQE-30 в Е. coli M15. Рекомбинантная ДНК рВ1 кодирует рекомбинантный белок РВ1, обладающий протективными свойствами в отношении указанных выше стрептококков, который не имеет ферментативной активности и вызывает синтез анти-РВ1 антител, обладающих протективными свойствами в отношении Streptococcus pyogenes и Streptococcus agalactiae. В изобретении создана рекомбинантная плазмидная ДНК pQE-pB1, представляющая собой плазмидную ДНК pQE-30, несущую рекомбинантную ДНК рВ1, и штамм-продуцент Е. coli M15-PB1, позволяющий экспрессировать рекомбинантный белок РВ1. Отсутствие у полученного рекомбинантного белка ферментативной активности позволит применять его в качестве компонента вакцины против Streptococcus pyogenes и Streptococcus agalactiae. 5 н. и 2 з.п. ф-лы, 7 ил., 4 табл.
Реферат
Изобретение относится к области микробиологии и молекулярной генетики и может быть использовано в медицинской промышленности при производстве вакцин против Streptococcus pyogenes, стрептококков группы А (СГА), и Streptococcus agalactiae, стрептококков группы В (СГВ).
Streptococcus pyogenes (СГА) являются широко распространенным патогеном для человека и приматов, инфицируя, главным образом, назофарингеальную слизистую и кожу. Стрептококки, инфицирующие слизистую человека, вызывают острую ангину, скарлатину, хронический тонзилит и фарингит, которые часто сопровождаются серьезными осложнениями, такими как отит, ревматизм и гломерулонефрит. К кожным заболеваниям, вызываемым СГА, относятся импетиго, васкулиты, гнойные посттравматические и постожоговые поражения тканей, рожистое воспаление. В ряде случаев инфекции, вызванные СГА, переходят в более генерализованные формы: некротический фасцит, стрептококковый сепсис и токсический шоковый синдром. Эти заболевания характеризуются высоким процентом летальных исходов вследствие быстрого развития шока на фоне общей недостаточности работы органов человеческого организма.
Streptococcus agalactiae (СГВ) является основной причиной серьезных перинатальных инфекций, чаще всего протекающих в виде пневмоний, сепсиса и менингита. Заражение ребенка происходит во время родов от матери с носительством СГВ или еще антинатально в случае бессимптомного носительства СГВ у матери. У детей старшего возраста стрептококковая инфекция проявляется в форме остеомиелита, артрита, поражения глаз, кожи и мочевого пузыря. У взрослых стрептококки группы В также могут вызывать ряд тяжелых заболеваний, таких как пиелонефрит, артрит, офтальмит, эндокардит, септицемия и др.
В настоящее время заболевания, вызываемые стрептококками группы А и В, рассматриваются как важная социально-экономическая и медицинская проблема во всех странах мира. Заболевания, вызываемые стрептококками группы А и В, лечат с помощью антибиотиков (Страчунский Л.С., Козлов С.Н., Соврем. Антимикроб. Химиотер., М.: Боргес, 1-432 (2002), Поляк М.С. Основы антибиотикотерапии, СПб: НИЦФ, 1-53 (2003)). Препаратами выбора при лечении СГА и СГВ инфекций являются бета-лактамы: бензилпенициллин, ампициллин (Семина Н.А., Сидоренко С.В. и др., Клин. Микробиол. Антимикроб. Химиотер.6 (4): 306-359 (2004)), ампициллин + сульбактам (Бурбелло А.Т. и др., Соврем. Лекар. Средства, СПб: Нева, 332 (2003)); макролиды: эритромицин, кларитромицин, рокситромицин, азитромицин; ванкомицин (Зуева Л.П., Поляк М.С. и др., Микробиологический мониторинг, СПб: Медицинский информационно-аналитический центр, 1-72 (2004)).
В целях профилактики СГА и СГВ инфекций используют такие антибиотики, как бензатин бензилпенициллин (Бурбелло А.Т. и др., Соврем. Лекар. Средства, СПб: Нева, 323-324 (2003)), эритромицин (Бурбелло А.Т. и др., Соврем. Лекар. Средства, СПб: Нева, 352 (2003)), ампициллин + сульбактам (Бурбелло А.Т. и др., Соврем. Лекар. Средства, СПб: Нева, 332 (2003)).
Антибиотикотерапия, широко применяемая в качестве мер профилактики и лечения, нередко оказывается неэффективной в силу увеличения числа антибиотикоустойчивых штаммов. Другим значительным недостатком антибиотикотерапии является возникновение побочных эффектов для здоровья людей. К ним относятся аллергические реакции, срыв иммунной системы организма, нарушение микробиоценоза организма и развитие сопутствующих заболеваний и осложнений на фоне иммунодефицита, негативное действие на центральную нервную и сердечно-сосудистую системы и на некоторые важные внутренние органы человека.
В этой связи необходимость создания вакцины против стрептококков групп А и В остается актуальной проблемой.
Практически все штаммы СГА и СГВ продуцируют на поверхности клетки С5а пептидазу - фермент, расщепляющий С5а компонент комплемента человека, обезьяны и коровы, который обладает свойствами анафилатоксина и участвует в привлечении полиморфноядерных лейкоцитов в очаг инфекции (Wexler D.E., and P.P.Cleary, Infect. Immun. 39:239-246 (1983); Wexler D.E., and P.P.Cleary, Infect. Immun. 50:757-764 (1985)). Кроме того, было продемонстрировано, что С5а пептидаза обладает способностью связывать фибронектин, а также участвует в инвазии эпителиальных клеток (Beckmann С. и др., Infect. Immun. 70: 2869-2876 (2002); Cheng Q. и др., Infect. Immun., 70: 2408-2413 (2002)).
При сравнении генов scpA и scpB, кодирующих С5а пептидазу стрептококков групп А и В, была выявлена 95-98% гомология их нуклеотидных последовательностей (Chmouryguina I., Suvorov А. и др., Infect. Immun. Jul: 2387-2390, (1996)). Было также обнаружено, что единственной областью, отличающей scpA от scpB, является дополнительная область гена размером 51 п.н., локализованная близко к 3' концу scpA (Cleary Р.Р.и др.. Infect. Immun. 60: 4239-4244 (1992)).
Впервые ген, кодирующий С5а пептидазу СГА (CS24) M12 серотипа был проклонирован с использованием экспрессионного вектора рТТ1 в Е. coli DH 5а в 1989 году американскими учеными Cleary P.P. и Chen С.С. (Chen C.C. and Cleary P. Infect. Immun, 57. 1740-1745 (1989)).
В 2000 г. были проклонированы полноразмерные гены scpB из двух штаммов СГВ (125 и 130) III серотипа с использованием плазмидного вектора pGEX-2T и получены рекомбинантные белки SCPB (John F. Bohnsack J.F. и др. Infect. Immun. 68(9): 5018-5025 (2000)).
В 2002 г. из СГВ (СHI) III серотипа были проклонированы гены scpB, кодирующие полноразмерную С5а пептидазу (с 1-го по 1090-й аминокислотный остаток) и фрагмент С5а пептидазы (с 116-го по 227-й аминокислотный остаток) с использованием плазмидного вектора pGEX-4T3 в Е. coli BL21(DE3) (Beckmann С. и др., Infect. Immun. 70(6): 2869-2876 (2002)).
Прототипом изобретения является ген, кодирующий С5а пептидазу СГВ штамма 78/471 II/c серотипа, который был проклонирован в Е. coli DH 5а с использованием экспрессионного плазмидного вектора pGEX-4T-l в 1996 г. российскими учеными Шмурыгиной И.И. и Суворовым А.Н. совместно с американскими учеными Ferrieri P. и Cleary P.P. В результате этой работы был экспрессирован и очищен рекомбинантный белок SCPB молекулярной массы 126 кДа. В тесте на подавление хемотаксиса клеток крови человека была продемонстрирована биологическая активность полученного белка SCPB (Chmouryguina I., Suvorov А. и др., Infect. Immun. Jul: 2387-2390, (1996)).
При рассмотрении возможного применения SCPB для создания вакцины недостатком этого белка являлось сохранение его ферментативной активности, что ставило под сомнение возможность его применения для человеческого организма.
Задачей данного изобретения стало получение рекомбинантного белка РВ1 с отсутствием ферментативной активности, обладающего иммуногенными и протективными свойствами, причем получение его на основе СГВ Ia серотипа С5а пептидазы, с целью использования его в качестве компонента вакцины против Streptococcus pyogenes и Streptococcus agalactiae. Задачей изобретения стало создание штамма-продуцента рекомбинантного белка РВ1.
Поставленная задача решалась конструированием уникальных праймеров, с помощью которых в полимеразной цепной реакции получали фрагмент нуклеотидной последовательности, кодирующий часть аминокислотной последовательности С5а пептидазы СГВ, которая при образовании третичной структуры белка не формировала центр протеазной активности. С целью быстрого и простого получения рекомбинантного белка РВ1 для клонирования фрагмента ДНК была использована система экспрессионных плазмид pQE. Для создания штамма-продуцента рекомбинантного белка РВ1 был использован штамм Е. coli M15 (The QIAexpress System, Qiagen, США). В результате экспериментальной работы этот штамм приобрел новые свойства: способность экспрессировать рекомбинантный белок РВ1. Новый штамм получил название Е. coli M15-РВ1.
Сущностью предлагаемого изобретения является создание уникальной рекомбинантной ДНК (обозначенной как рВ1), полученной в результате полимеразной цепной реакции (ПЦР) с использованием хромосомной ДНК штамма 090R Ia серотипа СГВ, уникальных праймеров Pb1 и Pb2 и последующего клонирования с использованием экспрессионной плазмиды pQE-30 (The QIAexpress System, Qiagen, США). Полученная рекомбинантная ДНК рВ1 кодирует уникальный рекомбинантный белок РВ1.
Также сущностью предлагаемого изобретения является создание рекомбинантной плазмидной ДНК pQE-pB1, несущей рекомбинантную ДНК рВ1, и штамма-продуцента Е. coli M15-PB1, позволяющего при определенных условиях экспрессировать рекомбинантный белок РВ1.
Авторами получен фрагмент гена, кодирующего С5а пептидазу штамма 090R Ia серотипа СГВ, с 114 п.н. по 1049 п.н. (обозначенный как рВ, размером 936 п.н.) с помощью полимеразной цепной реакции с использованием праймеров Pb1 и Pb2 и хромосомной ДНК штамма 090R Ia серотипа СГВ. Также авторами осуществлено клонирование рВ с использованием экспрессионной плазмиды pQE-30 и последующей трансформацией полученной рекомбинантной плазмиды (обозначенной как pQE-pB1) в гетерологическую систему Е.coli M15. Авторами получен штамм-продуцент рекомбинантного белка РВ1, обозначенный как Е. coli M15-PB1. Также авторами реализована экспрессия рекомбинантного белка РВ1 клетками штамма Е. coli M15-PB1 с последующей одноступенчатой аффинной очисткой с использованием Ni-сефарозы (Amersham, США).
Авторами получены анти-РВ1 антитела при подкожном введении рекомбинантного белка РВ1 млекопитающим (мышам и кроликам).
Авторами также обнаружены анти-РВ1 антитела в сыворотках от больных, перенесших инфекционное заражение СГВ.
Авторами также изучены протективные свойства анти-РВ1 антител в модельных экспериментах in vitro (опсонофагоцитарный тест с использованием перитонеальных мышиных макрофагов и стрептококков групп А и В) и in vivo (изучение динамики развития генерализованной СГВ инфекции у мышей, предварительно проиммунизированных рекомбинантным белком РВ1).
Представленный здесь новый рекомбинантный белок РВ1 имеет желаемую физиологическую стабильность, не имеет ферментативной активности, вызывает синтез анти-РВ1 антител, обладающих протективными свойствами против Streptococcus pyogenes и Streptococcus agalactiae. Рекомбинантный белок РВ1 полезен в качестве вакцинного компонента для профилактики и лечения бактериальной инфекции, вызванной Streptococcus pyogenes и Streptococcus agalactiae. Рекомбинантный белок РВ1 также полезен как в качестве единственного компонента вакцинного препарата, так и в качестве одной из составляющих частей многокомпонентной вакцины против Streptococcus pyogenes и Streptococcus agalactiae.
Получение рекомбинантного белка РВ1
Хромосомную ДНК выделяли из референс штамма 090R Ia серотипа СГВ фенольно-хлороформной экстракцией. Ген, кодирующий С5а пептидазу штамма 090R Ia серотипа СГВ, был обозначен как scpB1. Для получения фрагмента гена scpB1 с 114 п.н. по 1049 п.н. (обозначенного как рВ, размером 936 п.н.) использовали метод полимеразной цепной реакции. Полученные в результате ПНР фрагменты ДНК разделяли с помощью горизонтального электрофореза в 1% агарозном геле. Фрагмент рВ выделяли из агарозы с помощью набора «QIAquick Gel Extraction Kit» (Qiagen, США).
Полученный фрагмент pB клонировали с использованием экспрессионной плазмиды pQE-30 (The QIAexpress System, Qiagen, США). При подготовке к клонированию была проведена двойная рестрикция выделенного из агарозы рВ (936 п.н.) и плазмиды pQE-30 (3462 п.н.) ферментами BamHI и SacI с образованием липких концов. Продукты рестрикции разделяли с помощью горизонтального электрофореза в 1% агарозном геле. Рестрицированный рВ (фрагмент гена scpB1 после рестрикции: с 119 по 1043 п.н., размером 925 п.н., обозначенный как рВ') и рестрицированную плазмиду pQE-30 (обозначенную как pQE-30', размером 3446 п.н.) выделяли из агарозы с помощью набора «QIAquick Gel Extraction Kit» (Qiagen, США). В результате проведенного клонирования была получена рекомбинантная плазмидная ДНК (обозначенная как pQE-pB1), несущая рекомбинантную ДНК (обозначенную как рВ1 и состоящую из 925 п.н. фрагмента гена scpB1 и 50 п.н. фрагмента плазмиды pQE-30). Нуклеотидная последовательность рВ1 представлена на фиг.1.
Рекомбинантная плазмидная ДНК pQE-pB1 была трансформирована в Е. coli M15 (The QIAexpress System, Qiagen, США) с помощью кальциевого метода.
Клоны-трансформанты отбирали после роста на плотных селективных средах, учитывая маркер устойчивости к ампициллину, который несла плазмида pQE-30. Из клонов-трансформантов были отобраны клоны, содержащие рекомбинантную плазмиду pQE-pB1, наличие которой определяли с помощью ПЦР с использованием исходных праймеров Pb1 и Pb2 и последующим электрофоретическим анализом полученных фрагментов ДНК в 1,5% агарозном геле.
Клоны Е. coli M15, содержащие рекомбинантную плазмиду pQE-pB1, (обозначенные как Е. coli M15-PB1), проверяли на способность экспрессировать белок РВ1. Для получения очищенного препарата рекомбинантного белка клетки Е. coli M15-PB1 культивировали на бульоне ВНЕ (Brain Heart Infusion Broth, Gibco, США) с добавлением антибиотиков (ампициллин (100 мкг/мл) и канамицин (25 мкг/мл)) до поздней логарифмической фазы роста (OD600=0,7÷0,9). Затем экспрессию рекомбинантного белка индуцировали добавлением изопропил-бета-D-тиогалактопиранозида (IPTG), и клетки культивировали еще 4 часа. После этого клетки осаждали центрифугированием, отмывали лизирующим буфером А (20 мМ Na2HPO4, 20 мМ NaH2PO4, 500 мМ NaCl, 20 мМ имидазола, рН=7.4) и суспендировали в том же буфере. Суспензию клеток вскрывали ультразвуком. Клеточный лизат, освобожденный от клеточных обломков центрифугированием, наносили на колонку, заполненную Ni-сефарозой (Amersham, США). После того, как белок связывался на матриксе колонки, ее промывали буфером А для удаления неспецифически связавшихся белков. Рекомбинантный белок РВ1 элюировали с колонки элюирующим буфером Б (20 мМ Na2HPO4, 20 мМ NaH2PO4, 500 мМ NaCl, 500 мМ имидазола, рН=7.4). Полученный после аффинной хроматографии РВ1 был диализован против 20 мМ Na2HPO4, 20 мМ NaH2PO4, pH=7,8 с добавлением 500 мМ NaCl.
Молекулярную массу РВ1 определяли с помощью 12% SDS-PAGE, сравнивая пробег белка РВ1 с пробегом белков известной молекулярной массы (Precision Plus Protein standards (№161-0373), Bio-Rad, США). Молекулярная масса рекомбинантного белка РВ1 оказалась равной (43,0±0,5) кДа.
Фиг.1 (нуклеотидная последовательность рекомбинантной ДНК рВ1) представляет полную нуклеотидную последовательность рекомбинантной ДНК pB1, состоящую из 975 п.н. и кодирующую аминокислотную последовательность рекомбинантного белка PB1.
Фиг.2 (аминокислотная последовательность рекомбинантного белка PB1) представляет аминокислотную последовательность рекомбинантного белка PB1, состоящую из 325 аминокислотных остатков.
Таким образом, рекомбинантный белок PB1 содержит аминокислотную последовательность С5а пептидазы СГВ штамма 090R Ia серотипа с 39 по 348 аминокислотный остаток, ковалентно связанную с шестнадцатью аминокислотными остатками, кодируемыми pQE-30 (The QIAexpress System, Qiagen, США). Аминокислотная последовательность СГВ С5а пептидазы, входящая в состав рекомбинантного белка PB1 и кодируемая pB', состоит из 309 аминокислотных остатков и содержит лишь два (D130 и Н193) из трех аминокислотных остатков, участвующих в формировании центра ферментативной активности, что гарантирует отсутствие ферментативной активности у рекомбинантного белка PB1.
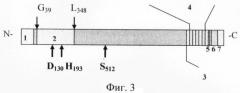
Для лучшего понимания изобретения на фиг.3 схематично представлено положение аминокислотной последовательности, кодируемой рВ' относительно аминокислотной последовательности С5а пептидазы СГВ.
На фиг.3. (Схема аминокислотной последовательности С5а пептидазы СГВ):
1 - сигнальный пептид;
2 - аминокислотная последовательность, кодируемая фрагментом pB';
3 - участок, связанный с пептидогликаном;
4 - С-повторы;
5 - LPXTN-мотив;
6 - гидрофобный трансмембрантный участок;
7 - цитоплазматический участок;
D130, H193, S512 - аминокислотные остатки, формирующие центр ферментативной активности.
Результатом изобретения является рекомбинантная ДНК рВ1, имеющая нуклеотидную последовательность, представленную на фиг.1; рекомбинантная плазмидная ДНК pQE-pB1, представляющая собой плазмиду pQE-30, несущую рекомбинантную ДНК рВ1; штамм Е. coli M15, трансформированный рекомбинантной плазмидной ДНК pQE-pB1, и экспрессирующий рекомбинантный белок РВ1; рекомбинантный белок РВ1, имеющий аминокислотную последовательность, представленную на фиг.2.
Рекомбинантный белок РВ1 обладает следующими свойствами:
а. при введении в организм млекопитающим (мышам и кроликам) вызывает синтез анти-РВ1 антител;
б. синтезируемые анти-РВ1 антитела обладают протективными свойствами в отношении Streptococcus pyogenes и Streptococcus agalactiae;
в. не обладает ферментативной активностью.
Ниже приводятся конкретные примеры, иллюстрирующие некоторые варианты изобретения, но не ограничивающие его.
Пример 1. Получение ДНК-фрагмента рВ методом полимеразной цепной реакции.
К 0,25 мкг геномной ДНК, выделенной из СГВ 090R Ia серотипа, добавляли 10 мкмолей каждого из специфических праймеров (Pb1, Pb2), фланкирующих исследуемую последовательность, буфер с магнием для полимеразы, по 0,2 мМ каждого из 4 дезоксирибонуклеотидтрифосфатов, объем доводили водой до 25 мкл. Добавляли 0,2 мкл термостабильной ДНК полимеразы. На поверхность жидкости наслаивали 40 мкл минерального масла. Пробирки помещали в амплификатор («Терцик», Россия). Смесь инкубировали при 94°С в течение 3 минут. Прибор программировали на цикл денатурации 94°С на 15 секунд, цикл отжига праймеров 68°С на 15 секунд, цикл синтеза ДНК 72°С на 20 секунд. Последовательность таких циклов повторялась 35 раз.
После чего смесь инкубировали при 72°С в течение 1 минуты. Олигонуклеотидные праймеры, использованные в работе, приведены в Таблице 1.
| Таблица 1 | |||
| Олигонуклеотидные праймеры | |||
| Название | Нуклеотидная последовательность от 5' к 3' | Положение на нуклеотидной последовательности гена scpB1 | Температура плавления |
| Pb1 | TCCTGGATCCGAACAAACCGTAGAAАСТССАС | 114-145 п.н. | 69,5°С |
| Pb2 | TCTTGGAGCTCGGCTGTTTTGACCCTAACAGT | 1049-1018 п.н. | 69,5°С |
В результате полимеразной цепной реакции с праймерами Pb1 и Pb2 был получен ДНК-фрагмент с 114 п.н. по 1049 п.н. (936 п.н.), обозначенный как рВ. Кроме того, на 5'-концах праймеров находились сайты распознавания эндонуклеазами BamHI и SacI с целью последующего клонирования ДНК-фрагмента рВ. Результат ПЦР оценивали с помощью горизонтального электрофореза в 1% агарозном геле (фиг.4). Размеры полученных фрагментов ДНК рассчитывали с помощью компьютерной программы SEQAID, исходя из сравнения их электрофоретической подвижности с электрофоретической подвижностью маркера молекулярных весов (100 п.н. ДНК-маркер, Сибэнзим, Россия).
На фиг.4. (Получение ДНК-фрагмента рВ методом ПЦР):
1 - 100 п.н. ДНК-маркер;
2 - продукты ПЦР, полученные при температуре отжига праймеров 67°С;
3 - продукт ПЦР, полученный при температуре отжига праймеров 68°С.
Пример 2. Клонирование ДНК-фрагмента рВ с использованием экспрессионной плазмиды pQE-30.
Клонирование ДНК-фрагмента рВ осуществляли с использованием экспрессионной плазмиды pQE-30 («The QIAexpress System», Qiagen, США). При подготовке к клонированию была проведена двойная рестрикция выделенного из агарозы рВ (936 п.н.) и плазмиды pQE-30 (3462 п.н.) ферментами BamHI и SacI с образованием липких концов. Продукты рестрикции разделяли с помощью горизонтального электрофореза в 1% агарозном геле. Размеры полученных фрагментов ДНК рассчитывали, как описано в примере 1. Рестрицированные рВ (фрагмент гена scpB1 после рестрикции: с 119 по 1043 п.н., размером 925 п.н., обозначенный как рВ') и плазмиду pQE-30 (обозначенную как pQE-30', размером 3446 п.н.) выделяли из агарозы с помощью набора «QIAquick Gel Extraction Kit» (Qiagen, США).
В ходе клонирования к 30 мкл фрагмента ДНК рВ' добавляли 2 мкл плазмиды pQE-30' (The QIAexpress System, Qiagen, США) в соотношении концентраций 4:1, 5 мкл десятикратного лигазного буфера и 1 мкл лигазы, выделенной из фага Т4. Объем доводили водой до 50 мкл. Смесь инкубировали в течение 1 часа при комнатной температуре и при температуре 4°С в течение 12 часов. В результате проведенного клонирования была получена рекомбинантная плазмидная ДНК (обозначенная как pQE-pB1), несущая рекомбинантную ДНК (обозначенную как рВ1 и состоящую из 925 п.н. фрагмента гена scpB1 и 50 п.н. фрагмента плазмиды pQE-30).
Пример 3. Трансформация культуры Е. coli M15 плазмидной ДНК pQE-рВ1.
Рекомбинантную плазмидную ДНК pQE-pB1 трансформировали в гетерологичную систему Е. coli M15. В качестве положительного контроля параллельно проводили трансформацию Е. coli M15 исходной плазмидной ДНК pQE-30. Генетическим маркером плазмидной ДНК pQE-30 был ген amp, кодирующий бета-лактамазу, что обеспечивало устойчивость к ампициллину клеток, несущих данную плазмиду. Культуру клеток Е. coli M15 культивировали на бульоне BHI (Brain Heart Infusion Broth, Gibco, США) с канамицином (25 мкг/мл) в течение 12 часов при 37°С и интенсивном перемешивании, пересевали на новый объем той же среды (1/50V) и инкубировали при 37°С в течение 2-3 часов при интенсивном перемешивании до ОД600=0,35. Выращенные клетки в объеме 1,5 мл центрифугировали в течение 1 мин при 12000 об/мин и полученный осадок ресуспендировали в 200 мкл 0,1 М CaCl2. Далее смесь инкубировали во льду 1 час. После центрифугирования осадок ресуспендировали в 187,5 мкл 0,1 М CaCl2 и 62,5 мкл деионизованной воды. Затем в пробирку вносили 0,2 мкг плазмидной ДНК и инкубировали смесь во льду 1 час. Далее смесь выдерживали 2 мин при 42°С и снова переносили в лед на 10 мин. После этого к смеси добавляли 1 мл бульона BHI с канамицином (25 мкг/мл) и инкубировали 1 час при 37°С. После осаждения центрифугированием (8000 об/мин, в течение 1 мин) клетки высевали на чашки с 1% L-агаром (Difco, США), содержащим ампициллин (100 мкг/мл) и канамицин (25 мкг/мл). Отбор клонов-трансформантов проводили через 18 часов роста клеток при 37°С. В качестве отрицательного контроля высевали чистую культуру клеток Е. coli M15.
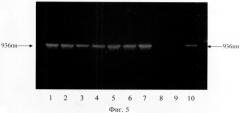
Наличие рекомбинантной ДНК рВ1 в плазмиде pQE-pB1 определяли ПЦР с использованием исходных праймеров Pb1 и Pb2 и последующим электрофоретическим анализом полученных фрагментов ДНК в 1,5% агарозном геле (фиг.5). Размеры полученных фрагментов ДНК рассчитывали, как описано в примере 1.
На фиг.5. (Электрофорез продуктов ПНР, полученных в результате амплификации ДНК, выделенной из различных клонов-трансформантов):
1-7 - рекомбинантные клоны, несущие плазмиду pQE-pB1;
8 - пропущенная дорожка;
9 - клон, несущий исходную плазмиду pQE-30;
10 - продукт ПЦР исходной хромосомной ДНК штамма СГВ 090R.
Таким образом, полученные данные позволяют сделать вывод о том, что в результате проведенного клонирования были получены рекомбинантные клоны, несущие плазмиды pQE-pB1 с рекомбинантной ДНК рВ1, которые получили название Е. coli M15-PB1.
Пример 4. Очистка рекомбинантного белка РВ1.
Культуру штамма Е. coli M15-PB1 выращивали на бульоне ВHI с добавлением ампициллина в концентрации 100 мкг/мл и канамицина в концентрации 25 мкг/мл в течение ночи при интенсивном перемешивании. Клетки культивировали в течение 12 часов, пересевали на 300 мл той же среды (1/50V) и инкубировали при 37°С в течение 2-3 часов при интенсивном перемешивании до OD600=0,7÷0,9. Экспрессию рекомбинантного белка индуцировали добавлением раствора изопропил-бета-D-тиогалактопиранозида до конечной концентрации 2 мМ, после чего инкубировали клетки при тех же условиях еще 4 часа. Полученную суспензию клеток центрифугировали при 6000 об/мин 5 мин. Надосадочную жидкость сливали, а клетки ресуспендировали в буфере А (20 мМ Na2HPO4, 20 мМ NaH2PO4, 500 мМ NaCl, 20 мМ имидазола, рН=7.4), добавляя ингибитор протеаз фенилметилсульфонилфторид (PMSF) до конечной концентрации 1 мМ.
Полученную суспензию клеток центрифугировали при 8000 об/мин 1 мин. Надосадочную жидкость сливали, а клетки ресуспендировали в буфере А. Для лизирования клеток была использована трехкратная ультразвуковая обработка при 4°С в течение 20 сек с перерывом в 40 сек в ультразвуковом дезинтеграторе (УЗДН-1У4.2, СССР). Лизат клеток центрифугировали при 13400 об/мин и 4°С в течение 20 мин. Надосадочную жидкость пропускали через 0,2 мкм фильтры (Millipore, США). Далее профильтрованный лизат клеток наносили на колонку с Ni-сефарозой (Qiagen, США), предварительно уравновешенной буфером А. Далее колонку промывали тем же буфером до тех пор, пока значения OD280 выходящего раствора не были меньше, чем 0,01. Белок элюировали раствором буфера Б (20 мМ Na2HPO4, 20 мМ NaH2PO4, 500 мМ NaCl, 500 мМ имидазола, pH=7.4), создавая градиент имидазола от 20 до 500 мМ. Элюат собирали фракциями по 500 мкл и анализировали в 12% SDS-PAGE. Фракции, в которых содержался белок, диализовали при перемешивании при 4°С против буфера В (20 мМ Na2HPO4, 20 мМ NaH2PO4, 500 мМ NaCl, рН-7,8) в течение 12 часов.
На фиг.6 представлена электрофореграмма рекомбинантного белка РВ1 на разных этапах очистки.
На фиг.6. (Электрофореграмма рекомбинантного белка РВ1 на разных стадиях очистки с помощью Ni-сефарозы):
1,8 - маркеры молекулярной массы;
2 - супернатант белков после ультразвукового вскрытия клеток Е. coli М15-РВ1;
3 - препарат белков, не связавшихся с Ni-сефарозой;
4 - препарат белков в отмывочном буфере после отмывки Ni-сефарозы 30-кратным объемом буфера;
5, 6, 7 - фракции препарата чистого белка (К=0,5 мг/мл) при элюции в градиенте имидазола от 20 мМ до 500 мМ.
Молекулярную массу РВ1 определяли с помощью 12% SDS-PAGE, сравнивая пробег белка РВ1 с пробегом: белков известной молекулярной массы (Precision Plus Protein standards (161-0373), Bio-Rad, США). Молекулярная масса рекомбинантного белка РВ1 оказалась равной (43,0±0,5) кДа.
Пример 5. Динамика изменения титра антител к рекомбинантному белку РВ1 после иммунизации млекопитающих.
Гуморальный иммунный ответ к рекомбинантному белку РВ1 изучали на беспородных белых мышах (самцах массой 16-18 г), и кроликах (самках массой 2,5 кг), полученных из питомника «Рапполово», РАМН. Иммунизацию проводили двукратно и подкожно с адъювантом гидроокиси алюминия. В эксперименте использовали 30 мышей и 2-х кроликов, которым вводили 0,2 мл и 0,5 мл РВ1 с адъювантом в соотношении объемов 1:1 соответственно. Для мышей при первой инъекции вводили 0,2 мл РВ1 с адъювантом в соотношении объемов 1:1 и на 22 день проводили бустирование 0,2 мл РВ1 без адъюванта. При первой инъекции конечная концентрация РВ1 составляла 100 мкг/мл и 50 мкг/мл при второй инъекции, которые делали на 1-й и 22-й дни соответственно. Кроликам дважды вводили подкожно по 0,5 мл РВ1 адъювантом в соотношении объемов 1:1. При первой инъекции конечная концентрация РВ1 была 240 мкг/мл и 120 мкг/мл - при второй инъекции, которые делали на 1-й и 28-й дни соответственно. Мышиные антитела к РВ1 определяли с 22-го по 118-й дни от начала иммунизации, используя пул сывороток от 3-х животных. Кроличьи антитела к РВ1 определяли с 28-го по 66-ой дни от начала иммунизации, используя пул сывороток от 2-х животных.
Анти-РВ1 антитела определяли с помощью двухслойного метода иммуноферментного анализа (ИФА). В лунки полистеролового планшета с высокой сорбционной емкостью (Costar, США) вносили по 100 мкл антигена (рекомбинантный белок РВ1) в концентрации 2 мкг/мл. Сорбцию проводили в 100 мМ бикарбонатном буфере (рН=9,45) в течение 16-20 часов при 4°С.
После этого содержимое из планшета удаляли и добавляли в лунки по 150 мкл забуференного физиологического раствора, рН=7,4 (PBS), содержащего 0,05% Твин-20 (PBST). Инкубацию проводили при 37°С в течение 30 мин. Содержимое планшета удаляли и трижды промывали PBST. Затем в лунки планшета вносили иммунную или нормальную (в качестве отрицательного контроля) сыворотку (с начальным разведением 1:100) с последующим шагом разведения, равным двум. Все разведения осуществляли в PBST, и каждую пробу дублировали. Инкубацию проводили в течение 1 часа при 37°С. Далее содержимое планшета удаляли и дважды промывали планшет PBST. После этого в лунки добавляли по 100 мкл А-ПХ конъюгата (белок А стафилококка, ковалентно связанный с пероксидазой хрена) в концентрации 10-7 моль/л. После часовой инкубации при 37°С содержимое планшета удаляли и трижды отмывали планшет PBST и один раз PBS, чтобы избежать ингибирующего действия Твин-20 на ферментативную активность пероксидазы. Далее для визуализации реакции в лунки планшета вносили по 100 мкл субстратной смеси (0,5 мкг/мл о-фенилендиамин в 150 мМ фосфатно-цитратном буфере (рН=5,0), 10 мкл 30% перекиси водорода), которую готовили непосредственно перед применением. Планшет инкубировали в течение 30 мин в темноте при комнатной температуре, и реакцию останавливали внесением в лунки по 30 мкл 50% концентрированной серной кислоты. Реакцию регистрировали при длине волны 492 нм с помощью прибора Titertek Multiskan (США).
Титр специфических антител определяли на разных сроках от начала иммунизации. Через три недели от начала эксперимента по иммунизации лабораторных животных было отмечено появление в крови специфических антител к РВ1. Полученные результаты, представленные на фиг.7, показали наличие выраженного гуморального иммунного ответа на введение рекомбинантного белка РВ1. При этом максимальное значение титра антител к белку РВ1 наблюдалось на 60 (1,6×10-6) день и 52 день (5,1×10-4) от начала иммунизации у кроликов и мышей соответственно.
На фиг.7. (Динамика изменения титра анти-РВ1 антител после иммунизации мышей и кроликов).
Пример 6. Определение анти-РВ1 антител в сыворотках от больных СГВ.
Для получения дополнительных доказательств об участии в развитии патогенного процесса поверхностного белка СГВ РВ1 сыворотки от больных СГВ, полученные из НИИ акушерства и гинекологии имени Д.О.Отто, были протестированы на наличие антител к рекомбинантному белку РВ1. Анти-РВ1 антитела в сыворотках от больных определяли с использованием двухслойного метода иммуноферментного анализа, как описано выше в примере 5. Полученные данные представлены в таблице 2.
| Таблица 2 | |||||
| Титр специфических анти-РВ1 антител в сыворотках от больных СГВ | |||||
| Номер сыворотки | Титр анти-РВ1 антител | ||||
| Норма | 4×10-2 | ||||
| 4849gl, | 1,6×10-3 | ||||
| 3598gl, | |||||
| 2607gl, | |||||
| 5218gl | |||||
| 2207gl, | 3,2×10-3 | ||||
| 3693gl, | |||||
| 6558gl, | |||||
| 2359gl, | |||||
| 3252gl, 297 la | |||||
| 2655gl, | 1,3×10-4 | ||||
| 5150gl | |||||
| 5358gl | 2,6×10-4 |
Данные таблицы 2 показывают, что из 13 протестированных сывороток более чем у половины (69%) сывороток был обнаружен высокий титр анти-РВ1 антител. Полученные результаты свидетельствуют о том, что в сыворотках от больных среди антител, образовавшихся к интактной клетке СГВ, имеются антитела к рекомбинантному белку РВ1.
Пример 7. Изучение опсонизирующей эффективности кроличьих анти-РВ1 антител.
Хорошо известно, что основным защитным механизмом макроорганизма от бактериальной инфекции является процесс фагоцитоза, опосредованного специфическими антителами (опсонофагоцитоз). Опсонизирующую активность кроличьих анти-РВ1 антител (с титром = 9,6×10-5) изучали на монослое мышиных перитонеальных макрофагов. Макрофаги индуцировали за двое суток до получения перитонеального экссудата введением мышам 0,5 мл 10% пептона внутрибрюшинно. Перитонеальный экссудат от 4-5 мышей смывали питательной средой IMDM (Iscove's Modified Dulbecco's Media, БиолоТ, Россия), клетки отмывали, суспендировали в концентрации 1 млн/мл и высевали в объеме 0,2 мл на 96-луночные платы для культуры тканей, в объеме 1,0 мл на 24-луночные платы для культуры тканей, содержащие покровные стекла (Sarstedt, Германия). Через 1 час инкубации неприкрепившиеся клетки отмывали, и макрофаги продолжали культивировать в среде IMDM с 10% ЭТС (эмбриональная телячья сыворотка, БиолоТ, Россия) в присутствии стрептомицина (100 мкг/мл) и пенициллина (100 ЕД/мл). Через сутки монослой отмывали от антибиотиков и вносили суспензию СГВ и СГА в среде IMDM, в концентрации 1×107 КОЕ/мл. Бактерии предварительно инкубировали в течение 30 минут с нормальной и иммунной кроличьей сывороткой, разведенной в 50 раз, в среде IMDM. Контакт бактерий с макрофагами продолжался 30 мин, после чего монослой тщательно отмывали от не прикрепившихся к поверхности клеток стрептококков. Все описанные выше этапы проводились при 37°C в атмосфере 5% CO2. Далее препараты фиксировали 30 мин абсолютным спиртом и последовательно окрашивали азидом и азуром в течение 30 мин. Монослой тщательно отмывали от остатков краски. При микроскопии на покровных стеклах исследовали не менее 100 клеток в трех параллельных пробах, подсчитывая процентную долю макрофагов, инфицированных стрептококками, и среднее число кокков на одну клетку. Степень инфицированности оценивали по фагоцитарному индексу (ФИ), который представляет собой произведение обоих показателей.
Результаты опсонофагоцитарного теста представлены в таблице 3. Кратность увеличения индекса инфицирования в два и более раза (2,0-6,4) при обработке стрептококков иммунной кроличьей сывороткой по сравнению с индексом инфицирования при обработке стрептококков нормальной кроличьей сывороткой свидетельствует о протективности анти-РВ1 антител как в отношении СГВ, так и в отношении СГА.
| Таблица 3 | |||||
| Результаты опсонофагоцитарного теста на монослое перитонеальных мышиных макрофагов с использованием нормальной иммунной кроличьих сывороток | |||||
| Штамм | Сыворотка | Показатели опсонофагоцитоза | |||
| Инфицированные макрофаги (%) | Среднее число кокков на клетку | ФИ | Кратность увеличения ФИ | ||
| СГВ Ia (58/59) | нормальная | 23 | 1,5 | 35 | |
| анти-PB1 | 47 | 4,0 | 188 | 5,4 | |
| СГВ Iac (5/70) | нормальная | 50 | 2,5 | 125 | |
| анти-РВ1 | 89 | 8 | 712 | 5,7 | |
| СГВ II (60/59) | нормальная | 36 | 1,6 | 58 | |
| анти-РВ1 | 69 | 5,4 | 373 | 6,4 | |
| СГВ III (55/81) | нормальная | 38 | 2,2 | 84 | |
| анти-РВ1 | 51 | 3,5 | 179 | 2,1 | |
| СГВ III (72/93) | нормальная | 71 | 10,0 | 710 | |
| анти-РВ1 | 92 | 15,4 | 1417 | 2,0 | |
| СГВ VI(2/68) | нормальная | 23 | 1,0 | 23 | |
| анти-РВ1 | 40 | 2,5 | 90 | 3,9 | |
| СГА М49 (NZ131) | нормальная | 40 | 5,8 | 232 | |
| анти-РВ1 | 82 | 16,3 | 1337 | 5,8 |
Пример 8. Изучение протективных свойств мышиных анти-РВ1 антител на мышах, инфицированных СГВ.
Протективная эффективность анти-РВ1 антител in vivo была изучена на «мышиной» модели генерализованной инфекции. Известно, что в этих условиях ведущим защитным механизмом является опсонофагоцитарная реакция.
В экспериментах in vivo лабораторным мышам сначала вводили подкожно белок РВ1 по схеме иммунизации, упомянутой ранее в примере 5, или физиологический раствор (в качестве контроля). Затем обеим группам мышей внутрибрюшинно вводили суспензию СГВ серотипа Iac (штамм 5/70) в сублетальной дозе (LD50=2,7×107 КОЕ/мл) на сроках с максимальной выработкой антител к белку РВ1 (52-й день от начала иммунизации). Контроль развития инфекции осуществляли с помощью высева стрептококков из селезеночной суспензии мышей на среду с кровяным агаром на разных сроках после введения СГВ.
| Таблица 4 | |||||||
| Динамика стрептококкового очага в селезенке мыши | |||||||
| Время после заражения СГВ, час | |||||||
| 1 | 3 | 5 | 24 | 48 | 72 | ||
| Количество колоний СГВ в селезенке мыши, КОЕ/мл×10-7 | Контроль (мыши с введением PBS) | 1,4 | 1,3 | 2,5 | 5,6 | 2,1 | 0 |
| Опыт (мыши, с введением РВ1) | 1,1 | 0,2 | 0,3 | 0,2 | 0,7 | 0 |
Как видно из данных таблицы 4, в контрольной группе на первых часах шло накопление числа СГВ в селезенке мышей, и только через 24 часа начиналась естественная элиминация стрептококков из селезенки. В то время как в опытной группе практически с первых часов происходила элиминация стрептококков из селезенки. Таким образом, результаты опыта показали, что рекомбинантный белок РВ1 способен стимулировать протективный гуморальный иммунный ответ.
1. Рекомбинантная ДНК рВ1, кодирующая рекомбинантный белок РВ1, обладающий протективными свойствами в отношении Streptococcus pyogenes и Streptococcus agalactiae, и имеющая нуклеотидную последовательность, представленную на фиг.1.
2. Рекомбинантная плазмидная ДНК pQE-pB1, представляющая собой плазмидную ДНК pQE-30, несущую рекомбинантную ДНК по п.1.
3. Штамм Е. coli M15, трансформированный рекомбинантной плазмидной ДНК по п.2, и экспрессирующий рекомбинантный белок РВ1.
4. Рекомбинантный белок РВ1, состоящий из ам