Способ и устройство для улучшенного наноспектроскопического сканирования
Иллюстрации
Показать всеИзобретение относится к области наноспектроскопического сканирования. Изобретение содержит подложку, имеющую зеркальную поверхность, выполненную из плазмонно-резонансного металла, источник луча света и линзовый блок, состоящий из одной или более плазмонно-резонансных частиц, расположенных вокруг отверстия, образующего область детектирования. При направлении луча света на образец в области детектирования частицы способны создавать электромагнитные щелевые моды ближнего поля в пространстве между нанолинзой и противолежащей областью детектирования на поверхности подложки при зазоре между нанолинзой и подложкой, имеющем выбранное расстояние 40 нм или меньше. Устройство также содержит детектор для приема света, излучаемого или рассеиваемого образцом на область детектирования, и для преобразования принятого света в усиленный щелевыми модами рамановский спектр и механизм поступательного перемещения для перемещения образца относительно линзового блока через отверстие в линзовом блоке, чтобы поместить последовательные химические группы в образце в область детектирования. 2 н. и 18 з.п. ф-лы, 17 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области наноспектроскопического сканирования, в частности к способу и устройству для идентификации последовательности химических групп в линейном полимерном образце, такой как последовательность оснований в нуклеиновой кислоте.
Уровень техники
Перечисленные ниже источники информации составляют часть известного уровня техники и/или описывают методы, которые можно применить в различных аспектах настоящего изобретения. Все эти документы включены в данное описание для сведения.
G.R.Brewer. Electron-Beam Technology in Microelectronic Fabrication, Academic Press, NY, 1980.
David Ginger et al. "The evolution of Dip-Pen Nanolithography", Angew.Chem.Int.,v.43, p.30-45, 2004.
S.Hayashi. "Spectroscopy of Gap Modes in Meta Particle-Surface Systems", Troics Appl Phys 81:71-95 (2001).
I-K.Kneipp et al. "Ultrasensitive Chemical Analyses by Raman Spectroscopy", Chem.Rev., 1999, vol.99, p.2957-2975, p.271.
J.Li et al. "DNA molecules and configurations in a solid-state nanopore microscope", Nature Materials, vol.2, p.611-615 (2003).
V.Matyushin et al. "Tuning the setup of sputter-coated multilayers in nanocluster-based signal enhancing biochips for optimal performance in protein and DNA-assays", J.Nanoscience and Nanotechnology, Volume 4, Number (January/February 2004), pp.98-105 (2004).
D.McCamant. "Femtosecond Broadband Simulated Raman: A new Approach for High-Performance Vibrational Spectroscopy", Applied Spectroscopy, Vol.57, p.1317-1323, 2003.
S.C.Minne et al. "Automated parallel high-speed atomic force microscopy", Applied Physics Letters, Vol.72, p.2340-2342, 1998.
S.C.Minne et al. "Bringing Scanning Probe Microscopy up to Speed", 173 p. Kluwer Academic Publishers, 1999.
C.M.Niemeyer. "Self-assembled nanostructures based on DNA: towards the development of nanobiotechnology", Current Opinion in Chemical Biology, V.4, p.609-618, 2000.
J.Prikulis et al. "Optical Spectroscopy of Single Trapped Metal Nanoparticles in Solution", Nano Letters, v.4, p.115-118, 2004.
J.P.Rabe. "Self-assembly of single macromolecules at surfaces". Current Opinion in Colloid and Interface", Science. Vol.3, p.27-31, 1998.
F.Wolf et al. Review of Scientific Instruments, 1999, Vol.70, p.2751-2757, "Novel Scanning Near-Field Optical Microscope (SNOM)/scanning confocal optical microscope based on normal force distance regulation and bent etched fiber tips".
Y.Xia et al. Advanced Functional Materials, v.13, p.907-918, 2003, "Template-assisted Self-Assembly of Spherical Colloids into Complex and Controllable Structures".
H.Xu et al. Phys Rev E, v.62, p.4318, 2000.
J.Xu et al. "Microfabricated Quill-Type Surface Patterning Tools for the Creation of Biological Micro/Nano Arrays", Biomedical Microdevices, v.6, p.117-123, (2004).
F.Zenhausen et al. "Scanning Interferometric Apertureless Microscopy: Optical Imaging at 10 Angstrom Resolution", Aug.25, 1995, Science, Vol.269.
Известен целый ряд устройств и способов для изучения поверхностных признаков и структуры на микро- и даже наномасштабном уровне. Сканирующая зондовая микроскопия (СЗМ) позволяет картировать топологию поверхности в микромасштабе путем перемещения детекторной иглы, установленной на свободном конце консольной балки, над поверхностью или по поверхности картируемого материала. Микроскоп такого типа может работать при прямом физическом контакте с поверхностью (сканирующая атомно-силовая микроскопия, АСМ) или в туннельном режиме, путем детекции туннельного тока, когда игла находится на выбранном расстоянии от поверхности (сканирующая туннельная микроскопия, СТМ).
Эти виды устройств доказали свою полезность в картировании топографии поверхности, например, для обнаружения дефектов интегральных микросхем, однако они не предназначены или не могут использоваться для обнаружения определенных химических соединений или химических групп. Эта концепция была расширена параллельной высокоскоростной АСМ (например, Minne, 1998, 1999).
Принцип сканирования иглой был также адаптирован для оптического определения картографии поверхности. Например, в патенте США №6441359 описана сканирующая ближнеполевая оптическая система, в которой ближнеполевая оптика установлена на свободном конце консольной балки. В этом патенте также описаны способы микроизготовления для изготовления матрицы таких оптических элементов для оптической сканирующей системы. Расстояние между иглой и образцом в устройстве регулируется оптической системой отклонения уровня, которая удерживает иглу вблизи поверхности образца. Эта система способна обеспечивать разрешение меньше длины волны посредством сканирования апертуры с размерами меньше длины волны или посредством сканирования сплошной иммерсионной линзой очень близко к образцу. Однако данное устройство не предназначено и не может использоваться для детектирования отдельных химических молекул или групп из-за очень низкого уровня создаваемого сигнала. Известны также оптические сканирующие ближнеполевые микроскопы (ОСБМ) (например, Wolf).
Известен высокочувствительный зонд для химического анализа, построенный на принципе поверхностно-усиленной рамановской спектроскопии, ПУРС (например, Kneipp). Принцип ПУРС был также применен в сканирующем микроскопе высокого разрешения для получения спектроскопической информации высокого разрешения от поверхности образца, например, в патенте США №6002471. Это устройство содержит малый проводящий элемент (плазмонно-резонансную частицу, ПРЧ) на свободном острие сканирующей консольной балки для усиления света, излучаемого вблизи зонда. Подложка для образца выполнена из стекла. В этом патенте не раскрыты и не предложены способы использования электромагнитных щелевых мод для увеличения спектроскопического разрешения, т.е. для разрешения единичных химических структур, например оснований ДНК, а также не предложена система, способная регистрировать параллельно множество образцов, например растянутых нитей ДНК.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Согласно одному аспекту изобретения предложено устройство для идентификации последовательности химических групп в линейном полимерном образце, такой как последовательность оснований в нуклеиновой кислоте. Устройство содержит подложку, имеющую зеркальную поверхность, выполненную из плазмонно-резонансного металла, источник луча света и линзовый блок, состоящий из одной или более плазмонно-резонансных частиц, расположенных вокруг отверстия, образующего область детектирования. Частицы расположены таким образом, чтобы создавать электромагнитные щелевые моды ближнего поля в пространстве между нанолинзой и противолежащей областью детектирования на поверхности подложки при зазоре между нанолинзой и подложкой, имеющем выбранное расстояние 40 нм или меньше, когда луч света направляется на образец в области детектирования. Также имеется детектор для приема света, излучаемого или рассеиваемого образцом на область детектирования, и для преобразования принятого света в усиленный щелевыми модами рамановский спектр, чтобы идентифицировать химическую группу образца в области детектирования, и механизм поступательного перемещения для перемещения образца относительно линзового блока через отверстие в линзовом блоке, чтобы поместить последовательные химические группы в образце в область детектирования.
Устройство может дополнительно содержать фокусирующий механизм для перемещения линзового блока по направлению к поверхности подложки и от нее для обеспечения выбранного расстояния.
Нанолинза в линзовом блоке может включать в себя по меньшей мере три плазмонно-резонансные частицы, расположенные симметрично вокруг центральной оси, проходящей перпендикулярно плоскости поверхности подложки, причем каждая частица имеет размер меньше 200 нм в своем наибольшем измерении, и расстояние от края до края любой пары частиц по существу меньше длины волны луча света. Частицы могут быть сферическими или эллиптическими, а их большие оси ориентированы таким образом, чтобы пересечь центральную ось.
Источник света может создавать луч циркулярно поляризованного света, плоскость поляризации которого перпендикулярна центральной оси.
В одном общем варианте подложка образует отверстие, которое выровнено с отверстием в нанолинзе и находится на расстоянии от него, а механизм поступательного перемещения протягивает линейный образец через отверстия в подложке и линзе. Механизм поступательного перемещения может иметь электрическое поле для протягивания образца через устройство и через отверстия в подложке и линзе. Альтернативно образец может иметь присоединенные к его противоположным концам частицы, способные взаимодействовать с лазерными или магнитными пинцетными манипуляторами. В данном случае механизм поступательного перемещения может содержать лазерные или магнитные пинцетные манипуляторы для взаимодействия с частицами и протягивания образца через канал и отверстия в подложке и линзе.
В другом общем варианте линзовый блок установлен на консольной балке, имеющей отверстие, через которое луч света поступает в область детектирования линзы. Образец можно установить на одном конце на опору и подвижно пропускать через отверстия в линзе и консольной балке, при этом движение опоры относительно консольной балки с помощью механизма поступательного перемещения обеспечивает протягивание образца через отверстие в линзовом блоке. Для секвенирования множества линейных образцов устройство может содержать множество таких консольных балок и связанных с ними линзовых блоков.
Согласно другому аспекту изобретения предложен способ идентификации последовательности химических групп в линейном полимерном образце, такой как последовательность оснований в нуклеиновой кислоте. Способ заключается в том, что протягивают образец через отверстие в линзовом блоке, состоящем из одной или более плазмонно-резонансных частиц, расположенных вокруг данного отверстия. Как было описано выше, частицы образуют область детектирования в отверстии и способны создавать при направлении луча света на образец в области детектирования электромагнитные щелевые моды ближнего поля в пространстве между нанолинзами и противолежащей областью детектирования на поверхности подложки, причем подложка имеет зеркальную поверхность, выполненную из плазмонно-резонансного металла, при зазоре между нанолинзой и подложкой, имеющем выбранное расстояние 40 нм или меньше. Луч света направляют на образец с областью детектирования при протягивании образца через отверстие в линзовом блоке и свет, излучаемый или рассеиваемый образцом на область детектирования, принимают и преобразуют в усиленный щелевыми модами рамановский спектр, чтобы идентифицировать химическую группу образца в области детектирования.
Для осуществления предложенного способа могут использоваться различные конструктивные варианты устройства, описанные выше.
Эти и другие задачи и существенные признаки изобретения будут более понятны из следующего подробного описания изобретения в совокупности с прилагаемыми чертежами.
Краткое описание чертежей
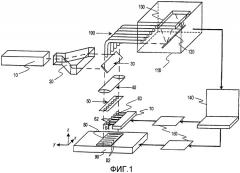
Фиг.1 изображает расположение составных элементов устройства, выполненного согласно одному варианту изобретения;
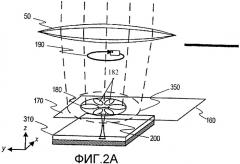
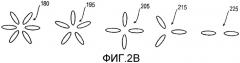
фиг.2А иллюстрирует электромагнитные явления, вызывающие образование электромагнитных щелевых мод ближнего поля при направлении циркулярно поляризованного луча света на нанолинзу, выполненную согласно одному варианту настоящего изобретения в виде нанолинзы из шести частиц, а фиг.2B изображает нанолинзы, состоящие из 2-6 ПРЧ;
фиг.3А и 3B изображают перспективный вид (3А) и поперечное сечение (3B) соответственно конца консольной балки с интегрированными нанолинзами согласно настоящему изобретению;
фиг.4 изображает подложку с матрицей растянутых нитей ДНК на ее верхней поверхности;
фиг.5А и 5B иллюстрируют перспективный вид (5А) и поперечное сечение (5B) соответственно оптических явлений, использованных в настоящем изобретении для детекции отдельных последовательных оснований в образце растянутой ДНК;
фиг.6А, 6B и 6С изображают результаты численного моделирования серебряной нанолинзы в форме трехконечной звезды. На фиг.6А показана частотная зависимость амплитуды поля в центре нанолинзы, соответствующая плазмонному резонансу при 2,45 эВ; на фиг.6B показано распределение поля по оси у, и на фиг.6С показан топографический вид сверху распределения поля;
фиг.7А, 7B и 7С подобны фиг.6А-6С соответственно, но иллюстрируют результаты численного моделирования серебряной нанолинзы в форме четырехконечной звезды;
фиг.8 изображает распределение поля в нанолинзе в форме четырехконечной звезды по оси х с максимальным усилением 3000 вблизи поверхности ПРЧ;
фиг.9 иллюстрирует плазмонную нанолинзу в комбинации с нанопористым устройством;
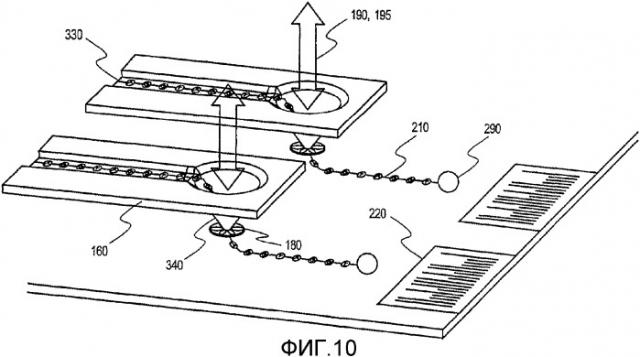
фиг.10 иллюстрирует плазмонную нанолинзу в комбинации со сканирующим устройством, имеющим матрицу игл.
Осуществление изобретения
А. Определения
Приведенные ниже термины используются, если не указано иное, в следующих значениях.
"Плазмонно-резонансный" металл означает любой металл, такой как золото, серебро или алюминий, который способен поддерживать поверхностные электромагнитные моды - поверхностные плазмонные поляритоны (ППП), представляющие собой связанные моды фотонов и плазмонов.
"Химическая группа" в образце может включать в себя подэлементы в полимере или группировки подэлементов, такие как основания нуклеиновой кислоты, или химические замещающие группы, такие как гидроксильные, аминные, алкильные, кислотные или альдегидные группы. Эти химические группы характеризуются уникальными усиленными рамановскими спектральными сигнатурами или признаками.
"Щелевые моды" означают нормальные электромагнитные моды или собственные электромагнитные моды, которые возбуждаются внешним электромагнитным полем в пространстве между двумя или более плазмонно-резонансными частицами, расположенными близко (на расстоянии менее 40 нм) к металлической поверхности, предпочтительно к поверхности плазмонно-резонансного металла. Примерами плазмонно-резонансных частиц являются частицы серебра или золота размером 5-200 нм в их наибольшем измерении.
"Усиленный щелевыми модами рамановский спектр" образца относится к спектральным признакам в рамановском спектре образца, которые усилены присутствием щелевых мод в образце.
В. Устройство для наноспектроскопического сканирования
На фиг.1 изображено устройство, обозначенное, в общем, позицией 35, для идентификации химических групп в образце, присоединенном к поверхности. На чертеже показаны сканирующая площадка 90, а на ней ДНК-чип 80, имеющий множество растянутых нитей ДНК, таких как нити 82, закрепленных на поверхности чипа и расположенных параллельно друг другу. Способы крепления растянутых полимерных нитей, таких как нити ДНК, на поверхности чипа будут описаны ниже. Согласно существенному признаку данного варианта изобретения поверхность чипа, на которую опирается образец, имеет зеркальное покрытие из плазмонно-резонансного металла, например серебра, золота или алюминия.
Нити ДНК сканируются посредством сканирующей площадки 90, такой как площадка с пьезоэлектрическим или электромагнитным контролем движения. Площадка с электромагнитным контролем движения позволяет сканировать области размером до десятков сантиметров и больше, что делает возможным сканирование ДНК-чипов одной молекулы, соответствующей отдельной хромосоме.
Луч света, предпочтительно имеющий когерентную циркулярную поляризацию, создается лазером 10. Этот лазер может содержать два лазера для выполнения нелинейной рамановской спектроскопии, такой как CARS, и лазерно-индуцированной фемтосекундной рамановской спектроскопии (D.McCamant). В примерной лазерной системе используется Ti:сапфировый настраиваемый лазер с импульсным и непрерывным рабочими режимами. Длина волны возбуждающего луча света выбирается и настраивается таким образом, чтобы она была близкой к максимальному спектральному пику в спектрах поглощения плазмонного резонанса плазмонно-резонансной подложки. В случае сканирования плазмонной нанолинзой при корректировке частоты необходимо учитывать спектры поглощения плазмонного резонанса всей системы (плазмонная нанолинза плюс плазмонно-резонансная подложка). Важно отметить, что спектры плазмонного поглощения изменяются из-за наноскопической близости плазмонных нанолинз к поверхности плазмонно-резонансной подложки.
Луч света расширяется с помощью расширителя луча или преобразуется в сканирующий луч в растре 20 луча. Таким образом, один луч света делится на группу лучей света, каждый из которых направлен на отдельную плазмонную нанолинзу в матрице нанолинз 60. Каждый отдельный луч света направляется через делитель 30 луча и коллиматор 40 на матрицу 50 микролинз. Матрица микролинз позволяет осуществлять индивидуальное цифровое управление каждым отдельным лучом света, направленным на отдельные плазмонные нанолинзы, такие как линзы 62 в матрице 60, расположенные на свободном конце консольной балки 64, как будет более подробно описано ниже.
Из дальнейшего описания будет понятно, что плазмонные нанолинзы с щелевыми модами, описанные в настоящем изобретении, основаны на способности локализованных плазмонов (коллективных колебаний электронов), возбуждаемых внутри металлических наночастиц внешней электромагнитной волной, усиливать электромагнитные поля в зоне ближнего поля, находящейся в тесной близости к плазмонно-резонансной поверхности, и локализовать их в чрезвычайно малых наномасштабных объемах. Это нераспространяющееся поле концентрируется в тесной близости (на расстоянии нескольких десятков нанометров, 30-40 нм) к поверхностям наночастиц и называется "электромагнитное поле ближней зоны", чтобы отличить его от распространяющегося электромагнитного поля в дальних зонах.
На фиг.1 также показано, что луч света, направляемый на каждую плазмонную нанолинзу в матрице на консольной балке, можно модулировать с помощью системы 50 микрообработанных зеркал, такой как Digital Micromirror Device компании Texas Instruments, Inc., Dallas, Texas. Эта система позволяет осуществлять цифровое управление освещением каждой отдельной плазмонной нанолинзы и считывать сигнал, рассеиваемый каждой плазмонной нанолинзой. Эта система особенно полезна для реализации цифрового управления высокоскоростным программируемым многоканальным импульсным освещением с отдельной адресацией и захвата рассеянного сигнала, что очень важно для реализации сверхбыстрого прямого секвенирования ДНК с прямой оцифровкой данных последовательности в память компьютера.
Система изгиба консоли по обратной связи поддерживает расстояние между плазмонными нанолинзами и образцом ДНК. Такие системы управления хорошо известны и описаны для атомно-силовых микроскопов, например, в патенте США №5883705 или для сканирующих ближнеполевых микроскопов, например, в патенте США №5354985, упоминаемых здесь для сведения. В одном способе индивидуальной активизации и регулирования каждой консольной балки в матрице 60 во время процесса сканирования используется пьезорезисторное управление по обратной связи, подробно описанное в патенте США № 6441359, который также упоминается здесь для сведения.
Расстояние между каждой плазмонной нанолинзой и соответствующим образцом ДНК предпочтительно поддерживается на уровне от 0,1 нм до нескольких нанометров, чтобы обеспечить оптимальное усиления поля и локализацию в зазоре между нанолинзой и образцом ДНК и поверхностью подложки путем возбуждения электромагнитных щелевых мод ближнего поля, как показано на фиг.2, 6а и 6b. При изменении зазора между каждой нанолинзой и поверхностью подложки, на которой расположен образец, также изменяется локализация и интенсивность электромагнитных щелевых мод. Поэтому изменение расстояния между нанолинзой и образцом ДНК (или поверхностью подложки) позволяет регулировать форму и локализацию электромагнитных щелевых мод, чтобы получить максимальный сигнал рассеянного света (для считывания) и максимальное пространственное разрешение. Путем оптимизации этих щелевых мод можно достичь такого уровня разрешения, который позволяет различать отдельные основания в нити ДНК, иммобилизированной на поверхности подложки. В зависимости от степени чрезмерного растяжения нитей ДНК на чипе требования, предъявляемые к пространственному разрешению, могут варьироваться для каждого основания и каждой нити отдельно. Однако это расстояние находится в интервале от нескольких нанометров до менее одного нанометра.
В варианте, показанном на фиг.1, отраженный свет, рассеянный в обратном направлении от каждой плазмонной нанолинзы, взаимодействующей с отдельными основаниями ДНК, направляется обратно через матрицу 50 микролинз, коллиматор 40 и делитель 30 луча на приемный конец оптоволоконной ленты 100. Однако следует понимать, что изобретение не ограничено сбором обратно-рассеянного света. В других реализациях изобретения геометрия освещения и сбора света может быть другой, причем оптические системы освещения и сбора света могут быть отдельными.
Рассеянный световой сигнал по оптоволоконной ленте 100 направляется в щель монохроматора многоканального спектрального анализатора 110. Для удаления падающего света используются узкополосные режекторные фильтры. Дифракционная решетка 120 делит рассеянный световой луч на группу монохроматических лучей света, которые будут преобразовываться в отдельные рамановские спектры. Спектры, полученные на матрице 130 детектора, затем преобразуются в цифровую форму и передаются в компьютер 140, где они обрабатываются для получения данных о последовательности для образцов ДНК на чипе. В другой подходящей оптической конфигурации, не показанной в данном описании, используется метод интерферометрического детектирования, который был описан ранее (например, F.Zenhausen).
С. Действие нанолинзы и ее изготовление
В данном разделе будут описаны конкретные структуры нанолинзы, предназначенные для размещения в тесной близости к гладкой металлической поверхности подложки образца, чтобы создавать локализованные щелевые моды, когда линза освещается лучом света, например когерентным и/или циркулярно поляризованным лучом света. Эти моды можно использовать для прямого оптического считывания молекул, находящихся в пространстве между нанолинзой и зеркальной поверхностью подложки, с высоким пространственным разрешением для обеспечения субнанометрового разрешения и с усилением сигнала, позволяющим определить спектральную сигнатуру одной малой молекулы, такой как отдельные основания нитей ДНК.
Наиболее общая конфигурация нанолинзы содержит одну, предпочтительно несколько (например, 2-6) металлических наночастиц, имеющих выбранную форму и геометрию относительно друг друга. Предпочтительная геометрия частиц представляет собой симметричное расположение частиц вокруг центральной оси, как будет проиллюстрировано ниже, хотя возможны также и другие геометрии, например беспорядочная фракталь. Наночастицы, образующие линзу, могут иметь различные формы и размеры и находиться в наноскопической близости друг к другу. Однако наибольшее измерение каждой наночастицы и системы в целом не должно превышать длину волны освещающего света. Предпочтительно, чтобы наночастицы имели размер в интервале 5-200 нм, например 20-50 нм.
На фиг.2 показан детальный перспективный вид части консольной балки 160, на свободном (дистальном) конце которой расположена нанолинза 180, состоящая из шести частиц. Видно, что циркулярно поляризованный луч света 190 от лазерного источника направляется через конфокальную линзовую оптику 50 на нанолинзу 180. Эта нанолинза расположена на держателе 170, выполненном из прозрачного диэлектрика, в качестве которого в одном варианте может служить свободный конец консоли 160, используемой для регулирования расстояния между нанолинзой и образцом в сканирующем зонде. Нанолинза размещена в тесной близости к металлической зеркальной поверхности 200 на подложке образца. Так как свет дальнего поля, направляемый конфокальной оптикой, можно сфокусировать на пятне размером около или немного меньше 1 микрона в зависимости от предела дифракционной оптики, диаметр нанолинзы (диаметр круга, описывающего частицы нанолинзы) предпочтительно составляет 50-200 нм, т.е. меньше длины волны освещающего света. Как видно на чертеже, освещаемая площадь (штриховой круг 350) обычно больше, чем площадь нанолинзы. Однако можно создать нанолинзу диаметром 0,5-1,0 микрон, чтобы она совпадала с фокусным пятном. В этом случае нанолинза будет действовать как наноантенна, которая будет концентрировать электромагнитную энергию к центру нанолинзы путем возбуждения локализованных плазмонов.
В варианте, показанном на фиг.2А, плазмонные нанолинзы 180 имеют структуру в форме звезды, состоящей из шести металлических наночастиц, таких как частицы 182, каждая из которых имеет форму либо вытянутого сфероида с большой эксцентричностью (предпочтительно более 5), либо цилиндрического наностержня с полусферическими головками на концах, либо металлической нанопроволоки. Эта геометрия частиц также показана позицией 180 на фиг.2B вместе с конфигурациями частиц 195, 205, 215 и 225 для нанолинзы с пятью, четырьмя, тремя и двумя частицами соответственно.
Как отмечалось выше, освещение каждой нанолинзы предпочтительно осуществлять лазерным лучом или некогерентной электромагнитной волной с циркулярной поляризацией. Максимальное усиление электромагнитного поля, показанное позицией 200 на фиг.2А, достигается в центральной части линзы близко к ее оси. Эта область имеет диаметр размером несколько нанометров или меньше. Как показали результаты численного моделирования, описанные ниже со ссылками на фиг.6А-6С, 7А-7С и 8, коэффициент усиления поля может достигать 1500-3000 в центре нанолинзы. Этот коэффициент усиления существенно превышает усиление, достигаемое в известных конфигурациях, состоящих из сферических наночастиц и наночастиц другой формы. Максимальное локальное усиление поля, достигнутое в численном моделировании, о котором сообщалось в работе H.Xu, составляет 300.
Для изготовления предлагаемой нанолинзы можно использовать целый ряд известных методов. Обычно нанолинзу выполняют как одно целое с консольной балкой, используя существующие методы наноизготовления на основе электронно-лучевой литографии, или метода сфокусированного ионного пучка (G.R.Brewer), или литографии на основе сканирующей туннельной микроскопии. Еще один способ изготовления может быть основан на методе самосборки по шаблонам (Y.Xia). Можно использовать альтернативные методы, такие как нанолитография глубокого пера, для создания конфигураций плазмонной нанолинзы на различных опорных материалах (например, D.Ginger) или метод самосборки на основе ДНК (C.M.Niemeyer). В одном варианте плазмонная нанолинза может быть интегрирована в свободный конец консоли, которая является частью сканирующего зонда и которая может одновременно выполнять функцию консольной иглы, которая регулирует расстояние между нанолинзой и образцом во время сканирования в сканирующих зондах, таких как атомно-силовой микроскоп, АСМ, или оптический сканирующий ближнеполевой микроскоп, ОСБМ. Один возможный вариант плазмонной нанолинзы, интегрированной в консоль сканирующего спектроскопического зонда, представлен на фиг.3.
На фиг.3 показано, как плазмонную нанолинзу можно интегрировать в свободный конец консоли сканирующего спектроскопического устройства, и как она может одновременно выполнять функцию консольной иглы, которая регулирует расстояние между нанолинзой и образцом во время сканирования образца. Консоль 160 изготовлена из композиционного материала, имеющего непрозрачную часть 260 и оптически прозрачную часть 170, которая образует оптическое окно 250, позволяющее падающему циркулярно поляризованному свету взаимодействовать с нанолинзой 180 и эффективно возбуждать локализованные плазмы (ЛП) и щелевые моды (ЩМ).
D. Изготовление подложки, держащей образец
Подложка или опора в устройстве выполнена с возможностью усиления электромагнитного поля в тесной близости к поверхности и покрыта тонкой пленкой плазмонно-резонансного материала, такого как серебро, золото или алюминий. Толщина этой пленки предпочтительно составляет 25-200 нм, например 50 нм. Покрытие из металлической пленки можно нанести на подходящую подложку, например, из стекла, используя известные методы, такие как вакуумное осаждение или высокочастотное напыление. Примерные покрытия подложки и способы их получения описаны в патенте США №5611998 на изобретение "Оптохимический датчик и способ его изготовления", упоминаемом для сведения, а также в работе V. Matyushin, также упоминаемой для сведения.
Нити ДНК длиной, например, от 100 нм до 2,5 мм размещаются на подложке, как показано позицией 82 на фиг.1. Расстояние между нитями должно быть в интервале 200-300 микрон и соответствовать расстоянию между соседними консолями в матрице консолей. Предпочтительное расстояние составляет 250 микрон, что соответствует стандартному шагу 250 микрон в применениях оптоволоконных лент.
На фиг.4 показан примерный чип или подложка 80 для применения в устройстве и способе согласно настоящему изобретению. Как видно на чертеже, образцы ДНК, полученные, например, из геномной ДНК, имеют форму однонитевых фрагментов ДНК длиной до 2,5 мм (5 Mbase). Нити, такие как 210, размещаются на поверхности предметного стекла 80 со свойствами оптического усиления плазмонного резонанса. Они размещаются упорядоченным адресуемым способом. Каждый конец нити ДНК прикреплен к комплементарному олигонуклеотиду на правом/левом штриховом коде 220а и 220b. Расстояние между нитями должно быть в интервале 200-300 микрон и соответствовать расстоянию между соседними консолями в матрице консолей. Предпочтительное расстояние составляет 250 микрон, что соответствует стандартному шагу 250 микрон оптоволоконной ленты.
Способы растяжения и ориентирования линейных полимерных образцов, таких как ДНК, РНК, нуклеиновые аналоги, полипептиды, линейные углеводороды и т.п., известны. Например, противоположные концы полимерного образца, такого как ДНК, можно ковалентно присоединить к микросферам, например латексным или стеклянным шарикам, и затем манипулировать этими шариками с помощью молекулярных пинцетов импульсного лазера до тех пор, пока не будет достигнута достаточная степень растяжения и предпочтительно чрезмерного растяжения. Этот метод проиллюстрирован на фиг.4, где изображены микросферы 290а, 290b, прикрепленные к противоположным концам нити ДНК 210. Каждая сфера "захватывается" лазерным лучом, таким как луч 300а, 300b, для манипуляции сферами, чтобы растянуть и ориентировать нить для ее размещения на поверхности подложки. После достижения этого размещения концы нити закрепляются на подложке посредством гибридизации с комплементарными олигонуклеотидами, прикрепленными к области штрихового кода подложки. Способы захвата и манипуляции микросферами в лазерном луче описаны, например, в патенте США №5620857 и заявке на патент США 2004/0001371, упоминаемых здесь для сведения.
В одном известном методе концы полимерной нити ковалентно присоединяют к магнитным шарикам или к твердой основе и магнитному шарику и прикладывают магнитное поле (поля) к шарику(ам) до тех пор, пока не будет достигнута соответствующая степень растяжения и ориентации нити. В более общем случае противоположные концы нити можно присоединить к паре относительно подвижных опор и позиционировать опоры до тех пор, пока не будет достигнута требуемая степень растяжения и ориентации, как описано, например, в патенте США №6342353, упоминаемом для сведения.
Также известны способы протягивания заряженной полимерной нити в линейном устройстве с помощью электрофореза в узком микроканале.
После растяжения и ориентации полимерных нитей для их присоединения к подложке молекулу образца закрепляют на подложке любым из целого ряда подходящих способов. Как отмечалось выше, подложку можно снабдить концевыми олигонуклеотидами, способными гибридизироваться с последовательностями на концах нити ДНК образца. Если нить растягивается путем манипуляции частицами, ковалентно присоединенными к концам нити, подложка может содержать химические группы или магнитную структуру для прикрепления частиц к подложке, при этом нить находится в вытянутом состоянии. Обычным химическим агентом крепления для золотой поверхности является тиоловый реагент, ковалентно размещенный на концах нити образца.
Обычные процедуры подготовки поверхности подложки, к которой следует прикрепить молекулы ДНК, известны специалистам в области методов детектирования гибридизации ДНК (см. например, J.P.Rabe).
Е. Метод сканирования и детектирования
Как отмечалось выше, важным применением предложенного устройства и способа является секвенирование образцов нуклеиновых кислот, таких как хромосомная или полная геномная ДНК. В этом разделе будет описано действие предложенных устройства и способа в данном конкретном применении, хотя понятно, что те же самые действие и способ применимы для изучения химических групп в любом образце.
В простейшем виде способ используется для изучения одной или более химических групп одной молекулы или набора похожих молекул, локализованных в определенной области детектирования на подложке. В этом применении одна нанолинза, расположенная, например, на свободном конце консольной балки, перемещается по направлению к образцу, например, на расстояние в интервале менее 10-40 микрон до тех пор, пока не будет наблюдаться максимальное усиление для различения усиленного рамановского спектрального признака. Альтернативно спектральные признаки можно регистрировать, когда нанолинза движется поочередно по направлению к поверхности образца и от нее, чтобы получить изменяющийся во времени спектр образца. Колебания нанолинзы, например, в интервале 0,1-10 нм можно использовать при создании изменяющегося во времени спектра.
В более общем представлении предложенный способ идентификации химических групп в образце заключается в том, что образец прикрепляют к подложке, имеющей зеркальную поверхность, на которой держится образец и которая выполнена из плазмонно-резонансного металла. Луч света направляют на нанолинзу описанного выше типа для создания электромагнитных щелевых мод ближнего поля в пространстве между нанолинзой и противолежащей областью детектирования на поверхности подложки при зазоре между нанолинзой и подложкой 30 нм или меньше. Затем линзовый блок перемещают по направлению к поверхности подложки и от нее с расстоянием между нанолинзой и поверхностью подложки менее 40 нм для создания электромагнитных щелевых мод, которые усиливают рамановские спектроскопические сигналы, созданные образцом в области детектирования. Свет, излучаемый или рассеиваемый образцом на область детектирования, принимается детектором и преобразуется в усиленный щелевыми модами рамановский спектр, чтобы идентифицировать химическую группу образца в области детектирования.
Если образец содержит множество групп, расположенных вдоль линейной части молекул образца, как в случае нуклеинового образца для идентификации последовательных групп оснований, описанная процедура применяется последовательно к каждому основанию по мере перемещения нанолинзы относительно подложки. Это движение можно осуществлять посредством поступательного перемещения консоли относительно стационарной подложки или движения площадки с подложкой относительно стационарной нанолинзы. При размещении нанолинзы в каждом последовательном положении ее затем перемещают по направлению к образцу и от него, чтобы найти оптимальное расстояние детектирования или создать изменяющийся во времени спектр, как было описано выше. Линзу и основания образца можно удерживать совмещенными одним из множества методов совмещения. Например, можно отслеживать "контрольной" нанолинзой детектированные основания в образце ДНК с известной последовательностью, расположенном на подложке. При отслеживании этой последовательности вместе с одним или более образцами с неизвестной последовательностью можно подтвердить, что при относительном перемещении между линзами и подложкой сохраняется совмещение между образцом и последовательными основаниями ДНК. Альтернативно одна из консольных балок в устройстве может быть иглой сканирующего атомно-силового микроскопа для обнаружения движения иглы над каждым основанием контрольной нити ДНК, когда матрица консольных устройств движется вдоль нитей ДНК.
В наиболее обычном применении множество нитей линейных образцов, например нитей ДНК, показанных позицией 82 в устройстве на фиг.1, выравнивается на одной подложке для одновременного считывания множеством нанолинз. Фиг.5A и 5B иллюстрируют эту операцию применительно к считыванию множества растянутых ориентированных нитей ДНК, таких как нить 210, расположенная на подложке 310. Хотя данные чертежи иллюстри