Композиция, стимулирующая иммунный ответ, содержащая наночастицы на основе сополимера метилвинилового эфира малеинового ангидрида
Иллюстрации
Показать всеИзобретение относится к области медицины и касается композиции, стимулирующей иммунный ответ, содержащей наночастицы на основе сополимера метилвинилового эфира малеинового ангидрида. Указанные наночастицы могут дополнительно содержать аллерген или антиген и/или иммуностимулирующий агент, который может находиться внутри указанных наночастиц и/или по крайней мере частично покрывать поверхность указанных наночастиц и необязательно перекрестно-связывающий агент. Композиция, стимулирующая иммунный ответ может использоваться в качестве адъюванта в иммунотерапии и вакцинах. Преимущество изобретения заключается в повышении активности. 6 н. и 26 з.п. ф-лы, 2 табл., 14 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к применению наночастиц на основе сополимера метилвинилового эфира малеинового ангидрида, необязательно содержащих аллерген или антиген и/или иммуностимулирующий агент, в качестве адъюванта в иммунотерапии и вакцинах. Также настоящее изобретение относится к композициям, стимулирующим иммунный ответ, содержащим указанные наночастицы.
Уровень техники, предшествующий изобретению
Как известно, существуют высокоиммуногенные антигены, которые способны индуцировать защитные иммунные ответы у пациента, хотя существуют другие антигены, которые не индуцируют указанный защитный ответ или которые индуцируют очень слабый иммунный ответ. Как правило, иммунный ответ хозяина на слабый иммуногенный антиген может быть стимулирован посредством совместного введения с адъювантом.
Адъюванты .
Адъювантом является любое вещество, которое усиливает иммунный ответ на антиген, с которым он смешан. Адъюванты, главным образом, действуют посредством трех механизмов: i) формирования антигенного или аллергенного депозита в месте вакцины, из которого биологически активный продукт будет выделяться в течение различного периода времени; ii) доставки антигена или аллергена к антиген-презентующим клеткам; iii) индуцирования секреции интерлейкина.
Некоторыми классическими примерами адъювантов являются соли алюминия (Alhydrogel) и катехоламины (которые усиливают Th2 ответ) и липополисахарид грамотрицательных бактерий и определенные последовательности CpG (которые усиливают Th1 ответ). С другой стороны, многочисленные исследования показывают, что определенные небиологические векторы, такие как микрочастицы (сферические частицы полимерной природы, покрытые веществом) или липосомы (сферические пузырьки с водной центральной полостью, покрытые различными бимолекулярными фосфолипидами и холестериновыми пленками), также могут действовать как адъюванты [Eldridge et al., Infect Immun, 59 (1991) 2978-2986; O`Hagan et al., Vaccine, 18 (2000) 1793-1801; Murillo et al., Vaccine, 30 (2001) 4099-4106].
Другим типом небиологических векторов, который может рассматриваться для использования в качестве адъювантов, являются твердые частицы коллоидных систем с размером менее микрометра, также называемые наночастицами, которые подразделяются на матриксные наносферы и везикулярные нанокапсулы [Orecchioni and Irache, Formes pharmaceutiques pour application locale. Lavoisier Tech and Doc., Paris, (1996) 441-457]. Нанокапсулы являются везикулярными системами, образованными внутренними полостями, которые окружены полимерной мембраной или стенкой. Наносферы являются матриксными формами, образованными пространственной полимерной сеткой. В обоих случаях молекулы биологически активного вещества могут быть растворены, захвачены или связаны с макромолекулярной структурой (в наносферах) или инкапсулированы полимерной мембраной (в нанокапсулах) и даже могут быть адсорбированы на поверхности наночастицы.
Распространение наночастиц в организме, как правило, зависит от его физикохимических характеристик (главным образом, размера и свойств поверхности), определяющих его взаимодействие с биологической средой. Таким образом, наночастицы являются фармакологическими формами, которые вызывают особенный интерес для иммунотерапии или в качестве адъювантов вакцины для введения антигенов и/или аллергенов.
Как правило, наиболее значимые возможности, предоставляемые такими векторами небиологической природы, являются следующими (i) они защищают инкапсулированный материал от химической, ферментативной или иммунологической инактивации при введении и на месте действия; (ii) они улучшают транспорт биологически активной молекулы к труднодоступным местам и ее проникновение в клетку; (iii) они пролонгируют время пребывания лекарственного средства в организме и контролируют его высвобождение; (iv) они повышают специфическую активность посредством избирательности, эффективности и регуляции концентрации инкапсулированных материалов в клетки мишени и/или молекулы мишени; и (v) они повышают стабильность материала, в который они введены в процессе производства, транспортировки и хранения медицинского препарата.
Применение адъювантов в вакцинации
Применение частиц адъювантов в форме эмульсий, микрочастиц ISCOMS или липосом были оценены ранее несколькими исследовательскими группами [см.: Singh et al., Int J Parasitology 33 (2003) 469-478].
Захват антигена «антиген-презентующими клетками» повышается, если эти антигены связаны с полимерными частицами или находятся внутри них. На протяжении многих лет в качестве контролируемых антиген производящих систем на людях и животных использовались биодеградируемые и биосовместимые полиэфиры [Okad et al., J Pharm Sci, 12 (1995) 1-99; Putney et al., Nat Biotechnol, 16 (1998) 153-157]. В отличие от аллюминевых адъювантов микрочастицы эффективны для индуцирования клеточных и цитотоксичных иммунных ответов у мышей [Nixon et al., Vaccine 14 (1996) 1523-1530; Maloy et al., Immunology 81 (1994)661-667; Moore et al., Vaccine 13 (1995) 1741-1749]. Пероральная иммунизация микрочастицами у мышей индуцирует сильные иммунные ответы на слизистой и на системном уровне по сравнению с инкапсулированными антигенами [Chalacombe et al., Immunology 176 (1992) 164-168; Eldrige et al., J Control Rel 11 (1990) 205-214; O`Hagan et al., Novel Delivery Systems for Oral Vaccines (1990) 175-205]. Эта способность является результатом интернализации антигена посредством специализированных клеток лимфоидной ткани слизистых оболочек [O`Hagan, J Anat, 189 (1996) 477-482]. Было показано, что мукозальная иммунизация различными корпускулярными системами эффективна против различных патогенов, таких как Bordetella pertussis [Chaill et al., Vaccine 13 (1995) 455-462; Jones et al., Vaccine 15 (1997) 814-817; Shahin et al., Infect Immun, 63 919950 1195-1200; Conway et al., Vaccine 19 (2001) 1940-1950], Chlamidia trachomatis [Whittum-Hudson et al., Nat Med 2 (1996) 1116-1121], Salmonella Typhimurium [Allaoui-Attarki et al., Infect Immun 65 (1997) 853-857] и Brucella [Murillo et al., Vaccine, 19 (2001) 4099-4106].
Применение адъювантов в иммунотерапии
Аллергические заболевания являются патологическим проявлением, вызванным негативным иммунным ответом (реакция гиперчувствительности) на, по сути, безвредные макромолекулы, называемые аллергенами. Такая реакция гиперчувствительности проявляется приблизительно у 30% мировой популяции, главным образом в индустриально развитых странах. Реакция гиперчувствительности является причиной таких заболеваний, как аллергические риниты, бронхиальная астма, пищевые аллергии и аллергии на лекарственные средства и насекомых [Settipane et al., Allergy Proc, 15 (1994) 21-25].
В Испании этот тип заболеваний характерен для возрастной группы от 4 до 17 лет и составляет 13,3%; среди них у 6,4% возникает бронхиальная астма, показатель смертности от астмы в Испании составляет 1,5/100000 жителей.
Согласно механистической теории аллергические заболевания возникают в результате нарушения баланса между двумя основными типами ответов, которые могут возникнуть после активации хелперных Т-клеток: Th1 и Th2. Цитокины, находящиеся во внешней среде клетки, действуют определенным образом, направляя дифференциацию незрелых Т-клеток (Th0) таким образом, что присутствие интерлейкина 12 (IL-12), гамма-интерферона (INF-γ), инрелейкина 18 (IL-18) и альфа-интерферона (INF-α) индуцирует дифференциацию в Th1, которые в основном характеризуются продукцией большого количества INF-γ и в меньшей степени интерлейкина 2 (IL-2) и бета-интерферона (INF-β). Последующая стимуляция В-клеток в этом типе ответа ведет к повышению продукции IgG2a, IgG2b, IgG3. С другой стороны, если Th0 клетка находится в окружающей среде, в которой преобладают интерлейкин 4 (IL-4) и простагландин Е2 (PGE2), то будет происходить дифференциация в Th2, для которой характерен синтез большого количества IL-4, интерлейкина 5 (IL-5) и интерлейкина 13 (IL-13), и синтез IgG1 и IgЕ, а биотип напрямую вовлечен в триггерный процесс [Hannah et al., Ann Rev Immunol, 21 (2003) 579-628].
Важность преобладания Th2 аллергенспецифического типа ответа при аллергических заболеваниях была подтверждена большим числом исследований [Romagnani, Ann Rev Immunol, 12 (1994) 227; Bousquet et al., Allergy, 53 (1998) 1-42; Majori et al., Clin Exp Allergy, 30 (2000) 341-347]. Клетки с фенотипом Th2 являются клетками, способными только непосредственно распознать аллергенные пептиды, и принимают участие в продукции IgЕ В-клетками, активации и продукции мастоцитов, активации и созревании эозинофилов, что было показано как на животных моделях, так и у людей [Cohn et al., Pharmacology and Therapeutics, 88 (2000) 187-196].
Таким образом, функциональное преобладание клеток Th2 над клетками Th1 ведет к аллергическому ответу, тогда как функциональное преобладание клеток Th1 над клетками Th2 может ингибировать аллергический ответ [Martin et al., Alergol Immunol Clin, 17 (2002) 104-110].
На основании других исследований было сделано утверждение, что ингибирование Th2 ответа с преобладанием Th1 может привести к развитию аутоиммуных заболеваний, поэтому было бы правильно усиливать иммунную регуляцию баланса Th1/Th2 посредством увеличения популяций регуляторных Т-клеток (Tr) и IL-10, и фактора роста β Т-клеток (TGF-β). Это могло бы привести к синтезу IgG4 и антител IgА (медиаторы невоспалительного ответа) и к подавлению продукции IgЕ В-клетками [Akids et al., Immunology, 103 (2001) 131-136; Akids et al., J Clin Invest, 102 (1998) 98-106; Blaser et al., Int Arch Allergy Immunol, 117 (1998) 1-10]. Недавние исследования подтвердили важность IL-10 в инактивации Th2-клеток (Gruning et al., J Exp Med, 185 (1997) 1089-1099; Adachi et al., Int Arch Allergy Immunol, 118 (1999) 391-394] и также было обнаружено, что введение IL-10 in vivo оказывает благотворное влияние при аллергиях у животных [Zuany-Amorim et al., J Clin Invest, 95 (2003) 2644-2651; Stampfli et al., Am J Respir Cell Mol Biol, 21 (1999) 586-596; Hall et al., Vaccine, 21 (2003) 549-561]. На этом основании было сделано предположение, что IL-10 играет важную регуляторную роль в гиперактивной характеристике Th2-клеток у пациентов с аллергией.
IL-10 может играть важную физиопатологическую роль в противодействии воспалительным заболеваниям (болезнь Крона, ревматоидные артриты, псориаз и т.д.), некоторым вирусным инфекциям (гепатит С, инфекции, вызванные вирусом иммунодефицита человека (ВИЧ) и т.д.) и даже в подавлении побочных эффектов при трансплантации органов. Таким образом, непосредственное применение IL-10 или, кроме того, применение адъювантов, стимулирующих продукцию IL-10, может оказать огромное воздействие на лечение этих заболеваний [Аsadullah et al., Pharmacol Rev, 55, (2003) 241-269]. В настоящий момент ведутся исследования возможности такого лечения аутоиммунных заболеваний, таких как ревматоидные артриты [Feldman et al., Annu Rev Immunol (1996) 397-440; Katsikis et al., J Exp Med (1994) 1517-1527; Chomarat et al., J Immunol (1995) 1432-1439]. Противовоспалительная и регуляторная роль цитокина, таким образом, является существенной и в случае Th1 (аутоиммунные заболевания) и в случае Th2 (аллергия) гиперактивных ответов.
Существует, главным образом, три подхода в лечении аллергических заболеваний (i) избегание любых контактов с аллергеном; (ii) использование антигистаминных препаратов; и (iii) лечение посредством иммунотерапии. Принимая во внимание, что первые два способа могут в некоторых случаях быть неподходящими, иммунотерапия могла бы стать наиболее подходящим способом контроля.
Специфическая иммунотерапия аллергенами представляет собой повторное введение аллергенов пациентам с IgЕ-опосредованными нарушениями в целях обеспечения защиты против аллергических симптомов и воспалительных реакций, связанных с природным воздействием этих аллергенов [Jutel, M., J Immunol, 154 (1995) 4178-4194].
Это альтернативное лечение направлено на усиление функционального преобладания Th1 ответа по сравнению с Th2 ответом, что будет ингибировать аллергические симптомы. Модуляция Th1 также может использоваться в других процессах, таких как контроль посредством вакцинации против бактериальных внутриклеточных паразитов (таких как Brucella и Salmonella).
Несмотря на то, что было описано применение различных небиологических векторов, например наночастиц, таких как адъюванты, в иммунотерапии или вакцинах для введения антигенов и/или аллергенов, до сих пор существует потребность в создании альтернативных адъювантов взамен существующих с целью увеличения арсенала возможностей для производства вакцин и композиций для иммунотерапии. Преимущественно указанные адъюванты должны быть эффективными для иммунизации или иммунотерапии при пероральном введении без необходимости применения очень высоких доз аллергенов и антигенов. Как известно, несмотря на возможные преимущества пероральной иммунизации в терапевтических или профилактических целях должны быть решены некоторые сложности, связанные с тем, что требуемая для благотворного клинического эффекта доза иммуногенных или аллергенных активных ингредиентов является чрезмерно высокой по причине потери иммуногенной активности. Таким образом, как правило, из-за низкой стабильности аллергена или антигена в желудочно-кишечном тракте (pH и присутствие гидролитических ферментов) дозы должны быть всегда более высокими (вплоть до 200 кратного повышения), чем при подкожном введении [Taudorf et al., J Allergy Clin Immunol (1987) 153-161; Creticos et al., J Allergy Clin Immunol (1990) 165]. Кроме того, слизистая желудочно-кишечного тракта является труднопреодолимым барьером для абсорбции этих макромолекул.
Неожиданно было обнаружено, что наночастицы на основе сополимера метилвинилового эфира малеинового ангидрида, необязательно содержащие аллерген или антиген и/или иммуностимулирующий агент, способны стимулировать или усиливать иммунный ответ при введении пациенту, что позволяет использовать их в иммунотерапии и вакцинах. Указанные наночастицы являются стабильными при пероральном приеме, обладают удовлетворительными биоадгезивными характеристиками и, таким образом, могут использоваться при иммунизации или иммунотерапии с применением различных способов введения, включая пероральный прием, без необходимости применения таких высоких доз аллергена или антигена, как те, которые были указаны в разделе, касающемся предшествующего уровня техники. Кроме того, указанные наночастицы являются низкотоксичными, биодеградируемыми и простыми для получения.
Наночастицы сополимера метилвинилового эфира малеинового ангидрида
В патентной заявке WO 02/069938, принадлежащей тому же заявителю, описываются наночастицы сополимера метилвинилового эфира малеинового ангидрида (PVM/MA), способ их получения и применение в качестве носителя лекарственных средств. Указанный сополимер PVM/MA структурно состоит из двух дифференцированных функциональных групп, имеющих различные характеристики растворимости: гидрофобная эфирная группа и ангидридная группа. Карбоксильная группа является солюбилизирующим агентом, так как способна растворять полимер, если он ионизирован, а эфирная группа является гидрофобной, то есть препятствует проникновению воды в полимер [Heller et al., J Appl Polym Sci, 22 (1978) 1991-2009]. Синтетические сополимеры PVM/MA имеют очень различное применение. Gantrez® AN широко применяется в качестве загустителя и флоккулирующего агента, дентального адгезива, наполнителя таблеток для перорального приема, наполнителя для трансдермальных пластырей и т.п. С другой стороны, было описано применение этих сополимеров для контролируемого высвобождения лекарственных средств [Heller et al.,J Appl Polym Sci, 22 (1978) 1991-2009] и в матриксных формах, для локального высвобождения лекарственного средства при офтальмологическом применении [Finne et al., J Pharm Sci, 80 (1991) 670-673; Finne et al., Int J Pharm, 78 (1992) 237-241].
Наночастицы на основе PVM/MA имеют биоадгезивные характеристики [Arbуs et al., Int J Pharm, (2002)129-136] и, таким образом, при пероральном приеме они могут взаимодействовать с пейеровыми бляшками, которые содержат 20% всех лимфоцитов организма и запускают усиленный иммунный ответ на те антигены и/или аллергены, которые были введены с водным раствором.
Наночастицы на основе PVM/MA являются коллоидными системами, которые способны удерживать биологически активные вещества посредством: (i) растворения или захвата макромолекулярных структур или матрикса, (ii) ковалентного связывания лекарственного средства с ангидридными группами сополимера и (iii) абсорбционных процессов, опосредованных слабыми связями. Чрезмерная реактивность сополимера PVM/MA из-за циклических ангидридных групп также способствует захвату молекул, лекарственных средств или других субстанций. В патентной заявке WO 02/069938 описывается применение наночастиц сополимера PVM/MA в качестве носителей лекарственных средств, в частности 5-фториодина, ганцикловира и антисмыслового олигонуклеотида ISIS 2922.
Краткое описание изобретения
Объектом настоящего изобретения является композиция, стимулирующая иммунный ответ у пациента, используемая в качестве адъюванта в иммунотерапии и вакцинах, стабильная при пероральном введении, обладающая удовлетворительными биоадгезивными характеристиками в отношении взаимодействия со слизистыми оболочками, способная необязательно нести аллерген или антиген и/или иммуностимулирующий агент и высвобождать указанный агент контролируемым способом и, таким образом, используемая при иммунизации или иммунотерапии путем введения различными способами лекарственного средства, включая пероральное.
Неожиданно было обнаружено, что наночастицы на основе сополимера метилвинилового эфира малеинового ангидрида, необязательно содержащие аллерген или антиген и/или иммуностимулирующий агент, способны стимулировать или усиливать иммунный ответ при их введении пациенту, что делает возможным их применение в иммунотерапии и вакцинах. В частности, было обнаружено, что указанные наночастицы просты в получении, обладают удовлетворительными биоадгезивными характеристиками, являются низкотоксичными и биодеградируемыми (например, они растворяются или разлагаются в течение периода времени, приемлемого для желаемой формы применения, в случае терапии in vivo, если они доступны в физиологическом растворе с уровнем рН 6-9 и температурой в промежутке от 25 до 40°С).
Кроме того, одним из аспектов настоящего изобретения является композиция, стимулирующая иммунный ответ, содержащая наночастицы на основе сополимера метилвинилового эфира малеинового ангидрида. Указанные наночастицы могут дополнительно содержать аллерген или антиген и/или иммуностимулирующий агент, который может содержаться внутри указанных наночастиц и/или, по крайней мере, частично покрывать поверхность указанных наночастиц. Если необходимо, указанные метаболические пути также могут содержать перекрестно-связывающий агент. Указанная композиция, необязательно, может быть в лиофилизированной форме.
В другом аспекте настоящее изобретение относится к вакцине или иммунотерапевтической композиции, содержащей указанную композицию, стимулирующую иммунный ответ. В одном из конкретных вариантов осуществления настоящего изобретения указанная иммунотерапевтическая вакцина или композиция является составом, подходящим для перорального приема, тогда как в другом конкретном варианте осуществления настоящего изобретения указанная иммунотерапевтическая вакцина или композиция является составом, подходящим для парентерального введения.
В другом аспекте настоящее изобретение относится к применению указанной композиции, стимулирующей иммунный ответ, при производстве вакцины или иммунотерапевтической композиции.
В другом аспекте настоящее изобретение относится к применению указанной композиции, стимулирующей иммунный ответ, при производстве фармакологической композиции для селективной стимуляции иммунного Th1 ответа, или при производстве фармакологической композиции для селективной стимуляции иммунного Th2 ответа, или при производстве фармакологической композиции для сбалансированной стимуляции иммунных Th1 и Th2 ответов.
В другом аспекте настоящее изобретение относится к способу получения композиции, стимулирующей иммунный ответ, содержащей указанные наночастицы на основе PVM/MA и аллерген или антиген и/или иммуностимулирующий агент, в котором предусмотрено добавление указанного аллергена или антигена и/или иммуностимулирующего агента в органический раствор, содержащий указанный сополимер PVM/MA перед десольватацией в водно-спиртовом растворе, или, в качестве альтернативы, инкубация указанного аллергена или указанного антигена и/или с иммуностимулирующим агентом с указанными наночастицами PVM/MA. В указанном способе, кроме того, может быть дополнительно предусмотрены элиминация органического растворителя и/или этапы очистки, а также этапы стабилизации наночастиц, полученных с помощью перекрестно-связывающих агентов. Указанный способ может необязательно предусматривать дополнительный этап лиофилизации.
Краткое описание чертежей
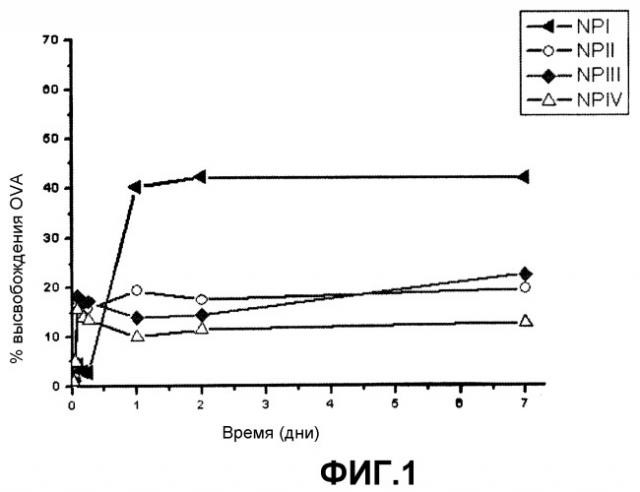
На фигуре 1 представлен график, показывающий зависимость высвобождения овальбумина (%) из составов NP-I, NP-II, NP-III, NP-IV во времени (дни).
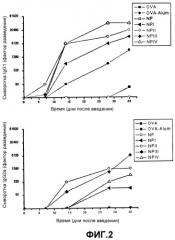
На фигуре 2 представлен график, показывающий зависимость уровней специфических антител против овальбумина (IgG1, IgG2a) после трансдермальной иммунизации мышей Balb/c раствором овальбумина (OVA) в свободной форме, овальбумином, адсорбированным в альгидрогеле (OVA-Alum), и пустыми наночастицами (NP), NP-I, NP-II, NP-III, NP-IV во времени.
На фигуре 3 представлен график, показывающий зависимость уровней специфических антител против овальбумина (IgG1, IgG2a) после пероральной иммунизации мышей Balb/c раствором овальбумина (OVA) в свободной форме и пустыми наночастицами (NP), NP-I, NP-II, NP-III, NP-IV во времени.
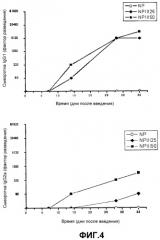
На фигуре 4 представлен график, показывающий зависимость уровней специфических антител против овальбумина (IgG1, IgG2a) после пероральной иммунизации мышей Balb/c различными дозами инкапсулированного овальбумина (NP-III25 и NP-III50) и пустыми наночастицами (NP) во времени.
На фигуре 5 представлен график, показывающий зависимость уровней специфических антител против овальбумина (IgG1) после трансдермальной иммунизации мышей Balb/c раствором овальбумина, свободного от (OVA), овальбумином, абсорбированном на альгидрогеле (OVA-Alum), и пустыми наночастицами (NP), NP-I, NP-II, NP-III, NP-V, NP-VI и NP-VII во времени.
На фигуре 6 представлен график, показывающий зависимость уровней специфических антител против овальбумина (IgG2a) после трансдермальной иммунизации мышей Balb/c раствором овальбумина, свободного от (OVA), овальбумином, абсорбированном на альгидрогеле (OVA-Alum), и пустыми наночастицами (NP), NP-I, NP-II, NP-III, NP-V, NP-VI и NP-VII во времени.
На фигуре 7 представлен график, показывающий зависимость концентрации сыворотки IL-10 после трансдермальной иммунизации мышей Balb/c раствором овальбумина, свободного от (OVA), овальбумина, абсорбированного на альгидрогеле (OVA-Alum), и пустыми наночастицами (NP), NP-I, NP-II, NP-III, NP-V, NP-VI и NP-VII во времени.
На фигуре 8 представлен график, показывающий зависимость уровней специфических антител против овальбумина (IgG1, IgG2a) после трансдермальной иммунизации мышей Balb/c раствором овальбумина, овальбумином, абсорбированном на альгидрогеле (OVA-Alum) OVASAL и раствором овальбумина (OVA) во времени.
На фигуре 9 представлен результат разделения экстракта НЕ электрофорезом на полиакриламидном геле с натрий додецил сульфатом (SDS-PAGE) и окрашивания Coomassie на белок (10 мкг на лунку).
На фигуре 10 представлен результат иммуноблоттинга экстракта НЕ перед (А) и после (В) инкапсуляции с использованием смеси сывороток инфицированных кур.
На фигуре 11 представлен график, показывающий результаты эксперимента по интраперитониальной защите у мышей Balb/c с летальной дозой 102 колониеобразующих единиц (КОЕ) S. enteritidis 3934.
На фигуре 12 представлена столбиковая диаграмма высвобождения IFN-γ (A) и IL-4 (B) клетками селезенки мышей Balb/c, рестимулированных экстрактом НЕ.
На фигуре 13 представлена столбиковая диаграмма, показывающая результат непрямого ELISA на сыворотках мышей Balb/c в сравнении с экстрактом НЕ с использованием антител IgG1 и IgG2a.
Подробное описание изобретения
Неожиданно было обнаружено, что наночастицы на основе сополимера метилвинилового эфира малеинового ангидрида, необязательно содержащие аллерген или антиген и/или иммуностимулирующий агент, способны стимулировать или усиливать иммунный ответ при их введении пациенту, что позволяет использовать их в иммунотерапии и вакцинах.
Термин «пациент», используемый в настоящем описании, включает в себя любое животное, обладающее иммунной системой, предпочтительно, млекопитающее, более предпочтительно, человек.
Одним из аспектов настоящего изобретения является композиция, стимулирующая иммунный ответ, обозначенная в настоящем описании как композиция по изобретению, содержащая наночастицы на основе сополимера метилвинилового эфира малеинового ангидрида. Указанные наночастицы могут дополнительно содержать аллерген или антиген и/или иммуностимулирующий агент, который может содержаться внутри указанных наночастиц и/или, по крайней мере, частично покрывать поверхность указанных наночастиц. Если желательно, указанные наночастицы также могут содержать перекрестно-связывающий агент.
Под использующимся в настоящем описании термином «наночастицы» понимают коллоидные системы твердых частиц размером менее чем 1,0 микрометр, предпочтительно, в пределах от 10 до 900 нанометров (нм), и к ним относятся матриксные наносферы и везикулярные нанокапсулы. В конкретном варианте осуществления настоящего изобретения средний размер указанных наночастиц составляет менее чем 400 нм.
Наночастицы, присутствующие в композиции по настоящему изобретению, включают сополимер метилвинилового эфира малеинового ангидрида или PVM/MA. Указанный сополимер PVM/MA является известным продуктом, который может быть получен подходящими способами, например посредством полимеризации ацетилена с малеиновым ангидридом, или может быть закуплен на рынке. В этом смысле, компания International Specialty Products (ISP) производит сополимеры PVM/MA, имеющие различную молекулярную массу, представленные под торговой маркой Gantrez® AN. Как правило, для осуществления настоящего изобретения на практике молекулярная масса указанного сополимера PVM/MA может изменяться в очень широком диапазоне от 100 до 2400 кДа, более предпочтительно, от 200 до 2000 кДа. В одном из вариантов настоящего изобретения предпочтительной молекулярной массой сополимера PVM/MA является молекулярная масса от 180 до 250 кДа.
Применение указанного сополимера PVM/MA имеет особые преимущества, позволяя широко использовать его в фармацевтике вследствие его низкой токсичности (LD50=8-9 г/кг перорально) и его превосходной биосовместимости. Кроме того, он прост в получении и может реагировать с другими гидрофильными веществами, благодаря своим функциональным группам, без использования обычно используемых органических реагентов (производные глютаральдегида и карбодиимида), обладающих значительной токсичностью [Arbуs et al., J. Controlled Rel., 83 (2002) 321-330]. Сополимер PVM/MA нерастворим в водной среде, но присутствующая в нем ангидридная группа гидролизуется, образуя карбоксильные группы. Раствор является слабым и зависит от условий, в которых он получен. Благодаря доступности функциональных групп в PVM/MA при инкубировании в водной среде происходит ковалентное связывание молекул с нуклеофильными группами, такими как гидроксильные или аминогруппы. Указанные наночастицы PVM/MA также обладают биоадгезивными свойствами [Arbуs et al., Int J Pharm, (2002) 129-136], таким образом, при пероральном введении они взаимодействуют с пейеровыми бляшками, которые содержат 20% всех лимфоцитов организма и запускают усиленный иммунный ответ на те антигены и/или аллергены, которые были введены вместе с водным раствором.
В конкретном варианте осуществления настоящего изобретения композиция по настоящему изобретению включает наночастицы на основе PVM/MA, не содержащие антиген или аллерген и иммуностимулирующий агент. Указанные наночастицы в настоящем описании называются «пустыми» наночастицами и могут быть легко получены способом, например, описанным в патентной заявке WO/069938, полное содержание которой приведено в данном описании в качестве ссылки. В качестве иллюстрации указанные пустые наночастицы легко получают десольватацией водно-спиртовой фазой раствора сополимера PVM/MA в ацетоне. Образовавшиеся наночастицы могут быть приведены в состояние стабильной водной суспензии или лиофилизированы. Необязательно может быть введен перекрестно-связывающий агент. Может быть использован фактически любой перекрестно-связывающий агент, содержащий одну или более функциональную группу, которая может взаимодействовать с ангидридными группами сополимера PVM/MA, преимущественно, полиамин или углевод, например аминокислота, белок, -оз или -озид и т.п., например, лизин, аргинин, гистидин, водорастворимые белки, поли-L-лизин, поли-L-аргинин, и т.п., предпочтительно, 1,3-диаминопропан.
Указанные пустые наночастицы могут выступать в роли адъюванта при вакцинации или в иммунотерапии, при совместном введении с вакцинами или композициями для иммунотерапии (иммунотерапевтическими композициями), содержащими антиген или аллерген соответственно, вызывая эффект стимуляции иммунного ответа после введения вакцины или иммунотерапевтической композиции и пустых наночастиц. На фигуре 12 показано, что введение пустых наночастиц индуцирует секрецию значительного количества IFN-γ. Совместное введение вакцины или иммунотерапевтической композиции и наночастиц может быть одновременным или последовательным в разное время в любом порядке, например первой может быть введена вакцина или иммунотерапевтическая композиция и затем наночастицы, или наоборот. В качестве альтернативы указанная вакцина или иммунотерапевтическая композиция и указанные наночастицы могут быть введены одновременно. Вакцина или иммунотерапевтическая композиция и наночастицы также могут быть введены в одной и той же композиции или различных композициях. Доза вводимых пустых наночастиц может изменяться в широких пределах, например, приблизительно от 0,01 до приблизительно 10 мг/кг массы тела, предпочтительно, от 0,1 до 2 мг/кг массы тела.
В другом конкретном варианте осуществления настоящего изобретения композиция по настоящему изобретению включает наночастицы на основе PVM/MA, заполненные аллергеном или антигеном и/или иммуностимулирующим агентом.
В одном из вариантов осуществления настоящего изобретения композиция по настоящему изобретению включает наночастицы на основе PVM/MA, заполненные аллергеном или антигеном, где указанные наночастицы на основе PVM/MA включают аллерген или антиген.
Использованный в настоящем описании термин «аллерген» относится к веществу, к которому пациент чувствителен и которое является причиной иммунной реакции, например аллерген цветочной пыльцы, аллерген насекомых, пищевые аллергены или аллергены пищевых продуктов, компоненты, присутствующие в слюне, клещи и жалящие насекомые, вызывающие гиперреакцию у пациента, компоненты, присутствующие в растениях, индуцирующие реакцию чувствительности у пациента, и т.д. Следовательно, например, также может быть использован белок пыльцы растений, такой как, пыльца растений (Lolium perenne, Poa pretense, Cynodon dactylon, Festuca pratensis, Dactylis glomerata, Secale cereale, Hordeum vulgare, Avena sativa, Triticum sativa) пыльца из других растений (таких как, Artemisia vulgaris, Chenopodium album, Plantago lanceolata, Traxacum vulgare, Parietaria judaica, Salsola kali, Urtica dioica), или пыльца деревьев (таких как, Olea europea, Plantus sp., Cupressus sp.) и т.д. Также может быть использован белок насекомых, таких как пылевой клещ (такие, как, Dermatophagoides pteronyssinus, Dermatophagoides farinae, Acarus siro, Blomia tropicalis, Euroglyphus maynei, Glyciphagus domesticus, Lepidoglyphus destructor, Tyrophagus putrescentiae) и т.д. Другой аллерген может быть получен из грибков и эпителия животного (Alternaria alternata, Cladosporium herbarum, эпителий собак, эпителий кошек, эпителий лошади, смесь пера и пуха разных видов водоплавающих птиц, Penicillium notatum и т.д.), а также компонентов пищевых продуктов и т.д. Фактически в композиции по настоящему изобретению может быть использован любой аллерген для заполнения наночастиц; однако в конкретном варианте осуществления настоящего изобретения указанный аллерген представляет собой овальбумин (OVA) - белок, который широко используется в качестве экспериментальной модели аллергии.
Использованный в настоящем описании термин «антиген» относится к природному или рекомбинантному иммуногенному продукту, полученному из высшего организма или из микроорганизма, например бактерии, вируса, паразита, протозоа, грибка и т.д., содержащему один или более эпитопов, например структурные компоненты указанного организма; токсины, например экзотоксины и т.д. Фактически в композиции по настоящему изобретению может быть использован любой антиген для заполнения наночастиц; однако в конкретном варианте осуществления настоящего изобретения указанный антиген является экстрактом НЕ Salmonella enteritidis.
Как известно, Salmonella enteritidis в пищевых продуктах является обычным агентом желудочно-кишечного тракта человека, наиболее часто выявляемым при пищевых отравлениях (60% случаев, при которых был выделен этот агент). Птица и субпродукты из птицы признаны главным источником Salmonella и самым главным источником инфекций человека, вызываемых Salmonella enteritidis. Инфекция является зоонозом, передаваемым посредством переваривания зараженных пищевых продуктов или воды, и в настоящее время является пандемией. Для контроля сальмонеллеза Всемирная Организация Здравоохранения (ВОЗ) и Европейский Союз опубликовали рекомендации по мониторингу и уничтожению инфекции Salmonella enteritidis у птиц из-за очевидной эффективности для человеческой популяции. Для контроля Salmonella у птиц используют антибиотики, конкурентное исключение, генетический отбор птиц и вакцин, также улучшение гигиенических условий на фермах по разведению птиц. Из этих мер наиболее распространенной и самой практичной следует считать вакцинацию как самый простой и недорогой в использовании метод. Несмотря на широкое применение ослабленных живых вакцин и (убитых бактериальных) вакцин обе они являются достаточно неэффективными на птицеводческих фермах (куриных и других видов птиц) [Zhang-Barder et al., Vaccine, 17 (1999) 2538-2545]. Помимо своей низкой эффективности, большим недостатком живых вакцин является их вирулентный потенциал у животных с подавленным иммунитетом, а также их способность изменять инвазивный статус. Кроме того, вакцины должны быть введены парентерально и они взаимодействуют с обычными серологическими диагностическими тестами. Инактивированные (убитые) бактерии не обладают остаточной вирулентности, но они не индуцируют клеточный иммунный ответ. Требуется введение сильного адъюванта и существует необходимость многократного ревакцинирования. Альтернативой могло бы стать применение субклеточных вакцин, которые способны стимулировать соответствующий иммунный ответ против инфекции, вызванной Salmonella enteritidis. Несмотря на высокую степень защиты, описанную для этих вакцин на стадии эксперимента, как и в случае убитым бактериальным вакцинам, для них требуются многократные бустер-дозы для получения приемлемой степени защиты [Powell, Pharm Res, 13 (1996) 1777-1785]. С другой стороны, при пероральном введении происходит денатурация и расщепление в желудочно-кишечном тракте [Langer et al., Adv Drug Deliv. Rev, 28 (1997) 97-119], и таким образом, этот тип вакцин должен вводиться парентерально, что связанно с определенными материально-техническим и экономическими затруднениями. Антигены Salmonella enteritidis могут быть инкапсулированы в наночастицы PVM/MA, описанные в настоящем описании выше, с целью решения этих трудностей.
Аллерген или антиген, присутствующий в этом варианте композиции по настоящему изобретению, может по крайней мере частично покрывать поверхность указанных наночастиц и/или заполнять указанные наночастицы. В конкретном варианте осуществления настоящего изобретения указанный аллерген или антиген покрывает всю или часть поверхности указанных наночастиц. Этот вариант осуществления изобретения используется для селективной стимуляции Th2 ответа у пациента. В другом конкретном варианте осуществления настоящего изобретения указанный аллерген или антиген инкапсулирован в указанные PVM/MA наночастицы. Этот вариант осуществления изобретения используется для стимуляции сбалансированного Th1 и Th2 ответа или для преобладания Th1 ответа.
PVM/MA наночастицы, заполненные аллергеном или антигеном, легко могут быть получены способом, аналогичным описанному в патентной заявке WO02/069938. В качестве иллюстрации указанные наночастицы, заполненные аллергеном или антигеном, легко могут быть получены десольватацией жидкой фазой, например водно-спиртовой фазой, такой как жидкая фаза, образова