Комбинации, содержащие антимускариновые средства и бета-адренергические агонисты
Иллюстрации
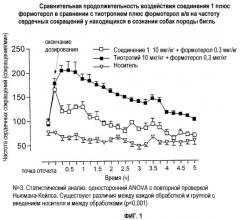
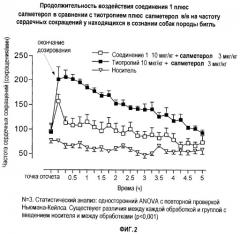
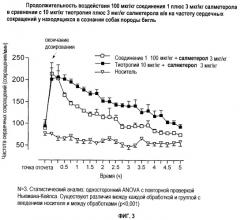
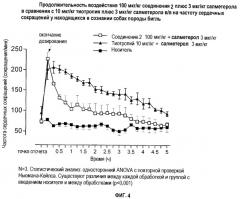
Показать всеНастоящее изобретение относится к области лекарственных средств, в частности к комбинации, продукту, набору, упаковке, предназначенным для лечения астмы, острого или хронического бронхита, эмфиземы, хронического обструктивного заболевания легких (COPD), гиперреактивности бронхов или ринита, содержащим эффективное количество (а) β2-агониста и эффективное количество (b) антагониста мускариновых рецепторов М3, который представляет собой (3R)-1-фенэтил-3-(9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октан в форме соли с анионом X, который представляет собой фармацевтически приемлемый анион моно- или поливалентной кислоты. Также изобретение относится к применению и способам лечения. Указанные активные компоненты в комбинации обеспечивают сокращенную продолжительность воздействия на частоту сердечных сокращений.
8 н. и 13 з.п. ф-лы, 5 ил., 1 табл.
Реферат
Настоящее изобретение относится к новым комбинациям определенных антимускариновых средств с β-адренергическими агонистами и их применению для лечения респираторных нарушений.
Предпосылки изобретения
β-адренергические агонисты, конкретно β2-адренергические агонисты и антимускариновые средства, конкретно антагонисты мускариновых рецепторов М3, представляют собой два класса бронходилатирующих лекарственных средств, пригодных для лечения респираторных нарушений, таких как астма или хронические обструктивные заболевания легких (COPD).
Известно, что оба класса лекарственных средств можно применять в комбинации. В международных патентных заявках WO 0238154 и WO 03000241 описаны некоторые примеры таких комбинаций.
Известно, что комбинация лекарственных средств, в которых активные ингредиенты действуют различными физиологическими путями, являются терапевтически эффективными. Часто терапевтическое преимущество является результатом того, что комбинация может достигать терапевтически эффективного действия с использованием меньших концентраций каждого активного компонента. Это позволяет минимизировать побочные эффекты лекарственного средства. Таким образом, комбинацию можно составлять так, что каждый активный ингредиент присутствует в концентрации, которая в клетках, отличных от клеток-мишеней, при заболевании является субклинической. Тем не менее комбинация терапевтически эффективна в клетках-мишенях, отвечающих за оба ингредиента.
Вопреки приведенному выше обсуждению, известно, что комбинации известных антагонистов мускариновых рецепторов М3 и β-адренергических агонистов, которые применяют в сочетании для лечения респираторных нарушений, обладают нежелательным действием на сердце. По-видимому, сердечные клетки чувствительны и к известным антагонистам М3 и к β-адренергическим агонистам точно так же, как и клетки дыхательных путей. Сердечные побочные эффекты, по-видимому, более заметны и часты, когда оба класса лекарственных средств применяют в комбинации. Таким образом, применение комбинаций известных антимускариновых средств и β-адренергических агонистов приводит к нежелательным сердечным побочным эффектам, например к тахикардии, усиленному сердцебиению, жалобам на боли, подобные болям при стенокардии, и аритмиям, таким образом, ограничивая терапевтическую ценность комбинации, особенно у пациентов с основной болезнью сердца.
Описание изобретения
Неожиданно в настоящее время обнаружено, что комбинация определенного конкретного антагониста мускариновых рецепторов М3 (далее обозначаемых авторами изобретения как антагонисты М3 по изобретению) с β2-адренергическими агонистами (далее обозначаемых авторами изобретения как β2-агонисты) проявляет значительно меньше побочных эффектов на сердце, таких как тахикардия, чем комбинации, предлагаемые в данной области, сохраняя при этом сильную активность в дыхательных путях.
Таким образом, настоящее изобретение относится к комбинации, которая содержит эффективное количество (а) β2-агониста и эффективное количество (b) антагониста мускариновых рецепторов М3, который представляет собой (3R)-1-фенэтил-3-(9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октан в форме соли с анионом X, который представляет собой фармацевтически приемлемый анион моно- или поливалентной кислоты.
Как правило, антагонист мускариновых рецепторов М3 представляет собой бромид (3R)-1-фенэтил-3-(9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана.
Как правило, комбинация содержит активные ингредиенты (а) и (b), образующие часть единой фармацевтической композиции.
Во избежание неопределенности, подразумевается, что указанные выше формулы и термин (3R)-1-фенэтил-3-(9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октан включают в себя соли в диссоциированной, частично диссоциированной или недиссоциированной форме, например, в водном растворе. Различные соли соединения могут существовать в форме сольватов, т.е. в форме гидратов, и все эти формы также находятся в объеме настоящего изобретения. Кроме того, в объеме настоящего изобретения различные соли и сольваты соединения могут находиться в аморфной форме или в форме различных полиморфных модификаций.
Также предоставлен продукт, содержащий (а) β2-агонист и (b) М3 антагонист согласно изобретению в виде комбинированного препарата для одновременного, совместного, раздельного или последовательного применения для лечения человека или животного.
В основном продукт предназначен для одновременного, совместного, раздельного или последовательного применения для лечения реагирующего на антагонизм М3 респираторного заболевания у человека или животного.
Настоящее изобретение дополнительно относится к применению (а) β2-агониста и (b) М3 антагониста согласно изобретению для получения лекарственного средства для одновременного, совместного, раздельного или последовательного применения для лечения реагирующего на антагонизм М3 респираторного заболевания у человека или животного.
Также предоставлено применение (b) М3 антагониста согласно изобретению для получения лекарственного средства для одновременного, совместного, раздельного или последовательного применения в комбинации с (а) β2-агонистом для лечения реагирующего на антагонизм М3 респираторного заболевания у человека или животного.
Также предложено применение (а) β2-агониста для получения лекарственного средства для одновременного, совместного, раздельного или последовательного применения в комбинации с (b) М3 антагониста согласно изобретению для лечения реагирующего на антагонизм М3 респираторного заболевания у человека или животного.
Настоящее изобретение дополнительно относится к способу лечения человека или животного, страдающего респираторным заболеванием, которое реагирует на антагонизм М3, или предрасположенного к нему, где способ включает в себя одновременное, совместное, раздельное или последовательное введение указанному пациенту эффективного количества (b) М3 антагониста согласно изобретению и (а) β2-агониста.
В основном указанное респираторное заболевание представляет собой астму, острый или хронический бронхит, эмфизему, хроническое обструктивное заболевание легких (COPD), гиперреактивность бронхов или ринит, в частности астму или хроническое обструктивное заболевание легких (COPD).
Как правило, указанный пациент - человек или животное - страдает ранее присущей ему болезнью сердца или состоянием, которое могло бы осложниться вследствие тахикардии, например, пациенты, с существующей ранее аритмией сердца, гипо- или гипертензией, стенокардией или сходными со стенокардией жалобами, инфарктом миокарда в анамнезе, болезнью коронарных артерий, или пожилые пациенты. Предпочтительно указанный пациент является человеком.
Также предоставлена фармацевтическая композиция, содержащая (а) β2-агонист и (b) М3 антагонист согласно изобретению совместно с (с) фармацевтически приемлемым носителем или разбавителем.
Изобретение также относится к набору, содержащему (b) М3 антагонист согласно изобретению вместе с инструкциями для одновременного, совместного, раздельного или последовательного применения в комбинации с (а) β2-агонистом для лечения человека или животного, страдающего реагирующим на антагонизм М3 респираторным заболеванием или предрасположенного к нему.
Дополнительно предоставлена упаковка, содержащая (b) М3 антагонист согласно изобретению и (а) β2-агонист для одновременного совместного, раздельного или последовательного применения для лечения реагирующего на антагонизм М3 респираторного заболевания.
Дополнительно предоставлены комбинация, продукт, набор или упаковка, как описано выше в данном описании, где такие комбинация, продукт, набор или упаковка дополнительно содержат (с) другое активное соединение, выбранное из: (а) ингибиторов PDE IV, (b) кортикостероидов, (с) антагонистов лейкотриена D4, (а) ингибиторов киназы egfr, (e) ингибиторов киназы р38 и (f) агонистов рецепторов NK1 для совместного, раздельного или последовательного применения. Как правило, дополнительное активное соединение (с) выбирают из группы, состоящей из (а) ингибиторов PDE IV и (b) кортикостероидов.
Вариант осуществления настоящего изобретения представляет собой комбинацию, продукт, набор или упаковку, содержащие (b) М3 антагонист согласно изобретению и (а) β2-агонист в качестве единственных активных соединений.
Вариант осуществления настоящего изобретения также представляет собой применение (b) М3 антагониста согласно изобретению и (а) β2-агониста, без какого-либо другого активного соединения, для получения лекарственного средства для одновременного совместного, раздельного или последовательного применения для лечения реагирующего на антагонизм М3 респираторного заболевания у человека или животного.
Предпочтительные β2-агонисты для применения в комбинациях по изобретению представляют собой: арформотерол, бамбутерол, битолтерол, броксатерол, карбутерол, кленбутерол, допексамин, фенотерол, формотерол, гексопреналин, ибутерол, изоэтарин, изопреналин, левосальбутамол, мабутерол, мелуадрин, метапротенерол, ноломирол, орципреналин, пибутерол, прокатерол, репротерол, ритодрин, римотерол, сальбутамол, сальмефамол, салметерол, сибенадет, сотенерот, сульфонтерол, тербуталин, тиарамид, тулобутерол, GSK-597901, GSK-159797, GSK-678007, GSK-642444, GSK-159802, HOKU-81, моногидрат гидрохлорида (-)-2-[7(S)-[2(R)-гидрокси-2-(4-гидроксифенил)этиламино]-5,6,7,8-тетрагидро-2-нафтилокси]-N,N-димeтилaцeтaмидa, кармотерол, QAB-149 и 5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1Н-хинолин-2-он, 4-гидрокси-7-[2-{[2-{[3-(2-фенилэтокси)пропил]сульфонил}этил]амино}этил]-2(3Н)-бензотиазолон, 1-(2-фтор-4-гидроксифенил)-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[3-(4-метоксибензиламино)-4-гидроксифенил]-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-[3-(4-М,1М-диметиламинофенил) -2-метил-2-пропиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1,4-бензоксазин-8-ил]-2-[3-(4-метоксифенил)-2-метил-2-пропиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1, 4-бензоксазин-8-ил]-2-[3-(4-н-бутилоксифенил)-2-метил-2-пропиламино]этанол, 1-[2Н-5-гидрокси-3-оксо-4Н-1, 4-бензоксазин-8-ил]-2-{4-[3-(4-метоксифенил)-1,2,4-триазол-3-ил]-2-метил-2-бутиламино}этанол, 5-гидрокси-8-(1-гидрокси-2-изопропиламинобутил)-2Н-1,4-бензоксазин-3-(4Н)-он, 1-(4-амино-3-хлор-5-трифторметилфенил)-2-грег-бутиламино)этанол и 1- (4-этоксикарбониламино-3-циано-5-фторфенил)-2-(трет-бутиламино)этанол, необязательно в форме их рацематов, их энантиомеров, их диастереомеров и их смесей и необязательно их фармакологически совместимых кислотно-аддитивных солей.
Предпочтительные β2-агонисты для применения в комбинациях по изобретению представляют собой: арформотерол, бамбутерол, битолтерол, броксатерол, карбутерол, кленбутерол, допексамин, фенотерол, формотерол, гексопреналин, ибутерол, изопреналин, левосальбутамол, мабутерол, мелуадрин, ноломирол, орципреналин, пирбутерол, прокатерол, (R,R)-формотерол, репротерол, ритодрин, римотерол, сальбутамол, салметерол, сибенадет, сульфонтерол, тербуталин, тулобутерол, GSK-597901, GSK-159797, KUL-1248, ТА-2005 и QAB-149, необязательно в форме их рацематов, их энантиомеров, их диастереомеров и их смесей и необязательно их фармакологически совместимых кислотно-аддитивных солей.
Так как антагонисты М3 по изобретению обладают продолжительным временем действия, предпочтительно, чтобы их комбинировали с длительно действующими β2-агонистами (также известными как LABA). Таким образом комбинированные лекарственные средства можно вводить один раз в сутки.
Особенно предпочтительные LABA представляют собой формотерол, салметерол и GSK-597901, GSK-159797, KUL-1248, ТА-2005 и QAB-149, необязательно в форме их рацематов, их энантиомеров, их диастереомеров и их смесей, и необязательно их фармакологически совместимых кислотно-аддитивных солей. Более предпочтительными являются салметерол, формотерол и QAB-149. Еще более предпочтительными являются салметерол и формотерол, конкретно ксинафоат салметерола и фумарат формотерола.
Следующие соединения можно рассматривать как примеры пригодных кислот для формирования аддитивных солей β2-агонистов: соляная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, метансульфоновая кислота, уксусная кислота, фумаровая кислота, янтарная кислота, молочная кислота, лимонная кислота, малеиновая кислота и трифторуксусная кислота. Кроме того, можно использовать смеси указанных выше кислот.
Особенно предпочтительный вариант осуществления настоящего изобретения представляет собой комбинацию М3 антагониста согласно изобретению с LABA, выбранным из формотерола, салметерола, GSK-597901, GSK-1 М3 антагонист согласно изобретению 59797, KUL-1248, ТА-2005 и QAB-149.
Другой вариант осуществления настоящего изобретения представляет собой комбинацию М3 антагониста, представляющего собой бромид (3R)-1-фенэтил-3-(9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана, с LABA, выбранным из формотерола, салметерола, GSK-597901, GSK-159797, KUL-1248, ТА-2005 и QAB-149.
По одному из вариантов осуществления изобретения β2-агонисты представляют собой формотерол, конкретно - фумарат формотерола.
По другому варианту осуществления изобретения β2-агонисты представляют собой салметерол, конкретно - ксинафоат салметерола.
Комбинации по изобретению необязательно могут содержать одно или несколько дополнительных активных веществ, для которых известно, что они пригодны для лечения респираторных нарушений, такие как ингибиторы PDE4, кортикостероиды или глюкокортикоиды, ингибиторы лейкотриена D4, ингибиторы киназы egfr, ингибиторы киназы р38 и/или агонисты рецепторов NK1.
Примеры пригодных ингибиторов PDE4, которые можно сочетать с антагонистами М3 и β2-агонистами, представляют собой денбуфиллин, ролипрам, ципамфиллин, арофиллин, филаминаст, пикламиласт, мезопрам, дротаверина гидрохлорид, лиримиласт, рофлумиласт, циломиласт, 6-[2-(3,4-диэтоксифенил)тиазол-4-ил]пиридин-2-карбоновая кислота, (R)-(+)-4-[2-(3-циклопентилокси-4-метоксифенил)-2-фенилэтил]пиридин, N-(3,5-дихлор-4-пиридинил)-2-[1-(4-фторбензил)-5-гидрокси-1Н-индол-3-ил]-2-оксоацетамид, 9-(2-фторбензил)№6-метил-2-(трифторметил)аденин, N-(3,5-дихлор-4-пиридинил)-8-метоксихинолин-5-карбоксамид, N-[9-метил-4-оксо-1-фенил-3,4,6,7-тетрагидропирроло[3,2,1-jk][1,4]бензодиазепин-3(R)-ил]пиридин-4-карбоксамид, гидрохлорид 3-[3-(циклопентилокси)-4-метоксибензил]-6-(этиламино)-8-изопропил-3Н-пурина, 4-[6,7-диэтокси-2,3-бис(гидроксиметил)нафталин-1-ил]-1-(2-метоксиэтил)пиридин-2(1Н)-он, 2-карбометокси-4-циано-4-(3-циклопропилметокси-4-дифторметоксифенил)циклогексан-1-он, цис-[4-циано-4-(3-циклопропилметокси-4-дифторметоксифенил)циклогексан-1-ол, ONO-6126 (Eur Respir J 2003, 22(Suppl. 45): Abst 2557) и соединения, указанные в формуле изобретения в патентных заявках РСТ с номерами WO03/097613 и РСТ/ЕР03/14722 и в испанской патентной заявке с номером Р200302613.
Примеры пригодных кортикостероидов и глюкокортикоидов, которые можно сочетать с антагонистами М3 и β2-агонистами, представляют собой преднизолон, метилпреднизолон, дексаметазон, нафлокорт, дефлазакорт, ацетат галопредона, будезонид, дипропионат беклометазона, гидрокортизон, триамцинолона ацетонид, флуоцинолона ацетонид, флуоцинонид, клокортолон, пивалат, метилприднизолона ацепонат, дексаметазона пальмитоат, типредан, гидрокортизона ацепонат, предникарбат, алклометазона дипропионат, галометазон, метилпреднизолона сулептанат, мометазона фуроат, римексолон, преднизолона фарнезилат, циклезонид, депродона пропионат, флутиказона пропионат, галобетазола пропионат, лотепреднола этабонат, бетаметазона бутирата пропионат, флунизолид, преднизон, дексаметазона натрия фосфат, триамцинолон, бетаметазона 17-валерат, бетаметазон, бетаметазона дипропионат, гидрокортизона ацетат, гидрокортизона натрия сукцинат, преднизолона натрия фосфат и гидрокортизона пробутат.
Примеры пригодных антагонистов LTD4, которые можно сочетать с антагонистами М3 и β2-агонистами, представляют собой томелукаст, ибудиласт, побилукаст, пранлукаста гидрат, зафирлукаст, ритолукаст, верлукаст, сулскаст, циналукаст, иралукаст натрия, монтелукаст натрия, 4-[4-[3-(4-ацетил-3-гидрокси-2-пропилфенокси)пропилсульфонил]фенил]-4-оксомаслянная кислота, [[5-[[3-(4-ацетил-3-гидрокси-2-пропилфенокси)пропил]тио]-1,3,4-тиадиазол-2-ил]тио]уксусная кислота, 9-[(4-ацетил-3-гидрокси-2-н-пропилфенокси)метил]-3-(1Н-тетразол-5-ил)-4Н-пиридо[1,2-а]пиримидин-4-он, натриевая соль 5-[3-[2-(7-хлорхинолин-2-ил) винил] фенил]-8-(N,N-диметилкарбаморил)-4,6-дитиаоктановой кислоты, натриевая соль 3-[1-[3-[2-(7-хлорхинолйн-2-ил)винил]фенил]-1-[3-(диметиламино)-3-оксопропилсульфанил]метилсульфанил]пропановой кислоты, 6-(2-циклогексилэтил)-[1,3,4]тиадиазоло[3,2-а]-1,2,3-триазоло[4,5-d]пиримидин-9(1Н)-он, 4-[6-ацетил-3-[3-(4-ацетил-3-гидрокси-2-пропилфенилтио)пропокси]-2-пропилфенокси]масляная кислота, (R)-3-метокси-4-[1-метил-5-[N-(2-метил-4,4,4-трифторбутил)карбамоил]индол-3-илметил]-N-(2-метилфенилсульфонил)бензамид, (R)-3-[2-метокси-4-[N-(2-метилфенилсульфонил)карбамоил]бензил]-1-метил-N-(4,4,4-трифтор-2-метилбутил)индол-5-карбоксамид, (+)-4(S)-(4-карбоксифенилтио)-7-[4-(4-феноксибутокси)фенил]-5(Z)-гептеновая кислота и соединения, указанные в формуле изобретения в патентной заявке РСТ с номером РСТ/ЕР03/12581.
Примеры пригодных ингибиторов киназы egfr, которые можно сочетать с антагонистами М3 и β2-агонистами, представляют собой палифермин, цетуксимаб, гефитиниб, репифермин, эрлотиниба гидрохлорид, канертиниба дигидрохлорид, лапатиниб и N-[4-(3-хлор-4-фторфениламино)-3-циано-7-этоксихинолин-6-ил]-4-(диметиламино)-2(Е)-бутенамид.
Примеры пригодных ингибиторов киназы р38, которые можно сочетать с антагонистами М3 и β2-агонистами, представляют собой хлорметиазола эдизилат, дорамапимод, 5-(2,6-дихлорфенил)-2-(2,4-дифторфенилсульфанил)-6Н-пиримидо[3,4-b]пиридазин-6-он, 4-ацетамидо-N-(трет-бутил)бензамид, SCIO-469 (описанный в Clin Pharmacol Ther 2004, 75(2): Abst PII-7) и VX-702, описанный в Circulation 2003, 108(17, Suppl. 4): Abst 882.
Примеры пригодных антагонистов рецепторов NK1, которые можно сочетать с антагонистами М3 и β2-агонистами, представляют собой нолпитантиума безилат, дапитант, ланепитант, вофопитанта гидрохлорид, апрепитант, езлопитант, С-1.7-O-3.1 лактон N-[3-(2-пентилфенил)пропионил]-треонил-N-метил-2,3-дегидротирозиллейцил-D-фенилаланилаллотреониласпарагинилсерина, N-бензил-N-метиламид 1-метилиндол-3-илкарбонил-[4(R)-гидрокси]-L-пролил-[3- (2-нафтил)]-L-аланина, (+)-(23,33)-3-[2-метокси-5-(трифторметокси)бензиламино]-2-фенилпиперидин, (2R,43)-N-[1-[3,5-бис(трифторметил)бензоил]-2-(4-хлорбензил)пиперидин-4-ил]хинолин-4-карбоксамид, бис(М-метил-О-глукаминовая) соль 3-[2(R)-[1(R)-[3,5-бис(трифторметил)фенил]этокси]-3(3)-(4-фторфенил)морфолин-4-илметил]-5-оксо-4,5-дигидро-1Н-1,2, 4-триазол-1-фосфиновой кислоты; 1-дезокси-1-(метиламине)-D-глюцитоловая (1:2) соль [3-[2(R)-[1(R)-[3,5-бис(трифторметил)фенил]этокси]-3(3)-(4-фторфенил)-4-морфолинилметил]-2,5-дигидро-5-оксо-1Н-1,2,4-триазол-1-ил]фосфоновой кислоты, гидрохлорид 2(3)-оксида 1'-[2-[2(R)-(3,4-дихлорфенил)-4-(3,4,5-триметоксибензоил)морфолин-2-ил]этил]спиро[бензо[с]тиофен-1(3Н)-4'-пиперидина] и соединение СS-003, описанное в Eur Respir J 2003, 22(Suppl. 45): Abst P2664.
Активные соединения в комбинации, т.е. антагонист М3 по изобретению, β2-агонист и любые другие активные соединения можно вводить вместе в одной и той же фармацевтической композиции или в различных композициях, предназначенных для раздельного, одновременного совместного, раздельного или последовательного введения одними и теми же или различными путями.
В предпочтительном варианте осуществления изобретения активные соединения в комбинации вводят посредством ингаляции, с применением обычных устройств доставки, где их можно составлять в одной и той же или различных фармацевтических композициях.
В наиболее предпочтительном варианте осуществления антагонист М3 по изобретению и β2-агонист находятся в одной и той же фармацевтической композиции и их вводят посредством ингаляции с применением обычных устройств доставки.
В одном из аспектов изобретение относится к комбинации, как определено в данном описании, отличающейся тем, что активные ингредиенты (а) и (b) образуют часть одной фармацевтической композиции.
Предложенная фармацевтическая композиция может быть приготовлена путем смешения обработки антагониста мускариновых рецепторов М3, β2-агониста и необязательно других добавок и/или носителей с применением по существу известных способов.
Активные соединения в комбинации, т.е. антагонист МЗ по изобретению, β2-агонист и любые другие необязательные активные соединения можно вводить любым подходящим способом, в зависимости от природы нарушения, которое необходимо лечить, например, перорально (в виде сиропов, таблеток, капсул, пастилок, препаратов с контролируемым высвобождением, быстрорастворимых препаратов и т.д.); топически (в виде кремов, мазей, лосьонов, назальных спреев или аэрозолей и т.д.); посредством инъекции (подкожной, внутрикожной, внутримышечной, внутривенной и т.д.) или посредством ингаляции (в виде сухого порошка, раствора, дисперсии и т.д.).
Фармацевтические препараты могут быть представлены в форме стандартной дозы и могут быть получены любым из способов, хорошо известных в области фармацевтики. Все способы включают в себя стадию приведения активного ингредиента(ов) в сочетании с носителем. Как правило, препараты получают посредством однородного и непосредственного приведения активного ингредиента в сочетании с жидкими носителями или тонкоизмельченными твердыми носителями или обоими, а затем, если необходимо, придания продукту формы желательного препарата.
Препараты по настоящему изобретению, пригодные для перорального введения, можно предоставлять в виде раздельных единиц, таких как капсулы, саше или таблетки, где каждая содержит определенное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной жидкости или в неводной жидкости; или в жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. Активный ингредиент также можно предоставлять в виде болюса, электуария или пасты.
Препарат в виде сиропа, как правило, состоит из суспензии или раствора соединения или соли в жидком носителе, например этаноле, натуральных, синтетических или полусинтетических маслах, таких как кокосовое масло и оливковое масло, глицерин или вода с ароматизатором, подсластителем и/или красителем.
Когда композиция находится в форме таблетки, можно применять любой фармацевтический носитель, обычно применяемый для получения твердых препаратов. Примеры таких носителей включают в себя виды целлюлозы, стеараты, такие как стеарат магния или стеариновая кислота, тальк, желатин, гуммиарабик, крахмалы, лактозу и сахарозу.
Таблетку можно получать посредством прессования или формования, необязательно с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки можно получать прессованием в подходящем устройстве активного ингредиента в сыпучей форме, такой как порошок или гранулы, необязательно смешанного со связующими веществами, смазками, инертными разбавителями, смазывающими, поверхностно-активными или диспергирующими средствами. Формованные таблетки можно получать посредством формования в подходящем устройстве смеси порошковой композиции, содержащей активные вещества, увлажненные инертным жидким разбавителем и, необязательно, высушенные и просеянные. Таблетки, необязательно, можно покрывать или наносить на них бороздки и можно составлять так, чтобы обеспечить модифицированное (т.е. медленное и контролируемое) высвобождение находящегося в них активного ингредиента.
Когда композиция находится в форме капсулы, подходит любой способ инкапсуляции, например, с применением указанных выше носителей в твердую желатиновую капсулу. Когда композиция находится в форме мягкой желатиновой капсулы, можно рассматривать и помещать в мягкую желатиновую капсулу любой фармацевтический носитель, обычно применяемый для получения дисперсий или суспензий, например водные смолы, виды целлюлозы, силикаты или масла.
Композиции сухих порошков для топической доставки к легким посредством ингаляции, например, можно предоставлять в различных первичных упаковочных системах (таких как капсулы и картриджи, например, из желатина, или блистеры, например, из ламинированной алюминиевой фольги), для применения в ингаляторе или инсуффляторе.
Способ упаковки препарата может подходить для доставки одной дозы или нескольких доз. В случае доставки нескольких доз препарат можно предварительно дозировать или дозировать при применении. Таким образом, ингаляторы сухих порошков делятся на три группы: (а) однократная доза, (b) многократные единицы дозирования и (с) устройство с несколькими дозами.
Препараты, как правило, содержат порошковую смесь для ингаляции соединений по изобретению и подходящей порошковой основы (вещество-носитель), такой как лактоза или крахмал. Применение лактозы предпочтительней. Каждая капсула или картридж, как правило, могут содержать от 2 мкг до 400 мкг каждого терапевтически активного ингредиента. Альтернативно активный ингредиент(ы) может присутствовать без эксципиентов.
Для ингаляторов с однократной дозой первого типа производитель навешивает однократные дозы в небольшие контейнеры, которые в большинстве случаев представляют собой желатиновые капсулы. Капсулу необходимо взять из отдельного футляра или упаковки и вставить в приемник ингалятора. Затем капсулу необходимо открыть или проколоть иголками или режущими пластинами, чтобы позволить части потока вдыхаемого воздуха проходить через капсулу для захвата порошка или для извлечения порошка из капсулы через эти отверстия посредством центробежной силы в течение ингаляции. После ингаляции пустую капсулу снова необходимо удалить из ингалятора. В большинстве случаев для вставки или удаления капсулы необходима разборка ингалятора, которая представляет собой действие, которое является сложным и тяжелым для некоторых пациентов. Другие препятствия, относящиеся к применению твердых желатиновых капсул для ингаляционных порошков, представляют собой (а) плохую защиту от влажности, захватываемой из окружаемого воздуха, (b) проблемы с открыванием или прокалыванием после того, как капсулы ранее подверглись чрезмерной относительной влажности, которая вызывает фрагментацию или сминание и (с) возможное вдыхание фрагментов капсул. Кроме того, имеются сообщения о неполном опорожнении ряда капсульных ингаляторов (например, Nielsen et al., 1997).
У некоторых капсульных ингаляторов есть магазин, из которого отдельные капсулы можно переносить в принимающую камеру, в которой происходит прокалывание и опорожнение, как описано в WO 92/03175. У других капсульных ингаляторов есть вращающиеся магазины с камерами для капсул, которые можно привести в соответствие с воздуховодом для выделения дозы (например, WO 91/02558 и GB 2242134). Они совместно с блистерными ингаляторами составляют тип ингаляторов с несколькими единицами дозирования, с ограниченным числом единиц дозирования в запасе на диске или ленте.
Блистерные ингаляторы обеспечивают лучшую защиту лекарственного средства от влажности, чем капсульные ингаляторы. Доступ к порошку обеспечивается прокалыванием крышки, а также фольги блистера или посредством снятия покрывающей фольги. Когда вместо диска используют блистерную ленту, количество доз можно увеличить, но для пациента неудобно заменять пустую ленту. Таким образом, такие устройства часто доступны с встроенной системой дозирования, включая сюда способ, применяемый для транспортировки ленты и открытия блистерных упаковок.
Многодозовые ингаляторы не содержат предварительно отмеренных количеств порошкового препарата. Они состоят из относительно большого контейнера и отмеряющего дозу элемента, которым нужно управлять пациенту. В контейнере находится множество доз, рабочим объемом индивидуально изолированных от массы порошка. Существуют различные отмеряющие дозу элементы, включая вращающиеся мембраны (например, ЕР0069715) или диски (например, GB 2041763; ЕР 0424790; DE 4239402 и ЕР 0674533), вращающиеся цилиндры (например, ЕР 0166294; GB 2165159 и WO 92/09322) и вращающиеся конусы (например, WO 92/00771), все несущие полости, которые необходимо заполнить порошком из упаковки. У других многодозовых устройств есть измерительные выпускные устройства (например, US 5201308 и WO 97/00703) или измерительные поршни с локальным или периферическим углублением для перемещения определенного объема порошка из упаковки в камеру сжатия или воздуховод, например, ЕР 0505321, WO 92/04068 и WO 92/04928.
Повторяемое отмеривание дозы представляет собой одну из важнейших задач для многодозовых ингалирующих устройств.
Порошковый препарат должен обладать хорошими и стабильными реологическими свойствами, так как наполнение отмеряющих дозу углублений или полостей обычно происходит под действием силы тяжести.
Для перезаряжаемых однодозовых ингаляторов или ингаляторов с несколькими единицами дозирования точность отмеривания дозы и воспроизводимость может быть гарантирована производителем. С другой стороны, многодозовые ингаляторы могут содержать намного большее количество доз, тогда как количество операций получения дозы, как правило, является меньшим.
Так как поток вдыхаемого воздуха в многодозовых устройствах часто напрямую проходит через отмеряющую дозу полость и так как тяжелые и жесткие отмеряющие дозу системы многодозовых устройств невозможно встряхнуть этим потоком вдыхаемого воздуха, масса порошка просто увлекается из полости, и при подаче получают небольшую дезагломерацию.
Таким образом, необходимы отдельные средства для дезинтеграции. Однако на практике они не всегда составляют часть конструкции ингалятора. Вследствие большого количества доз в многодозовых устройствах необходимо минимизировать адгезию порошка на внутренние стенки воздуховодов и средства дезагломерации, и/или должна быть возможной регулярная чистка этих частей без воздействия на оставшиеся дозы в устройстве. У некоторых многодозовых ингаляторов есть одноразовые упаковки для лекарственных средств, которые можно заменять после того, как принято предписанное количество доз (например, WO 97/000703). Для таких полупостоянных многодозовых ингаляторов с одноразовыми упаковками для лекарственных средств требование предотвращения накопления лекарственного средства является еще строже.
Кроме применения посредством ингаляторов сухого порошка, композиции по изобретению можно вводить в виде аэрозолей, действующих посредством газов-пропеллентов или посредством так называемых распылителей, посредством которых растворы фармакологически активных веществ можно распылять при повышенном давлении так, что образуется аэрозоль вдыхаемых частиц. Достоинство этих распылителей состоит в том, что можно полностью обойтись без применения газов-пропеллентов.
Такие распылители описаны, например, в патентной заявке РСТ №WO 91/14468 и международной патентной заявке № WO 97/12687, на содержание которых в этом описании сделана ссылка.
Композиции спреев для топической доставки в легкие посредством ингаляции, например, можно составлять в виде водных растворов или суспензий или в виде аэрозолей, извлекаемых из упаковок под давлением, таких как ингалятор с отмеренными дозами с применением подходящих сжиженных пропеллентов. Пригодные для ингаляции аэрозольные композиции могут быть или суспензией, или раствором и, как правило, содержат активный ингредиент(ы) и подходящий пропеллент, такой как фторуглерод или содержащий водород хлорфторуглерод, или их смеси, в частности гидрофторалканы, например, дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, особенно 1, 1, 1, 2-тетрафторэтан, 1, 1, 1, 2, 3, 3, 3-гептафтор-н-пропан или их смеси. Также в качестве пропеллента можно использовать диоксид углерода или другой подходящий газ. В аэрозольной композиции могут отсутствовать другие эксципиенты, отличные от пропеллентов или, необязательно, она может содержать дополнительные хорошо известные в данной области составляющие эксципиенты, такие как поверхностно-активные вещества, например олеиновая кислота или лецитин, или сорастворители, например этанол. Препараты под давлением, как правило, должны храниться в баллоне (например, в алюминиевом баллоне), закрытом клапаном (например, дозирующий клапан) и встроенном в механизм, снабженный мундштуком.
Желательно, чтобы лекарственные средства для введения посредством ингаляции обладали контролируемым размером частиц. Оптимальный размер частиц для ингаляции в систему бронхов, как правило, составляет 1-10 мкм, предпочтительно 2-5 мкм. Частицы с размером свыше 20 мкм, как правило, являются слишком большими, чтобы при ингаляции достичь дыхательных путей с малым диаметром. Для достижения таких размеров частиц размер частиц активного ингредиента при получении можно уменьшать традиционными средствами, например, посредством способов тонкого измельчения или сверхкритической жидкости. Желательную фракцию можно отделить посредством воздушной сортировки или просеивания. Предпочтительно частицы являются кристаллическими.
Достижение высокой воспроизводимости дозы с применением тонкоизмельченных порошков является трудным вследствие их плохой сыпучести и экстремальной тенденции к агломерации. Для увеличения эффективности сухих порошковых композиций частицы должны быть большими в ингаляторе, но маленькими при выпускании в дыхательные пути. Таким образом, как правило, применяют такой эксципиент, как лактоза, маннит или глюкоза. Размер частиц эксципиента, как правило, существенно больше, чем ингалируемого лекарственного средства по настоящему изобретению. Когда эксципиент является лактозой, он, как правило, присутствует в виде размолотой лактозы, предпочтительно кристаллического моногидрата альфа-лактозы.
Аэрозольные композиции под давлением, как правило, помещены в баллоны, снабженные клапаном, особенно дозирующим клапаном. Баллоны необязательно могут быть покрыты пластмассами, например фторуглеродным полимером, как описано в WO 96/32150. Баллоны встраивают в механизм, приспособленный для буккальной доставки.
Типичные композиции для назальной доставки включают в себя композиции, указанные выше для ингаляции и дополнительно включающие в себя не находящиеся под давлением композиции в форме раствора или суспензии в инертном носителе, таком как вода, необязательно в комбинации с традиционными эксципиентами, такими как буферы, противомикробные средства, мукоадгезивные средства, модификаторы тоничности и модификаторы вязкости, которые можно вводить посредством назальной помпы.
Типичные дермальные и трансдермальные препараты содержат традиционный водный или неводный носитель, например крем, мазь, лосьон или пасту, или находятся в форме медицинского пластыря, наклейки или мембраны.
Пропорции, в которых можно использовать (а) β2-агонист и (b) антагонист мускариновых рецепторов М3 по изобретению, являются переменной величиной. Активные вещества (а) и (b) возможно могут присутствовать в форме их сольватов или гидратов. В зависимости от выбора соединений (а) и (b) массовые соотношения, которые можно использовать в объеме настоящего изобретения, изменяются на основании различных молекулярных масс различных форм солей. Фармацевтические комбинации по изобретению могут содержать (а) и (b), как правило, в массовом соотношении (b): (а) в диапазоне от 1:5 до 500:1, предпочтительно - от 1:10 до 400:1.
Указанные ниже массовые соотношения представлены для соединения (b), представляющего собой бромид (3R)-1-фенэтил-3-(9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана, и свободных оснований β2-агонистов, таких как салметерол и формотерол, которые являются особенно предпочтительными по изобретению.
Например, в случае формотерола, фармацевтические комбинации по изобретению могут содержать (а) и (b) в массовом соотношении (b): (а) в диапазоне от 1:10 до 300:1, предпочтительно - от 1:5 до 200:1, предпочтительно - от 1:3 до 150:1, более предпочтительно - от 1:2 до 100:1.
Содержащие комбинации (а) и (b) фармацевтические композиции по изобретению обычно вводят так, что бромид (3R)-1-фенэтил-3-(9Н-ксантен-9-карбонилокси)-1-азонийбицикло[2.2.2]октана и формотерол вместе находятся в дозах от 5 до 5000 мкг, предпочтительно - от 10 до 2000 мкг, более предпочтительно - от 15 до 1000 мкг, еще лучше - от 20 до 800 мкг на одну дозу.
Например, без ограничения тем самым объема изобрете