Способ прогнозирования эффективности лечения хронического гнойного риносинусита
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к оториноларингологии, и может быть использовано для прогнозирования эффективности лечения хронического гнойного риносинусита. Способ включает прогнозирование эффективности лечения хронического гнойного риносинусита при иммунотерапии рекомбинантным цитокином, проводимой на основе генотипирования аллельного полиморфизма гена цитокина. Проводят терапию рекомбинантным интерлейкином-1β, и при наличии низкопродуцирующего аллеля гена цитокина IL-1β прогнозируют повышение фагоцитарной активности нейтрофилов за счет увеличения уровня IL-8 и гарантируют высокую эффективность лечения. Использование изобретения позволяет прогнозировать эффективность предстоящей терапии рекомбинантным интерлейкином-1β за счет определения индивидуальной восприимчивости каждого больного с учетом способности функциональной активности клеток в зависимости от генотипа. 1 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится к области медицины, а именно к способам лечения инфекционных и воспалительных заболеваний рекомбинантными цитокинами, и может быть использовано при иммунотерапии заболеваний верхних дыхательных путей.
В последние годы отмечен существенный рост заболеваний носа и околоносовых пазух. Несмотря на существование множества консервативных и хирургических методов лечения хронических гнойных риносинуситов (далее ХГРС), достигнуть полного излечения удается редко, рецидивы же заболевания приходится наблюдать достаточно часто.
Иммунотерапия как понятие объединяет различные способы воздействия на систему иммунитета с целью прекращения патологического процесса в организме.
Для специфического лечения используют препараты антигенов или антител, специфичные по отношению к возбудителю или антигену. Неспецифические методы включают воздействия на систему иммунитета химических веществ, физических факторов и антигенов, неспецифичных по отношению к возникшему патологическому процессу. Заместительная неспецифическая иммунотерапия характеризуется тем, что готовые неспецифические факторы иммунитета и клетки вводятся больному, у которого имеется их недостаточность.
В настоящее время наблюдается переход от терапии массовой к терапии индивидуальной, позволяющей вылечить конкретного больного. Однако отсутствие значимых прогностических факторов эффективности делает такую терапию зачастую непредсказуемой, поскольку в зависимости от условий и доз воздействующего агента можно вызвать как стимуляцию, так и угнетение ряда показателей системы иммунитета.
Известно использование для решения таких задач рекомбинантных цитокинов, в частности цитокинов, регулирующих воспаление, таких как интерлейкин-1 (далее IL-1), фактор некроза опухолей (TNFα), «пролиферативные» - IL-2, или «стимуляторы аллергии» - IL-4, IL-5 и др. Они могут возмещать недостающие регуляторные факторы и тем усиливать иммунные реакции.
На уровне организма цитокины осуществляют связь между иммунной, нервной, эндокринной, кроветворной и другими системами и служат для их вовлечения в организацию и регуляцию единой защитной реакции. Таким образом, цитокины служат той организующей системой, которая формирует и регулирует весь комплекс патофизиологических сдвигов при внедрении патогенов.
К провоспалительным цитокинам в настоящее время относят IL-1α, IL-1β, IL-2, IL-6, IL-8, TNFα, интерферон гамма (IFNg), к противовоспалительным цитокинам - рецепторный антагонист IL-1 (IL-1RA), IL-4, IL-10. В настоящее время получено большое число рекомбинантных аналогов цитокинов, в том числе участвующих в регуляции воспаления, кроме того, их число постоянно растет.
Однако опыт клинического применения рекомбинантных аналогов цитокинов показал, что действуют они выборочно. Многим пациентам такая терапия существенно помогает в ряде случаев, позволяя вылечить после первого применения, некоторым не помогает вообще, а в ряде случаев наблюдаются выраженные побочные реакции.
Следовательно, прогноз эффективности цитокиновой терапии является актуальным, а определение персональной чувствительности больного к цитокиновой терапии позволит применять ее более обоснованно и результативно.
Известен способ лечения хронических гнойных риносинуситов путем иммунотерапии препаратом Беталейкин, включающий его системное и местное применение [1].
Рекомбинантный IL-1b под коммерческим названием Беталейкин (далее БЛ) разрешен Минздравом РФ к клиническому применению (№97/51/6). Биологические свойства этого цитокина, а именно стимуляция костно-мозгового кроветворения, перестройка иммунопоэза, активация метаболизма соединительной ткани, усиление пролиферации фибробластов и эпителиальных клеток (ранозаживляющее действие), в настоящее время с успехом используются в клинической практике для лечения ряда патологий (онкологических, инфекционных, хирургических, ЛОР и др.).
После терапии БЛ по данному способу у большинства больных (53%) резко сокращается количество гноя в промывных водах, который исчезает на третьи сутки лечения (отличный результат), у части больных (33%) небольшое количество гноя в промывных водах наблюдается до четвертого дня лечения (хороший результат), и у части пациентов (14%) на фоне уменьшения количества выделений из пазух сохраняются прожилки гноя и имеет место отек и гиперемия слизистой оболочки носа (удовлетворительный результат). Таким образом, эффект терапии отличается у разных больных.
Недостатком данного способа является то, что отсутствует прогностический критерий, определяющий индивидуальную восприимчивость и побочный эффект терапии БЛ.
Известен также способ диагностического использования полиморфизма гена, кодирующего рецептор к TNF типа II для выявления пациентов, не отвечающих на анти-TNF терапию, в котором в качестве прогностического фактора неэффективности терапии антителами к TNFα выявляют полиморфизм гена рецептора для этого цитокина [2].
Данный способ позволяет выявить респондентов, не отвечающих на терапию антителами к TNFα, однако он не прогнозирует степень ее эффективности.
Наиболее близким по технической сущности к заявляемому решению является способ прогнозирования эффективности лечения интерлейкином-1 [3].
Данный способ включает анализ данных генотипирования по признакам аллельного полиморфизма гена цитокина и позволяет сделать прогноз эффективности лечения препаратом IL-1 на основании индивидуальной восприимчивости больного к лечению этим препаратом для исключения побочного эффекта предстоящей терапии. При наличии у пациента гомозиготного по высокопродуцирующему аллелю гена цитокина и изменении температуры в сторону повышения прогнозируют низкую эффективность лечения, а при наличии у пациента гомозиготного по низкопродуцирующему аллелю гена цитокина и отсутствии повышения температуры прогнозируют высокую эффективность лечения.
Недостатками данного способа является то, что в нем не учитывается способность функциональной активности клеток в зависимости от генотипа.
Технический результат изобретения заключается в прогнозировании эффективности лечения больных с хроническим гнойным риносинуситом при иммунотерапии препаратом Беталейкин, проводимой на основании индивидуальной восприимчивости препарата каждым больным и с учетом способности функциональной активности клеток в зависимости от генотипа.
Для достижения указанного технического результата в способе прогнозорования эффективности лечения хронического гнойного риносинусита осуществляют иммунотерапию рекомбинантным цитокином, которую проводят на основе генотипирования аллельного полиморфизма гена цитокина.
Согласно предложению терапию проводят рекомбинантным интерлейкином-1β, и при наличии низкопродуцирующего аллеля гена цитокина IL-1β прогнозируют повышение фагоцитарной активности нейтрофилов за счет увеличения уровня IL-8 и гарантируют высокую эффективность лечения.
Наличие отличительных признаков свидетельствует о соответствии заявляемого технического решения критерию патентоспособности «новизна».
Предложенный способ основан на влиянии функционального полиморфизма генов цитокинов на характер иммунного ответа, при этом эффективность терапии характеризуется повышением фагоцитарной активности клеток на основе их рекомбинантных аналогов.
Известно, что активность всех цитокинов, участвующих в реакциях воспаления, реализуется и регулируется по сходному механизму, поэтому нами был рассмотрен IL-1.
Этот цитокин полифункционален и выполняет не менее 50 различных функций, мишенями которых служат клетки практически всех органов и тканей. Основными продуцентами IL-1 являются моноциты и макрофаги, также вырабатывать IL-1 могут многие другие клетки организма человека, в частности кератиноциты.
IL-1 является индуцибельным белком, синтез которого начинается в ответ на внедрение микроорганизмов либо повреждение тканей и который необходим для развития местного воспаления и осуществления всего комплекса защитных реакций, именуемых острофазовым ответом.
В семейство IL-1 принято включать IL-1α, IL-1β, рецепторы IL-1 (IL-1Re) и рецепторный антагонист этого цитокина (IL-RA). Равновесие между продукцией, экспрессией и ингибицией синтеза белков семейства IL-1 играет одну из ключевых ролей в развитии, регуляции и исходе воспалительного процесса. Кластер генов IL-1(430Kb) находится на 2q13 хромосоме и содержит гены IL-1α, IL-1β рецепторов IL-1Re и IL-1RA, строение которых достаточно консервативно.
При всплеске IL-1β синтезируется провоспалительный цитокин IL-8, который, как показали эксперименты, стимулирует фагоцитарную активность клеток нейтрофильного звена.
IL-8 синтезируется NK-клетками после активации рецепторов фибронектина (β1-интегринов) с участием внутриклеточного сигнального пути Rac1/p38 МАРК. IL-8 обнаружен в назальных секретах больных, инфицированных синтициальным вирусом при синуситах, а также при бактериальных инфекциях.
Установлено, что грамположительные и грамотрицательные бактерии могут по-разному запускать синтез IL-8. Снижение уровня продукции IL-1 приводит к существенному снижению синтеза IL-8. Синтез IL-8, начавшийся в ответ на эндогенные стимулы, проявляющиеся в очаге воспаления при развитии местной защитной реакции на внедрение патогенов, формирует цитокиновую сеть, регулирующую местную воспалительную реакцию, включающую активацию нейтрофилов.
Изначально IL-8 был охарактеризован как растворимый фактор, обладающий хемотаксической активностью для нейтрофилов. Участие этого цитокина в привлечении нейтрофилов и активации фагоцитоза в очаге воспаления подтверждено эксперементами in vivo.
Подкожное введение IL-8 эксперементальным животным вызывало аккумуляцию нейтрофилов в месте внедрения. Введение специфических нейтрализующих антител к IL-8 при подобных моделированных воспалительных реакциях предотвращало инфильтрацию нейтрофилов и нейтрофил-опосредованное повреждение тканей. Эти наблюдения позволили сделать вывод, что IL-8 играет ключевую роль в миграции - активации нейтрофилов в очаге воспаления.
Известно, что функциональный (ответственный за измененную экспрессию и продукцию соответствующего белка) полиморфизм генов, кодирующих ряд известных про- и противовоспалительных цитокинов, несущих небольшие мутационные изменения (точечные замены нуклеотидов (SNP, single nucleotide polymorphism) или тандемные повторы частей гена (VNTR, variable number tandem repeat)), может приводить к дисбалансу воспалительного и противоинфекционного иммунного ответа.
Выявлены аллельные варианты генов ряда про- и противовоспалительных цитокинов, ответственные за повышенную продукцию кодируемых ими белков: IL-1α - замена нуклеотидов в позиции (-889), IL-1β(+3953), IL-1RA(VNTR), TNFα(-308),
IL-6(-174), IL-4(-590), IL-10(-1082), IFNg(+874), IL-2(-330) и др., частота встречаемости которых в ряде популяций в гетерозиготном виде достигает 40-50%, а в гомозиготном 10-15%.
Таким образом, в зависимости от индивидуального ансамбля высоко- или низкопродуцирующих (нормальных) вариантов этих генов характер воспалительного ответа может варьироваться между индивидуумами с «полярными» сочетаниями: например, «провоспалительный генотип» - большинство генов провоспалительных цитокинов (IL-1α, IL-1β, TNFα, IFNgamma и др.) являются высокопродуцирующими, а противовоспалительных цитокинов (IL-1RA, IL-4, IL-10 и др.) - низкопродуцирующими; или «противовоспалительный генотип» - носительство нормальных вариантов генов провоспалительных цитокинов в сочетании с высокопродуцирующими вариантами генов противовоспалительных цитокинов.
Некоторые аллельные ассоциации генов семейства IL-1 ответственны за измененный характер экспрессии и продукции кодируемых ими белков. Выявлен ряд SNP-маркеров высокопродуцирующего варианта гена IL-1β, наследуемых, как правило, совместно
(+3953, -511, -3737, -1469, -999). Носительство полиморфного варианта 2 гена IL-1RA(VNTR), несущего ряд повторов по 86 п.о. (IL-1RA*2) связано с повышенным уровнем циркулирующего IL-1RA и уровнем экспрессии мРНК этого белка в ходе воспаления.
У лиц, гомо- или гетерозиготных по варианту гена IL-1β(+3953), продуцируется, соответственно, в четыре раза и в два раза большее количество этого цитокина при воспалительном ответе, чем у лиц, гомозиготных по нормальному варианту этого гена (IL-1β*1).
Присутствие в геноме сочетаний (знак «+» - вариант гена присутствует, знак «-» - отсутствует) IL-1β(SNP)+/IL-1RA*2-, IL-1β(SNP)-/IL-1RA*2+ и IL-1β(SNP)+/IL-1RA*2+ может оказывать существенное влияние на соотношение экспрессии и продукции этих белков и являться одной из главных причин дисрегуляции воспалительного ответа.
Согласно данным популяционных исследований, вариант IL-1RA*2 чаще встречается в ассоциации с нормальным (низкопродуцирующим) вариантом гена IL-1β(IL-1β*1) и редко присутствует совместно с высокопродуцирующим вариантом - IL-1β*2 (маркер - одна из замен нуклеотидов, перечисленных выше). Феномен такого наследования объясняется тем, что эти варианты генов, расположенных близко друг к другу, наследуются, как правило, совместно.
У лиц, гетерозиготных по этим вариантам генов, одна из хромосом несет гаплотип IL-1β*1/IL-1RA*2, вторая - IL-1β*2/IL-1RA*1, в результате давая сочетание «1/2»IL-1β+«1/2»IL-1RA. Гаплотип IL-1β*2/IL-1RA*2 встречается у 1-2% популяции и, по всей видимости, является результатом мейотической рекомбинации.
Таким образом, присутствие в геноме больных ХГРС сочетаний IL-1β(+3953)+/IL1RA*2-, IL-1β(+3953)-/IL1RA*2+ и IL-1β(+3953)+/IL1RA*2+ может оказывать существенное влияние на уровень продукции этих белков и соответственно снижать выработку IL-8, который оказывает воздействие на фагоцитирующие клетки.
Предложенный способ путем выявления гомозиготного по нормальному варианту гена цитокина определяет высокую эффективность терапии в следствие активации фагоцитарного звена иммунитета и позволяет выбрать тактику лечения больных с хроническими гнойно-воспалительными заболеваниями околоносовых пазух на основании индивидуальной генетически обусловленной восприимчивости больного к такой терапии.
Из вышесказанного следует, что технический результат изобретения достигается новой совокупностью существенных признаков как вновь введенных, так и известных, следовательно, заявляемый способ соответствует критерию патентоспособности «изобретательский уровень».
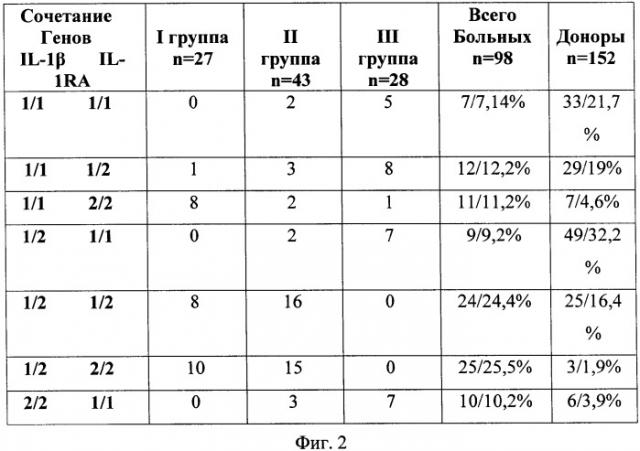
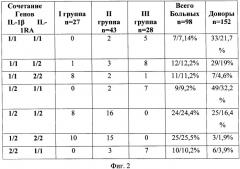
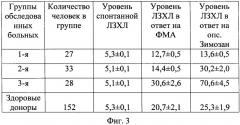
Способ иллюстрируется чертежом, где на фиг.1 представлена фотография агарозного геля с вариантами полос, визуально наблюдаемых при аллелях 1 и 2 гена IL-1RA(VNTR), - 1/1 - ген, гомозиготный по варианту IL-1RA*1, 1/2 - гетерозиготный ген, 2/2 - ген, гомозиготный по варианту IL-1RA*2; на фиг.2 приведена таблица 1, где показано носительство сочетаний вариантов генов IL-1β и IL-1RA в группах больных ХГРС и здоровых доноров (больные/%); на фиг.3 приведена таблица 2, где представлены особенности ответа клеток периферической крови больных хроническими риносинуситами на различные индукторы в реакции ЛЗХЛ (имп/с); на фиг.4 представлена таблица 3, где приведены группы больных в зависимости от интенсивности ЛЗХЛ и сочетаний генотипов.
Способ осуществляют следующим образом.
До проведения иммунотерапии у пациента берут материал, содержащий клетки (кровь, смывы из верхнечелюстных пазух), который затем исследуют.
Во-первых, проводят молекулярно-генетическое определение вариантов генов цитокинов. Из клеток одним из известных методов, например с помощью фенол/хлороформ-экстракции по Хомчинскому, получают образцы высокомолекулярной ДНК.
Во-вторых, методом хемилюминесценции (далее ХЛ), основаном на том, что любой биологический процесс в живом организме сопровождается выбросом кванта света, определяют функциональную активность фагоцитирующих клеток нейтрофильного звена. Так как световой импульс очень мал, уловить его можно, только многократно усилив с помощью специальных реагентов аплификаторов (люминол, люцегинин). Регистрацию усиленного сигнала производят приборами люминометрами.
Варианты аллелей генов, нормальные и несущие точечные замены нуклеотидов SNP, определяют методом ПДРФ-анализа продуктов ПЦР-амплификации специфических участков генома (RELF-PCR).
ПЦР-реакцию проводят с использованием праймеров (библиотека Gene Bank), ограничивающих участок гена IL-1β, могущий содержать указанную замену нуклеотидов. На этапе рестрикации полученный амплификат инкубируют с индивидуально подобранными ферментами рестрикции.
Продукты рестрикции разделяют, например, электрофоретически в агарозном геле, окрашивают ДНК-красителем и визуализируют. В качестве маркера размера фрагментов ДНК используют, например, набор маркеров молекулярного веса.
При наличии в геноме полиморфной мутации продукт амплификации остается целым, у гетерозиготных индивидов выявляют как целый, так и фрагментированный продукт.
Наличие тандемных повторов частей гена (VNTR) определяют, например, методом ПЦР(РСК): амплифицируют участок ДНК, содержащий разное число тандемных повторов, аллельный тип определяют по длине получаемого продукта амплификации при разделении и визуализации (фиг.1).
Для краткого обозначения аллелей генов IL-1β и IL-1RA приняты следующие сокращения: нормальный, не несущий выявляемую мутацию аллель обозначается цифрой 1, полиморфный - 2, соответственно гомозиготный нормальный ген - «1/1», гомозиготный высокопродуцирующий ген - «2/2», гетерозиготный - «1/2».
Методом хемилюминесценции определяют функциональную активность фагоцитирующих клеток нейтрофильного звена. Регистрацию усиленного сигнала производят с помощью мультисканирующего люминометра, позволяющего использовать очень малые количества реагентов.
Для исследования используют венозную кровь, стабилизированную гепарином (20 МЕ/мл), и смыв из верхнечелюстных пазух. Воспалительные клетки, содержащиеся в смыве, отмывают изотоническим раствором дважды при 1500 об/мин в течение 10 минут, ресуспендируют в растворе Хенкса в концентрации 1×106 клеток/мл и используют в нижеуказанной реакции.
Реакцию осуществляют следующим образом.
В лунки 96-луночной белой, непрозрачной платы раскапывают по 20 мкл исследуемого материала (кровь, смыв из околоносовых пазух), добавляют вещества, стимулирующие функциональную активность клеток воспаления (форбол-миристат ацетат, опсонизированный зимозан), содержащихся в исследуемом материале, 40 мкл раствора люминола в конечной концентрации 10-4 М, общий объем реактогенной среды доводят раствором Хенкса до 200 мкл. Все исследования проводят в трех параллелях. Регистрацию реакции осуществляют в течение одного часа при 37°С.
Результат реакции выражают светосуммой, то есть количеством импульсов, накопленных за время эксперимента.
Приготовление реагентов осуществляют следующим образом.
Люминол - является веществом, акцептирующим на себя весь пул свободнорадикальных форм кислорода (супероксидрадикал, гидроксил радикал, синглентный кислород), а также перекиси водорода и миелопироксидазы, продуцируемых клетками воспалительной реакции (нейтрофилы, макрофаги) при их активации.
17,7 мг люминола растворяют в 10 мл диметилсульфоксида (ДМСО), получают маточный раствор, который хранят при температуре холодильника в течение одного месяца. Перед исследованием приготовляют рабочий раствор, растворяя 1 объем маточного раствора люминола в 10 объемах раствора Хенкса.
Форбол-миристат ацетат (ФМА) относится к группе форболовых эфиров, является неспецифическим активатором функциональной активности клеток воспаления, действует непосредственно через протеинкиназный путь активации, минуя рецепторный аппарат. ФМА вызывает ряд последовательных реакций в клетке, приводя к мощному оксидативному взрыву и выбросу свободнорадикальных форм кислорода. Использование данного активатора позволяет оценить оксидативный потенциал клетки. ФМА используют в реакции в концентрации 10 нг/мл.
Зимозан - фрагмент клеточной стенки пекарских дрожжей - употребляется в реакции также в качестве активатора клеток воспалительной реакции. Использование данного активатора позволяет оценить интенсивность оксидативного взрыва, возникающего в нейтрофильных клетках в результате рецепторного взаимодействия опсонизированного компонентами комплемента зимозана с С3в рецепторами на поверхности клетки. Проведение реакции с опсонизированным (опс) зимозаном является вариантом реакции фагоцитоза.
Зимозан в количестве 10 мг разводят в 10 мл раствора NaCl 0,9% и кипятят в течение 30 минут для получения гомогенной взвеси. Взвесь дважды отмывают изотоническим раствором, ресуспедируют в 2,5 мл того же раствора, добавляют эквивалентное количество пулированной (не менее 4 человек) сыворотки крови человека. Затем помещают на 40 минут в термостат при температуре 37°С.
После отмывания от избытка сыворотки зимозан разводят 10 мл изотонического раствора и аликвотируют по 500 мкл в пластиковые пробирки. Хранят при t-18°C в течение месяца.
Уровни цитокинов в сыворотках крови, лаважах и супернатантах клеток определяют методом твердофазного ИФА, используя полистироловые планшеты, тест-системы ТОО «Цитокин» (IL-1 и IL-8). Концентрацию конкретного цитокина в образце устанавливают по калибровочной кривой соотношения оптической плотности раствора в лунке и известной концентрации данного цитокина в качестве стандарта, умножая на соответствующее разведение образца.
Отбор больных для исследования проводили на базе ФГУ «Санкт-Петербургский НИИ уха, горла, носа и речи». Нами было обследовано 98 больных ХГРС и 152 здоровых донора в возрасте от 18 до 60 лет. Всего 250 человека, из них 115 мужчин и 135 женщин. Большинство отобранных для исследования больных имели давность заболевания от 5-ти до 10-ти лет.
Следовательно, заболевание имело достаточно длительное течение. Благодаря этому можно объективно оценить результаты обследования больных.
Проводился детальный анализ распределения сочетаний полиморфных вариантов генов IL-1β и IL-1RA у больных ХГРС и здоровых доноров (таблица 1 на фиг.2).
Полиморфизм гена IL-1RA оказывал влияние в I группе больных с низкой фагоцитарной активностью. Все больные I группы являлись носителями варианта IL-1RA*2. Наиболее низкие значения в сравнении с группой здоровых доноров имели носители гаплотипов «1/1»IL-1β+«2/2»IL-1RA, «1/2»IL-1β+«1/2»IL-1RA и «1/2»IL-1β+«2/2»IL-1RA.
Больные II группы имели наиболее смешанные гаплотипы. Однако наиболее существенным является сочетание генов «1/2»IL-1β+«1/2»IL-1RA и «1/2»IL-1β+«2/2»IL-1RA.
При анализе гаплотипов IL-1β+IL-1RA установлено, что индивидуумы гомозиготных нормальных вариантов этих генов имели высокий ответ на оба индуктора и вошли в III группу, у этих больных ответ на ФМА 30,6 имп/с был также выше в сравнении с той же группой здоровых доноров 20,7 - имп/с, (таблица 2 на фиг.3).
Однако больные III группы, кроме носителей «1/2»IL-1β+«1/2»IL-1RA и «1/2»IL-1β+«2/2»IL-1RA, имели достаточно низкий уровень спонтанной ЛЗХЛ, 5,1имп/с в сравнении с реакцией на зимозан и ФМА. Это обуславливало нарушение очередности фаз фагоцитоза, но дефекта фагоцитарной системы у этих больных не отмечалось.
Таким образом, носительство варианта IL-1RA*2 определяло снижение функциональной активности клеток венозной крови больных ХГРС.
С диагностической и лечебной целью проводили пункции верхнечелюстных пазух по общепринятым стандартным методикам в условиях местной анестезии. Исследование ЛЗХЛ пунктата было проведено 98-ми пациентам, страдающим хроническим гнойным риносинуситом.
Также изучалось влияние полиморфизма генов IL-1β и IL-1RA на функциональную активность нейтрофилов непосредственно в очаге воспаления - в клетках промывной жидкости верхнечелюстных пазух.
Клеточный состав смывов в основном был представлен нейтрофильными клетками. Изучение ЛЗХЛ проводили также с использованием 2-х индукторов. Для того чтобы результаты исследования были сопоставимы, перед исследованием проводили количественный подсчет клеток смывов.
Содержание клеток в исследуемом смыве после 2-кратного отмывания изотоническим раствором доводили до 1 млн/мл. Исследование ЛЗХЛ смывов проводили до лечения.
Первоначальный анализ полученных результатов показал, что уровни ЛЗХЛ смывов из околоносовых пазух колебались в широком диапазоне от 12, 2 имп/с за время исследования (30 минут) до 2495,4 имп/с, в связи с чем нами было выделено 3 группы больных в зависимости от интенсивности ЛЗХЛ.
Уровни ответа определяли как низкий, средний, высокий.
Как видно из таблицы 3 на фиг.4, при низком уровне ответ на ФМА не превышал 35,8±5,6 имп/с за 30 минут исследования, а опсонизированный зимозан был равен 28,9±4,8 имп/с. В то время как уровень спонтанной ЛЗХЛ был наименьшим 11,2±2,0 имп/с.
Низкий уровень ответа (таблица 3 на фиг.4) отмечался у больных носителей варианта «2/2»IL-1RA, и также отмечались низкие значения ответа на ФМА, опсонизированный зимозан и спонтанной ЛЗХЛ. При этом обращают на себя внимание гаплотипы «1/1»IL-1β+«2/2»IL-1RA и «1/2»IL-1β+«2/2»IL-1RA, носительство сочетаний этих генов влияло на клиническую симптоматику. Так клинический анализ больных с низким уровнем ответа ЛЗХЛ показал, что (по данным анамнеза) длительность рецидива заболевания в данной группе больных превышала 15 дней до момента обращения в стационар. Больные отмечали наличие слизисто-гнойного отделяемого и в межрецидивный период. Данный факт подтверждает нарушение фагоцитоза и невозможность полного завершения воспалительного процесса в околоносовых пазухах.
Средний уровень ответа на ФМА был отмечен у больных ХГРС и равнялся 290,8±33,4 имп/с, на опсонизированный зимозан 253,8±38,2 имп/с. Больные, имеющие средний уровень ответа, являлись носителями различных гаплотипов, однако большинство из них являлись носителями «1/2»IL-1β+«1/2»IL-1RA и «1/2»IL-1β+«2/2»IL-1RA. Следует отметить, что больные, имеющие средний уровень ответа местно в очаге воспаления, относились к II группе больных при определении хемилюминесцентной активности периферической крови (таблица 1 на фиг.2).
В группе с высокими показателями средние показатели ответа на ФМА -1012,1±1472 имп/с, на опсонизированный зимозан -1180,3±144 имп/с.
Наиболее высокий уровень отмечался в III группе больных, наивысшие медианы значений спонтанной и индуцированной ЛЗХЛ клеток отмечались у больных носителей гаплотипов «1/1»IL-1β+«1/1»IL-1RA, «1/2»IL-1β+«1/1»IL-1RA и «2/2»IL-1β+«1/1»IL-1RA. Уровень спонтанной ЛЗХЛ у больных III группы превышал в 12, 8 раз уровень спонтанной ЛЗХЛ II группы, уровень ЛЗХЛ в ответ на ФМА - в 28,9 раз, а уровень ЛЗХЛ в ответ на опсонизированный зимозан - в 42,1 раза. Данное наблюдение сочетаний гаплотипов «1/1»IL-1β+«1/1»IL-1RA, «1/2»IL-1β+«1/1»IL-1RA и «2/2»IL-1β+«1/1»IL-1RA с высокой фагоцитарной активностью характеризует остроту воспаления в околоносовых пазухах. Больные, имеющие высокий уровень интенсивности, имели в анамнезе наименьшее число рецидивов в год. Однако возникающие периоды обострений сопровождались яркой клинической картиной.
Во всех трех группах больных наблюдали высокий спонтанный уровень ЛЗХЛ. Даже в группе с низкой активностью ЛЗХЛ спонтанный уровень реакции в два раза превышал уровень фона (5-6 имп/с). Следовательно, высокий спонтанный уровень ЛЗХЛ клеток, содержащихся в смывах из носа, обусловлен массивным фагоцитозом микрофлоры, находящейся в полости околоносовых пазух, несмотря на то, что «качество» фагоцитоза значительно разнится.
Значительные различия в интенсивности хемилюминесцентного ответа на индукторы клеток из очага воспаления отражают уровень функциональной активности этих клеток.
Согласно проведенному скринингу, ХГРС, ассоциирующийся с полиморфизмом гена IL-1RA*2 (VNTR) (73,4%) и сочетаниями «1/1»IL-1β+«2/2»IL-1RA, «1/2»IL-1β+«1/2»IL-1RA и «1/2»IL-1β+«2/2»IL-1RA, обуславливает снижение функциональной активности нейтрофилов как в периферической крови, так и в очаге гнойного воспаления. Следовательно, полиморфизм этих генов может являться одной из главных причин нарушения фагоцитоза. Так, снижение уровня сывороточной продукции IL-1β (2,37±1,2) в сравнении со здоровыми донорами IL-1β (33,1±20,1) гарантированно пролангирует снижение синтеза IL-8(3,4±2,1) относительно тех же доноров IL-8 (36,1±29,1), ответственного за стимуляцию фагоцитоза.
У здоровых доноров сочетание генов «1/2»IL-1β+«2/2»IL-1RA встречалось в 1,9% случаев, а у обследованных лиц с ХГР данный генотип встречался в 25,5% случаев. Анализ показателей функциональной активности фагоцитирующих клеток нейтрофильного звена у больных ХГР показал, что клетки смывов из верхнечелюстных пазух имели два типа ответа на используемые воспалительные индукторы.
При первом типе ответа реакция на ФМА была ниже таковой на опсонизированный зимозан. При втором типе ответа мы наблюдали снижение реакции на опсонизированный зимозан по сравнению с ответом клеток на ФМА. Этот тип ответа свидетельствует об уменьшении количества С3b рецепторов и соответственно о дефекте фагоцитоза клеток из очага воспаления.
Интересно, что в группе с высоким ответом на индукторы (таблица 3 на фиг.4) только у четырех из 32 больных наблюдался второй тип ответа. В тоже время в группах с низким и средним уровнем реакции на воспалительные индукторы у большинства больных (62%) отмечено снижение фагоцитарной активности воспалительных клеток, полученных из очага воспаления. Следовательно, снижение ответа на воспалительные стимулы отражает степень угнетения фагоцитарной активности воспалительных клеток.
Анализ результатов, полученных нами при определении функциональной активности фагоцитирующих клеток нейтрофильного звена в периферической крови и в смывах из околоносовых пазух больных ХГРС, свидетельствует о корреляционной зависимости носительства варианта «2/2»IL-1RA и уровня хемилюминесценции клеток.
Согласно этому выводу сверхпродукция IL-1RA генетически обуславливает снижение выработки IL-1β→IL-8 и соответственно снижает активность фагоцитирующих клеток в ответ на внедрение патогенна.
Генетически пролонгируемая дисрегуляция продукции IL-1β/IL-IRA у больных ХГРС приводит к продолжительному воспалительному ответу и соответственно невозможности элиминации внедрившихся чужеродных агентов (бактерий, вирусов, грибов и т.д.).
Также исследования показали, что больные ХГРС имеют различную активность фагоцитирующих клеток нейтрофильного звена в зависимости от генотипа пациента.
Влияние функционального полиморфизма генов IL-1β и IL-1RA на фагоцитарное звено иммунной системы можно описать в виде следующих закономерностей: носительство нормальных вариантов генов определяет адекватную фагоцитарную активность фагоцитирующих клеток; у носителей генетического перевеса в сторону IL-1β фагоцитоз протекает более интенсивно; у носителей генетически обусловленного перевеса в сторону выработки IL-1RA фагоцитоз замедлен или снижен, что может являться причиной торможения элиминации патогенна из очага воспаления, а тем самым способствовать хронизации гнойного процесса.
После проведенного лечения получили следующие данные.
Носители гаплотипов «1/1»IL-1β+«1/1»IL-1RA, «1/2»IL-1β+«1/1»IL-1RA и «2/2»IL-1β+«1/1»IL-1RA имели уровень ответа на опсонизированный зимозан выше, чем носители «1/1»IL-1β+«2/2»IL-1RA, «1/2»IL-1β+«1/2»IL-1RA и «1/2»IL-1β+«2/2»IL-1RA.
В группах с более высоким уровнем ответа на опсонизированный зимозан через семь дней показатели функциональной активности нейтрофилов быстрее приходили к нормальным показателям под действием рекомбинантного IL-1β (БЕТАЛЕЙКИНА).
При наличии у цитокина (агониста) медиатора-антагониста, подавляющего функции агониста, для более точного прогноза определяли характер носительства сочетаний генов агониста и антагониста.
При выявлении у пациента сочетаний «1/1» гена агониста (IL-1β) и «1/1», «1/2» или «2/2» гена антагониста (IL-1RA) предсказывают высокую эффективность терапии, обусловленную активацией фагоцитарной активности нейтрофилов.
При выявлении у пациента сочетаний «2/2» гена агониста (IL-1β) и «1/1» или «1/2» антагониста (IL-1RA) предсказывают низкую эффективность терапии рекомбинантным IL-1β.
Вышеуказанные данные получены при генотипировании 250 человек.
Контрольную группу составили 152 донора. В качестве маркера высокопродуцирующего варианта гена IL-1β определялась замена нуклеотидов С/Т в позиции (+3953) методом ОТ-ПЦР (RELF-PCR), в качестве маркера IL-1RA - наличие тандемных повторов по 86 п.о. (VNTR) методом ПЦР (PCR).
Статистическую обработку результатов осуществляли с использованием точного метода Фишера, критериев Манна-Уитни и Крускала-Уоллеса, регрессии Кокса.
Следует отметить, что совместное носительство гомозиготных вариантов «2/2» генов IL-1β и IL-1RA у больных и доноров в наших исследованиях не встречалось.
Таким образом, выявление аллелей IL-1β(+3953)+, IL-1RA*2 и функционально полярных генотипов в отношении выработки соответствующих белков позволяет предсказать усиление функциональной активности фагоцитирующих клеток нейтрофильного звена иммунитета при введении препарата БЛ.
Анализ представленных данных показывает, что введение экзогенного IL-1β регулирует описанный дисбаланс воспалительного ответа у носителей сочетаний генов IL-1β и IL-1RA.
Применение БЛ в лечении больных ХГРС показало, что этот препарат высокоэффективен для носителей нормального и гетерозиготного варианта гена IL-1β и варианта IL-1RA*2. В течение 2-5 дней терапия больных, являющихся носителями таких генотипов, приводила к полному исчезновению гнойного отделяемого и прекращению воспалительного процесса в верхнечелюстных пазухах, что подтверждается хемолюминесцентным методом.
Введение экзогенного IL-1β оказывало стимулирующее воздействие на функции иммунной системы таких пациентов, регулировало соотношение IL-1RA и IL-1β в сыворотке крови и очаге воспаления путем усиления фагоцитоза и тем самым элиминации патогенна из организма, активируя функциональное состояние иммунного ответа непосредственно в очаге воспаления и ускорение завершения гнойно-воспалительного процесса в околоносовых пазухах.
После терапии БЛ у большинства больных возврата заболевания в течение 1,5 лет не наблюдалось.
Таким образом, для пациентов с ХГРС, являющихся согласно проведенному генотипированию носителями полиморфного варианта гена IL-1RA*2, терапия БЛ являлась высокоэффективным способом иммунокоррекции.
Кроме того, для лиц, чувствительных к терапии БЛ после первого применения, этот препарат является одним из эффективных средств при рецидивировании заболевания.
А присутствие в генотипе высокопродуцирующего варианта гена про- или противовоспалительного цитокина является фактором, определяющим неэффективность дополнительного введения в организм с целью иммунотерапии рекомбинантного аналога этого цитокина, и может вызывать выраженный побочный эффект.
Способ поясняется следующими примерами.
Пример 1
Больная Селькина Т.Г. обратилась в ФГУ «Санкт-Петербургский НИИ уха, горла, носа и речи» с жалобами на слизисто-гнойное отделяемое из носа, чувство стекания по задней стенке глотки, слабость, быструю утомляемось. Больной себя считает с детства. Число рецидивов заболевания - 5-6 раз в год.
При обследовании компьютерная томография выявила картину двустороннего гаймороэтмоидита с наличием жидкостного содержимого в верхнечелюстных пазухах и клетках решетчатого лабиринта. Объективно:
слизистая застойная с синюшным оттенком, отек не выражен. В общих носовых ходах - гнойное отделяемое. Под средней носовой раковиной - гнойные полоски. Произведена пункция верхнечелюстных пазух, получен густой вязкий гной зеленого цвета в количестве приблизительно 4 мл. Поставлен диагноз - двусторонний гнойный гаймороэтмоидит.
Назначено лечение: БЛ в дозе 10 нг в 1 мл изотонического раствора однократно ежедневно после промывания пазух изотоническим раствором.
Больная по данным генотипирования является носителем гетерозиготного гена IL-1β и гомозиготного по высокопродуцирующему варианту гена IL-1RA*2 («1/2»IL-1β+«2/2»IL-1RA).
По данным исследования ХЛ больная имеет средний уровень ответа - так уровень спонтанной ЛЗХЛ равнялся 5,9 имп/с; а уровень ЛЗХЛ в ответ на oпс. Зимозан 14,3 имп/с; уровень ЛЗХЛ в ответ на ФМА был 40,5 имп/с. Данный факт указывал на незначительную фагоцитарную активность нейтрофилов, на степень активизации местно в очаге воспаления у больной, являющейся носителем генотипа «1/1»IL-1β+«2/2»IL-1RA.
После третьего введения препарата больная отметила улучшение состояния, уменьшилось гнойное отделяемое. После четвертого (и последнего) применения БЛ промывная жидкость не содержит патологических