Профилактическое средство против васкулита
Иллюстрации
Показать всеИзобретение относится к области медицины и касается профилактического средства против васкулита. Сущность изобретения включает профилактическое и/или терапевтическое средство против васкулита, включающее антитело к рецептору интерлейкина-6 (IL-6) в качестве активного ингредиента а также способ предупреждения и/или лечения васкулита. Преимущество изобретения заключается в разработке нового средства, обладающего терапевтической эффективностью при лечении васкулита. 3 н. и 36 з.п. ф-лы, 6 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение имеет отношение к новому профилактическому и/или терапевтическому средству против васкулита.
Уровень техники
Васкулит является одним из трудноизлечимых патологических состояний, обычно наблюдаемых при аутоиммунных заболеваниях, и многие его случаи трудно поддаются лечению с помощью общепринятых терапевтических способов, таких как применение стероидов и иммунодепрессантов, и поэтому происходил поиск новых терапевтических способов. При васкулитном синдроме возникает воспаление в артериях различных размеров и лихорадка, боль в мышцах и суставах, окклюзия сосудов, язвы кожи, и может развиваться множественный мононеврит. Васкулит включает трудноизлечимый васкулитный синдром, такой как нодозный полиартериит и синдром аортита. Поражения нодозным полиартериитом характеризуются некротическими воспалениями средней оболочки стенки кровеносного сосуда и адвентиции.
Аортит также называют артериитом Такаясу. Предполагают, что патология васкулита связана с IL-6. Например, Noris et al. сообщили, что уровень IL-6 в крови увеличивается у пациентов с артериитом Такаясу в активной стадии патологии по сравнению с нормальными здоровыми людьми (Circulation 1999 Jul 6; 100 (1); 55-60). Однако в этой статье также сообщается, что концентрация в сыворотке крови RANTES, одного из хемокинов, также увеличивается. Noris et al. также предположили возможность того, что эти цитокины отвечают за васкулитные поражения у пациентов с артериитом Такаясу.
Раскрытие изобретения
В статье, однако, не делается никаких упоминаний о возможности того, что артериит Такаясу можно лечить, ингибируя IL-6. Поэтому настоящее изобретение обеспечивает профилактические и/или терапевтические средства против васкулита, включающие антагонист IL-6 в качестве активного ингредиента.
После интенсивного и обширного исследования авторы настоящего изобретения продемонстрировали, что IL-6 является обязательным участником в патологии васкулита и что антагонист IL-6 обладает терапевтическим эффектом при васкулите. К удивлению, в исследовании, проведенном авторами настоящего изобретения, было обнаружено, что если связывание IL-6 с его рецептором ингибировалось антителом к рецептору IL-6, уровень IL-6 в крови per se уменьшался. Таким образом, было показано, что терапия, основанная на ингибировании IL-6, не только сама по себе обладает противовоспалительным эффектом при васкулите, но также лечит васкулит, действуя на саму суть заболевания.
Таким образом, настоящее изобретение обеспечивает профилактическое и/или терапевтическое средство против васкулита, указанное средство включает в качестве активного ингредиента антагонист интерлейкина-6 (IL-6).
Настоящее изобретение обеспечивает профилактическое и/или терапевтическое средство против васкулита, устойчивого к стероидам и/или иммунодепрессантам, указанное средство включает в качестве активного ингредиента антагонист интерлейкина-6 (IL-6).
Указанный выше васкулит представляет собой, например, нодозный полиартериит, синдром аортита или васкулит, который ассоциирован с иммунологическими аномалиями. Синдром аортита также называют артериитом Такаясу. В качестве васкулита, ассоциированного с иммунологическими аномалиями, например, можно упомянуть васкулит, ассоциированный с ревматизмом, и васкулит, ассоциированный с системной красной волчанкой (SLE).
Указанный выше антагонист IL-6 представляет собой, например, антитело к IL-6 или антитело к рецептору IL-6, предпочтительно моноклональное антитело к рецептору IL-6. Указанное антитело к рецептору IL-6 наиболее предпочтительно представляет собой моноклональное антитело к человеческому рецептору IL-6, например антитело РМ-1, или моноклональное антитело к мышиному рецептору IL-6, например антитело MR16-1. Указанное выше антитело к рецептору IL-6 предпочтительно является рекомбинантным антителом.
Указанное антитело к рецептору IL-6 может быть химерным антителом, гуманизированным антителом или человеческим антителом. В качестве применяемого здесь антитела наиболее предпочтительным является гуманизированное антитело РМ-1.
Настоящее изобретение может также иметь следующие аспекты.
(1) Применение антагониста интерлейкина-6 (IL-6) для изготовления профилактического и/или терапевтического средства против васкулита.
(2) Применение антагониста интерлейкина-6 (IL-6) для изготовления профилактического и/или терапевтического средства против васкулита, обладающего устойчивостью к стероидам и/или иммунодепрессантам.
(3) Применение по (1) или (2), в которых указанный васкулит является нодозным полиартериитом.
(4) Применение по (1) или (2), в которых указанный васкулит является синдромом аортита.
(5) Применение по (1) или (2), в которых указанный васкулит является васкулитом, ассоциированным с иммунологическими аномалиями.
(6) Применение по любому из (1)-(5), в которых указанный антагонист IL-6 является антителом к рецептору IL-6.
(7) Применение по (6), в котором указанное антитело к рецептору IL-6 является моноклональным антителом к рецептору IL-6.
(8) Применение по (6), в котором указанное антитело к рецептору IL-6 является моноклональным антителом к человеческому рецептору IL-6.
(9) Применение по (6), в котором указанное антитело к рецептору IL-6 является моноклональным антителом к мышиному рецептору IL-6.
(10) Применение по любому из (6)-(9), в которых указанное антитело к рецептору IL-6 является рекомбинантным антителом.
(11) Применение по (8), в котором указанное моноклональное антитело к человеческому рецептору IL-6 является антителом РМ-1.
(12) Применение по (8), в котором указанное моноклональное антитело к мышиному рецептору IL-6 является антителом MR16-1.
(13) Применение по любому из (6)-(12), в которых указанное антитело к рецептору IL-6 является химерным антителом, гуманизированным антителом или человеческим антителом.
(14) Применение по (13), в котором указанное гуманизированное антитело к рецептору IL-6 является гуманизированным антителом РМ-1.
(15) Способ предупреждения и/или лечения васкулита, включающий введение антагониста интерлейкина-6 (IL-6).
(16) Способ предупреждения и/или лечения васкулита, обладающего устойчивостью к стероидам и/или иммунодепрессантам, включающий введение антагониста интерлейкина-6 (IL-6).
(17) Способ по (15) или (16), в которых указанный васкулит является нодозным полиартериитом.
(18) Способ по (15) или (16), в которых указанный васкулит является синдромом аортита.
(19) Способ по (15) или (16), в которых указанный васкулит является васкулитом, ассоциированным с иммунологическими аномалиями.
(20) Способ по любому из (15)-(19), в которых указанный антагонист IL-6 является антителом к рецептору IL-6.
(21) Способ по (20), в котором указанное антитело к рецептору IL-6 является моноклональным антителом к рецептору IL-6.
(22) Способ по (20), в котором указанное антитело к рецептору IL-6 является моноклональным антителом к человеческому рецептору IL-6.
(23) Способ по (20), в котором указанное антитело к рецептору IL-6 является моноклональным антителом к мышиному рецептору IL-6.
(24) Способ по любому из (20)-(23), в которых указанное антитело к рецептору IL-6 является рекомбинантным антителом.
(25) Способ по (22), в котором указанное моноклональное антитело к человеческому рецептору IL-6 является антителом РМ-1.
(26) Способ по (23), в котором указанное моноклональное антитело к мышиному рецептору IL-6 является антителом MR1.
(27) Способ по любому из (20)-(26), в которых указанное антитело к рецептору IL-6 является химерным антителом, гуманизированным антителом или человеческим антителом.
(28) Способ по (27), в котором указанное гуманизированное антитело к рецептору IL-6 является гуманизированным антителом РМ-1.
Краткое описание фигур
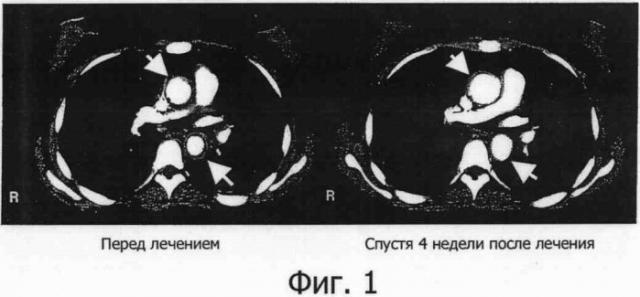
Фигура 1 представляет собой фотографию, показывающую результат компьютерной томографии (СТ) при лечении васкулитного синдрома с помощью гуманизированного антитела IL-6R, на которой верхняя стрелка указывает на восходящую часть дуги аорты и нижняя стрелка указывает на нисходящую часть аорты.
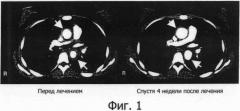
Фигура 2 представляет собой фотографию, показывающую результат СТ при лечении васкулитного синдрома с помощью гуманизированного антитела IL-6R, на которой стрелка указывает на арку аорты.
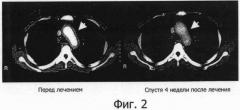
Фигура 3 представляет собой фотографию, показывающую результат СТ при лечении васкулитного синдрома с помощью гуманизированного антитела IL-6R, на которой верхняя стрелка указывает на восходящую часть дуги аорты и нижняя стрелка указывает на нисходящую часть аорты.
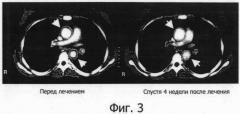
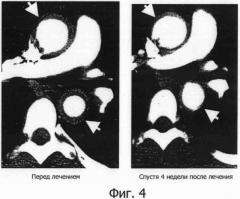
Фигура 4 представляет собой фотографию, показывающую результат СТ при лечении васкулитного синдрома с помощью гуманизированного антитела IL-6R, на которой верхняя стрелка указывает на восходящую часть дуги аорты и нижняя стрелка указывает на нисходящую часть аорты.
Фигура 5 представляет собой фотографию, показывающую результат СТ при лечении васкулитного синдрома с помощью гуманизированного антитела IL-6R, на которой стрелка указывает на арку аорты.
Фигура 6 представляет собой фотографию, показывающую результат СТ при лечении васкулитного синдрома с помощью гуманизированного антитела IL-6R, на которой верхняя стрелка указывает на восходящую часть дуги аорты, а нижняя стрелка указывает на нисходящую часть аорты.
Осуществление изобретения
IL-6 представляет собой цитокин, который также называют фактором-2, стимулирующим В-клетки (BSF2), или интерлейкином β2. IL-6 был открыт как фактор дифференцировки, вовлеченный в активацию В-лимфатических клеток (Hirano, Т. et al., Nature (1986) 324, 73-76). Впоследствии было обнаружено, что IL-6 является полифункциональным цитокином, который влияет на различные функции клеток (Akira, S. et al., Adv. in Immunology (1993) 54, 1-78). Было показано, что IL-6 индуцирует созревание Т-лимфатических клеток (Lotz, M. et al., J. Exp. Med. (1988) 167, 1253-1258).
IL-6 сообщает клеткам свою биологическую активность через два типа белков клетки. Один из них - рецептор IL-6, лиганд-связывающий белок с молекулярной массой около 80 кДа, к которому присоединяется IL-6 (Taga, Т. et al., J. Exp. Med. (1987) 166, 967-981; Yamasaki, К. et al., Science (1987) 241, 825-828). Рецептор IL-6 встречается не только в мембраносвязанной форме, которая проникает и экспрессируется в клеточной мембране, но также в виде растворимого рецептора IL-6, в основном состоящего из внеклеточной части рецептора.
Другой белок представляет собой мембраносвязанный белок gp130, имеющий молекулярную массу около 130 кДа, который вовлечен в передачу сигнала без связывания лигандов. IL-6 и рецептор IL-6 образуют комплекс IL-6/рецептор IL-6, который после связывания с gp130 передает клетке биологически активный сигнал IL-6 (Taga, Т. et al., Cell (1989) 58, 573-581).
Антагонист IL-6 представляет собой вещество, которое ингибирует передачу биологически активного сигнала IL-6. В качестве антагонистов IL-6 до настоящего времени были известны антитело к IL-6 (анти-IL-6 антитело), антитело к рецептору IL-6 (анти-IL-6-рецепторное антитело), антитело к gp130 (анти-gp130 антитело), измененный IL-6, неполные пептиды IL-6 или неполные пептиды рецептора IL-6 и т.п.
Антитело к рецептору IL-6 описано в нескольких работах (Novick, D. et al., Hybridoma (1991) 10, 137-146, Huang, Y.W. et al., Hybridoma (1993) 12, 621-630, International Patent Publication WO 95-09873, French Patent Application FR 2694767, United States Patent US 521628). Гуманизированное антитело к РМ-1 было получено путем пересадки участка, определяющего комплементарность (CDR), одного из антител такого типа, мышиного антитела РМ-1 (Hirata, Y. et al., Immunology (1989) 143, 2900-2906), в антитело человека (International Patent Publication WO 92-19759).
Указанный антагонист IL-6 предпочтительно является антителом к рецептору IL-6, предпочтительно моноклональным антителом к человеческому рецептору IL-6 или моноклональным антителом к мышиному рецептору IL-6. Указанное выше моноклональное антитело к человеческому рецептору IL-6 можно проиллюстрировать на примере антитела РМ-1, а указанное выше моноклональное антитело к мышиному рецептору IL-6 можно проиллюстрировать на примере антитела MR16-1. Указанное антитело предпочтительно является химерным антителом, гуманизированным антителом или человеческим антителом, например гуманизированным антителом РМ-1.
Антагонисты IL-6 для применения в настоящем изобретении могут быть любого происхождения, любого вида и любой формы, до тех пор, пока они полезны в качестве активного ингредиента для профилактического или терапевтического эффекта при васкулите.
Антагонисты IL-6 блокируют передачу сигнала от IL-6 и ингибируют биологическую активность IL-6. Антагонисты IL-6 предпочтительно являются веществами, обладающими активностью, ингибирующей любой из IL-6, рецептора IL-6 и gp130. В качестве антагонистов IL-6 могут быть упомянуты, например, антитело к IL-6, антитело к рецептору IL-6, антитело к gp130, измененный IL-6, измененный растворимый рецептор IL-6, неполный пептид IL-6 или неполный пептид рецептора IL-6 и вещества с низкой молекулярной массой, обладающие такой же активностью, как и они.
Антитела к IL-6 для применения в настоящем изобретении можно получить в виде поликлональных или моноклональных антител с помощью известного метода. В качестве антител к IL-6 в настоящем изобретении предпочтительно применяются моноклональные антитела, в особенности антитела млекопитающих. Моноклональные антитела млекопитающих включают антитела, продуцируемые гибридомой, и рекомбинатное антитело, продуцируемое «хозяином», который был трансформирован с помощью экспрессионного вектора, включающего генетически сконструированные гены антител. Эти антитела, связываясь с IL-6, блокируют связывание IL-6 с рецептором IL-6 и, таким образом, блокируют передачу биологически активного сигнала IL-6 в клетку.
Примеры таких антител включают антитело МН166 (Matsuda Т. et al., Eur. J. Immunol. (1988) 18, 951-956) и антитело SK2 (Sato, К. et al., The 21st Nihon Menekigakkai Soukai (General Meeting of the Japan Immunology Society), Academic Record (1991) 21, 166) и т.п.
Гибридому, продуцирующую антитело к IL-6, можно в основном сконструировать, используя известную процедуру, описанную ниже. Таким образом, в качестве сенсибилизирующего антигена можно применять IL-6 и иммунизировать им с помощью традиционного метода иммунизации. Полученные таким образом иммунные клетки сливают с известными родительскими клетками в обычном процессе клеточного слияния, и затем, для получения требуемой гибридомы, клетки, продуцирующие моноклональное антитело, отбирают с помощью традиционных методов скрининга.
В частности, антитело к IL-6 можно получить следующим способом. Например, человеческий IL-6, применяемый в качестве сенсибилизирующего антигена для получения антитела, можно получить, используя ген/аминокислотную последовательность IL-6, раскрытую в Eur. J. Biochem. (1987) 168, 543-550, J. Immunol. (1988) 140, 1534-1541 или в Agr. Biol. (1990) 54, 2685-2688.
После трансформации подходящей клетки-хозяина с помощью вставки генной последовательности IL-6 в известную систему экспрессионного вектора интересующий белок IL-6 очищают из клетки-хозяина или супернатанта культуры его клеток, и очищенный белок IL-6 может быть использован в качестве сенсибилизирующего антигена. Альтернативно, в качестве сенсибилизирующего антигена можно использовать белок, образованный слиянием IL-6 и другого белка.
Антитела к рецептору IL-6 для применения в настоящем изобретении могут быть получены в виде поликлональных или моноклональных антител с использованием известного метода. В качестве антител к IL-6 для применения в настоящем изобретении предпочтение имеют моноклональные антитела, в особенности антитела млекопитающих. Моноклональные антитела млекопитающих включают антитела, продуцируемые гибридомой, и антитела, продуцируемые «хозяином», который был трансформирован с помощью экспрессионного вектора, включающего генетически сконструированные гены антитела. Эти антитела, связываясь с рецептором IL-6, блокируют связывание IL-6 с рецептором IL-6 и, таким образом, блокируют передачу биологически активного сигнала IL-6 в клетку.
Примеры таких антител включают антитело MR16-1 (Tamura, Т. et al., Proc. Natl. Acad. Sci. USA (1993) 90, 11924-11928), антитело РМ-1 (Hirata, Y. et al., J. Immunol. (1989) 143, 2900-2906) или антитело AUK12-20, антитело AUK64-7 или антитело AUK146-15 (International Patent Publication WO 92-19759) и т.п. Среди них наиболее предпочтительным является антитело РМ-1.
В этой связи клеточная линия гибридомы РМ-1, которая продуцирует антитело РМ-1, была депонирована для международного признания 12 июля 1989 года в соответствии с условиями Будапештского договора как FERM ВР-2998 в Patent Microorganism Depository of National Institute of Industrial Science and Technology, Chuo 6, 1-1, Higashi 1-chome, Tsukuba city, Ibaraki pref., Japan. Клеточная линия гибридомы, которая продуцирует антитело MR16-1, была депонирована для международного признания 13 марта 1997 года в соответствии с условиями Будапештского договора как FERM BP-5875 в Patent Microorganism Depository of National Institute of Industrial Science and Technology, Chuo 6, 1-1, Higashi 1-chome, Tsukuba city, Ibaraki pref., Japan.
Гибридомы, продуцирующие моноклональное антитело к рецептору IL-6, могут быть получены в основном с помощью известной процедуры, описанной ниже. Таким образом, в качестве сенсибилизирующего антигена применяют рецептор IL-6, и им иммунизируют с помощью обычного метода иммунизации. Полученные таким образом иммунные клетки сливают с известными родительскими клетками в обычном процессе клеточного слияния, и затем для получения требуемой гибридомы клетки, продуцирующие моноклональное антитело, отбирают с помощью традиционного метода скрининга.
В частности, антитело к рецептору IL-6 можно получить следующим способом. Например, человеческий рецептор IL-6, применяемый в качестве сенсибилизирующего антигена для получения антитела, можно получить, используя ген/аминокислотную последовательность рецептора IL-6, раскрытую в European Patent Application EP 325474, и мышиный рецептор IL-6 можно получить, используя последовательность гена и аминокислотную последовательность рецептора IL-6, раскрытую в Japanese Unexamined Patent Publication (Kokai) 3-155795.
Существует два типа белков рецептора IL-6: рецептор IL-6, экспрессированный на клеточной мембране и рецептор IL-6, отделенный от клеточной мембраны (растворимый рецептор IL-6) (Yasukawa К. et al., J. Biochem. (1990) 108, 673-676). Растворимый рецептор IL-6 формируется в значительной степени из внеклеточного участка рецептора IL-6, связанного с клеточной мембраной, и, таким образом, отличается от мембрано-связанной формы рецептора IL-6 тем, что растворимый рецептор не содержит трансмембранный участок или трансмембранный участок вместе с внутриклеточным участком. В качестве белка рецептора IL-6 можно использовать любой рецептор IL-6 до тех пор, пока его можно применять в качестве сенсибилизирующего антигена для получения антитела к рецептору IL-6 для применения в настоящем изобретении.
После того как последовательность гена рецептора IL-6 включают в известную экспрессионную векторную систему для трансформации подходящей клетки-хозяина, требуемый белок рецептора IL-6 может быть очищен из клетки-хозяина или из его клеточной культуры с помощью известного метода, и очищенный белок рецептора IL-6 может быть использован в качестве сенсибилизирующего антигена. Альтернативно, в качестве сенсибилизирующего антигена можно использовать клетки, экспрессирующие рецептор IL-6, или белок, образованный слиянием белка рецептора IL-6 и другого белка.
Е. coli, которая имеет плазмиду pIBIBSF2R, содержащую кДНК, кодирующую рецептор IL-6 человека, была депонирована для международного признания 9 января 1989 года в соответствии с условиями Будапештского договора как FERM ВР-2232 в Patent Microorganism Depository of National Institute of Industrial Science and Technology, Chuo 6, 1-1, Higashi 1-chome, Tsukuba city, Ibaraki pref., Japan.
Антитела к gp130 для применения в настоящем изобретении могут быть получены в виде поликлональных или моноклональных антител с использованием известного метода. В качестве антител к gp130 для применения в настоящем изобретении предпочтительно используют моноклональные антитела, в особенности антитела млекопитающих. Моноклональные антитела млекопитающих включают антитела, продуцируемые гибридомой, и антитела, продуцируемые «хозяином», который был трансформирован с помощью экспрессионного вектора, включающего генетически сконструированные гены антитела. Антитела, связываясь с gp130, блокируют связывание комплекса IL-6/рецептор IL-6 с gp130 и, таким образом, блокируют передачу биологически активного сигнала IL-6 в клетку.
Примеры таких антител включают антитело АМ64 (Japanese Unexamined Patent Publication (Kokai) 3-219894), антитело 4В11 и антитело 2Н4 (US 5571513), антитело В-S12 и антитело В-Р8 (Japanese Unexamined Patent Publication (Kokai) 8-291199).
Гибридома, продуцирующая моноклональное антитело к gp130, может быть получена, в основном, с помощью известной процедуры, описанной ниже. Таким образом, gp130 применяют в качестве сенсибилизирующего антигена и используют для иммунизации с помощью обычного метода иммунизации. Полученные таким образом иммунные клетки сливают с известными родительскими клетками в обычном процессе клеточного слияния, и затем для получения желаемой гибридомы клетки, продуцирующие моноклональное антитело, отбирают с помощью традиционного метода скрининга.
В частности, моноклональное антитело можно получить следующим способом. Например, gp130, применяемый в качестве сенсибилизирующего антигена для получения антитела, можно получить, используя ген/аминокислотную последовательность gp130, раскрытую в European Patent Application EP 411946.
После того как подходящую клетку-хозяина трансформируют путем включения последовательности гена gp130 в известную экспрессионную векторную систему, интересующий белок gp130 очищают из клетки-хозяина или из его клеточной культуры. Очищенный рецепторный белок gp130 может быть использован в качестве сенсибилизирующего антигена. Альтернативно, в качестве сенсибилизирующего антигена можно использовать белок, образованный слиянием белка gp130 и другого белка.
Хотя выбор млекопитающих, применяемых для иммунизации, специально не ограничен, их предпочтительно выбирают из соображений их совместимости с родительскими клетками, используемыми для клеточного слияния. Обычно они включают грызунов, таких как мыши, крысы, хомяки и т.п.
Иммунизацию животных сенсибилизирующим антигеном проводят, используя известный способ. Общий способ, например, включает внутрибрюшинное или подкожное введение млекопитающим сенсибилизирующего антигена. В частности, сенсибилизирующий антиген, который был разведен и суспендирован в подходящем количестве фосфатно-солевого буфера (PBS) или физиологического раствора и т.д., смешивают по желанию с подходящим количеством обычного адъюванта, например полного адъюванта Фрейнда. После эмульгирования он вводится млекопитающему предпочтительно в несколько приемов каждые 4-21 дня. Альтернативно, во время иммунизации сенсибилизирующим антигеном может быть использован подходящий носитель.
После иммунизации и подтверждения того, что в сыворотке крови повысился уровень требуемого антитела, иммунные клетки извлекают из млекопитающего и подвергают клеточному слиянию. Предпочтительными иммунными клетками, подвергавшимися клеточному слиянию, являются, в частности, клетки селезенки.
Клетки миеломы млекопитающих как другой тип родительских клеток, которые сливают с упомянутыми выше иммунными клетками, предпочтительно включают различные известные клеточные линии, такие как P3X63Ag8.653 (Kearney, J. F. et al., J. Immunol. (1979) 123, 1548-1550), P3X63Ag8U.1 (Current Topics in Microbiology and Immunology (1978) 81, 1-7), NS-1 (Kohler, G. and Milstein, C., Eur. J. Immunol. (1976) 6, 511-519), MPC-11 (Margulies, D.H. et al., Cell (1976) 8, 405-415), SP2/0 (Shulman, M. et al., Nature (1978) 276, 269-270), FO (de St. Groth, S.F. et al., J. Immunol. Methods (1980) 35; 1-21), S194 (Trowbridge, I.S, J. Exp. Med. (1978) 148, 313-323), R210 (Galfre, G. et al., Nature (1979) 277; 131-133) и т.п.
Слияние клеток между указанными выше иммунными клетками и клетками миеломы по существу может быть проведено в соответствии с известным способом, таким как способ, описанный в работе Milstein et al. (Kohler, G. and Milstein, С., Methods Enzymol. (1981) 73, 3-46) и т.п.
Более конкретно, указанное слияние клеток проводят в подходящем питательном бульоне в присутствии, например, катализатора клеточного слияния. В качестве катализатора клеточного слияния, например, можно использовать полиэтиленгликоль (ПЭГ), вирус Сендай (HVJ) и нечто подобное, и, кроме того, чтобы усилить эффективность слияния, по желанию можно добавлять адъювант, такой как диметилсульфоксид и т.д.
Предпочтительное соотношение используемых иммунных клеток и клеток миеломы составляет, например, от 1- до 10-кратного избытка иммунных клеток по отношению к клеткам миеломы. Примеры культуральных сред, применяемых для указанного выше клеточного слияния, включают среду RPMI1640 и культуральную среду MEM, подходящую для роста указанных выше клеточных линий миеломы, а также обычную культуральную среду, используемую для такого типа клеточной культуры, и, помимо этого, можно вводить сывороточные добавки, такие как фетальная сыворотка теленка (FCS).
При слиянии клеток предварительно определенное количество иммунных клеток и клеток миеломы тщательно смешивают в указанных выше культуральных жидкостях, к которым добавляют предварительно прогретый до 37°С раствор ПЭГ, например раствор ПЭГ с молекулярной массой от 1000 до 6000 в концентрации от 30 до 60% (мас./об.), и перемешивают для образования требуемых слитых клеток (гибридома). Затем, с помощью процедуры повторного последовательного добавления подходящей культуральной среды и центрифугирования для удаления супернатанта, можно удалить вещества, вызывающие клеточное слияние, и т.п., присутствие которых нежелательно для роста гибридомы.
Указанная выше гибридома может быть отобрана с помощью культивирования в обычной селекционной среде, например в культуральной среде HAT (культуральная жидкость, содержащая гипоксантин, аминоптерин и тимидин). Культивирование в указанной культуральной среде HAT продолжают обычно в течение времени, достаточного для гибели клеток, не являющихся клетками требуемой гибридомы (неслившиеся клетки), и которое обычно длится от нескольких дней до нескольких недель. Используют обычный метод предельных разведений, с помощью которого отбирают гибридомы, продуцирующие желаемое антитело, и моноклонально клонируют.
Кроме получения указанной выше гибридомы с помощью иммунизации антигеном животного, не являющегося человеком; также можно сенсибилизировать in vitro лимфоциты человека требуемым антигеном или клетками, экспрессирующими требуемый антиген; полученные сенсибилизированные В-лимфоциты сливают с клетками миеломы человека, например с клетками U266, для получения требуемого человеческого антитела, обладающего активностью связывания с требуемым антигеном или клетками, экспрессирующими требуемый антиген (см. Japanese Post-examined Patent Publication (Kokoku) No. 1-59878). Кроме этого, чтобы получить требуемое человеческое антитело с помощью способа, описанного выше (см. International Patent Publication WO 93/12227, WO 92/03918, WO 94/25585, WO 96/34096, WO 96/33735), антигеном или клетками, экспрессирующими антиген, можно иммунизировать трансгенное животное, имеющее набор всех генов антител человека.
Сконструированную таким образом гибридому, продуцирующую моноклональное антитело, можно субкультивировать в обычной культуральной жидкости или можно хранить длительное время в замороженном состоянии при температуре жидкого азота.
Чтобы получить моноклональные антитела из указанной гибридомы, можно использовать способ, в котором гибридому культивируют обычным образом и получают антитела в виде супернатанта, или с помощью способа, в котором гибридому вводят и выращивают в животных-млекопитающих, совместимых с указанной гибридомой, а антитела получают в виде асцита. Первый способ подходит для получения высокоочищенных антител, тогда как последний способ подходит для производства больших количеств антител.
Например, гибридому, продуцирующую антитело к рецептору IL-6, можно сконструировать, используя способ, раскрытый в Japanese Unexamined Patent Publication (Kokai) 3-139293. Ее можно сконструировать с помощью способа, в котором гибридому, продуцирующую антитело РМ-1, которая была депонирована для международного признания 12 июля 1989 года в соответствии с условиями Будапештского договора как FERM ВР-2998 в Patent Microorganism Depository of National Institute of Industrial Science and Technology, Chuo 6, 1-1, Higashi 1-chome, Tsukuba city, Ibaraki pref., Japan, вводят внутрибрюшинно мышам BALB/c для получения асцитов, из которых очищают антитело РМ-1; или с помощью способа, в котором указанную гибридому культивируют в подходящей культуральной среде, такой как среда RPMI1640, содержащая 10%-ную бычью фетальную сыворотку и 5%-ный MB-Condimed HI (производство фирмы «Boehringer Mannheim»), или гибридомная среда SFM (производство фирмы «GIBCO-BRL»), или среда PFHM (производство фирмы «GIBCO-BRL») и т.п., и затем антитело РМ-1 можно очистить из супернатанта.
Рекомбинантное антитело, которое было получено с помощью технологии рекомбинантных генов, в которой ген антитела был клонирован из гибридомы и интегрирован в подходящий вектор, который затем был введен в хозяина, может быть использовано в настоящем изобретении как моноклональное антитело (см., например, Borrebaeck C.A.K. and Larrick J.W. THERAPEUTIC MONOCLONAL ANTIBODIES, published in the United Kingdom by MACMILLAN PUBLISHERS LTD., 1990).
В частности, мРНК, кодирующую вариабельную (V) область желаемого антитела, выделяют из клеток, продуцирующих антитело, таких как гибридома. Выделение мРНК проводят, получая суммарный препарат РНК, с использованием, например, известного способа, такого как метод ультрацентрифугирования в присутствии гуанидина (Chirgwin, J.M. et al., Biochemistry (1979) 18, 5294-5299), метода AGPC (Chomczynski, P. et al., Anal. Biochem. (1987) 162, 156-159), и затем мРНК получают из суммарного препарата РНК, используя набор mRNA Purification Kit (фирма «Pharmacia») и сходные наборы. Альтернативно, мРНК можно выделить непосредственно, используя набор QuickPrep mRNA Purification Kit (фирма «Pharmacia»).
кДНК V-области антитела можно синтезировать из полученной таким способом мРНК, используя обратную транскриптазу. кДНК можно синтезировать, используя набор AMV Reverse Transcriptase First-strand cDNA Synthesis Kit и сходные наборы. Альтернативно, для синтеза и амплификации кДНК можно использовать набор 5'-Ampli FINDER RACE Kit (фирма «Clontech»), и метод 5'-RACE (Frohman, M.A. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 8998-9002; Belyavsky, A. et al., Nucleic Acids Res. (1989) 17, 2919-2932), в котором используется полимеразная цепная реакция (ПЦР). Требуемый фрагмент ДНК очищают из продукта ПЦР, и его можно лигировать в вектор ДНК. Кроме того, из него конструируют рекомбинантный вектор и вводят его в Е. coli и т.д., из которой отбирают колонии для получения требуемого рекомбинантного вектора. Последовательность оснований требуемой ДНК может быть подтверждена с помощью известного способа, такого как дидезокси-метод секвенирования.
После получения ДНК, кодирующей V-область требуемого антитела, ее можно лигировать в молекулу ДНК, кодирующую константную область (С-область) требуемого антитела, которую затем интегрируют в экспрессионный вектор. Альтернативно, ДНК, кодирующую V-область антитела, можно интегрировать в экспрессионный вектор, содержащий ДНК, кодирующую С-область антитела.
Чтобы продуцировать антитело для применения в настоящем изобретении, ген антитела интегрируют, как описано ниже, в экспрессионный вектор для того, чтобы он экспрессировался под контролем экспрессионного регуляторного участка, например энхансера и/или промотора. Затем экспрессионный вектор может быть трансформирован в клетку-хозяина, и в ней затем может экспрессироваться антитело.
В соответствии с настоящим изобретением в целях снижения гетерологичной антигенности у человека можно применять искусственно измененное рекомбинантное антитело, такое как химерное антитело, гуманизированное антитело и человеческое антитело. Эти модифицированные антитела можно получать, применяя известные методы.
Химерное антитело можно получить с помощью лигирования полученной таким образом ДНК, кодирующей V-область антитела, в ДНК, кодирующую С-область человеческого антитела, которую затем интегрируют в экспрессионный вектор и вводят в «хозяина» для продуцирования в нем антитела (см. European Patent Application EP 125023 и International Patent Publication WO 92-19759). С использованием этого известного способа можно получить химерное антитело, полезное в настоящем изобретении.
Например, плазмида, которая содержит ДНК, кодирующую L-цепь V-области или Н-цепь V-области химерного антитела РМ-1, была обозначена как pPM-k3 или рРМ-h1 соответственно, и штаммы Е. coli, имеющие эти плазмиды, были депонированы для международного признания 12 февраля 19991 года в соответствии с условиями Будапештского договора как NCIMB 40366 и NCIMB 40362 соответственно. National Collections of Industrial and Marine Bacteria Limited (23 St Machar Drive, Aberdeen, Scotland, AB2 1RY, United Kingdom of Great Britain and Northern Ireland).
Гуманизированное антитело, которое также называют человеческим антителом с измененной формой, может быть получено с помощью переноса участка, определяющего комплементарность антитела (CDR) млекопитающего, но не человека, например мышиного антитела, в CDR человеческого антитела. Общепринятая технология рекомбинантных ДНК для получения таких антител также известна (см. European Patent Application EP 125023 и International Patent Publication WO 92-19759).
В частности, последовательность ДНК, которая была сконструирована для лигирования CDR мышиного антитела без нарушения рамки считывания (FR) человеческого антитела, синтезируется из отдельных олигонуклеотидов, имеющих на концах перекрывающиеся области. Полученную таким образом ДНК лигируют в ДНК, кодирующую С-область человеческого антитела, и затем объединяют в экспрессионный вектор, который вводят в «хозяина» для продукции антитела (см. European Patent Application EP 239400 и International Patent Publication WO 92-19759).
Чтобы получить FR человеческого антитела, дотированного в CDR-участке, выбирали участок, определяющий комплементарность, формирующий подходящий участок связывания антигена. При желании можно было заменить аминокислоты без нарушения рамки считывания в вариабельном участке антитела, так чтобы участок, определяющий комплементарность человеческого антитела с измененной формой, мог образовать соответствующее место связывания антигена.
Например, для химерного антитела или гуманизированного антитела используют С-область человеческого антитела. В качестве С-области человеческого антитела могут быть использованы Сγ и Сγ1, Сγ2, Сγ3 и Сγ4, которые следует упомянуть в качестве примеров. С-область человеческого антитела можно модифицировать для улучшения стабильности антитела или его продукции.
Химерное антитело состоит из вариабельной области антитела, происходящего из млекопитающих, отличных от человека, и С-области, происходящей из человеческого антитела, тогда как гуманизированное антитело состоит из участка, определяющего комплементарность антитела, происходящего из млекопитающих, отличных от человека, а также каркасной области и С-области, происходящих из человеческого антитела, В соответствии с этим их антигенность в организме человека снижена таким образом, что они полезны в качестве антител для применения в настоящем изобретении.
В качестве предпочтительного воплощения гуманизированного антитела для применения в настоящем изобретении можно упомянуть гуманизированное антитело РМ-1 (см. International Patent Publication WO 92-19759).
Кроме того, в дополнение к способам, описанным выше, для получения человеческого антитела известна технология, использующая пэннинг с помощью библиотеки человеческих антител. Например, чтобы пометить фаг, который связывается с антигеном, вариабельную область человеческого антитела экспрессируют на поверхности фага в виде отдельной цепи антитела (scFv), используя метод фагового дисплея. С помощью анализа гена выделенного фага можно определить последовательность ДНК, кодирующую вариабельную область человеческого антитела, которое связывается с антигеном. После того как последовательность ДНК цепи scFv, которая связывает антиген, выяснена, можно сконструировать подходящий экспрессионный вектор, который содержит указанную последовательность, и использовать его в дальнейшем для получения человеческого антитела. Эти способы уже известны и их можно найти в WO 92/01047, WO 92/20791, WO 92/06213, WO 92/11236, WO 92/19172, WO 92/01438 и WO 92/15388.
Гены антител, сконструированные, как было описано выше, можно экспрессировать и получить с помощью известного метода. В случае клеток млекопитающих экспрессию можно осуществить, используя вектор, включающий обычно используемый полезный промотор, экспрессируемый ген антитела, ДНК, к 3'-концу которой функционально присоединена сигнальная последовательность поли-А, или вектор, включающий указанную ДНК. Примеры промотора/энхансера включают немедленный ранний промотор/энхансер цитомегаловируса человека.
Кроме того, в качестве промотора/энхансера, которые могут быть использованы для экспрессии антитела для применения в настоящем изобретении, можно использовать вир