Способы и композиции для индукции апоптоза раковых клеток
Иллюстрации
Показать всеИзобретение относится к области медицины и касается способов и композиций для индукции апоптоза раковых клеток. Сущность изобретения включает модифицированные антитела-агонисты к DR-5, которые в сочетании с апоптоз-индуцирующими агентами синергетически индуцируют апоптоз раковых клеток. Преимущество изобретения заключается в усилении противоопухолевой активности. 7 н. и 12 з.п ф-лы, 4 табл., 35 ил.
Реферат
Перекрестные ссылки на родственные заявки
Данная заявка притязает на приоритет четырех предварительных заявок на патент США: 60/504901, поданной 22 сентября, 2003 г.; 60/494714, поданной 12 августа 2003 г.; 60/448,960, поданной 21 февраля 2003 г.; и 60/429,842, поданной 27 ноября 2002 г., каждая из которых для всех целей полностью включена в настоящее описание в качестве ссылки.
Предпосылки создания изобретения
Апоптоз представляет собой высококонсервативный процесс запрограммированной гибели клеток, важный для развития и тканевого гомеостаза всех многоклеточных организмов. Изменения апоптозного пути, препятствующие или замедляющие нормальное обновление клеток, могут быть столь же важны для патогенеза болезней, как и аномалии в регуляции клеточного цикла. Аналогично клеточному делению, которое контролируется комплексом взаимосвязей между регуляторными белками клеточного цикла, апоптоз в нормальных условиях регулируется путем взаимодействия продуктов генов, которые либо препятствуют, либо индуцируют гибель клеток.
Связанный с TNF апоптоз-индуцирующий лиганд (TNF-related apoptosis-inducing ligand, TRAIL, также называемый Apo2L) является представителем семейства цитокинов TNF. При связывании с DR4 или DR5, двумя представителями суперсемейства TNF-рецепторов, TRAIL индуцирует гибель клеток в результате апоптоза (см., например Pan и др. Science 277, 1997, cc.815-818; Sheridan и др., Science 277, 1997, cc.818-821 3; Walczak и др., ЕМВО J. 16, 1997, cc.5386-5397 4). Установлено, что in vitro TRAIL уничтожает опухолевые клетки, но является относительно нетоксичным для здоровых клеток.
Для лечения рака необходимо разработка новых терапевтических методов лечения. Задачей настоящего изобретения является решение этой и других проблем.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способам индукции апоптоза раковых клеток. В некоторых вариантах осуществления изобретения способ заключается в том, что клетку приводят в контакт с (I.) агонистом, представляющим собой агент, который обладает аффинностью к DR4 или к DR5, характерной для антитела к DR4 или к DR5 (агент-агонист); и (II.) апоптоз-индуцирующим агентом. В некоторых вариантах осуществления изобретения агонист представляет собой антитело к DR5. В некоторых вариантах осуществления изобретения антитело к DR5 обладает специфичностью связывания, характерной для антитела, которое содержит вариабельную область тяжелой цепи, несущую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 несет вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 представляет собой антитело А. В других вариантах осуществления изобретения агонист представляет собой антитело к DR4.
В некоторых вариантах осуществления изобретения клетку приводят в контакт с агонистом, представляющим собой антитело к DR4 (агонистическое антитело к DR4, антитело-агонист к DR4), и агонистом, представляющим собой антитело к DR5 (агонистическое антитело к DR5, антитело-агонист к DR5).
В некоторых вариантах осуществления изобретения агонист представляет собой гуманизированное антитело. В некоторых вариантах осуществления изобретения агонист представляет собой одноцепочечное антитело.
В некоторых вариантах осуществления изобретения агент предотвращает или снижает экспрессию BCL-2 или UbcH10. В других вариантах осуществления изобретения агент препятствует активации NFκB. В некоторых вариантах осуществления изобретения агент препятствует расщеплению IkВ. В некоторых вариантах осуществления изобретения агент представляет собой ингибитор протеосомы. В некоторых вариантах осуществления изобретения ингибитор протеосомы выбран из группы, включающей PS-341, MG-262 и MG-132.
В некоторых вариантах осуществления изобретения агент представляет собой ингибитор белка-ингибитора апоптоза (IAP). В других вариантах осуществления изобретения этот ингибитор представляет собой SMAC или миметик SMAC.
В других вариантах осуществления изобретения агент представляет собой ингибитор полипептида, выбранного из группы, включающей плексин В1 (PLXNB1); несущий SET-домен белок 7 (SET7); киназу 5 киназы активируемой митогеном протеинкиназы (МАР3К5); SТЕ20-подобную киназу (JIК); сериновую/треониновую киназу 1, связывающую МАР-киназу (MKNK1); предполагаемый трансмембранный белок эндоплазматического ретикулума с несколькими связями (RFT1); 5-киназу типа I, гамма (PIP5K1C); активируемую протеинкиназой, активируемой митогеном, протеинкиназу 2 (МАРКАРК2); киназу 5 активируемой митогеном протеинкиназы (МАР2К5); зависящую от циклина киназу 6 (CDK6); рецептор 1 активина А, подобный рецептору типа II (ACVRL1); гомолог онкогена вируса Гарднера-Рашида саркомы кошачьих (v-fgr) (FGR); гипотетический белок FLJ21802 (FLJ21802); тирозинкиназу мышечно-скелетных рецепторов (MUSK); открытую рамку считывания 88 хромосомы 20 (C20orf88); при почковании не ингибируемый бензимидазолами гомолог 1 (гомолог дрожжей) (BUB1); полипептид 5 рибосомной протеин-S6-киназы, 90 кДа (RPS6KA5); связанный с вирусом саркомы Ямагучи гомолог онкогена v-yes-1 (LYN); активируемую митогеном протеинкиназу 7 (МАРК7) и гомолог 1 онкогена вируса мышиной тимомы v-akt (AKT1).
В некоторых вариантах осуществления изобретения агент представляет собой активатор полипептида, выбранного из группы, включающей: распознающую сигнал частицу с молекулярной массой 72 кДа (SRP72); каспазу-8; Bid; В-лимфоидную тирозинкиназу (BLK); генный продукт, аналогичный пируваткиназе, изозим М2 (LOC148283); киназу 3 альфа гликогенсинтазы (GSK3A); гипотетический белок FLJ32312 (FLJ32312); активируемую митогеном протеинкиназу 10 (МАРК10); TCF4 (фактор транскрипции 4), гомолог 2 онкогена вируса мышиного лейкоза Абелсона (Abelson) v-ab1 (arg, Abelson-родственный ген) (ABL2); гомолог 1 онкогена вируса саркомы птиц v-ros UR2 (ROS1) и гомолог онкогена вируса миелоцитоматоза птиц v-myc.
В некоторых вариантах осуществления изобретения раковая клетка представляет собой клетку рака ободочной кишки или клетку рака поджелудочной железы.
В других вариантах осуществления изобретения агент представляет собой антагонист РАК1. В некоторых вариантах осуществления изобретения агент представляет собой антагонист полипептида, выбранного из группы, включающей UbcH10, nsurf, stk12, Ask1 и JIIK. В других вариантах осуществления изобретения агент представляет собой молекулу siPHK (малая обладающая способностью к интерференции РНК).
Настоящее изобретение относится также к способам индукции апоптоза раковых клеток у индивидуума, который нуждается в этом. В некоторых вариантах осуществления изобретения способ заключается в том, что индивидууму вводят терапевтически эффективное количество (I.) агониста, представляющего собой агент, который обладает аффинностью к DR4 или к DR5, характерной для антитела к DR4 или к DR5, и (II.) апоптоз-индуцирующего агента.
В некоторых вариантах осуществления изобретения агонист и агент вводят раздельно. В других вариантах осуществления изобретения агонист и агент вводят в смеси. В некоторых вариантах осуществления изобретения агонист представляет собой антитело к DR-5. В некоторых вариантах осуществления изобретения антитело к DR5 обладает специфичностью связывания, характерной для антитела, которое содержит вариабельную область тяжелой цепи, несущую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 несет вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 представляет собой антитело А. В других вариантах осуществления изобретения агонист представляет собой антитело к DR4. В некоторых вариантах осуществления изобретения клетку приводят в контакт с агонистом, представляющим собой антитело к DR4, и агонистом, представляющим собой антитело к DR5.
В некоторых вариантах осуществления изобретения агонист представляет собой гуманизированное антитело. В некоторых вариантах осуществления изобретения агонист представляет собой одноцепочечное антитело.
В некоторых вариантах осуществления изобретения агент предотвращает или снижает экспрессию BCL-2 или UbcH10. В других вариантах осуществления изобретения агент препятствует активации NFκB. В других вариантах осуществления изобретения агент препятствует расщеплению IkВ. В некоторых вариантах осуществления изобретения агент представляет собой ингибитор протеосомы. В некоторых вариантах осуществления изобретения ингибитор протеосомы выбран из группы, включающей PS-341, MG-262 и MG-132.
В некоторых вариантах осуществления изобретения агент представляет собой ингибитор белка-ингибитора апоптоза (IAP). В некоторых вариантах осуществления изобретения этот ингибитор представляет собой SMAC или миметик SMAC.
В некоторых вариантах осуществления изобретения раковая клетка представляет собой клетку рака ободочной кишки или клетку рака поджелудочной железы. В других вариантах осуществления изобретения агент представляет собой антагонист РАК1. В некоторых вариантах осуществления изобретения агент представляет собой антагонист полипептида, выбранного из группы, включающей UbcH10, nsurf, stk12, Ask1 и JIK. В других вариантах осуществления изобретения агент представляет собой молекулу siPHK.
Настоящее изобретение относится также к физиологической композиции, содержащей терапевтически эффективное количество (I.) агониста, представляющего собой агент, который обладает аффинностью к DR4 или к DR5, характерной для антитела к DR4 или к DR5; и (II.) апоптоз-индуцирующего агента.
В некоторых вариантах осуществления изобретения агонист представляет собой антитело к DR-5. В некоторых вариантах осуществления изобретения антитело к DR5 обладает специфичностью связывания, характерной для антитела, которое содержит вариабельную область тяжелой цепи, несущую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 несет вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 представляет собой антитело А. В других вариантах осуществления изобретения агонист представляет собой антитело к DR4. В некоторых вариантах осуществления изобретения клетку приводят в контакт с антителом-агонистом к DR4 и антителом-агонистом к DR5.
В некоторых вариантах осуществления изобретения агонист представляет собой гуманизированное антитело. В некоторых вариантах осуществления изобретения агонист представляет собой одноцепочечное антитело.
В некоторых вариантах осуществления изобретения агент предотвращает или снижает экспрессию BCL-2 или UbcH10. В других вариантах осуществления изобретения агент препятствует активации NFκB. В других вариантах осуществления изобретения агент препятствует расщеплению IκВ. В некоторых вариантах осуществления изобретения агент представляет собой ингибитор протеосомы. В некоторых вариантах осуществления изобретения ингибитор протеосомы выбран из группы, включающей PS-341, МО-262 и MG-132.
В некоторых вариантах осуществления изобретения агент представляет собой ингибитор белка-ингибитора апоптоза (IAP). В некоторых вариантах осуществления изобретения этот ингибитор представляет собой SMAC или миметик SMAC.
В других вариантах осуществления изобретения агент представляет собой антагонист РАК1. В некоторых вариантах осуществления изобретения агент представляет собой антагонист полипептида, выбранного из группы, включающей UbcH10, nsurf, stk12, Ask1 и JIK. В других вариантах осуществления изобретения агент представляет собой молекулу siPHK.
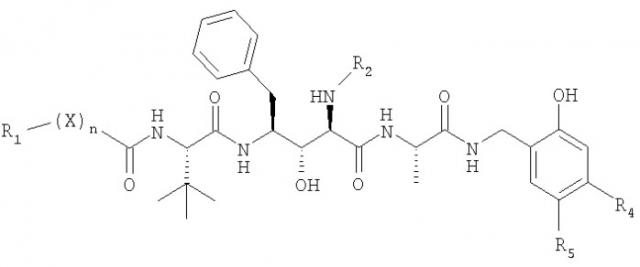
Настоящее изобретение относится также к обладающим аффинностью агентам со специфичностью связывания, характерной для антитела, которое содержит вариабельную область тяжелой цепи, несущую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения обладающие аффинностью агенты представляют собой антитела, несущие вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35.
Настоящее изобретение относится также к клеткам, экспрессирующим антитело, которое несет вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35.
Настоящее изобретение относится также к способам индукции апоптоза раковых клеток, заключающимся в том, что клетку приводят в контакт с обладающим аффинностью агентом со специфичностью связывания, характерной для антитела, которое несет вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения агонист представляет собой антитело к DR-5. В некоторых вариантах осуществления изобретения антитело к DR5 обладает специфичностью связывания, характерной для антитела, которое несет вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 несет вариабельную область тяжелой цепи, содержащую последовательность, которая представлена на фиг.24 или фиг.35, и вариабельную область легкой цепи, представленную на фиг.25 или фиг.35. В некоторых вариантах осуществления изобретения антитело к DR5 представляет собой антитело А.
Определения
Понятие «антитело» относится к полипептиду, который содержит каркасный участок, кодируемый геном иммуноглобулина или его фрагмента, который специфически связывается с антигеном и распознает его. Известные гены иммуноглобулинов включают гены константных областей каппа, лямбда, альфа, гамма, дельта, эпсилон и мю, а также множество генов вариабельных областей иммуноглобулинов. Легкие цепи классифицируются как каппа- или лямбда-цепи. Тяжелые цепи классифицируются как гамма-, мю-, альфа-, дельта- или эпсилон-цепи, что в свою очередь определяет классы иммуноглобулинов IgG, IgM, IgA, IgD и IgE соответственно.
Встречающиеся в естественных условиях иммуноглобулины имеют общую основную структуру, в которой две идентичные легкие цепи (с молекулярной массой примерно 24 кДа) и две идентичные тяжелые цепи (с молекулярной массой примерно 55 или 70 кДа) формируют тетрамер. N-концевую область каждой цепи называют вариабельной (V) областью, и она отличается от остальных более консервативных константных (С) областей каждой цепи. В вариабельной области легкой цепи присутствует С-концевой участок, который называют J-участком. В вариабельной области тяжелой цепи помимо J-участка присутствует D-участок. Большинство вариаций аминокислотной последовательности иммуноглобулинов затрагивает три отделенных друг от друга участка в V-областях, которые называют гипервариабельные участки (CDR), они непосредственно участвуют в связывании антигена. Эти три участка, начиная с N-конца, обозначают CDR1, CDR2 и CDR3 соответственно. CDR сохраняют свое положение с помощью более консервативных каркасных участков (FR). Эти участки, начиная с N-конца, обозначают FR1, FR2, FR3 и FR4 соответственно. Локализация CDR- и FR-участков и система их нумерации предложена Кэботом с соавторами (Kabat и др.. Sequences of Proteins of Immunological Interest, 5-ое изд., U.S. Department of Health and Human Services, U.S. Government Printing Office (1991)).
Приведенная в качестве примера структурная единица иммуноглобулина (антитела) содержит тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, каждая пара несет одну «легкую» (с молекулярной массой примерно 25 кДа) и одну «тяжелую» цепь (с молекулярной массой примерно 50-70 кДа). N-конец каждой цепи содержит вариабельную область, состоящую примерно из 100-110 или большее количество аминокислот, которая прежде всего ответственна за распознавание антигена. Понятия вариабельная область легкой цепи (VL) и вариабельная область тяжелой цепи (VH) относятся к указанным участкам легкой и тяжелой цепей соответственно.
Антитела существуют, например, в форме интактных иммуноглобулинов или в виде нескольких их фрагментов с хорошо известными характеристиками, которые получают расщеплением различными пептидазами. Так, например, пепсин расщепляет антитело за дисульфидными мостиками в шарнирной области, приводя к образованию F(аb)'2 - фрагмента, димера Fab, который сам представляет собой легкую цепь, связанную с vh-ch1 дисульфидной связью. F(ab)'2 может восстанавливаться в мягких условиях, при которых происходит расщепление дисульфидного мостика в шарнирной области, что приводит к превращению димера F(ab)'2 в мономер Fab'. Мономер Fab' представляет собой в основном Fab-фрагмент с частью шарнирной области (см. fundamental immunology (под ред. Paul, 3-е изд., 1993). Хотя обозначение различных фрагментов антитела определяется с точки зрения расщепления интактного антитела, специалисту в данной области должно быть очевидно, что такие фрагменты можно синтезировать de novo либо химически, либо с помощью рекомбинантной ДНК. Так, понятие антитело в контексте настоящего описания включает также фрагменты антитела, полученные либо путем модификации полных антител, либо синтезированные de novo с использованием методов рекомбинантной ДНК (например, одноцепочечный Fv), либо фрагменты, идентифицированные с помощью фаговых дисплейных библиотек (см., например, McCafferty и др., Nature 348, 1990, cc.552-554).
Для получения моноклональных или поликлональных антител можно использовать любой метод, известный в данной области (см., например, Kohler и Milstein, Nature 256, 1975, cc.495-497; Kozbor и др.. Immunology Today 4, 1983, с.72 (1983); Cole и др., в: Monoclonal Antibodies and Cancer Therapy, 1985, cc.77-96). Понятие «моноклональные» антитела относится к антителам, полученным из индивидуального клона. Методики получения одноцепочечных антител (US 4946778) можно адаптировать для получения антител к полипептидам, предлагаемых в настоящем изобретении. Кроме того, для экспрессии гуманизированных антител можно использовать трансгенных мышей или другие организмы, такие как другие млекопитающие. В другом варианте можно применять методики, основанные на использовании фаговых дисплейных библиотек, для идентификации антител и гетеромерных Fab-фрагментов, которые специфически связываются с выбранными антигенами (см., например, McCafferty и др. Nature 348, 1990, cc.552-554; Marks и др., Biotechnology 10, 1992, cc.779-783).
«Химерное антитело» представляет собой молекулу антитела, в которой (а) константная область или ее часть изменена, заменена или рекомбинирована так, что антигенсвязывающий центр (вариабельная область) связан с константной областью другого или измененного класса, эффекторной функцией и/или разновидностями, или с полностью отличной молекулой, которая придает новые свойства химерному антителу, например, с ферментом, токсином, гормоном, фактором роста, лекарственным средством и т.д.; или (б) вариабельная область или ее часть изменена, рекомбинирована или заменена вариабельной областью, имеющей другую или измененную антигенную специфичность.
«Гуманизированное» антитело представляет собой антитело, которое сохраняет реактивность антитела организма кроме человека, но которое обладает слабой имунногенностью для человека. Для достижения этого, например, можно сохранять CDR-участки организма кроме человека и заменять оставшиеся части антитела человеческими копиями (см., например, Morrison и др., Proc. Natl. Acad. Sci. USA, 81, 1984, cc.6851-6855; Morrison и Oi, Adv. Immunol., 44, 1988, cc.65-92; Verhoeyen и др., Science, 239, 1988, cc.1534-1536; Padlan, Molec. Immun., 28, 1991, cc.489-498; Padlan, Molec. Immun., 31(3), 1994, cc. 169-217).
Фраза «специфически (или избирательно) связывается» с антителом или «обладает специфической (или избирательной) иммунореактивностью с антителом» применительно к белку или пептиду относится к реакции связывания, которая позволяет выявлять присутствие белка в гетерологичной популяции белков и других биологических субстанций. Так, в определенных условиях иммунологического анализа связывание специфических антител с конкретным белком по меньшей мере в 2 раза превышает фоновое связывание, и они практически не связываются в значительной степени с другими белками, присутствующими в образце. Для специфического связывания с антителом в таких условиях может потребоваться антитело, отобранное на основе его специфичности к конкретному белку. Этот отбор можно осуществлять, отделяя антитела, которые дают перекрестную реакцию, например, с молекулами DR5, от других разновидностей. Целый ряд форматов иммунологического анализа можно применять для отбора антител, обладающих специфической иммунореактивностью с конкретным белком. Например, для отбора антител, обладающих специфической иммунореактивностью с конкретным белком, обычно применяют твердофазные иммуноферментные анализы (ELISA) (см., например, у Harlow и Lane, Antibodies A Laboratory Manual (1988) описание форматов иммунологических анализов и условия, которые можно применять для определения специфической иммунореактивности). Как правило, специфическая или избирательная реакция должна по меньшей мере в 2 раза превышать фоновый сигнал или шум и более предпочтительно превышать фоновый уровень более чем в 10-100 раз.
Понятия «пептидомиметик» и «миметик» относятся к синтетическому химическому соединению, которое имеет практически такие же структурные и функциональные характеристики, что и встречающийся в естественных условиях или не встречающийся в естественных условиях полипептид (например, SMAC). Пептидные аналоги, как правило, применяют в фармацевтической промышленности в качестве непептидных лекарственных средств, которые обладают свойствами, аналогичными свойствам основного пептида. Эти типы непептидных соединений обозначают как «пептидные миметики» или «пептидомиметики» (Fauchere J. Adv. Drug Res. 15, 1986, с.29; Veber и Freidinger TINS, 1985, с.392; и Evans и др. J. Med. Chem. 30, 1987, с.1229, публикации включены в настоящее описание в качестве ссылки). Пептидные миметики, которые структурно аналогичны применяемым в терапии пептидам, можно использовать для достижения эквивалентного или усиленного терапевтического или профилактического действия. Как правило, пептидомиметики структурно аналогичны полипептиду-образцу (т.е. полипептиду, который обладает биологической или фармакологической активностью), т.е. представляющему интерес полипептиду, но они несут одну или несколько пептидных связей, необязательно замененных связью, выбранной из группы, которая включает, например -CH2NH-, -CH2S-, -CH2-CH2-, -CH=CH- (цис- и транс), -COCH2-, -СН(ОН)СН2- и -CH2SO-. Миметик может либо полностью состоять из синтетических не встречающихся в естественных условиях аналогов аминокислот, либо представлять собой химерную молекулу, состоящую частично из аминокислот, которые входят в состав встречающихся в естественных условиях пептидов, и частично из не встречающихся в естественных условиях аналогов аминокислот. Миметик может включать также любое количество консервативных замен встречающихся в естественных условиях аминокислот, если такие замены не могут также в значительной степени изменять структуру/или активность миметика. Например, композиция миметика подпадает под объем изобретения, если он обладает по меньшей мере одним из видов связывающей или ферментативной активности представляющего интерес полипептида.
Понятие «siPHK» относится к малым способным к интерференции РНК, которые обладают способностью вызывать интерференцию и посттрансляционное молчание определенных генов в клетках, например клетках млекопитающих (включая человеческие клетки), и в организме, например организме млекопитающих (включая человека). Феномен интерференции РНК описан и его обсуждение проведено у Bass, Nature 411, 2001, cc.428-429; Elbahir и др., Nature 411, 2001, cc.494-498; и Fire и др., Nature 391, 1998, cc.806-811); и в WO 01/75164, где описаны также методы получения обладающих способностью к интерференции РНК. Основой siPHK являются последовательности и нуклеиновые кислоты, кодирующие генные продукты, представленные в настоящем описании, которые, как правило, состоят менее чем из 100 пар оснований и которые могут состоять, например, из 30 или менее пар оснований, и которые можно получать с использованием известных в данной области подходов, включая применение комплементарных цепей ДНК или методов синтеза. SiPHK могут вызывать интерференцию и посттрансляционное молчание определенных генов в клетках, например в клетках млекопитающих (включая человеческие клетки), и в организме, например организме млекопитающих (включая человека). Репрезентативные siPHK, предлагаемые в изобретении, могут иметь вплоть до 29, 25, 22, 21, 20, 15, 10, 5 пар оснований или любое целое число пар оснований примерно в этих пределах. Инструменты для создания оптимальных ингибирующих siPHK включают наборы, поставляемые фирмой DNAengine Inc. (Сиэтл, шт.Вашингтон) и фирмой Ambion, Inc. (Аустин, шт.Техас).
Один из методов создания ингибирующей РНК (PHKi) основан на применении генетических конструкций, в которых смысловые и антисмысловые последовательности помещают в область, фланкирующую интронную последовательность, в правильной сплайсинговой ориентации относительно сайтов сплайсинга донора и акцептора. В альтернативном варианте для разделения самокомплементарных областей последовательности в конструкции можно применять спейсерные последовательности различной длины. При процессинге транскрипта генной конструкции интронные последовательности удаляются сплайсингом, что дает возможность смысловым и антисмысловым последовательностям, а также последовательностям границы сплейсинга связываться с образованием двухцепочечной РНК. Затем определенные рибонуклеазы связываются с двухцепочечной РНК и расщепляют ее, инициируя тем самым каскад событий, приводящий к расщеплению специфических генных последовательностей мРНК и молчанию определенных генов.
Понятие «нуклеиновая кислота» относится к дезоксирибонуклеотидам или рибонуклеотидам и их полимерам либо в одноцепочечной, либо в двухцепочечной форме. Под понятие подпадают нуклеиновые кислоты, содержащие известные нуклеотидные аналоги или модифицированные каркасные остатки или связи, которые могут быть синтетическими, встречающимися в естественных условиях и не встречающимися в естественных условиях, могут обладать такой же способностью к связыванию, что и нуклеиновая кислота, с которой проводится сравнение, и метаболизируются аналогично нуклеотидам, с которыми проводится сравнение. Примеры таких аналогов включают (но, не ограничиваясь ими) фосфортиоаты, фосфорамидаты, метилфосфонаты, хиральные метилфосфонаты, 2-О-метилрибонуклеотиды, пептидонуклеиновые кислоты (ПНК).
Если не указано иное, то подразумевается, что конкретная нуклеотидная последовательность включает также ее консервативно модифицированные варианты (например, замены, связанные с вырожденностью генетического кода) и комплементарные последовательности, а также специально указанную последовательность. Так, замены, связанные с вырожденностью генетического кода, можно осуществлять, получая последовательности, в которых третье положение одного или нескольких (или всех) кодонов заменено смешанным основанием и/или дезоксиинозиновыми остатками (Batzer и др.. Nucleic Acid Res. 1991, с.15081; Ohtsuka и др., J. ВЫ. Chem. 260, 1985, cc.2605-2608; Rossolini и др., Mol. Cell. Probes 8, 1994, cc.91-98). Под понятие «нуклеиновая кислота» подпадают понятия ген, кДНК, мРНК, олигонуклеотид и полинуклеотид.
Понятия «полипептид», «пептид» и «белок» в контексте настоящего описания используют взаимозаменяемо для обозначения полимера, состоящего из аминокислотных остатков. Понятие применимо к аминокислотным полимерам, в которых один или несколько аминокислотных остатков представляют собой искусственный полученный химическим путем миметик соответствующей встречающейся в естественных условиях аминокислоты, а также к встречающимся в естественных условиях аминокислотным полимерам и не встречающимся в естественных условиях аминокислотным полимерам.
Понятие «аминокислота» относится к встречающимся в естественных условиях и синтетическим аминокислотам, а также к аминокислотным аналогам и аминокислотным миметикам, которые функционируют аналогично встречающимся в естественных условиях аминокислотам. Встречающиеся в естественных условиях аминокислоты представляют собой аминокислоты, кодируемые генетическим кодом, а также аминокислоты, которые впоследствии модифицируются, например, гидроксипролин, гамма-карбоксиглутамин и O-фосфосерин. Понятие «аминокислотные аналоги» относится к соединениям, которые имеют такую же основную химическую структуру, что и встречающаяся в естественных условиях аминокислота, т.е. имеют атом углерода в альфа-положении, который связан с водородом, карбоксильной группой, аминогруппой и R-группой, например гомосерин, норлейцин, метионинсульфоксид и метионинметилсульфоний. Такие аналоги несут модифицированные R-группы (например, норлейцин) или модифицированный пептидный каркас, но сохраняют такую же химическую структуру, что и встречающаяся в естественных условиях аминокислота. Понятие «аминокислотные миметики» относится к химическим соединениям, которые имеют структуру, отличную от общей химической структуры аминокислоты, но которые функционируют аналогично встречающейся в естественных условиях аминокислоте.
Понятие «консервативно модифицированные варианты» относится как к аминокислотным, так и к нуклеотидным последовательностям. Касательно конкретных нуклеотидных последовательностей консервативно модифицированные варианты относятся к таким нуклеиновым кислотам, которые кодируют идентичные или практически идентичные аминокислотные последовательности, или в случае, когда нуклеиновая кислота не кодирует аминокислотную последовательность, к практически идентичным последовательностям. Из-за вырожденности генетического кода любой конкретный белок кодирует большое количество функционально идентичных нуклеиновых кислот. Например, кодоны GCA, GCC, GCG и GCU все кодируют аминокислоту аланин. Таким образом, в каждом положении, в котором аланин кодируется кодоном, кодон можно заменять на любые соответствующие известные кодоны без изменения кодируемого полипептида. Такие варианты нуклеиновой кислоты являются «молчащими вариациями», которые представляют собой один из видов консервативно модифицированных вариантов. В контексте настоящего описания подразумевается, что каждая нуклеотидная последовательность, которая кодирует полипептид, включает также все возможные молчащие вариации нуклеиновой кислоты. Специалисту в данной области должно быть очевидно, что каждый кодон нуклеиновой кислоты (за исключением AUG, который, как правило, является единственным кодоном метионина, и TGG, который, как правило, является единственным кодоном триптофана) можно модифицировать с получением функционально идентичной молекулы. Таким образом, для каждой описанной последовательности подразумевается каждая молчащая вариация нуклеиновой кислоты, которая кодирует полипептид.
Касательно аминокислотных последовательностей специалисту в данной области должно быть очевидно, что индивидуальные замены, делеции или добавления в последовательности нуклеиновой кислоты, пептида, полипептида или белка, которые изменяют, добавляют или изымают одну аминокислоту или небольшой процент аминокислот в кодируемой последовательности, приводят к получению консервативно модифицированного варианта, в котором изменение приводит к замене аминокислоты на химически сходную аминокислоту. Перечень консервативных замен, обеспечивающий получение функционально аналогичных аминокислот, хорошо известен в данной области. Такие консервативно модифицированные варианты (и дополнительные варианты) не исключают полиморфные варианты, межвидовые гомологи и аллели, предлагаемые в изобретении.
Каждая из приведенных ниже 8 групп содержит аминокислоты, которые являются консервативными заменами друг друга:
1) аланин (А), глицин (G);
2) аспарагиновая кислота (D), глутаминовая кислота (Е);
3) аспарагин (N), глутамин (Q);
4) аргинин (R), лизин (К);
5) изолейцин (I), лейцин (L), метионин (М), валин (V);
6) фенилаланин (F), тирозин (Y), триптофан (W);
7) серин (S), треонин (Т) и
8) цистеин (С), метионин (М) (см., например, Creighton, Proteins (1984)).
В контексте настоящего описания понятие «процент идентичности последовательностей» означает величину, определяемую путем сравнения двух оптимальным образом сравниваемых последовательностей в окне сравнения, где фрагмент полинуклеотидной последовательности в окне сравнения может иметь вставки или делеции (т.е. бреши) по отношению к последовательности, с которой производится сравнение (например, последовательности полипептида, предлагаемого в изобретении), которая не имеет вставок или делеций, при оптимальном сравнении двух последовательностей. Процент рассчитывают путем определения количества положений, в которых в обеих последовательностях встречается идентичный нуклеотид или аминокислотный остаток, в результате чего получают количество совпадающих положений, деления количества совпавших положений на общее количество положений в окне сравнения и умножения результата на 100 для получения процента идентичности последовательностей.
Понятия «идентичный» или процент «идентичности» в отношении двух или более нуклеотидных или полипептидных последовательностей относится к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми. Две последовательности являются «практически идентичными», если две последовательности имеют определенный процент одинаковых аминокислотных остатков или нуклеотидов (т.е. идентичность на 60, необязательно идентичность на 65, 70, 75, 80, 85, 90 или 95% в определенной области или, если она не определена, в полной последовательности) при сопоставлении и сравнении с целью выявления максимального соответствия в окне сравнения или в предназначенной для этого области, что устанавливают с использованием одного из перечисленных ниже алгоритмов или путем сравнения вручную и визуального анализа. Изобретение относится к полипептидам или полинуклеотидам, которые являются практически идентичными полипептидам или полинуклеотидам, соответственно, приведенным в настоящем описании в качестве примеров (например, CDR, приведенным в качестве примеров на фиг.23-25). Необязательно идентичность имеет место в области длиной примерно 50 нуклеотидов или более предпочтительно в области длиной от 100 до 500 или 1000 или более нуклеотидов.
При сравнении последовательностей, как правило, одна последовательность представляет собой последовательность, с которой проводят сравнение (референс-последовательность), с которой сравнивают тестируемые последовательности. При использовании алгоритма сравнения тестируемую последовательность и референс-последовательность вводят в компьютер, при необходимости задают координаты подпоследовательности и параметры алгоритмической программы сравнения последовательностей. Можно использовать параметры программы, задаваемые по умолчанию, или альтернативные параметры. После этого алгоритм сравнения последовательностей рассчитывает на основе параметров программы процент идентичности для тестируемых последовательностей и референс-последовательности.
В контексте настоящего описания понятие «окно сравнения» относится к фрагменту, содержащему любое количество следующих непрерывно друг за другом положений, выбранных из группы, содержащей от 20 до 600, предпочтительно от примерно 50 до примерно 200, более предпочтительно от примерно 100 до примерно 150 положений, в которых можно сравнивать