Замещенные сульфоны и сульфоксиды, обладающие антиаритмической активностью, лекарственные средства и фармацевтические композиции на их основе
Иллюстрации
Показать всеИзобретение относится к классу серосодержащих соединений общей формулы R1-S(O)n-CH2-CH2-SR2, где n=1 или 2, при n=1 R2 =
(Х=Сl, Br, Н2РО4), R1 = низший алкил, замещенный или незамещенный арил; при n=2 R2=Н, C(O)CH3, SO3Na,
(Х=Сl, Вr, Н2РO4) R1 = нopмaльный или разветвленный алкил С1-С8, замещенный алкил; арил, замещенный арил, обладающих антиаритмической активностью, а также лекарственным средствам и фармацевтическим композициям на их основе. Заявляемые соединения в низких дозах обладают антиаритмической активностью, малотоксичны и могут использоваться в качестве действующих веществ в лекарственных средствах для лечения и профилактики нарушений сердечного ритма. 3 н. и 1 з.п. ф-лы, 11 ил., 1 табл.
Реферат
Изобретение относится к классу серосодержащих соединений -функционально замещенным сульфонам и сульфоксидам, проявляющим антиаритмические свойства, и лекарственным средствам и фармацевтическим композициям на их основе.
Нарушения ритма сердечной деятельности сопровождают практически все заболевания сердечно-сосудистой системы, обусловленные как органическими поражениями сердца, так и его функциональными расстройствами.
Современная кардиология располагает рядом высокоэффективных антиаритмических средств, которые на основании данных о механизмах действия разделяются на четыре класса:
I - препараты, оказывающие мембраностабилизирующее действие, такие как хинидин, прокаинамид, лидокаин и флекаинид;
II - блокаторы бета-адренергических рецепторов, наиболее распространенными из которых являются пропранолол (анаприлин, обзидан), окспренолол (тразикор), пиндолол (вискен) и талинолол (корданум);
III - амиодарон и амиодароноподобные препараты;
IV - антагонисты кальция, такие как верапамил, нифедипин (фенигидин, коринфар) и прениламин (коронтин).
Однако известные аритмические средства не в полной мере удовлетворяют требованиям клиники, поскольку они оказывают неблагоприятное влияние на гемодинамику из-за угнетения сократимости миокарда, снижения артериального давления, ухудшения коронарного кровотока, что препятствует их применению при выраженной сердечной недостаточности [1, 2].
Кроме того, для антиаритмических препаратов) I класса свойственны такие побочные эффекты, как желудочковая тахикардия, атриовентрикулярный блок, развитие декомпенсации, иммуногемолитической анемии, агранулоцитоза и синдрома красной волчанки [3].
Среди нежелательных побочных эффектов антиаритмических препаратов других классов следует отметить токсико-аллергические поражения кожи, гипогликемию, гиперлипидемию, гепатотоксические эффекты, нарушение сердечной проводимости, нарушение функции тромбоцитов и другие [4-8].
В последние годы описаны различные производные сульфонамидов, обладающие антиаритмическими свойствами, однако ни одно из них не используется в практической медицине в качестве лекарственного средства для лечения нарушений сердечного ритма (заявки на Европейский патент №№233051, 244115, 285323, 286278, 307121, 324543, 332570; патенты США №№4372955, 4396622).
Задачей настоящего изобретения является создание новых веществ, обладающих антиаритмической активностью, а также лекарственных средств и фармацевтических композиций на их основе, лишенных отмеченных выше нежелательных эффектов.
В соответствии с настоящим изобретением получен новый класс антиаритмических серосодержащих соединений - функционально замещенные сульфоны и сульфоксиды формулы (I):
,
где R1 = нормальный или разветвленный алкил C1-C8, замещенный алкил; арил, замещенный арил; n=1, 2.
R2=H, -SO3Na, (X=Cl, Br, H2PO4)
Наиболее предпочтительными из соединений (I) являются те, у которых
R1 - нормальный или разветвленный алкил C1-C5,
R2=Н, С(O)СН3, SO3Na,
n=2.
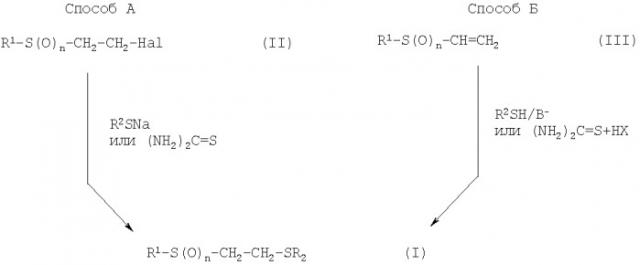
Соединения формулы (I) могут быть синтезированы различными способами. Выбор пути синтеза зависит от заместителей в формуле (I).
Схема иллюстрирует, но не ограничивает способы получения соединений формулы (I) по настоящему изобретению.
Схема получения соединений формулы (I)
Согласно способу А процесс проводят путем взаимодействия при нагревании 2-галогенэтилсульфонов (II, n=2) или -сульфоксидов (II, n=1) с соответствующими серосодержащими соединениями в водной, органической или водно-органической среде. В качестве органического растворителя применяют диоксан, спирты, ДМФА или подобные растворители. Целевые продукты выделяют обычными способами и при необходимости перекристаллизовывают.
Согласно способу Б процесс осуществляют путем взаимодействия винилсульфонов (III, n=2) или сульфоксидов (III, n=1) с соответствующими серосодержащими соединениями. При этом для получения соединений (I), где R2=С(O)СН3, взаимодействие проводят в присутствии щелочного катализатора (тритон Б, амины и другие основания) в среде апротонного растворителя, спирта или без него.
Для получения соединений (I), где R2=C(NH2)2 +X-, взаимодействие проводят в присутствии кислоты НХ в водной или в водно-органической среде. Целевой продукт выделяют известными методами.
Соединения (I), где R2=SO3Na, n=2, получают при взаимодействии винилсульфона с тиосульфатом натрия в водном буферном растворе.
Для получения соединений (I), где R2=Н, предпочтительным способом является метанолиз соответствующих этилтиолацетатов по схеме:
Процесс проводят при кипячении тиолацетатов в абсолютном метиловом спирте в присутствии HCl. Целевые продукты в зависимости от заместителя R1 выделяют либо перегонкой в вакууме, либо кристаллизацией.
Строение соединений (I) подтверждено данными ИК-, 1Н ЯМР-спектроскопии и химического анализа, приведенными в разделе «Примеры».
ИК-спектры зарегистрированы на приборах UR-20 и Specord М-82 в прессовке с KBr (кристаллические вещества) или в тонком слое (жидкости).
1Н ЯМР-спектры зарегистрированы на спектрометрах Bruker WM-250 (250 MHz) и АМ300 (300 MHz) в растворе CDCl3 (для неионогенных соединений) и ДМСО-d6 или D2O (для ионогенных соединений). Химические сдвиги сигналов приведены в δ-шкале относительно сигнала растворителя: для ДМСО-d6 - 2.52 м.д., для D2O - 4.72 м.д., для CDCl3 - 7.27 м.д.
Исходные вещества для синтеза заявляемых соединений (I) галогенэтилсульфоны и -сульфоксиды (II), а также винилсульфоны и -сульфоксиды (III) получают известными способами:
- соединения (II), где n=1, и соединения (III), где n=1, - избирательным окислением сульфидов R1-S-СН2-СН2-Hal и R1-S-СН=СН2 перекисью водорода в среде уксусного ангидрида [9] или перуксусной кислотой в среде хлороформа [10];
- соединения (II), где n=2, - избирательным окислением сульфида R1-S-СН2-СН2-Hal перекисью водорода в уксусной кислоте [11];
- соединения (III), где n=2, - избирательным окислением винилсульфидов R1-S-СН=СН2 70-80% перекисью водорода в среде третичного бутилового спирта в присутствии катализатора SeO2 при температуре 60-70°С [12].
Изучение антиаритмической активности заявляемых соединений проводили на моделях нарушения сердечного ритма. В качестве моделей использовали бариевую модель аритмии на кроликах и крысах, а также аконитиновую модель аритмии на крысах. Указанные модели аритмий моделируют тяжелые, в большинстве случаев несовместимые с жизнью нарушения ритма сердечной деятельности у человека и широко применяются при поиске антиаритмических препаратов [13].
Изменения ритма сердечной деятельности при использовании указанных моделей аритмий у животных регистрировали электрокардиографически во II-ом стандартном отведении на электрокардиографах ЭЛКАР-2 и ЭК IT-04; мониторные наблюдения проводили с помощью электрокардиоскопа ЭКС 2-01.
Бариевая модель аритмии на кроликах.
Внутривенное введение интактным кроликам хлористого бария в дозе 6 мг/кг вызывает политопную желудочковую аритмию, обусловленную нарушением автоматизма сердца, изменением возбудимости миокарда и характеризующуюся тахиаритмией и желудочковой экстрасистолией. Аритмия у кроликов возникала в течение ближайших 15-20 сек после введения хлористого бария и продолжалась около 1 часа, в среднем 46,4±4,2 мин, в отдельных случаях (около 20%) заканчивалась гибелью животных. Кардиограммы представлены на фиг.1-4.
Бариевая модель аритмии на крысах.
Внутривенное введение хлористого бария в дозе 20 мг/кг наркотизированным гексеналом крысам (75 мг/кг внутрибрюшинно) вызывает нарушение ритма сердечных сокращений, сходное с аритмией у кроликов после введения хлористого бария в дозе 6 мг/кг. Однако электрокардиографическая картина нарушения ритма сердечных сокращений у крыс под влиянием хлористого бария в дозе 20 мг/кг характеризуется более тяжелым течением, чем у кроликов (увеличение процента животных с трепетанием и фибрилляцией желудочков). Аритмия возникает через 10-15 сек после введения хлористого бария и, по данным электрокардиографии, отмечается на протяжении 42,7±5,2 мин, после чего наблюдается восстановление синусового ритма или в 85% случаев гибель животных. Типичная кардиограмма представлена на фиг.5.
Аконитиновая модель ариитмии на крысах.
Внутривенное введение наркотизированным крысам (гексенал 75 мг/кг внутрибрюшинно) аконитина бромгидрата в дозе 40 мкг/кг вызывает желудочковую экстрасистолию, быстро переходящую в тахисистолию, трепетание, мерцание и фибрилляцию желудочков, приводящих более чем в 90% случаев к гибели животных. Аритмия возникает через 1-2 мин после введения аконитина и продолжается в случае отсутствия фибрилляции желудочков в среднем 49,3±5,4 мин. Кардиограммы представлены на фиг.6-8.
После записи фоновой электрокардиограммы (ЭКГ) подопытным животным внутривенно медленно (в течение 20 сек) вводили растворы хлористого бария или аконитина бромгидрата в соответствующих дозах 6 мг/кг, 20 мг/кг и 40 мкг/кг. Через 2 мин после введения аритмогенных веществ на фоне развившейся аритмии внутривенно вводили изучаемые соединения в дозах 0,01-0,1 от ЛД50 (для мышей при внутрибрюшинном введении), после чего через 1, 2, 5, 10, 15, 20, 30, 45 и 60 мин проводили запись ЭКГ. Мониторные наблюдения вели непрерывно в течение 1-1,5 часа эксперимента. Кардиограммы представлены на фиг.1-8.
Каждую дозу соединения испытывали на 4-10 животных. Эффективность антиаритмического действия оценивали по длительности аритмии и проценту животных, у которых аритмия полностью снималась.
На основании нескольких серий экспериментов, в которых исследовались антиаритмические свойства различных доз изучаемых веществ, методом пробит-анализа по Литчфилду и Уилкоксону определяли дозу, снимающую аритмию у 50% животных - ЕД50 [14].
Изучение антиаритмических свойств заявляемых соединений проводили в сравнении с известными и применяемыми в медицинской практике антиаритмическими средствами - препаратом хинидиноподобного действия новокаинамидом (I класс), бета-адреноблокаторами пропранололом (Обзидан, фиг.9), пиндололом (Вискен, фиг.9 и 10), пенбуталолом (Бетапрессин) (II класс), препаратом III класса - амиодароном и антагонистом кальция верапамилом (IV класс, фиг.11).
Исследование токсичности с использованием метода пробит-анализа по Литчфилду и Уилкоксону показало, что заявляемые соединения при внутрибрюшинном введении мышам являются малотоксичными веществами, среднесмертельные дозы (ЛД50) которых составляют 170-1420 мг/кг (табл.1).
В экспериментах на моделях бариевой аритмии у кроликов и крыс, а также на модели аконитиновой аритмии у крыс, установлено, что все заявляемые соединения обладают выраженными антиаритмическими свойствами. В зависимости от величины испытанных доз и модели аритмии введение заявляемых соединений на фоне развившейся тяжелой аритмии в течение 5-15 мин приводило к полной нормализации ЭКГ-показателей или заметному ослаблению явлений аритмии с последующим восстановлением обычного синусового ритма и характеристик ЭКГ. Кардиограммы представлены на фиг.1-8 и фиг.11.
Введение ряда заявляемых соединений уже в дозах 1-5 мг/кг более чем в 2 раза по сравнению с контролем сокращало продолжительность бариевой аритмии. При этом наиболее активными были соединения 1-5, 7, 8, 11-14, 19, 21, 22, 23, 25, 28, 40, 41, 44, 45 (табл.1). Кардиограммы представлены на фиг.1-8 и фиг.11.
Увеличение дозы соединений приводило к усилению антиаритмического действия заявляемых соединений по этому показателю.
Высокая антиаритмическая активность заявляемых соединений подтверждается другим использованным критерием - процентом снятых аритмий. Применение этого критерия свидетельствует о выраженных антиаритмических свойствах заявляемых соединений. На моделях бариевой аритмии у кроликов и крыс ряд заявляемых соединений (1-8, 11-14, 19, 21, 22, 23, 25, 28, 40, 41, 44 и 45) в дозах до 5 мг/кг в 50-100% случаев снимает аритмии, вызванные введением хлористого бария (табл.1).
Наименьшими средними эффективными дозами (ЕД50) характеризуются соединения 1-5, 7, 8, 11, 13, 19, 21, 23, 40 и 44.
Такой важный показатель как терапевтический индекс (соотношение ЛД50/ЕД50), характеризующий диапазон терапевтического действия лекарственных препаратов, для ряда заявляемых соединений на модели бариевой аритмии превышает 100 и составляет для соединений 2, 8, 19, 21 и 23 величины 218, 240, 295, 412 и 483 соответственно.
Следует также отметить, что заявляемые соединения эффективны и при наиболее тяжелой форме бариевой аритмии - фибрилляции желудочков, наблюдающейся у 15-20% кроликов, 60-85% крыс и приводящей их к гибели в контроле.
Выраженные антиаритмические свойства заявляемых соединений, выявленные на моделях бариевой аритмии у кроликов и крыс, были подтверждены на модели аконитиновой аритмии у крыс. Нарушения сердечного ритма, вызванные внутривенным введением аконитина бромгидрата в дозе 40 мкг/кг, устранялись введением эффективных на модели бариевой аритмии у крыс доз заявляемых соединений. Кардиограммы представлены на фиг.6-8.
Внутривенное введение аконитина крысам приводило к возникновению тяжелых аритмий и сопровождалось резким нарушением параметров ЭКГ, значительной частотой возникновения серьезных осложнений - трепетание, мерцание и фибрилляция желудочков, приводящих в более чем в 90% случаев к гибели животных. Внутривенное введение заявляемых соединений в испытанных дозах приводило к нормализации ЭКГ-нарушений, вызванных аконитином, и выживанию 60-80% подопытных животных. Кардиограммы представлены на фиг.6-8.
Заявляемые соединения обладают выраженным профилактическим действием при введении хлористого бария и аконитина в аритмогенных дозах для кроликов и крыс. Предварительное введение заявляемых соединений в эффективных антиаритмических дозах (по лечебному действию) полностью предотвращало или существенно ослабляло аритмогенное действие хлористого бария и аконитина.
Сопоставление антиаритмических свойств заявляемых соединений и широко используемых в медицинской практике перечисленных выше препаратов сравнения свидетельствует о значительных преимуществах замещенных сульфонов и сульфоксидов. Как видно из данных, представленных в табл.1, заявляемые соединения характеризуются меньшей токсичностью и значительно большим терапевтическим индексом.
В качестве иллюстраций на графических изображениях (фиг.1-11) представлены ЭКГ кроликов и крыс с нарушениями сердечной деятельности под влиянием хлористого бария и аконитина, а также ЭКГ животных, свидетельствующие об эффективности антиаритмического действия некоторых из заявляемых соединений в сравнении с известными и широко применяемыми в медицинской практике антиаритмическими средствами.
Так, на фиг.1 представлена антиаритмическая эффективность соединения 8 в эксперименте на кроликах (бариевая модель аритмии):
ЭКГ 1. Изменение ЭКГ кролика после внутривенного введения хлористого бария в дозе 6 мг/кг. Обозначения: 1 - до введения (фон), 2-8 - после введения хлористого бария через 2, 5, 10, 20, 30, 45 и 60 минут соответственно.
ЭКГ 2. Влияние соединения 8 при внутривенном введении в дозе 1 мг/кг на изменение показателей ЭКГ кролика, вызванные хлористым барием 6 мг/кг. Обозначения: 1 - до введения хлористого бария (фон), 2 - через 2 минуты после введения хлористого бария, 3-9 - после введения соединения 8 через 2, 5, 10, 20, 30, 45 и 60 минут соответственно.
На фиг.2 представлена антиаритмическая эффективность соединения 19 в эксперименте на кроликах (бариевая модель аритмии):
ЭКГ 1. Изменение ЭКГ кролика после внутривенного введения хлористого бария в дозе 6 мг/кг.
Обозначения: 1 - до введения (фон), 2-8 - после введения хлористого бария через 2, 5, 10, 20, 30, 45 и 60 минут соответственно.
ЭКГ 2. Влияние соединения 19 в дозе 1,5 мг/кг при внутривенном введении на изменение показателей ЭКГ кролика, вызванные хлористым барием в дозе 6 мг/кг.
Обозначения: 1 - до введения хлористого бария (фон), 2 - через 2 минуты после введения хлористого бария, 3-9 - после введения соединения 19 через 2, 5, 10, 20, 30, 45 и 60 минут соответственно.
На фиг.3 представлена антиаритмическая эффективность соединения 39 в эксперименте на кроликах (бариевая модель аритмии):
ЭКГ 1. Изменение ЭКГ кролика после внутривенного введения хлористого бария в дозе 6 мг/кг.
Обозначения: 1 - до введения (фон), 2-9 - после введения хлористого бария через 1, 2, 5, 10, 20, 30, 45 и 60 минут соответственно.
ЭКГ 2. Влияние соединения 39 в дозе 5 мг/кг при внутривенном введении на изменение показателей ЭКГ кролика, вызванные хлористым барием в дозе 6 мг/кг.
Обозначения: 1 - до введения хлористого бария (фон), 2 - через 2 минуты после введения хлористого бария, 3-10 - после введения соединения 39 через 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
На фиг.4 представлена антиаритмическая эффективность соединения 40 в эксперименте на кроликах (бариевая модель аритмии):
ЭКГ 1. Изменение ЭКГ кролика после внутривенного введения хлористого бария в дозе 6 мг/кг.
Обозначения: 1 - до введения (фон), 2-9 - после введения хлористого бария через 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
ЭКГ 2. Влияние соединения 40 в дозе 2,5 мг/кг при внутривенном введении на изменение показателей ЭКГ кролика, вызванные хлористым барием в дозе 6 мг/кг.
Обозначения: 1 - до введения хлористого бария (фон), 2 - через 2 минуты после введения хлористого бария, 3-10 - после введения соединения 40 через 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
На фиг.5 представлена антиаритмическая эффективность соединения 4 в эксперименте на крысах (бариевая модель аритмии):
ЭКГ 1. Изменение ЭКГ крысы после внутривенного введения хлористого бария в дозе 20 мг/кг.
Обозначения: 1 - до введения (фон), 2-10 - после введения хлористого бария через 1, 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
ЭКГ 2. Влияние соединения 4 в дозе 1,5 мг/кг на изменение показателей ЭКГ крысы, вызванные хлористым барием.
Обозначения: 1 - до введения хлористого бария (фон), 2 - через 2 минуты после введения хлористого бария, 3-10 - после введения соединения 4 через 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
На фиг.6 представлена антиаритмическая эффективность соединения 2 в эксперименте на крысах (аконитиновая модель аритмии):
ЭКГ 1. Изменение ЭКГ крысы после внутривенного введения аконитина бромгидрата в дозе 40 мкг/кг.
Обозначения: 1 - до введения (фон), 2-10 - после введения аконитина через 1, 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
ЭКГ 2. Влияние соединения 2 в дозе 1 мг/кг на изменение показателей ЭКГ крысы, вызванные аконитином.
Обозначения: 1 - до введения аконитина (фон), 2 и 3 - через 1 и 2 минуты после введения аконитина, 4-10 - после введения соединения 2 через 2, 5, 10, 20, 30, 45 и 60 минут соответственно.
На фиг.7 представлена антиаритмическая эффективность соединения 8 в эксперименте на крысах (аконитиновая модель аритмии):
ЭКГ 1. Изменение ЭКГ крысы после внутривенного введения аконитина бромгидрата в дозе 40 мкг/кг.
Обозначения: 1 - до введения (фон), 2-10 - после введения аконитина через 1, 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
ЭКГ 2. Влияние соединения 8 в дозе 1 мг/кг на изменение показателей ЭКГ крысы, вызванные аконитином.
Обозначения: 1 - до введения аконитина (фон), 2 - через 2 минуты после введения аконитина, 3-10 - после введения соединения 8 через 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
На фиг.8 представлена антиаритмическая эффективность соединения 28 в эксперименте на крысах (аконитиновая модель аритмии):
ЭКГ 1. Изменение ЭКГ крысы после внутривенного введения аконитина бромгидрата в дозе 40 мкг/кг.
Обозначения: 1 - до введения (фон), 2-9 - после введения аконитина через 1, 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
ЭКГ 2. Влияние соединения 28 в дозе 4,5 мг/кг при внутривенном введении на изменение показателей ЭКГ крысы, вызванные аконитином бромгидратом в дозе 40 мкг/кг.
Обозначения: 1 - до введения аконитина (фон), 2 - через 2 минуты после введения аконитина, 3-10 - после введения соединения 28 через 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
На фиг.9 представлена антиаритмическая эффективность пропранолола (Обзидана, в дозе 10 мг/кг) и пиндолола (Вискена, в дозе 5 мг/кг) в эксперименте на крысах (аконитиновая модель аритмии):
ЭКГ 1. Влияние пропранолола (Обзидана) при в/в введении в дозе 10 мг/кг на изменения показателей ЭКГ крысы, вызванные аконитином бромгидратом в дозе 40 мкг/кг.
Обозначения: 1 - до введения (фон), 2 - через 2 минуты после введения аконитина, 3-10 - после введения пропранолола через 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
ЭКГ 2. Влияние пиндолола (Вискена) при в/в введении в дозе 5 мг/кг на изменения показателей ЭКГ крысы, вызванные аконитином бромгидратом в дозе 40 мкг/кг.
Обозначения: 1 - до введения (фон), 2 - через 2 минуты после введения аконитина, 3-10 - после введения пиндолола через 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
На фиг.10 представлена антиаритмическая эффективность пиндолола (Вискена, в дозе 10 мг/кг) в эксперименте на крысах (аконитиновая модель аритмии):
ЭКГ 1. Изменение ЭКГ крысы после внутривенного введения аконитина бромгидрата в дозе 40 мкг/кг.
Обозначения: 1 - до введения (фон), 2-9 - после введения аконитина через 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
ЭКГ 2. Влияние вискена при внутривенном введении в дозе 10 мг/кг на изменение показателей ЭКГ крысы, вызванные аконитином бромгидратом в дозе 40 м кг/кг.
Обозначения: 1 - до введения аконитина (фон), 2 - через 2 минуты после введения аконитина бромгидрата, 3-10 - после введения вискена через 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
На фиг.11 представлена антиаритмическая эффективность соединения 8 (в дозе 1 мг/кг) в сравнении с Верапамилом (в дозе 1 мг/кг) при профилактическом в/в введении препаратов в эксперименте на крысах (аконитиновая модель аритмии):
ЭКГ 1. Влияние соединения 8 при в/в профилактическом введении в дозе 1 мг/кг на изменения показателей ЭКГ крысы, вызванные введением аконитина бромгидрата в дозе 40 мкг/кг через 20 минут после соединения 8.
Обозначения: 1 - до введения (фон), 2 - через 20 минут после введения соединения 8, 3-11 - после введения аконитина через 1, 2, 5, 10, 20, 30, 45 и 60 минут соответственно.
ЭКГ 2. Влияние верапамила при в/в профилактическом введении в дозе 1 мг/кг на изменения показателей ЭКГ крысы, вызванные введением аконитина бромгидрата в дозе 40 мкг/кг через 20 минут после верапамила.
Обозначения: 1 - до введения (фон), 2 - через 20 минут после введения верапамила, 3-11 - после введения аконитина через 1, 2, 5, 10, 15, 20, 30, 45 и 60 минут соответственно.
Настоящее изобретение распространяется также на лекарственные препараты, содержащие в качестве действующего вещества соединения формулы (I). При этом последние могут применяться как самостоятельно, так и в смеси с фармацевтически приемлемыми носителями и компонентами, выбранными исходя из желаемого способа введения и обычной фармацевтической практики.
Соединения формулы (I) могут применяться как для лечения, так и для профилактики различных нарушений сердечного ритма.
Заявляемые соединения в зависимости от целей применения могут использоваться в различных лекарственных формах: инъекционной (внутривенно), пероральной, сублингвальной или наружной (мази, пластыри).
В качестве растворителей для инъекционных форм лекарственные препараты содержат стерильную воду или физиологический раствор, при необходимости они дополнительно могут содержать этанол и стабилизаторы.
Лекарственные препараты для перорального введения могут применяться в виде таблеток, драже и капсул, содержащих в качестве носителей целлюлозу микрокристаллическую, кальция карбонат, крахмал, кальция стеарат, лимонную кислоту, красители, а также другие известные в фармацевтике наполнители и вспомогательные вещества.
Соединения формулы (I) содержатся в лекарственных препаратах в количестве 15-150 мг, более предпочтительно от 15 до 50 мг. Лекарственные препараты на основе соединений формулы (I) могут применяться от 2 до 5 раз в сутки, обычно 2-3 раза.
В частности, для соединения формулы (I) - 2-(этилсульфонил)-этилтиолацетата (соединение 8, таблица) получены следующие лекарственные препараты:
- инъекционный раствор для внутривенного введения, представляющий собой стерильный 10% спиртовой раствор в ампулах по 1,0 мл для инфузии после разбавления содержимого одной ампулы 4,0 мл изотонического раствора хлорида натрия;
- таблетки для приема внутрь, покрытые оболочкой, содержащие на 1 таблетку: 50 мг 2-(этилсульфонил)-этилтиолацетата, 29 мг микрокристаллической целлюлозы, 28 мг кальция карбоната, 9 мг крахмала картофельного, 3 мг кислоты лимонной и 1 мг кальция стеарата (ядро таблетки);
- таблетки для сублингвального применения, содержащие на 1 таблетку: 15 мг 2-(этилсульфонил)-этилтиолацетата, 30 мг микрокристаллической целлюлозы, 35 мг кальция карбоната, 36 мг крахмала, 3 мг кислоты лимонной и 1 мг кальция стеарата.
Настоящее изобретение включает использование соединений формулы (I) для получения лекарственных средств, предназначенных для лечения и профилактики нарушений сердечного ритма, а также фармацевтических композиций на их основе.
Следующие примеры иллюстрируют получение соединений формулы (I).
Пример 1. 2-(Метилсульфонил)-этилтиолацетат
СН3-SO2-CH2-СН2-S-СО-СН3
К перемешиваемой смеси, содержащей 20 мл диоксана, 18,5 г (243 ммоль) тиоуксусной кислоты и 3 капли 40% тритона Б, при температуре 20-35°С прибавляют раствор 17,17 г (161,8 ммоль) метилвинилсульфона в 20 мл диоксана и нагревают при 30-40°С в течение 1 часа. ТСХ на пластинках с насыпным слоем Al2O3 2-ой степени активности (элюент - эфир, проявление перами йода) показывает отсутствие исходного метилвинилсульфона.
Растворитель и избыток тиоуксусной кислоты удаляют в вакууме, продукт перекристаллизовывают из воды. Получают 28,5 г (96%) 2-(метилсульфонил)-этилтиолацетата в виде бесцветных кристаллов с т. пл. 59,7-60,3°С.
| C5H10O3S2 | Найдено, %: | С - 32,98 | Н - 5,55 | S - 35,16 |
| Вычислено, %: | С - 32,95 | Н - 5,53 | S - 35,19 |
ИК-спектр, см-1: 1140 сильн. (vs SO2), 1270 сильн. и 1310 сильн. (vas SO2), 1690 сильн. (v СО).
Спектр 1Н ЯМР, Bruker WM-250 (250 MHz), CDCl3, δ, м.д.: 2,38 с (3Н, СН3СО), 2,99 с (3Н, CH3SO2), 3,26 с (4Н, СН2СН2).
Пример 2. 2-(Этилсульфонил)-этилтиолацетат
С2Н5-SO2-СН2-СН2-S-СО-СН3
а) К перемешиваемому раствору, содержащему 38,23 г (318,13 ммоля) этилвинилсульфона в 80 мл диоксана, при температуре 13-15°С прибавляют примерно 1/3 расчетного количества тиоуксусной кислоты и 1-2 капли тритона Б и продолжают прибавлять остальное количество реагентов с такой скоростью, чтобы температура смеси не превышала 20-23°С. Всего вводят 26,6 г (349,5 ммоль) тиоуксусной кислоты в 20 мл диоксана. Для завершения реакции смесь выдерживают при комнатной температуре в течение 3-х часов (ТСХ контроль). Растворитель и избыток тиоуксусной кислоты удаляют в вакууме, продукт кристаллизуют из эфира или водного метанола. Получают 59,2 г (94,8%) целевого продукта в виде белых кристаллов с т. пл. 33-34°С.
| C6H12O3S2 | Найдено, %: | С - 36,61 | Н - 6,08 | S - 32,61 |
| Вычислено, %: | С - 36,71 | Н - 6,16 | S - 32,67 |
ИК-спектр, см-1: 1115 сильн., 1150 сильн. (vs SO2), 1310 сильн. и 1292 сл. на плече (vas SO2), 1690 сильн. (v CO).
Спектр 1Н ЯМР, Bruker WM-250 (250 MHz), CDCl3, δ, м.д.: 1,45 т (3Н, СН3), 2,38 с (3Н, СН3СО), 3,09 к (2Н, СН 2СН3), 3,24 с (4Н, СН2СН2).
б) К перемешиваемому раствору, содержащему 52,7 г (692 ммоль) тиоуксусной кислоты в 50 мл изопропилового спирта, при температуре 10-20°С прибавляют 20 капель тиэтиламина и затем добавляют раствор этилвинилсульфона (76,88 г) в 30 мл изопропанола. Для завершения реакции температуру повышают до 29-30°С. ТСХ на пластинках Silufol или Al2O3 (элюент - эфир, проявление парами йода) показывает отсутствие этилвинилсульфона. Растворитель удаляют на роторном испарителе. Реакционную смесь разбавляют эфиром (300 мл), промывают насыщенным раствором NaHCO3 и сушат безводным Na2SO4. Целевой продукт кристаллизуют из эфира при охлаждении до 0°С. Из маточника после частичного испарения эфира дополнительно выделяют целевой продукт. Получают 103,7 г 2-(этилсульфонил)-этилтиолацетата с т. пл. 33-34°С. Из промывных вод после нейтрализации NaHCO3 и насыщения их NaCl экстрагируют эфиром (4×50 мл) и выделяют еще 7,2 г целевого продукта. Общий выход составляет 110,9 г (88%).
Пример 3. 2-(2-Гидроксиэтилсульфонил)-этилтиолацетат
НО-CH2-СН2-SO2-CH2-СН2-S-СО-СН3
К перемешиваемому раствору, содержащему 10,43 г (76,6 ммоля) (2-гидроксиэтил)винилсульфона в 30 мл диоксана, при температуре 8-10°С прибавляют раствор 8,74 г (114,8 ммоль) тиоуксусной кислоты в 15 мл диоксана и 15 капель триэтиламина, при этом наблюдается слабый тепловой эффект. Реакционную смесь выдерживают при температуре 20-30°С в течение 1-2 часов для завершения реакции (контроль ТСХ на пластинках Silufol, элюент - эфир, проявление парами йода). Растворитель и избыток тиоуксусной кислоты удаляют в вакууме. Перекристаллизацией из смеси метанол-эфир получают 10,44 г (64%) целевого продукта в виде бесцветных кристаллов с т. пл. 58-58.5°С.
| C6H12O4S2 | Найдено, %: | С - 33,94 | Н - 5,63 | S - 30,55 |
| Вычислено, %: | С - 33,95 | Н - 5,70 | S - 30,21 |
Спектр 1Н ЯМР, Bruker AM-300 (300 MHz), d6-DMSO, δ, м.д.: 2,37 с (3Н, СН3СО), 3,20 м (2Н, CH2SCO), 3,29 м (2Н, HOCH2CH 2), 3,35 м (2Н, CH 2CH2SCO), 3,80 к (2Н, НОСН 2СН2), 5,10 т (1Н, ОН).
Пример 4. 2-(н-Пропилсульфонил)-этилтиолацетат
n-С3Н7-SO2-СН2-СН2-S-СО-СН3
В условиях примера 3 из 13,42 г (100 ммоль) н-пропилвинилсульфона в 15 мл диоксана и 11,42 г (150 ммоль) тиоуксусной кислоты в 10 мл диоксана в присутствии 10 капель триэтиламина получают 19,56 г (93%) продукта с т. пл. 45,5-46,2°С.
| C7H14O3S2 | Найдено, %: | С - 40,03 | Н - 6,70 | S - 30,52 |
| Вычислено, %: | С - 39,98 | Н - 6,71 | S - 30,49 |
ИК-спектр, см-1: 1115 сильн. и 1154 сильн. (vs SO2), 1315 сильн. и 1325 ср. (vas SO2), 1690 сильн. (v CO).
Пример 5. 2-(н-Бутилсульфонил)-этилтиолацетат
n-С4Н9-SO2-СН2-СН2-S-СО-СН3
К смеси реагентов в отсутствии растворителя, содержащей 8,41 г (56,74 ммоль) н-бутилвинилсульфона и 6,48 г тиоуксусной кислоты, при перемешивании прибавляют 2 капли тритона Б и нагревают в течение 1 часа при 30-50°С. Методом ТСХ на Al2O3 (элюент - петролейный эфир:эфир 1:2) определяют отсутствие н-бутилвинилсульфона. Получают 11,3 г (89%) целевого продукта с т. пл. 40,2-40,5°С (из смеси метанол-вода).
| C8H16O3S2 | Найдено, %: | С - 42,96 | Н - 7,22 | S - 28,35 |
| Вычислено, %: | С - 42,84 | Н - 7,19 | S - 28,59 |
ИК-спектр, см-1: 1115 сильн. и 1146 сильн. (vs SO2), 1290 ср. и 1315 ср. (vas SO2), 1690 сильн. (v CO).
Спектр 1Н ЯМР, Bruker WM-250 (250 MHz), CDCl3, δ, м.д.: 1,00 с (3Н, СН 3(СН2)3SO2), 1,50 к (2Н, СН3СН 2(СН2)2), 1,87 м (2Н, СН3СН2СН 2СН2), 2,40 с (3Н, СН3СО), 3,05 т (2Н, C3H7CH 2SO2), 3,24 с (4Н, SO2CH2CH2S).
Пример 6. 2-(н-Октилсульфонил)-этилтиолацетат
n-C8H17-SO2-СН2-СН2-S-СО-СН3
В колбе с обратным холодильником нагревают в отсутствии растворителя смесь 7,52 г (36,8 ммоль) н-октилвинилсульфона и 4,2 г (55,2 ммоль) тиоуксусной кислоты в присутствии 3 капель тритона Б при 50°С в течение 1 часа. Реакционную массу кристаллизуют из метанола, получают 9,01 г (87%) целевого продукта с т. пл. 59,0-59,6°С.
| C12H24O3S2 | Найдено, %: | С - 51,20 | Н - 8,57 | S - 22,90 |
| Вычислено, %: | С - 51,40 | Н - 8,62 | S - 22,87 |
ИК-спектр, см-1: 1115 сильн. и 1140 сильн. (vs SO2), 1330 ср. и 1340 ср. (vas SO2), 1690 сильн. (v CO).
Спектр 1Н ЯМР, Bruker WM-250 (250 MHz), CDCl3, δ, м.д.: 0,88 т (3Н, CH 3(CH2)7SO2), 1,28 м (8Н, CH3(CH 2)4(CH2)3SO2), 1,46 м (2Н, СН3(СН2)4СН 2(CH2)2SO2), 1,87 м (2Н, CH3(CH2)5CH 2CH2SO2), 2,38 с (3Н, СН3СО), 3,04 т (2Н, СН3(СН2)6CH 2SO2), 3,24 с (4Н, SO2CH2CH2SC(O)).
Пример 7. 2-(Фенилсульфонил)-этилтиолацетат
С6Н5-SO2-CH2-СН2-S-СО-СН3
В условиях примера 2а из 7,20 г (42,8 ммоль) фенилвинилсульфона в 25 мл диоксана и 3,6 г (47,3 ммоль) тиоуксусной кислоты получают 9,57 г (92%) целевого продукта с т. пл. 57-59°С (из метанола).
| C10H12O3S2 | Найдено, %: | С - 49,19 | Н - 5,09 | S - 26,11 |
| Вычислено, %: | С - 49,16 | Н - 4,95 | S - 26,25 |
ИК-спектр, см-1: 1115 сильн. и 1145 сильн. (vs SO2), 1320 сильн. (на плече 1310 ср. и 1290 ср.) (vas SO2), 1690 сильн. (v СО).
Спектр 1Н ЯМР, Bruker WM-250 (250 MHz), CDCl3, δ, м.д.: 2,30 с (3Н, СН3СО), 3,13 к (2Н, SO2CH2CH 2S), 3,36 к (2Н, SO2CH2CH 2S), 7,36 к (2НВ, Ph), 7,69 м (1НС, Ph), 7,95 д (2На, Ph).
Пример 8. 2-(п-Толилсульфонил)-этилтиолацетат
p-СН3-С6Н5-SO2-СН2-СН2-S-СО-СН3
В условиях примера 2а из 6,74 г (37,0 ммоль) пара-толилвинилсульфона в 25 мл диоксана и 4,23 г (55,6 ммоль) тиоуксусной кислоты в 5 мл диоксана получают 9,07 г (95%) целевого продукта с т. пл. 66-67°С (из метанола).
| C11H14O3S2 | Найдено, %: | С - 51,09 | Н - 5,47 | S - 24,51 |
| Вычислено, %: | С - 51,14 | Н - 5,46 | S - 24,82 |
ИК-спектр, см-1: 1123 сильн. и 1148 сильн. (vs SO2), 1320 ср. и 1290 ср. (на плече 1306 ср.) (vas SO2), 1682 сильн. (v СО).
Спектр 1Н ЯМР, Bruker WM-250 (250 MHz), CDCl3, δ, м.д.: 2,32 с (3Н, СН3СО), 2,48 с (3Н, СН 3С6Н4), 3,11 к (2Н, SO2CH2CH 2S), 3,33 к (2Н, SO2CH 2CH2S), 7,40 д (2НВ, p-Tol), 7,81 д (2На, J=8,5 Hz, p-Tol).
Пример 9. 2-(Бензилсульфонил)-этилтиолацетат
C6H5-CH2-SO2-CH2-CH2-S-CO-CH3
В одногорлую колбу при комнатной температуре вносят 1,0 г (5,49 ммоль) бензилвинилсульфона, 2,5 мл диоксана, 0,63 г (8,28 ммоль) тиоуксусной кислоты в 1,5 мл диоксасна и прибавляют при перемешивании 3 капли свежеперегнанного триэтиламина. Реакционную смесь оставляют на ночь. ТСХ на Al2O3 по Брокману (элюент - эфир) показывает отсутствие исходного винилсульфона. После обычной обработки получают 1,32 г (93%) целевого продукта с т. пл. 97,0-97,5°С (из смеси метанол-эфир).
| C11H14O3S2 | Найдено, %: | С - 51,40 | Н - 5,54 | S - 24,90 |
| Вычислено, %: | С - 51,14 | Н - 5,46 | S - 24,82 |
Спектр 1Н ЯМР, Bruker АМ-300 (300 MHz), CDCl3, δ, м.д.: 2,36 с (3Н, СН3СО), 3,13 м (2Н, CH2SC(O)), 3,18 м (2Н, CH 2CH2SC(O)), 4,29 с (2Н, CH2Ph), 7,43 м (5Н, Ph).
Пример 10. 2-(Метилсульфонил)-этилтиол
CH3-SO2-CH2-CH2-SH
В колбе с обратным холодильником кипятят при 80-88°С в течение 5 часов раствор 12,66 г (69,5 ммоль) 2-(метилсульфонил)-этилтиолацетата (т. пл. 60°С) в 58 мл 1,2 Н HCl в абсолютном метаноле. Окончание реакции устанавливают по отсутствию исходного соединения в реакционной смеси методом ТСХ на Al2O3 2-степени активности или на силуфоле, проявление парами йода, элюент - эфир. После удаления в вакууме растворителя и МеОАс, остаток - низкоплавкие кристаллы (9,78 г) - перегоняют и получают 8,85 г (91