Производные азаспироалканов в качестве ингибиторов металлопротеаз
Иллюстрации
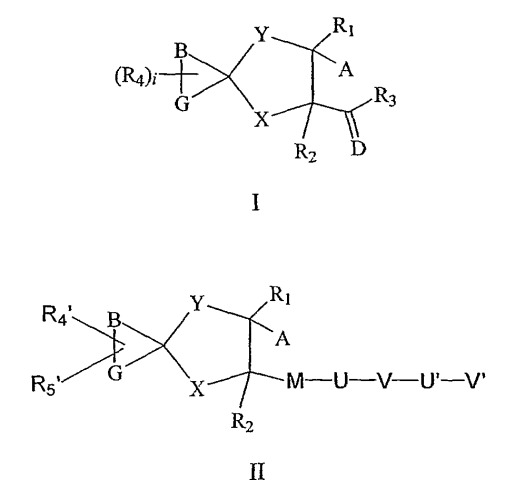
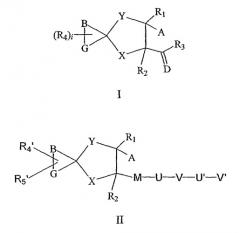
Показать всеИзобретение относится к соединениям формулы I или формулы II, к их фармацевтически приемлемым солям, энантиомерам и диастереомерам в качестве ингибиторов металлопротеаз, а также к фармацевтической композиции на их основе и вариантам его применения. Соединения могут найти применение для лечения заболеваний, опосредованных активностью металлопротеаз, Her-2 шеддаза, ADAM-10 и ADAM-17, таких как артрит, рак, сердечно-сосудистые расстройства, кожные заболевания, воспалительные и аллергические состояния и др. В общей формуле I или II:
А представляет собой CWNHOH; В представляет собой CH2; G представляет собой СН2; D представляет собой кислород; Х представляет собой CH2NRb; Y представляет собой СН2; М представляет собой СО; U отсутствует или представляет собой NRb; V отсутствует или представляет собой фенил, или 4-10-членный гетероциклил, содержащий 1-2 гетероатома, выбранных из N и S, замещенный 0-5 группами Re; U' отсутствует или представляет собой C1-10алкилен, О или их сочетания; V' представляет собой Н, С1-8алкил, NRbRc, С6-10карбоциклил, замещенный 0-3 группами Re, или 5-14-членный гетероциклил, содержащий 1-3 гетероатома, выбранных из N, О и S, замещенный 0-4 группами Re; Ra и Re, каждый независимо, представляет собой Н, Т, С1-8алкилен-Т, C(O)NRa'(CRb'Rc')r-T, (CRb'Rc')r-O-(CRb'Rc')r-T, ОН, Cl, F, CN, NO2, NRIRII, COORIV, ORIV, CONRIRII, С1-8галогеналкил, С3-13карбоциклил; Rb и Rc, каждый независимо, представляет собой Н, Т, C1-6алкилен-Т, C(O)O(CRb'Rc')r-T, C(O)(CRb'Rc')r-T, S(O)p(CRb'Rc')r-T; Т представляет собой Н, C1-10алкил, замещенный 0-1 группами Rb'; С3-6карбоциклил, 5-6-членный гетероциклил, содержащий один атом кислорода; Ra', Rb' и Rc', каждый независимо, представляет собой Н, ORIV или фенил; R1 представляет собой водород; R2 представляет собой водород; R3 представляет собой: (i) C1-10алкил; (ii) 4-14-членный гетероциклил, содержащий 1-3 атома азота, необязательно замещенный одним или двумя заместителями, выбранными из C1-6алкила, OR13, 5-10-членного гетероциклила, содержащего 1-3 гетероатома, выбранных из N О и S, или фенила; (iii) NR16R17; R4 представляет собой Н; R4' представляет собой Н; R5' представляет собой Н; W представляет собой кислород; R13 представляет собой C1-С6алкил; R16 и R17, каждый независимо, представляет собой C1-С10алкил или фенил, где каждый необязательно замещен одним С1-4алкилом; RI и RII, каждый независимо, представляет собой Н или C1-6алкил; RIV представляет собой C1-6алкил; i равно 0; p равно 1 или 2 и r равно 0, 1 или 2; при условии что: а) спирокольцо представляет собой стабильную химическую структурную единицу и b) NR8 и NRb не содержат ни N-N, ни N-O связей. 8 н. и 46 з.п. ф-лы, 1 табл.
Реферат
Область изобретения
Настоящее изобретение относится к азаспироалкановым соединениям, которые являются полезными для лечения заболеваний, патологических состояний и расстройств, связанных с активностью металлопротеаз, включая активность шеддаз и адамализинов (ADAM).
Предпосылки изобретения
Большинство тканей существуют в высокорегулируемом динамическом равновесии, где происходит образование новой ткани и разрушение и элиминация существующей ткани. Разрушение внеклеточного матрикса (ECM), включая соединительную ткань и базальные мембраны, осуществляется под действием металлопротеиназ, которые высвобождаются из соединительной ткани и инвазирующих воспалительных клеток. Избыточная нерегулируемая активность этих ферментов может привести к нежелательному разрушению тканей, и их активность регулируется на уровне транскрипции путем контролируемой активации латентного профермента и после трансляции - внутриклеточными специфическими факторами, такими как TIMP ("Тканевые Ингибиторы Металлопротеиназ"), или более общими ингибиторами протеиназ, такими как α2-макроглобулины.
Известно, что некоторые структурно родственные металлопротеазы (MP) играют важную роль в расщеплении структурных белков. Такие металлопротеазы обычно действуют на межклеточный матрикс и, таким образом, участвуют в разрушении и ремоделировании ткани. Такие белки называют металлопротеазами, или MP. Существует несколько различных семейств MP, которые классифицируют по гомологии последовательности. Некоторые семейства известных MP, а также их примеры раскрыты в известном уровне техники.
Такие MP включают металлопротеазы матрикса [MMP], цинк-металлопротеазы, многие из мембраносвязанных металлопротеаз, TNF-превращающие ферменты, ангиотензин-превращающие ферменты (ACE), дезинтегрины, включая ADAM (см. Wolfsberg et al., 131 J. Cell Bio. 275-78 October, 25 1995) и энкефалиназы. Примеры MP включают коллагеназу фибробластов кожи человека, желатиназу фибробластов кожи человека, коллагеназу, агреканазу и желатиназу мокроты из организма человека, и стромелизин человека. Считается, что коллагеназа, стромелизин, агреканаза и родственные ферменты играют важную роль в опосредовании симптоматологии различных заболеваний.
Цинк-протеазы подразделяются в соответствии с основной структурой их каталитических участков и включают глюцинкин, метцинкин, инуцинкин, карбоксипептидазу и подгруппы DD карбоксипептидазы (Hooper NM, 1994, FEBS Lett, 354:1-6). Подгруппа метцинкина дополнительно подразделяется на серрализины, астацины, матриксины и адамализины (Stocker W and Bode W, 1995, Curr Opin Struct Biol, 5:383-390).
Матриксины включают металлопротеазы матрикса, или MMP. MMP образуют семейство структурно схожих цинксодержащих металлопротеаз, которые участвуют в ремоделировании и разрушении внеклеточных матриксных белков и как часть нормальных физиологических процессов, и при патологических состояниях. См. Bode, W et al., 1996, Adv Exp Med Biol, 389:1-11. Соединительная ткань, составляющие элементы внеклеточного матрикса и базальные мембраны являются биологическим материалом, обеспечивающим ригидность, дифференциацию, сайты связывания и, в некоторых случаях, эластичность биологических систем. Компоненты соединительной ткани включают, например, коллаген, эластин, протеогликаны, фибронектин и ламинин, которые образуют каркас для всех тканей человека. В нормальных условиях процессы обновления и/или восстановления соединительной ткани контролируются и находятся в равновесии. Потеря такого баланса по какой-либо причине ведет к различным болезненным состояниям. Ингибирование ферментов, ответственных за потерю равновесия, обеспечивает контроль механизма разрушения такой ткани и, следовательно, лечение таких заболеваний. Неконтролируемое разрушение соединительной ткани под действием металлопротеаз является характерной особенностью многих патологических состояний.
Помимо роли в регуляции внеклеточного матрикса имеются также сведения, позволяющие предположить, что MMP опосредуют миграцию воспалительных клеток в ткани (Moscatelli D and Rifkin DB, 1988, Biochim Biophys Acta , 948: 67-85). В некоторых сообщениях было показано, что различные MMP могут активировать различные важные нематриксные белки, включая цитокины, хемокины, интегрины и антимикробные пептиды (см. Parks WC, 2002, J Clin Invest, 110:613-4). Многие из MMP человека сверхэкспресируются в опухолях человека, и они связаны с предопухолевым разрушением ткани и образованием метастазов. Другой важной функцией MMP является активация различных ферментов, включая другие MMP, путем расщепления про-доменов из их протеазных доменов. Так, некоторые MMP проявляют действие по регуляции активности других MMP, таким образом, сверхпродуцирование одной MMP может привести к чрезмерному протеолизу внеклеточного матрикса под действием другой. Также сообщалось, что MMP могут расщеплять и, таким образом, инактивировать эндогенные ингибиторы других протеиназ, таких как эластаза (Winyard PG et al., 1991, FEBS Letts, 279: 91-94). Ингибиторы MMP могли бы, таким образом, влиять на активность других деструктивных протеиназ путем изменения уровня их эндогенных ингибиторов. Кроме того, увеличение или поддержание уровней эндогенного или вводимого ингибитора серинпротеазы способствует лечению и профилактике заболеваний, таких как эмфизема, легочные заболевания, воспалительные заболевания и возрастные заболевания, такие как потеря способности к растяжению и эластичности кожи или органа. Таким образом, MMP нельзя рассматривать исключительно как протеиназы катаболизма ECM, а скорее как внеклеточные процессинговые ферменты, участвующие в регуляции клетка-клетка и клетка-ECM сигнальных событий.
Адамализины включают репролизины, металлопротеазы яда змеи и ADAM. ADAM (дезинтегрин и металлопротеазный домен) представляют собой семейство трансмембранных гликопротеинов типа I, играющих важную роль в различных биологических процессах, таких как клеточная адгезия и протеолитический шеддинг (“слущивание”) клеточно-поверхностных рецепторов. Члены семейства ADAM были идентифицированы из источников, относящихся к млекопитающим и немлекопитающим, включая Xenopus, Drosophila и Caenorhabditis elegans. Члены этого семейства имеют модульную конструкцию, отличающуюся присутствием металлопротеазной активности и активности связывания рецептора интегрина, а также цитоплазменный домен, который у многих членов этого семейства определяет сайты связывания для различных белков сигнальной трансдукции. Семейство ADAM участвует в контроле слияния мембран, шеддинга цитокинов, факторов роста и рецепторов факторов роста и миграции клеток, а также в таких процессах, как мышечный рост, оплодотворение, нейрогенез и детерминация гибели клеток. Потеря регуляции может привести к болезни и патологии. Было показано, что члены семейства ADAM играют роль в таких патологиях, как бесплодие, воспаление и рак. См. Wolfsberg TG and White JM, 1998, ADAM metalloproteinases. А также Handbook of Proteolytic Enzymes (Barrett AJ, Rawlings ND and Woessner JF eds), p.1310-1313, Academic Press, London; Seals DF and Courtneidge SA, 2003, Genes and Development, 17:7-30.
Некоторые конкретные примеры имеющих важное значение металлопротеаз ADAM включают TNFα-превращающий фермент, TACE или ADAM17, являющийся в настоящее время важной мишенью для противовоспалительных лекарственных средств (Moss ML et al., 2001, Drug Discov Today, 6:417-426 and Black RA, 2002, Int J Biochem Cell Biol, 34:1-5). Другие члены этого семейства также могут представлять собой хорошие терапевтические мишени. Сообщалось, что ADAM8 почти исключительно эксперссируется в клетках иммунной системы, в частности в B-клетках, моноцитах, эозинофилах и гранулоцитах. Поэтому ADAM8 представляет собой терапевтическую мишень для иммунозависимых заболеваний человека. ADAM15 обнаружена в клетках гладкой мышцы аорты человека и культивированных клетках эндотелия пупочной вены. Хотя ADAM15 не экспрессируется в нормальных кровеносных сосудах, она была обнаружена в развивающихся атеросклеротических изменениях (Herren B et al., 1997, FASEB J, 11:173-180), и также было показано, что происходит ее активация в остеоартритных хрящах человека в отличие от нормальных хрящей (Bohm BB et al., 1999, Artritis Rheum, 42:1946-1950). Таким образом, ADAM15 может играть определенную роль в таких заболеваниях, как атеросклероз и дегенерация хрящей. Лимфоцит-специфическая экспрессия ADAM28 дает основание предположить, что она может иметь важную иммунологическую функцию.
Считают, что сверхпродуцирование IgE является главным медиатором аллергических реакций. CD23 представляет собой обладающий низким сродством рецептор для IgE, где происходит зависимое от металлопротеазы типа ADAM протеолитическое высвобождение растворимых внеклеточных фрагментов, которые, как было показано, активируют продуцирование IgE и индукцию воспалительных цитокинов (см. Novak N et al., 2001, Curr Opin Immunol, 13:721-726 and Mayer RJ et al., 2002, Inflamm Res, 51:85-90). Повышенные уровни растворимого CD23 наблюдали при аллергической астме, хроническом B-лимфоцитном лейкозе и ревматоидном артрите. Ингибирование фермента(ов), ответственного за процессинг CD23, может предложить терапевтический подход для лечения различных иммунозависимых заболеваний. Оказалось, что металлопротеазы ADAM также ответственны за высвобождение или шеддинг (“слущивание”) растворимых рецепторов (например, CD30 и рецепторы для TNF), молекул адгезии (например, L-селектин, ICAМ-1, фибронектин), факторов роста и цитокинов (например, Fas лиганд, TGF-α, EGF, HB-EGF, SCF IL-6, IL-1, TSH и М-CSF) и рецепторов факторов роста (например, членов семейства EGFR, таких как Her-2 и Her-4, которые вовлечены в патогенез различных типов рака (Yarden Y and Sliwkowski MX, 2001, Nature Reviews 2:127-137). Например, в 25-30% случаев рака молочной железы человека происходит сверхэкспрессия Her-2, и он связан с повышенным риском рецидива и смертности (Slamon DJ et al, 1987, Science, 235:177-182). Недавно было показано, что ADAM17 является критической для регулируемого шеддинга Her-4 (Rio C et al, 2000, Biol Chem, 275:10379-10387). Протеаза, ответственная за расщепление Her-2, известная как Her-2 шеддаза, является неизвестной MMP, которая также может быть членом семейства ADAM (Codony-Servat J et al, 1999, Cancer Res 59:1196-1201). Поэтому модуляция такой активности может играть важную роль в модуляции заболевания человека. Обзор шеддазной активности ADAM см. в Moss ML and Lambert MH, 2002, Essays Biochem, 38:141-153.
ADAМ-TS протеазы были идентифицированы как члены семейства ADAM. Эти белки являются новыми, поскольку содержат уникальные мотивы тромбоспондина (TS) типа I помимо некоторых структурно консервативных доменов других членов семейства ADAM. ADAMTS также отличаются от ADAM отсутствием в них цистеин-обогащенного, EGF-подобного, трансмембранного и цитоплазматического доменов. Также было показано, что ADAМ-TS белки связаны с различными патологическими состояниями или заболеваниями человека. Например, ADAMTS-1 представляет собой селективный в отношении опухоли ген, экспрессируемый в клетках опухоли толстой кишки, и также является белком, который связан с воспалением. Недавно было показано, что человеческий ортолог ADAMTS-1, известный как METH-1, и родственный белок METH-2 обладают антиангиогенной активностью, и эти или другие члены семейства ADAMTS могут играть важную роль в регуляции роста сосудов. ADAMTS-2 участвует в процессе нормального роста кожи. Этот фермент был давно известен как N-протеиназа проколлагена - протеиназа, которая протеолитически удаляет аминопептиды в процессинге проколлагенов типа I и типа II до коллагенов, и было показано, что имеет место его дефицит в коже субъектов с наследственным заболеванием соединительной ткани типа синдрома VIIC Ehlers-Danros. ADAMTS-4 и ADAMTS-11 известны как агреканаза-1 и -2 благодаря их способности к расщеплению специфических сайтов в агрекане - протеогликане, поддерживающем механические свойства хряща. Прогрессивное разложение и истощение агрекана связано с дегенеративными заболеваниями суставов, такими как остеоартрит и воспалительные заболевания суставов, такие как ревматоидный артрит. Обзор металлопротеаз ADAМ-TS см. в Tang BL, 2001, Int J Biochem Cell Biol, 33:33-44 and Kaushal GP and SV Shah, 2000, J Clin Invest 105:1335-1337.
Металлопротеазы являются одним из старейших классов протеиназ, и они обнаружены в бактериях, грибах, а также в высших организмах. Многие ферменты содержат последовательность HEXXH, которая обеспечивает два гистидиновых лиганда для цинка, тогда как третий лиганд является либо глутаминовой кислотой (термолизин, неприлизин, аланиламинопептидаза) или гистидином (астацин). Другие семейства демонстрируют другой способ связывания атома Zn. Поэтому металлопротеазы были выделены из различных прокариотических и эукариотических источников. Кислотные металлопротеазы были выделены из яда широкополосного медноголового щитомордника и гремучей змеи. Нейтральные металлопротеазы, в частности те, которые обладают оптимальной активностью при нейтральном pH, например, были выделены из Aspergillus sojae. Щелочные металлопротеазы, например, были выделены из Pseudomonas aeruginosa и патогенного насекомого Xenorhabdus luminescens. Ингибирование микробных металлопротеаз может привести к ингибированию роста и представляет антибиотическую стратегию. Ингибирование металлопротеаз, ассоциированных со змеиным ядом или токсичностью насекомых, также может вывести на новые терапевтические стратегии.
Потенциальные терапевтические показания для ингибиторов MP обсуждались в литературе. См., например, патент США № 6500847 (Bayer Corporation), патент США № 6268379 (DuPont Pharmaceuticals Company), патент США № 5968795 (Bayer Corporation), патент США № 5892112 (Glycomed Incorporated and The University of Florida) и патент США № 5872152 (British Biotech Pharmaceuticals Limited). Некоторые примеры, где ингибирование активности металлопротеаз может быть полезным, включают: a) остеоартрит, b) ревматические заболевания и состояния, такие как аутоиммунное заболевание, ревматоидный артрит, c) септический артрит, d) рак, включая рост опухоли, метастазы опухоли и ангиогенез, e) заболевания периодонта, f) язвенные заболевания роговицы, эпидермиса и желудка (язвенные состояния могут иметь место в роговице в результате щелочных ожогов или в результате инфекции, вызванной Pseudomonas aeruginosa, Acanthamoeba, вирусами простого герпеса и оспы), g) протеинурию, h) различные сердечно-сосудистые и легочные заболевания, такие как атеросклероз, тромботические явления, атерома, гемодинамический шок, нестабильная стенокардия, рестеноз, сердечная недостаточность, i) аневризматические заболевания, включая аневризматические заболевания аорты, сердца или головного мозга, j) регулирование рождаемости, k) дистрофобную истинную акантолитическую пузырчатку, l) дегенеративную потерю хряща в результате травматического повреждения сустава, m) остеопении и другие заболевания аномальной потери костной ткани, включая остеопороз, n) умеренное мандибулярное заболевание суставов, o) легочные заболевания, такие как хроническое обструктивное заболевание легких, p) демиелинизирующие заболевания нервной системы, такие как рассеянный склероз, q) метаболические заболевания, включая диабет (с повышенным распадом коллагена) и ожирение, опосредованное резистентностью к инсулину, дегенерацию желтого пятна и диабетическую ретинопатию, опосредованную ангиогенезом, кахексию и преждевременное старение кожи, r) плохое заживление ран, включая ожоги, s) пролежни, t) острые и хронические нейродегенеративные расстройства, включая удар, повреждения спинного мозга и травматические повреждения головного мозга, боковой амиотрофический склероз, церебральную амилоидную ангиопатию, поражения ЦНС при СПИДе, болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона, предшествующие заболевания, злокачественную миатению и мышечную дистрофию Duchenne, u) боль, v) аутоиммунный энцефаломиелит и w) заболевания, связанные с продуцированием и/или передачей сигналов TNFα, такие как широкий ряд воспалительных и/или иммуномодуляторных заболеваний, включая ревматическую атаку, ревматоидный артрит, рассеянный склероз, аллергию, заболевания периодонта, гепатит, резорбцию кости, сепсис, грамотрицательный сепсис, септический шок, эндотоксический шок, синдром токсического шока, синдром системной воспалительной реакции, воспалительные заболевания кишечника, включая болезнь Крона и язвенный колит, реакции Jarisch-Herxheimer, астму, респираторный дистресс-синдром взрослых, острое фиброзное заболевание легких, легочный саркоидоз, аллергические респираторные заболевания, силикоз, пневмокониоз рабочих угольной промышленности, альвеолярное повреждение, печеночную недостаточность, заболевание печени в период острого воспаления, острый алкогольный гепатит, малярию, включая малярию Plasmodium falciparum и церебральную малярию, застойную сердечную недостаточность, нарушения после заболевания сердца, артериосклероз, включая атеросклероз, болезнь Альцгеймера, острый энцефалит, повреждение мозга, панкреатит, включая системные осложнения при остром панкреатите, плохое заживление ран и иммунные реакции при инфекционном воспалении и раке, миелодиспластические синдромы, системную красную волчанку, билиарный цирроз печени, инсулин-независимый сахарный диабет, некроз кишечника, псориаз, кахексию и анорексию, радиационные поражения и токсичность после введения моноклональных антител, таких как OKT3, реакции “хозяин против трансплантата”, включающие ишемическое реперфузионное повреждение и отторжения аллотрансплантата, включая отторжения аллотрансплантата почки, печени, сердца и кожи, отторжение легочного аллотрансплантата, в том числе хроническое отторжение легочного аллотрансплантата (облитерирующий бронхит), а также осложнения в результате вправления головки бедра, инфекционные заболевания, включая микобактериальные инфекции, менингит, инфекцию, вызванную Helicobacter pylori, при пептической язве, болезнь Chaga как результат инфекции, вызванной Trypanosoma cruzi, действие Shiga-подобного токсина в результате инфекции, вызванной E. coli, действие энтеротоксина A в результате инфекции, вызванной Staphylococcus, менингококковой инфекции и инфекций, вызванных Borrelia burgdorferi, Treponema pallidum, цитомегаловирусом, вирусом гриппа, вирусом Sendai, вирусом энцефаломиелита Theiler и вирусом иммунодефицита человека (ВИЧ). Могут иметь место нарушенные процессы заживления ран. Это может привести к неправильному заживлению ран, ведущему к плохому заживлению, спайкам и образованию рубцов. Эти последние дефекты могут привести к физическим недостаткам и/или к постоянной нетрудоспособности, как в случае постхирургических спаек.
Ингибиторы металлопротеазы матрикса являются полезными для лечения заболеваний, вызванных, по меньшей мере, частично, разрушением структурных белков. Хотя был получен целый ряд ингибиторов, все еще остается потребность в сильных ингибиторах металлопротеаз матрикса, полезных для лечения таких заболеваний. Заявителями, к удивлению, было обнаружено, что соединения по настоящему изобретению являются сильными ингибиторами металлопротеаз.
Краткое описание изобретения
Настоящее изобретение обеспечивает соединение формулы I или II:
или его энантиомер, диастереомер, пролекарство, сольват, метаболит или фармацевтически приемлемую соль, где составляющие члены описаны ниже.
Настоящее изобретение также обеспечивает композиции, содержащие соединение формулы I или II и фармацевтически приемлемый носитель.
Настоящее изобретение также обеспечивает способ лечения заболевания, связанного с нежелательной активностью металлопротеазы.
Настоящее изобретение также обеспечивает способ лечения заболевания, модулируемого металлопротеазой, у млекопитающего, где заболевание выбрано из группы, включающей артрит, рак, сердечно-сосудистое расстройство, кожные заболевания, воспалительное и аллергическое состояние.
Настоящее изобретение также обеспечивает способ лечения рака, включая, но, не ограничиваясь этим, рак молочной железы, у млекопитающего.
Настоящее изобретение также обеспечивает способ ингибирования патологических изменений, опосредованных повышенным уровнем металлопротеаз матрикса у млекопитающих, включающий введение указанному млекопитающему, нуждающемуся в этом, терапевтически эффективного количества соединения по настоящему изобретению.
Настоящее изобретение также обеспечивает способ лечения заболевания, связанного с нежелательной активностью TNF-α-превращающего фермента.
Настоящее изобретение также обеспечивает способ лечения заболевания, связанного с нежелательной активностью металлопротеаз матрикса у млекопитающего, где указанная металлопротеаза матрикса выбрана из группы, включающей MMP12, MMP14, MMP3, MMP2 и MMP9.
Настоящее изобретение также обеспечивает способ лечения заболевания, связанного с нежелательной активностью Her-2 шеддазы, шеддаз фактора роста или шеддаз цитокинов у млекопитающего.
Настоящее изобретение также обеспечивает способ лечения заболевания, связанного с активностью Her-2 шеддазы у млекопитающего.
Настоящее изобретение также обеспечивает способ лечения заболевания, связанного с нежелательной активностью ADAM10, ADAM15 или ADAM17 у млекопитающего.
Подробное описание изобретения
Настоящее изобретение обеспечивает, inter alia, соединения и фармацевтические композиции для лечения патологических состояний, которые связаны с активностью металлопротеаз, такой как быстрое и нерегулируемое разрушение ткани внеклеточного матрикса под действием MMP, включая, но, не ограничиваясь ими, MMP 12 и MMP 13. Некоторые из таких состояний включают ревматоидный артрит, остеоартрит, септический артрит, язвенные поражения роговицы, эпидермиса и желудка; заболевание периодонта, протеинурию, коронарный тромбоз, связанный с разрывом атеросклеротических бляшек, заболевание кости. Соединения по настоящему изобретению также полезны для лечения рака, включая, например, метастазы рака и ангиогенез, который, как оказалось, также связан с активностью металлопротеаз. Также, поскольку цикл повреждения ткани и ответная реакция связаны с ухудшением болезненного состояния, ограничение индуцированного металлопротеазами повреждения ткани из-за повышенного уровня протеиназ при помощи соединений по настоящему изобретению, как правило, может быть полезным терапевтическим подходом ко многим из таких серьезных заболеваний, а также и к другим. Соединения по настоящему изобретению также являются ингибиторами TNFα-превращающего фермента и шеддаз, включая Her-2 шеддазу и HB-EGF шеддазу и другие шеддазы факторов роста и цитокинов.
Настоящее изобретение обеспечивает соединение формулы I или II:
или его энантиомер, диастереомер, пролекарство, сольват, метаболит или фармацевтически приемлемую соль, где:
A представляет собой CWOH, CWNHOH, CWNHOR5, N(OH)CHO, N(OH)CWR6, SH, SR7 или гидантоинил;
B представляет собой (CH2)n, (CH2)nC=W, (CRdRf)nNR8, NR8(CRdRf)n, (CRdRf)nO(CRdRf)r, (CRdRf)nS(CRdRf)r, O(C=W)NR8, O, N, NR8, S(O)m, S, C(O)NR8(CRdRf)n, C(O)(CRdRf)n, или их сочетания;
G представляет собой (CH2)n, (CH2)nC=W, (CRdRf)nNR8, NR8(CRdRf)n, (CRdRf)nO(CRdRf)r, (CRdRf)nS(CRdRf)r, O(C=W)NR8, O, N, NR8, S(O)m, S, C(O)NR8(CRdRf)n, C(O)(CRdRf)n или их сочетания;
D представляет собой кислород или серу;
X отсутствует или представляет собой (CH2)j, C1-10алкилен, замещенный 0-3 группами Ra, C2-10алкенилен, замещенный 0-2 группами Ra, N, O, NRb, S(O)m, C=O, NRbC(O), NRbC(O)O, NRbC(O)NRb, C(O)O, OC(O), S(O)mNRb, NRbS(O)m, NRbS(O)mNRb, (CRdRf)jNRb, NRb(CRdRf)j или их сочетания;
Y отсутствует или представляет собой (CH2)j, C1-10алкилен, замещенный 0-3 группами Ra, C2-10алкенилен, замещенный 0-2 группами Ra, N, O, NRb, S(O)m, C=O, NRbC(O), NRbC(O)O, NRbC(O)NRb, C(O)O, OC(O), S(O)mNRb, NRbS(O)m, NRbS(O)mNRb, (CRdRf)jNRb, NRb(CRdRf)j или их сочетания;
M представляет собой CO или S(O)i;
U отсутствует или представляет собой C1-10алкилен, замещенный 0-5 группами Ra, C2-10алкенилен, замещенный 0-2 группами Ra, N, O, NRb, NRbC(O), NRbC(O)O, NRbC(O)NRb, NRbS(O)m, NRbS(O)NRb или их сочетания;
V отсутствует или представляет собой H, C3-13карбоциклил, замещенный 0-5 группами Re или гетероциклил, замещенный 0-5 группами Re;
U' отсутствует или представляет собой C1-10алкилен, замещенный 0-5 группами Ra, C2-10алкенилен, замещенный 0-2 группами Ra, N, O, NRbS(O)m, C=O, NRbC(O), NRbC(O)O, NRbC(O)NRb, C(O)O, OC(O), S(O)mNRb, NRbS(O)m, NRbS(O)NRb или их сочетания;
V' представляет собой H, C1-8алкил, NRbRc, C3-13карбоциклил, замещенный 0-5 группами Re или гетероциклил, замещенный 0-5 группами Re;
Ra и Re, каждый независимо, представляет собой H, T, C1-8алкилен-T, C2-8алкенилен-T, C2-6алкинилен-T, C(O)NRa'(CRb'Rc')r-T, C(O)O(CRb'Rc')r-T, S(O)p(CRb'Rc')r-T, (CRb'Rc')r-O-(CRb'Rc')r-T, OH, Cl, F, Br, I, CN, NO2, NRIRII, CORIII, COORIV, ORIV, CONRIRII, NRICONRIRII, OCONRIRII, NRICORII, SO2NRIRII, NRISO2RII, NRISO2NRIRII, OSO2NRIRII, SOpRV, C1-8галогеналкил, C3-13карбоциклил, гетероциклил, карбоциклилалкил или гетероциклилалкил, где каждая из указанных карбоциклильной, гетероциклильной, карбоциклилалкильной и гетероциклилалкильной групп, необязательно, замещена одной или несколькими группами C1-8алкил, алкокси, галоген, галогеналкил, галогеналкокси, циано, нитро, амино, алкиламино, диалкиламино, карбокси, сложный карбоксиалкиловый эфир, сложный карбоксиариловый эфир, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, сульфонил, аминосульфонил, алкиламиносульфонил, диалкиламиносульфонил, арилсульфонил, арилсульфинил, алкилсульфонил или арилсульфонил;
Rb и Rc, каждый независимо, представляет собой H, T, C1-6алкилен-T, C2-8алкенилен-T, C2-6алкинилен-T, C(O)NRa'(CRc'Rb')r-T, C(O)O(CRb'Rc')r-T, C(O)(CRb'Rc')r-T, S(O)p(CRb'Rc')r-T, (CRc'Rb')r-O-(CRc'Rb')r-T, C(NRa'Ra')(=N-CN) или C(NRa'Ra')(=CHNO2);
Rd и Rf, каждый независимо, представляет собой H, C1-6алкил, C2-6алкенил, C2-6алкинил, T, C1-6алкилен-T, C2-8алкенилен-T, C2-6алкинилен-T, C(O)NRa'(CRc'Rb')r-T, C(O)O(CRb'Rc')r-T, S(O)p(CRb'Rc')r-T или (CRc'Rb')r-O-(CRc'Rb')r-T, OH, Cl, F, Br, I, CN, NO2, NRIRII, CORIII, COORIV, ORIV, CONRIRII, RINCONRIRII, OCONRIRII, RINCORII, SO2NRIRII, NRISO2RII, NRISO2NRIRII, OSO2NRIRII, SOpRV, C1-8галогеналкил, карбоциклил, гетероциклил, карбоциклилалкил, гетероциклилалкил, карбоциклилокси или гетерокарбоциклилокси, где каждая из указанных карбоциклильной, гетероциклильной, карбоциклилалкильной, гетероциклилалкильной, карбоциклилокси или гетерокарбоциклилоксигрупп, необязательно, замещена одной или несколькими группами C1-8алкил, алкокси, галоген, галогеналкил, галогеналкокси, циано, нитро, амино, алкиламино, диалкиламино, карбокси, сложный карбоксиалкиловый эфир, сложный карбоксиариловый эфир, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, сульфонил, аминосульфонил, алкиламиносульфонил, диалкиламиносульфонил, арилсульфонил, арилсульфинил, алкилсульфонил или арилсульфонил;
T представляет собой H, C1-10алкил, замещенный 0-5 группами Rb'; C2-10алкенил, замещенный 0-5 группами Rb', C2-10алкинил, замещенный 0-5 группами Rb', C3-13карбоциклил, замещенный 0-3 группами Rb', гетероциклил, замещенный 0-5 группами Rb';
Ra', Rb' и Rc', каждый независимо, представляет собой H, C1-6алкил, C2-6алкенил, С2-6алкинил, ОН, Cl, F, Br, I, CN, NO2, NRIRII, CORIII, COORIV, ORIV, CONRIRII, RINCONRIRII, OCONRIRII, RINCORII, SO2NRIRII, NRISO2RII, NRISO2NRIRII, OSO2NRIRII, SOPRV, C1-8галогеналкил, карбоциклил, гетероциклил, карбоциклилалкил, гетероциклилалкил, карбоциклилокси или гетерокарбоциклилокси, где каждая из указанных карбоциклильной, гетероциклильной, карбоциклилалкильной, гетероциклилалкильной, карбоциклилокси или гетерокарбоциклилоксигрупп, необязательно, замещена одной или несколькими группами C1-8алкил, алкокси, галоген, галогеналкил, галогеналкокси, циано, нитро, амино, алкиламино, диалкиламино, карбокси, сложный карбоксиалкиловый эфир, сложный карбоксиариловый эфир, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, сульфонил, аминосульфонил, алкиламиносульфонил, диалкиламиносульфонил, арилсульфонил, арилсульфинил, алкилсульфонил или арилсульфонил;
R1 представляет собой водород, C1-6алкил, SR10, OR10 или NR11R12;
R2 водород, C1-6алкил, SR10, OR10 или NR11R12;
R3 представляет собой:
(i) C1-10алкил, С2-8алкенил или С2-8алкинил;
(ii) C3-13карбоциклил, необязательно, замещенный одним или несколькими заместителями, выбранными из галогена, C1-6алкила, SR13, NR11R12, OR13, гетероциклила, арила, =S, =О, CN, NO2, NRβRβ', CORγ, RγNC(O)NRγRγ', OC(O)NRγRγ', C(O)ORγ, C(O)NRγRγ' или RγNC(O)O;
(iii) арил, необязательно, замещенный одним или несколькими заместителями, выбранными из галогена, C1-6алкила, SR13, NR11R12, OR13, гетероциклила, арила, =S, =О, CN, NO2, NRβRβ', CORγ, RγNC(O)NRγRγ', OC(O)NRγRγ', C(O)ORγ, C(O)NRγRγ' или RγNC(O)O;
(iv) гетероциклил, необязательно, замещенный одним или несколькими заместителями, выбранными из галогена, C1-6алкила, SR13, NR11R12, OR13, гетероциклила, арила, =S, =О, CN, NO2, NRβRβ', CORγ, RγNC(O)NRγRγ', OC(O)NRγRγ', C(O)ORγ, C(O)NRγRγ' и RγNC(O)O;
(v) NR14(CH2)lNR14R15 или
(vi) NR16R17;
R4 и R5, каждый независимо, представляет собой Н, галоген, Т, C1-6алкилен-Т, С2-6алкинилен-Т, С(О)NRa'(CRc'Rb')r-T, CO(CRb'Rc')r-T, C(O)O(CRb'Rc')r-T, S(O)p(CRb'Rc')r-T, (CRc'Rb')r-O-(CRc'Rb')r-T, NR11R12, SR18 или OR18;
R4' представляет собой H, галоген, T, C1-6алкилен-T, C2-6алкинилен-T, C(O)NRa'(CRc'Rb')r-T, CO(CRb'Rc')r-T, C(O)O(CRb'Rc')r-T, S(O)p(CRb'Rc')r-T или (CRc'Rb')r-O-(CRc'Rb')r-T, NR11R12, SR18 или OR18;
R5' представляет собой H, галоген, T, C1-6алкилен-T, C2-6алкинилен-T, C(O)NRa'(CRc'Rb')r-T, CO(CRb'Rc')r-T, C(O)O(CRb'Rc')r-T, S(O)p(CRb'Rc')r-T или (CRc'Rb')r-O-(CRc'Rb')r-T, NR11R12, SR18 или OR18;
или R4' и R5', вместе с атомами, с которыми они связаны, образуют кольцо, выбранное из C3-13карбоциклила и 3-14-членного гетероциклила;
W представляет собой кислород или серу;
R6 и R7, каждый независимо, представляет собой водород, C1-6алкил, C2-8алкенил или C2-8алкинил;
R8 представляет собой H, C1-10алкилен-T, C2-10алкенилен-T и C2-10алкинилен-T,
(CRb'Rc)rO(CRb'Rc') r-T,
(CRb'Rc)rNRa'(CRb'Rc') r-T,
(CRb'Rc)rC(O)(CRb'Rc') r-T,
(CRb'Rc)rC(O)O(CRb'Rc') r-T,
(CRb'Rc)rOC(O)(CRb'Rc') r-T,
(CRb'Rc)rC(O)NRa'(CRb'Rc') r-T,
(CRb'Rc)rNRa'C(O)(CRb'Rc') r-T,
(CRb'Rc)rOC(O)O(CRb'Rc') r-T,
(CRb'Rc)rOC(O)NRa'(CRb'Rc') r-T,
(CRb'Rc)rNRa'C(O)O(CRb'Rc') r-T,
(CRb'Rc)rNRa'C(O)NRa'(CRb'Rc') r-T,
(CRb'Rc)rS(O)p(CRb'Rc') r-T,
(CRb'Rc)rSO2NRa'(CRb'Rc') r-T,
(CRb'Rc)rNRa'SO2(CRb'Rc') r-T или
(CRb'Rc)rSO2NRa'SO2(CRb'Rc') r-T;
R10 представляет собой H или C1-C6алкил;
R11 и R12, каждый независимо, представляет собой водород или C1-C8алкил, или R11 и R12 вместе с атомом N, с которым они связаны, образуют 3-14-членное гетероциклическое кольцо;
R13 представляет собой C1-C6алкил, C1-C6галогеналкил, C3-13карбоциклил, карбоциклилалкил, гетероциклил, гетероциклилалкил, каждый из которых, необязательно, замещен одной или несколькими группами, выбранными из галогена, C1-4алкила, C1-4алкокси, C1-4галогеналкила, C1-4галогеналкокси, CN, NO2, OH, COOH, амино, алкиламино или диалкиламино;
R14 и R15, каждый независимо, представляет собой водород, C1-10алкил, C3-13карбоциклил, замещенный одной или несколькими гетероциклильными группами, или R14 и R15 вместе с атомом N, с которым они связаны, образуют 3-14-членную гетероциклическую систему;
R16 и R17, каждый независимо, представляет собой водород, C1-C10алкил, C3-C13карбоциклил, арил, C3-C13карбоциклилалкил или арилалкил, где каждый из указанных C1-C10алкила, C3-C13карбоциклила, арила, C3-13карбоциклилалкила или арилалкила, необязательно, замещен одной или несколькими группами, выбранными из галогена, C1-4алкила, C1-4галогеналкила, OR17', SR17', COOR17', амино, алкиламино, диалкиламино или гетероциклила;
или R16 и R17 вместе с атомом N, с которым они связаны, образуют 3-14-членный гетероцикл, замещенный 0-5 группами Rα, или замещены одной или несколькими группами, выбранными из гетероциклила, гетероциклилалкила, C3-C13карбоциклила или карбоциклилалкила, где каждый из указанных гетероциклила, гетероциклилалкила, C3-C13карбоциклила или карбоциклилалкила, необязательно, замещен одной или несколькими группами Rα;
R17' представляет собой H, C1-4алкил, C1-4галогеналкил, C3-13карбоциклил, карбоциклилалкил, гетероциклил или гетероциклилалкил, где каждый из указанных C3-13карбоциклила, карбоциклилалкила, гетероциклила или гетероциклилалкила, необязательно замещен галогеном или C1-4алкилом;
R18 представляет собой C1-6алкил;
Rα представляет собой галоген, C1-6алкил, C2-8алкилоксиалкил, C1-6галогеналкил, SR13, NR11R12, OH, OR13, C3-13карбоциклил, гетероциклил, арил, =S, =O, CN, NO2, NRβRβ', CORγ, NRβC(O)NRβRβ', OC(O)NRβRβ', C(O)NRβRβ', C(O)ORγ, NRβC(O)ORγ или NRβC(O)Rγ, или два Rα вместе с атомом углерода, с которым они оба связаны, образуют C3-13карбоцикл;
Rβ, Rβ', Rγ, и Rγ', каждый независимо, представляет собой H, C1-4алкил, фенил или бензил;
RI и RII, каждый независимо, представляет собой H, C1-6алкил или C3-13карбоциклил;
RIII и RIV, каждый независимо, представляет собой H, C1-6алкил, галогеналкил, карбоциклил, гетероциклил, карбоциклилалкил или гетероциклилалкил, где каждый из указанных карбоциклила, гетероциклила, карбоциклилалкила или гетероциклилалкила, необязательно, замещен одной или несколькими группами, выбранными из галогена, C1-4алкила или C1-4алкокси;
RV представляет собой C1-6алкил, галогеналкил, карбоциклил или гетероциклил;
j равно 1, 2, 3 или 4;
i равно 0, 1 или 2;
l равно 2, 3, 4, 5, 6, 7 или 8;
n равно 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12;
m равно 0, 1 или 2;
p равно 1 и