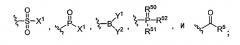Ингибиторы дипептидилпептидазы iv
Иллюстрации
Показать всеИзобретение относится к ингибиторам ферментов, расщепляющих белок после пролина, таким как ингибиторы дипептидил пептидазы IV, как и к их фармацевтическим композициям, и способам применения таких ингибиторов. В частности, ингибиторы по данному изобретению улучшены по сравнению с известными в данной области техники путем отбора особых классов боковых цепей в Р1 и/или Р2 положениях ингибитора, который содержит группировку карбоновой кислоты. Соединения формулы I, II и III по данному изобретению могут иметь улучшенный терапевтический индекс частично благодаря уменьшенной токсичности и/или повышенной специфичности по отношению к протеазе-мишени. 10 н. и 5 з.п. ф-лы, 2 ил.
Реферат
Родственные заявки
Данная заявка охватывает притязания временных заявок США № 60/547227, поданной 23 февраля 2004 г., и 60/599336, поданной 6 августа 2004 г. Содержание этих заявок в полном объеме включено в данный документ в качестве ссылки.
Уровень техники в области изобретения
Протеазы являются ферментами, которые вызывают расщепление белков по одной специфической пептидной связи. Протеазы могут быть классифицированы в четыре родовых класса: сериновые, тиольные или цистеиниловые, кислые или аспартиловые и металлопротеазы (Cuypers et al., J. Biol. Chem. 257:7086 (1982)). Протеазы существенны для многообразных видов биологической активности, таких как переваривание, формирование и растворение кровяных сгустков, воспроизводство и иммунные реакции на чужеродные клетки и организмы. Аберрантный протеолиз связан с многочисленными болезненными состояниями у человека и других млекопитающих. Во многих случаях полезно нарушить функцию одного или более протеолитического фермента в ходе терапевтического лечения животного.
Сайты связывания с пептидным субстратом состоят из серии «субсайтов специфичности» на поверхности фермента. Термин "субсайт специфичности» относится к карману или иному сайту фермента, способному взаимодействовать с участком субстрата фермента. В обсуждении взаимодействий пептидов с протеазами, например, сериновых и цистеиновых протеаз и им подобных, в данной заявке используется номенклатура Schechter and Berger [(1967) Biochem. Biophys. Res. Commun. 27:157-162)]. Индивидуальные аминокислотные остатки субстрата или ингибитора обозначены P1, P2 и т.д. и соответствуют субсайтам фермента, обозначенным S1, S2 и т.д., начиная с карбокси-концевого остатка, образовавшегося при реакции расщепления. Расщепляемой связью субстрата является амидная связь между P1-P1' субстрата. Таким образом, для пептида Xaal-Xaa2-Xaa3-Xaa4, который расщепляется между остатками Xaa3 и Xaa4, остаток Xaa3 обозначается как остаток P1 и связывается с субсайтом S1 фермента, Xaa2 обозначается как остаток P2 и связывается с субсайтом S2 и так далее.
Дипептидил пептидаза IV (DPIV), например, является сериновой протеазой, которая отщепляет дипептиды на N-конце пептидной цепи, содержащей предпочтительно остаток пролина в предпоследнем положении, например, в положении P1. DPIV принадлежит к группе пептидаз, связанных с клеточной мембраной и, как и большинство пептидаз клеточной поверхности, представляет собой интегральный мембранный белок типа II, заякоренный в плазматической мембране своей сигнальной последовательностью. DPIV обнаружена в множестве [видов] дифференцированного эпителия, эндотелия и гемопоэтических клеток, а также тканей млекопитающих, включая в себя таковые лимфоидного происхождения, где она обнаружена специфически на поверхности T-клеток CD4+. DPIV была идентифицирована как маркер дифференцировки лейкоцитов CD26.
Сущность изобретения
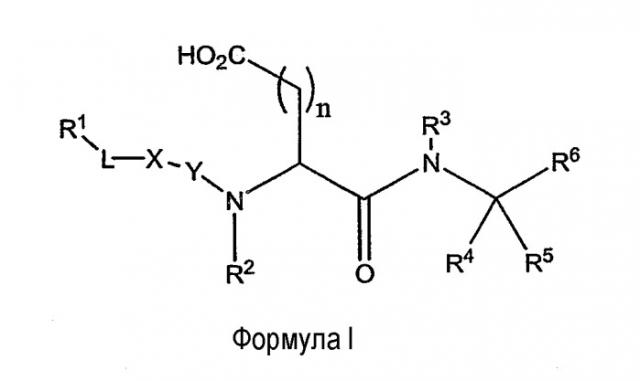
Один из объектов данного изобретения представляет ингибитор протеазы, имеющий структуру Формулы I
I
или его фармацевтически приемлемую соль, где:
R1 представляет собой H, алкил, алкокси, алкенил, алкинил, амино, алкиламино, ациламино, циано, сульфониламино, ацилокси, арил, циклоалкил, гетероциклил, гетероарил или полипептидную цепь с 1-8 аминокислотными остатками;
R2 представляет собой H, низший алкил или аралкил;
R3 и R4 независимо друг от друга представляют собой H, галоген или алкил или R3 и R4 вместе с углеродом, к которому они присоединены, образуют 3-6-членное гетероциклическое кольцо;
R5 представляет собой H, галоген, низший алкил или аралкил, предпочтительно H или низший алкил;
R6 представляет собой функциональную группу, которая реагирует с остатком в активном сайте протеазы-мишени с формированием ковалентной связи;
R7 представляет собой H, арил, алкил, аралкил, циклоалкил, гетероциклил, гетероарил, гетероаралкил или полипептидную цепь с 1-8 аминокислотными остатками;
L либо отсутствует, либо представляет собой алкил, алкенил, алкинил, -(CH2)mO(CH2)m-, -(CH2)mNR2(CH2)m-, и -(CH2)mS(CH2)m-;
X либо отсутствует, либо представляет собой -N(R7)-, -О- или -S-;
Y либо отсутствует, либо представляет собой -C(=О)-, -C(=S)- или -SO2-;
m представляет собой, в каждом случае независимо, число от 0 до 10, предпочтительно от 1 до 3; и
n - это число от 1 до 6.
В определенных предпочтительных вариантах реализации R1 представляет собой H или низший алкил, R3 представляет собой H, а R4 - низший алкил, или R3 и R4 вместе с углеродом, к которому они присоединены, образуют 5-членное кольцо, а n равно 2.
В определенных иных предпочтительных вариантах реализации R1 представляет собой H или низший алкил, R3 представляет собой H, R4 представляет собой H или низший алкил, R5 представляет собой H, а n равно 2.
В определенных предпочтительных вариантах реализации, когда X, Y и L отсутствуют, R1 - это полипептидная цепь с 2-8 аминокислотными остатками, где пролин - это остаток, который непосредственно присоединен к крайнему слева остатку в Формуле I. В таких определенных вариантах реализации R1 - это полипептидная цепь с 2 аминокислотными остатками, где пролин - это остаток, который непосредственно присоединен к крайнему слева азоту в Формуле I.
В некоторых из упомянутых выше вариантов реализации R6 представляет собой бороновую кислоту, CN, -SO2Z1, -P(=О)Z1, -P(=R8)R9R10, -C(=NH)NH2, -CH=NR11 или -C(=О)-R11, где:
R8 - это O или S;
R9 представляет собой N3, SH2, NH2, NО2 или OLR12 и
R10 представляет собой низший алкил, амино, OLR12 или их фармацевтически приемлемую соль или
R9 и R10 вместе с фосфором, к которому они присоединены, образуют 5-8-членное гетероциклическое кольцо;
R11 представляет собой H, алкил, алкенил, алкинил, NH2, -(CH2)p-R12, -(CH2)q-OH, -(CH2)q-О-алкил, -(CH2)q-О-алкенил, -(CH2)q-О-алкинил,
-(CH2)q-О-(CH2)p-R12, -(CН2)q-SH, -(CH2)q-S-алкил, -(CH2)q-S-алкенил, -(CH2)q-S-алкинил,
-(CH2)q-S-(CH2)p-R12, -C(О)NH2, -C(О)OR13 или -C(Z1)(Z2)(Z3);
R12 представляет собой H, алкил, алкенил, арил, гетероарил, циклоалкил, циклоалкенил или гетероциклил;
R13 представляет собой H, алкил, алкенил или LR12;
Z1 представляет собой галоген;
Z2 и Z3 независимо друг от друга представляют собой H или галоген;
p - это, в каждом случае независимо, число от 0 до 8 и
q - это, в каждом случае независимо, число от 1 до 8.
В некоторых предпочтительных вариантах реализации R6 представляет собой CN, CHO или C(=О)C(Z1)(Z2)(Z3), где Z1 представляет собой галоген, а Z2 и Z3 представляют собой H или галоген. В другом варианте реализации R6 представляет собой C(=О)C(Z1)(Z2)(Z3), где Z1 представляет собой фтор, а Z2 и Z3 представляют собой H или фтор.
В определенных предпочтительных вариантах реализации R6 представляет собой группу с формулой -B(Y1)(Y2), где Y1 и Y2 независимо друг от друга представляют собой OH или группу, которая может гидролизоваться до OH (т.е. до образования бороновой кислоты), или вместе с атомом бора, к которому они присоединены, образуют 5-8-членное кольцо, гидролизующееся до бороновой кислоты.
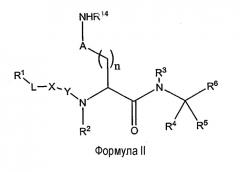
Другой объект данного изобретения относится к ингибитору протеазы, имеющему структуру Формулы II:
или его фармацевтически приемлемую соль, где
R1 представляет собой H, алкил, алкокси, алкенил, алкинил, амино, алкиламино, ациламино, циано, сульфониламино, ацилокси, арил, циклоалкил, гетероциклил, гетероарил или полипептидную цепь с 1-8 аминокислотными остатками;
R2 представляет собой H, низший алкил или аралкил;
R3 и R4 независимо друг от друга представляют собой H, галоген или алкил, или R3 и R4 вместе с углеродом, к которому они присоединены, образуют 3-6-членное гетероциклическое кольцо;
R5 представляет собой H, галоген, низший алкил или аралкил, предпочтительно H или низший алкил;
R6 представляет собой функциональную группу, которая реагирует с остатком в активном сайте протеазы-мишени с образованием ковалентной связи;
R7 представляет собой H, арил, алкил, аралкил, циклоалкил, гетероциклил, гетероарил, гетероаралкил или полипептидную цепь с 1-8 аминокислотными остатками;
R14 представляет собой H, алкил, алкокси, алкенил, алкинил или аралкил, предпочтительно H;
A либо отсутствует, либо представляет собой -NHC(=NH) или R14 и A вместе с азотом, к которому они присоединены, образуют гетероциклическое кольцо;
L либо отсутствует, либо представляет собой алкил, алкенил, алкинил, -(CH2)mO(CH2)m-, -(CH2)mNR2(CH2)m- или -(CH2)mS(CH2)m-;
X отсутствует или представляет собой -N(R7)-, -O- или -S-;
Y отсутствует или представляет собой -C(=О)-, -C(=S)- или -SO2;
m - это число, в каждом случае независимое, от 0 до 10 и
n - это число от 1 до 6.
В определенных предпочтительных вариантах реализации R1 представляет собой H или низший алкил, R3 - это H, а R4 - это низший алкил, или R3 и R4 вместе с углеродом, к которому они присоединены, образуют 5-членное кольцо, n - это число от 1 до 4.
В других определенных предпочтительных вариантах реализации R1 представляет собой H или низший алкил, R3 представляет собой H, R4 представляет собой H или низший алкил, R5 представляет собой H, а n - число от 1 до 4.
В некоторых предпочтительных вариантах реализации, когда X, Y и L отсутствуют, R1 - это полипептидная цепь из 2-8 аминокислотных остатков, в которой пролин - это остаток, который непосредственно присоединен к крайнему слева остатку в Формуле II. В некоторых таких вариантах реализации R1 - это полипептидная цепь из 2 аминокислотных остатков, в которой пролин является остатком, непосредственно присоединенным к крайнему слева азоту в Формуле II.
В определенных вариантах реализации R14 - это H или алкил. В таких определенных вариантах реализации A отсутствует или представляет собой -NHC(=NH)-.
В определенных вариантах реализации R14 - это H, A отсутствует, а n равно 4. В некоторых других вариантах реализации R14 - это H, A - это -NHC(=NH)-, а n равно 3.
В определенных вариантах реализации A и R14 вместе с азотом, к которому они присоединены, образуют имидазольное кольцо, а n равно 1.
В определенных вариантах реализации R6 представляет собой бороновую кислоту, -CN, -SO2Z1, -P(=О)Z1, -P(=R8)R9R10, -C(=NH)NH2, -CH=NR11 или -C(=О)-R11, где:
R8 - это O или S;
R9 представляет собой N3, SH2, NH2, NО2 или OLR12 и
R10 представляет собой низший алкил, амино, OLR12 или их фармацевтически приемлемую соль или
R9 и R10 вместе с фосфором, к которому они непосредственно присоединены, образуют 5-8-членное гетероциклическое кольцо;
R11 представляет собой H, алкил, алкенил, алкинил, -NH2, -(CH2)p-R12, -(CH2)q-OH, -(CH2)q-О-алкил, -(CH2)q-О-алкенил, -(CH2)q-О-алкинил,
-(CH2)q-О-(CH2)p-R12, -(CH2)q-SH, -(CH2)q-S-алкил, -(CH2)q-S-алкенил, -(CH2)q-S-алкинил,
-(CH2)q-S-(CH2)p-R12, -C(О)NH2, -C(О)OR13 или -C(Z1)(Z2)(Z3);
R12 представляет собой H, алкил, алкенил, арил, гетероарил, циклоалкил, циклоалкенил или гетероциклил;
R13 представляет собой H, алкил, алкенил или LR12;
Z1 представляет собой галоген;
Z2 и Z3 независимо друг от друга представляют собой H или галоген;
p - это число, в каждом случае независимое, от 0 до 8 и
q - это число, в каждом случае независимое, от 1 до 8.
В определенных предпочтительных вариантах реализации R6 представляет собой CN, CHO или C(=О)C(Z1)(Z2)(Z3), где Z1 представляет собой галоген, а Z2 и Z3 представляет собой H или галоген. В другом варианте реализации R6 представляет собой C(=О)C(Z1)(Z2)(Z3), где Z1 представляет собой фтор, а Z2 и Z3 представляют собой H или фтор.
В определенных предпочтительных вариантах реализации R5 представляет собой группу с формулой -B(Y1)(Y2), где Y1 и Y2 представляют собой независимо друг от друга OH или группу, гидролизующуюся до OH, или вместе с атомом бора, к которому они присоединены, образуют 5-8-членное кольцо, гидролизующееся до бороновой кислоты.
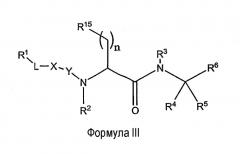
Другой объект данного изобретения относится к ингибитору протеаз, имеющему структуру Формулы III
или его фармацевтически приемлемую соль, где:
R1 представляет собой H, алкил, алкокси, алкенил, алкинил, амино, алкиламино, ациламино, циано, сульфониламино, ацилокси, арил, циклоалкил, гетероциклил, гетероарил или полипептидную цепь из 1-8 аминокислотного остатка;
R2 представляет собой H, низший алкил или аралкил;
R3 и R4 независимо друг от друга представляют собой H, галоген или алкил или R3 и R4 вместе с углеродом, к которому они присоединены, образуют 3-6-членное гетероциклическое кольцо;
R5 представляет собой H, галоген, низший алкил или аралкил, предпочтительно H или низший алкил;
R6 представляет собой функциональную группу, которая реагирует с остатком в активном сайте протеазы-мишени с образованием ковалентной связи;
R7 представляет собой H, арил, алкил, аралкил, циклоалкил, гетероциклил, гетероарил, гетероаралкил или полипептидную цепь из 1-8 аминокислотных остатков;
R15 - это функциональная группа, которая обладает положительным или отрицательным зарядом при физиологическом рН, предпочтительно амин или карбоновая кислота;
L отсутствует или представляет собой алкил, алкенил, алкинил, -(CH2)mO(CH2)m-, -(CH2)mNR2(CH2)m- и -(CH2)mS(CH2)m-;
X отсутствует или представляет собой -N(R7)-, -О- или -S-;
Y отсутствует или представляет собой -C(=О)-, -C(=S)- или -SО2-;
m - это число, в каждом случае независимое, от 0 до 10 и
n - это число от 1 до 6.
В определенных предпочтительных вариантах реализации R1 представляет собой H или низший алкил, R3 - это H, а R4 - низший алкил или R3 и R4 вместе с углеродом, к которому они присоединены, образуют 5-членное кольцо, а n - это число от 1 до 4.
В некоторых других предпочтительных вариантах реализации R1 представляет собой H или низший алкил, R3 представляет собой H, R4 представляет собой H или низший алкил, R5 представляет собой H, а n - это число от 1 до 4.
В определенных предпочтительных вариантах реализации, где X, Y и L отсутствуют, R1 является полипептидной цепью из 2-8 аминокислотных остатков, в которой пролин является остатком, который непосредственно присоединен к крайнему левому остатку в Формуле II. В некоторых таких вариантах реализации R1 является полипептидной цепью из 2 аминокислотных остатков, в которой пролин является остатком, который непосредственно присоединен к крайнему левому азоту в Формуле II.
В некоторых предпочтительных вариантах реализации n - это число от 1 до 4, а R15 является функциональной группой, которая имеет положительный или отрицательный заряд при физиологическом pH. В более предпочтительных вариантах реализации n - это число от 1 до 4, а R15 выбран из амина, карбоновой кислоты, имидазола и гуанидиновой функциональной группы.
В определенных вариантах реализации R6 представляет собой бороновую кислоту, -CN, -SO2Z1, -P(=О)Z1, -P(=R8)R9R10, -C(=NH)NH2, -CH=NR11 или -C(=О)-R11, где:
R8 - это O или S;
R9 представляет собой N3, SH2, NH2, NО2 или OLR12 и
R10 представляет собой низший алкил, аминогруппу, OLR12 или их фармацевтически приемлемую соль, или
R9 и R10 вместе с фосфором, к которому они присоединены, образуют 5-8-членное гетероциклическое кольцо;
R11 представляет собой H, алкил, алкенил, алкинил, NH2, -(CH2)p-R12, -(CH2)q-OH, -(CH2)q-О-алкил, -(CH2)q-О-алкенил, -(CH2)q-О-алкинил,
-(CH2)q-О-(CH2)p-R12, -(CH2)q-SH, -(CH2)q-S-алкил, -(CH2)q-S-алкенил, -(CH2)q-S-алкинил,
-(CH2)q-S-(CH2)p-R12, -C(О)NH2, -C(О)OR13 или -C(Z1)(Z2)(Z3);
R12 представляет собой H, алкил, алкенил, арил, гетероарил, циклоалкил, циклоалкенил или гетероциклил;
R13 представляет собой H, алкил, алкенил или LR12;
Z1 представляет собой галоген;
Z2 и Z3 независимо друг от друга представляют собой H или галоген;
p - это число, независимое в каждом случае, от 0 до 8 и
q - это число, независимое в каждом случае, от 1 до 8.
В определенных предпочтительных вариантах реализации R6 представляет собой CN, CHO или C(=О)C(Z1)(Z2)(Z3), в котором Z1 представляет собой галоген, а Z2 и Z3 представляют собой H или галоген. В других вариантах реализации R6 представляет собой C(=О)C(Z1)(Z2)(Z3), где Z1 представляет собой фтор, а Z2 и Z3 представляют собой H или фтор.
В некоторых предпочтительных вариантах реализации R6 представляет собой группу с формулой -B(Y1)(Y2), где Y1 и Y2 независимо друг от друга являются OH или группой, гидролизуемой до OH, или вместе с атомом бора, к которому они присоединены, образуют 5-8-членное кольцо, гидролизующееся до бороновой кислоты.
Еще один объект данного изобретения относится к ингибитору протеаз, имеющему структуру формулы IV:
или его фармацевтически приемлемую соль, где
A выбран из 4-8-членного гетероцикла, включающего в себя N и Cα углерод;
Z - это C или N;
W выбран из CN, -CH=NR5, функциональной группы, которая реагирует с остатком в активном сайте протеазы-мишени,
R1 выбран из присоединенного к C-концу аминокислотного остатка или аналога аминокислотного остатка, присоединенного к С-концу пептида или аналога пептида, аминопротектирующей группы,
R2 представляет собой один или более заместителей в кольце A, каждый из которых независимо друг от друга выбран из галогена, низшего алкила, низшего алкенила, низшего алкинила, низшего алкокси, низшего гидроксиалкила, низшего алкоксиалкила, карбонила, тиокарбонила, амино, ациламино, амидо, циано, нитро, азидо, сульфата, сульфоната, сульфонамидо, -(CH2)m-R7, -(CH2)m-OH, -(CH2)m-O-низшего алкила, -(CH2)m-O-низшего алкенила, -(CH2)n-O-(CH2)m-R7, -(CH2)m-SH, -(CH2)m-S-низшего алкила, -(CH2)m-S-низшего алкенила или
-(CH2)n-S-(CH2)m-R7, где по меньшей мере один из R2 выбран из -OH, низшего алкила, низшего алкокси, низшего гидроксиалкила и низшего алкоксиалкила, предпочтительно по меньшей мере один из низшего алкила (например, метила), низшего алкокси, низшего гидроксиалкила (например, гидроксиметила) и низшего алкоксиалкила;
когда Z - это N, R3 - это водород;
когда Z - это C, R3 выбран из водорода, галогена, низшего алкила, низшего алкенила, низшего алкинила, карбонила, тиокарбонила, амино, ациламино, амидо, циано, нитро, азидо, сульфата, сульфоната, сульфонамидо, -(CH2)m-R7, -(CH2)m-OH, -(CH2)m-О низшего алкила, -(CH2)m-O-низшего алкенила, -(CH2)n-О-(CH2)m-R7, -(CH2)m-SH, -(CH2)m-S- низшего алкила, -(CH2)m-S-низшего алкенила и -(CH2)n-S-(CH2)m-R7;
R5 выбран из водорода, алкила, алкенила, алкинила, -C(X1)(X2)X3, -(CH2)m-R7, -(CH2)n-OH, -(CH2)n-O-алкила, -(CH2)n-O-алкенила, -(CH2)n-O-алкинила, -(CH2)n-O-(CH2)m-R7, -(CH2)n-SH, -(CH2)n-S-алкила, -(CH2)n-S-алкенила, -(CH2)n-S-алкинила, -(CH2)n-S-(CH2)m-R7, -C(O)C(O)NH2 и -C(O)C(O)OR7';
R6 выбран из водорода, галогена, алкила, алкенила, алкинила, арила, -(CH2)m-R7, -(CH2)m-OH, -(CH2)m-O-алкила, -(CH2)m-O-алкенила, -(CH2)m-O-алкинила, -(CH2)m-O-(CH2)m-R7, -(CH2)m-SH, -(CH2)m-S-алкила, -(CH2)m-S-алкенила, -(CH2)m-S-алкинила или -(CH2)m-S-(CH2)m-R7,
каждый R7 выбран независимо от других из арила, аралкила, циклоалкила, циклоалкенила и гетероциклила;
каждый R7' выбран независимо от других из водорода, алкила, алкенила, арила, аралкила, циклоалкила, циклоалкенила и гетероциклила;
R8 и R9 каждый выбран независимо из водорода, алкила, алкенила, -(CH2)m-R7, -C(=О)-алкила, -C(=О)-алкенила, -C(=О)-алкинила и -C(=О)-(CH2)m-R7; или
R8 и R9 вместе с атомом N, к которому они присоединены, завершают гетероциклическое кольцо, имеющее от 4 до 8 атомов в структуре кольца;
R50 - это O или S;
R51 выбран из N3, SH, NH2, NО2 и OR7';
R52 выбран из водорода, низшего алкила, амина, OR7' или их фармацевтически приемлемой соли или
R51 и R52 вместе с атомом P, к которому они присоединены, завершают гетероциклическое кольцо, имеющее в структуре кольца от 5 до 8 атомов;
X1 - это галоген;
X2 и X3 каждый выбраны из водорода и галогена;
Y1 и Y2 каждый независимо от другого выбраны из OH и группы, гидролизующейся до OH, включая в себя циклические производные, в которых Y1 и Y2 соединены в кольце, имеющем от 5 до 8 атомов в структуре кольца;
m равно нулю или являются числом в диапазоне от 1 до 8 и
n - это число в диапазоне от 1 до 8.
В некоторых из вышеупомянутых вариантов реализации ингибитор протеаз ингибирует DPIV с Ki 50 нМ или менее.
В некоторых вариантах реализации ингибитор является активным при оральном введении.
В некоторых вариантах реализации на человеке ингибитор имеет терапевтический индекс по меньшей мере 2, а более предпочтительно 5, 10 или даже 100, например, как терапевтический индекс в отношении регуляции метаболизма глюкозы.
Другой объект данного изобретения представляет фармацевтическую композицию, включающую в себя фармацевтически приемлемый носитель и один или более ингибиторов протеазы, являющихся предметом изобретения, или его фармацевтически приемлемую соль, или его пролекарство.
Другой объект данного изобретения представляет использование одного или более ингибиторов, являющихся предметом данного изобретения, для получения лекарственного средства, ингибирующего фермент, расщепляющий белок in vivo после пролина. Например, рассматриваемые ингибиторы могут быть использованы для производства лекарственных средств, повышающих в плазме концентрации одного или более пептидных гормонов, подвергшихся действию ферментов, расщепляющих белок после пролина (например, DP-IV и подобные). Эти типичные лекарственные средства полезны для повышения концентраций в плазме таких гормонов, как глюкагоноподобный пептид, NPY (нейропептид Y), PPY, секретин, глюкагоноподобный пептид (GLP-1), GLP-2 и GIP.
В некоторых предпочтительных вариантах реализации рассматриваемые ингибиторы могут быть использованы для производства медикаментов, регулирующих метаболизм глюкозы, таких как используемые в лечении пациентов, страдающих от диабета II типа, резистентности к инсулину, непереносимости к глюкозе, гипергликемии, гипогликемии, гиперинсулинемии, ожирения, гиперлипидемии или гиперлипопротеинемии.
Еще один объект данного изобретения представляет упаковку фармацевтического изделия, включающую в себя: препарат одного или более рассматриваемых ингибиторов протеаз; если необходимо - фармацевтически приемлемый носитель и письменную или выполненную в форме рисунков инструкцию, описывающую использование препарата для ингибирования фермента, расщепляющего белок после пролина in vivo, такого, как регулирующий метаболизм глюкозы.
Упаковка фармацевтического препарата может также включать в себя, например, в виде совместной формы с ингибитором протеаз или просто совместной упаковки с ингибитором протеаз, инсулина и/или инсулинотропного агента.
Упакованный фармацевтический препарат может также включать в себя, например, в виде совместной формы с ингибитором протеаз или просто совместной упаковки с ингибитором протеаз, антагонист M1-рецептора, ингибитор пролактина, агенты, действующие на ATФ-зависимые калиевые каналы β-клеток, метформин и/или ингибиторы гликозидазы.
Данное изобретение также относится к улучшенным способам долговременного уменьшения и ослабления по меньшей мере одного из вышеупомянутых заболеваний, основанным на терапевтическом режиме введения в течение короткого периода.
Данное изобретение также представляет способ регуляции и изменения на долговременной основе глюкозной и липогенной реакций позвоночных животных, включая в себя человека.
В частности, соединения по данному изобретению могут быть использованы для разработки способов получения долговременных позитивных изменений в одном или более из нижеследующих показателей: чувствительности клеточного ответа данного биологического вида на инсулин (уменьшение резистентности к инсулину), уровня инсулина в крови, гиперинсулинемии, уровня глюкозы в крови, размера жировых отложений в теле и уровня липопротеинов в крови, обеспечивая таким образом эффективное лечение диабета, ожирения и/или атеросклероза.
Краткое описание чертежей
Фиг. 1 показывает ингибирование DPIV под действием Lys-борPro в трех разных дозах в течение 120 минут.
Фиг. 2 показывает ингибирование DPIV [под действием] Arg-борPro в трех разных дозах в течение 120 минут.
Подробное описание
I. Обзор
Данное изобретение относится к ингибиторам ферментов, расщепляющих белок после пролина (PPCE), таких как ингибиторы дипептидил пептидазы IV, также как к их фармацевтическим композициям и способам использования таких ингибиторов. Прототип этих молекул имеет кислую аминокислоту и электрофильный сайт, несущий различные боковые цепи.
Существенные характеристики соединений по данному изобретению включают в себя: лучшие терапевтические индексы, частично благодаря уменьшению токсичности и/или улучшенной специфичности к протеазе-мишени; лучшая доступность орального [введения]; увеличенный срок хранения; и/или увеличенную длительность действия (такая как доза разовой оральной формы, которая эффективна в течение более, чем 4 часов, а более предпочтительно в течение более, чем 8, 12 или 16 часов).
Соединения по данному изобретению могут быть использованы как часть лечения различных заболеваний/состояний, таких как опосредованные DPIV. Например, рассматриваемые ингибиторы могут быть использованы для повышения активности GIP и GLP-1, например, путем увеличения времени полужизни этих гормонов; как часть лечения с целью регуляции уровня глюкозы и/или метаболизма, например, для снижения резистентности к инсулину, коррекции гипергликемии, гиперинсулинемии, ожирения, гиперлипидемии, гиперлипопротеинемии (такой как хиломикроны, липопротеины очень низкой плотности (VLDL) и липопротеина низкой плотности (LDL)) и регулирования жира в организме или, в более общем смысле, липидных запасников, а в еще более общем смысле, для коррекции нарушений метаболизма, особенно таковых, связанных с диабетом, ожирением и/или атеросклерозом.
Вне зависимости от какой-либо специфической теории наблюдается, что соединения, которые ингибируют DPIV, соответственно, способны усиливать переносимость глюкозы, хотя и не обязательно через механизмы, вовлекающие само по себе ингибирование DPIV. Действительно, было показано, что сходные соединения эффективны на мышах, у которых отсутствует рецептор GLP-1, это предполагает, что рассматриваемый способ может не включать в себя механизм действия, непосредственно вовлекающий сам по себе GLP-1, хотя нельзя исключать, что к GLP-1 могут существовать другие рецепторы. Однако, в свете корреляции с ингибированием DPIV, в предпочтительных вариантах реализации рассматриваемый способ использует агент с Ki для ингибирования DPIV 50,0 нM или менее, более предпочтительно - 10,0 нM или менее и даже более предпочтительно 1,0, 0,1 или даже 0,01 нМ или менее. Действительно, рассматриваются ингибиторы со значениями Ki в пикомолярном и даже фемтомолярном диапазоне. Таким образом, хотя активные агенты для удобства описаны в данном документе как «ингибиторы DPIV», следует понимать, что такая номенклатура не направлена на ограничение объекта данного изобретения конкретным механизмом действия.
Определенные из рассматриваемых соединений обладают продленным действием. Соответственно, в некоторых предпочтительных вариантах реализации ингибитор (ингибиторы) выбран, а количество ингибитора подобрано так, чтобы обеспечить дозировку, которая ингибирует уровень сывороточного PPCE (ферменты, расщепляющие белок после пролина) (например, DPIV) по меньшей мере на 50 процентов по меньшей мере на 4 часа после приема разовой дозы, и даже более предпочтительно по меньшей мере на 8 часов или даже на 12 или 16 часов после приема разовой дозы.
Например, в определенных вариантах реализации способ включает в себя введение ингибитора DPIV, предпочтительно в предопределенный момент (моменты) времени в 24-часовой период в количествах, эффективных для улучшения одного или более аберрантных показателей, связанных с нарушением метаболизма глюкозы (например, непереносимость глюкозы, резистентность к инсулину, гипергликемия, гиперинсулинемия и диабет I и II типа).
В других вариантах реализации способ вовлекает введение ингибитора DPIV в количестве, эффективном для улучшения аберрантных показателей, связанных с ожирением. Жировые клетки выделяют гормон лептин, который с кровотоком направляется в мозг и через находящиеся там рецепторы лептина стимулирует продукцию GLP-1. GLP-1, в свою очередь, вызывает ощущение насыщения. Наиболее признанная теория состоит в том, что жировые клетки у людей с наиболее выраженным ожирением продуцируют достаточное количество лептина, но лептин не может нормально связываться с рецепторами лептина в мозге и, таким образом, не стимулирует продукцию GLP-1. Соответственно, существует большое количество исследований по использованию препаратов GLP-1 для подавления аппетита. Рассматриваемый способ представляет средства для увеличения времени полужизни и эндогенного, и добавленного извне GLP-1 при лечении нарушений, связанных с ожирением.
В более общем смысле данное изобретение представляет способ и композиции для изменения фармакокинетики множества различных полипептидных гормонов путем ингибирования протеолиза одного или более пептидных гормонов под действием DPIV
или какой-либо иной протеолитической активности. Постсекреторный метаболизм является важным элементом в общем гомеостазе регуляторных пептидов, и другие ферменты, вовлеченные в эти процессы, могут быть подходящими мишенями для фармакологического вмешательства с помощью рассматриваемого способа.
Например, рассматриваемый способ может быть использован для увеличения времени полужизни других происходящих из проглюкагона пептидов, таких как глицентин (соответствующий PG 1-69), оксинтомодулин (PG 33-69), родственный глицентину панкреатический полипептид (GRPP, PG 1-30), промежуточный пептид-2 (IP-2, PG 111-122амид) и глюкагоноподобный пептид-2 (GLP-2, PG 126-158).
GLP-2, например, был идентифицирован как фактор, ответственный за индукцию пролиферации кишечного эпителия. См., например, Drucker et al. (1996) PNAS 93:7911. Рассматриваемый способ может быть использован как часть режима, направленного на лечение повреждений, воспаления или при резекции кишечной ткани, например, в тех случаях, когда желательны усиленный рост и восстановление слизистого эпителия кишечника, как при лечении болезни Крона или воспалительной болезни кишечника (IBD).
DPIV также вовлечен в метаболизм и инактивацию релизинг-фактора гормона роста (GHRF). GHRF является членом семейства гомологичных пептидов, которое включает в себя глюкагон, секретин, вазоактивный кишечный пептид (VIP), пептид гистидин изолейцин (PHI), гипофизарный пептид, активирующий аденилатциклазу (PACAP), желудочный ингибиторный пептид (GIP) и хелодермин (Kubiak et al. (1994) Peptide Res 7:153). GHRF секретируется гипоталамусом и стимулирует выделение гормона роста (GH) из передней доли гипофиза. Таким образом, рассматриваемый способ может быть использован для улучшения клинической терапии некоторых детей с дефицитом гормона роста и клинической терапии взрослых для улучшения питания и изменения состава организма (отношение мышц к жировой ткани). Рассматриваемый способ может также быть использован в ветеринарной практике, например, для получения повышенного выхода молочной продукции и увеличения привесов скота.
Подобным образом ингибиторы DPIV по рассматриваемому изобретению могут быть использованы для изменения времени полужизни в плазме секретина, VIP, PHI, PACAP, GIP и/или хелодермина. Дополнительно, рассматриваемый способ может быть использован для изменения фармакокинетики пептида YY и нейропептида Y1, которые оба являются членами семейства панкреатических полипептидов, поскольку DPIV вовлечен в процессинг этих полипептидов, таким образом, что меняется селективность рецептора.
В других вариантах реализации рассматриваемые ингибиторы могут быть использованы для стимулирования гематопоэза.
В иных вариантах реализации рассматриваемые ингибиторы могут быть использованы для ингибирования роста и васкуляризации трансформированных клеток/тканей, например, для ингибирования клеточной пролиферации, такой как связанная с ростом опухолей и метастазов, и для ингибирования ангиогенеза в ненормально пролиферирующей клеточной массе.
В других вариантах реализации рассматриваемые ингибиторы также могут быть использованы для уменьшения иммунологических ответов, например, как иммуносупрессоры.
Помимо того, в других случаях ингибиторы DPIV в соответствии с данным изобретением могут быть использованы для лечения заболеваний ЦНС, таких как инсульты, опухоли, ишемия, болезнь Паркинсона, потеря памяти, потеря слуха, утрата зрения, мигрени, травма мозга, травма спинного мозга, болезнь Альцгеймера и http://www.multitran.ru/c/m.exe?t=357045_2_1 (http://www.multitran.ru/c/m.exe?t=357046_2_1, которая имеет центральный компонент). Дополнительно, ингибиторы DPIV могут быть использованы для лечения заболеваний, имеющих более периферическую природу, включая в себя рассеянный склероз и диабетическую невропатию.
Другой объект данного изобретения относится к фармацевтическим композициям рассматриваемых ингибиторов ферментов, расщепляющих белок после пролина, особенно ингибиторов DPIV, и их использованию в лечении и/или предупреждении заболеваний, которые могут быть корригированы изменением гомеостаза пептидных гормонов. В предпочтительном варианте реализации ингибиторы имеют гипогликемическую и антидиабетическую активность и могут быть использованы в лечении заболеваний, характеризующихся аберрантным метаболизмом глюкозы (включая в себя ее депонирование). В особых вариантах реализации композиции по рассматриваемым способам пригодны в качестве инсулинотропных агентов или для потенцирования инсулинотропных эффектов таких молекул, как GLP-1. В этом смысле определенные варианты реализации данных композиций могут быть полезны для лечения и/или профилактики разнообразных заболеваний, включая в себя одно или более из: гиперлипидемии, гипергликемии, ожирения, недостаточной пер