Способ получения пероксидированного наноразмерного силикагеля
Иллюстрации
Показать всеИзобретение относится к химии элементоорганических пероксидов, являющихся перспективными материалами для получения модифицированных полимеров. Способ получения пероксидированного наноразмерного силикагеля заключается во взаимодействии хлорированного наноразмерного силикагеля с гидропероксидом в присутствии основания в органическом растворителе при комнатной температуре. В качестве основания используют аммиак, а в качестве гидропероксида используют пероксид водорода, третбутилгидропероксид, геминальные бисгидропероксиды из ряда, включающего 1,1-бисгидропероксициклопентан, 1,1-бисгидропероксициклогексан или геминальные бисгидропероксиды общей формулы:
Изобретение позволяет упростить процесс получения пероксидированного наноразмерного силикагеля и улучшить его качество.
Реферат
Настоящее изобретение относится к области химии элементоорганических и органических пероксидов, конкретно к способу получения пероксидированного наноразмерного силикагеля с размером частиц 7-500 нанометров. Наноразмерные материалы (частицы) находят широкое применение для получения модифицированных полимеров с улучшенными механическими свойствами, повышенной теплостойкостью и электропроводностью [М.Alexandra, P.Dubois, Mater Sci Eng. 2000, 28,1; R.A.Varia, E.P.Gianellis, Macromolecules 1997, 30, 7990; H.Gleiter, Adv. Mater. 1992, 4, 474; B.M.Novak, Adv. Mater. 1993, 5, 422].
Полезное действие наноразмерных частиц основано на их фиксации в объеме полимера в результате физического взаимодействия на поверхности раздела матрица - наночастица. Фиксация наночастиц в объеме полимера в настоящее время осуществляется дорогостоящими и нетехнологичными процессами. Одно из решений этой задачи основано на переходе от физического взаимодействия к более надежному химическому связыванию. Наноразмерный пероксидированный силикагель является перспективным материалом для получения модифицированных полимеров, поскольку с его участием в процессе полимеризации одновременно проходят три процесса: инициирование полимеризации непредельных соединений с получением полимеров, ковалентное связывание наночастиц с макромолекулами полимера и структурирование полимера наночастицами. Подобное сочетание процессов создает принципиально новые материалы и технологии.
Известен способ получения пероксидированного третбутилгидропероксидом наноразмерного силикагеля, основанный на обработке хлорированного наноразмерного силикагеля третбутилгидропероксидом в диоксане в присутствии основания - бикарбоната натрия в атмосфере сухого азота без доступа света при температуре 20°С в течение 12 часов с многократным промыванием пероксидированного силикагеля метанолом (для удаления неорганических солей) и последующей сушкой в вакууме [A.Kasseh, A.Ait-Kadi, В.Riedl, J.F.Pierson. Polymer. 2003, 44, 1367-1375]. Способ предполагает использование только одного гидропероксида, отличается большой продолжительностью процесса, достаточно сложной процедурой очистки, необходимостью интенсивного перемешивания, использования инертной атмосферы и ограничения доступа света.
Известен также и принят нами за прототип способ получения пероксидированного наноразмерного силикагеля пероксидированием третбутилгидропероксидом в присутствии бикарбоната натрия или пиридина (для нейтрализации хлороводорода) в растворителе, диэтиловом эфире. Реакции проводили при охлаждении ~0°С в течение 5 часов. Полученный пероксидированный силикагель выделяли фильтрованием и затем промыванием последовательно диэтиловым эфиром и водой с последующей сушкой в вакууме [S.Bachmann, H.Wang, К.Albert, R.Partch. Journal of Colloid and Interface Science. 2007, 309, 169-175].
Недостатком прототипа является использование бикарбоната натрия, который не растворим в диэтиловом эфире, вследствие чего нейтрализация образующейся на поверхности силикагеля хлороводородной кислоты протекает медленно и происходит кислотно-катализированный распад пероксидов. Что касается использования пиридина, то за счет молекул большего размера он медленнее диффундирует к реакционным центрам силикагеля, вследствие чего нейтрализация образующийся на поверхности силикагеля хлороводородной кислоты также протекает медленнее и происходит кислотно-катализированный распад пероксидов. Недостаточно быстрая нейтрализация кислоты приводит к ухудшению качества целевого продукта. Для замедления распада пероксидов в прототипе используют охлаждение реакционной массы льдом.
Кроме того, образующиеся соли в случае использования бикарбоната натрия или пиридина необходимо удалять от пероксидированного силикагеля промыванием водой, остатки которой затем довольно долго (в течение ночи) удаляют под вакуумом. В итоге получают силикагель с некоторым количеством воды, которая, как известно, прочно удерживается гидроксильными группами силикагеля, что также снижает качество целевого продукта.
Задачей настоящего изобретения является улучшение качества пероксидированного наноразмерного силикагеля, а также упрощение процесса его получения.
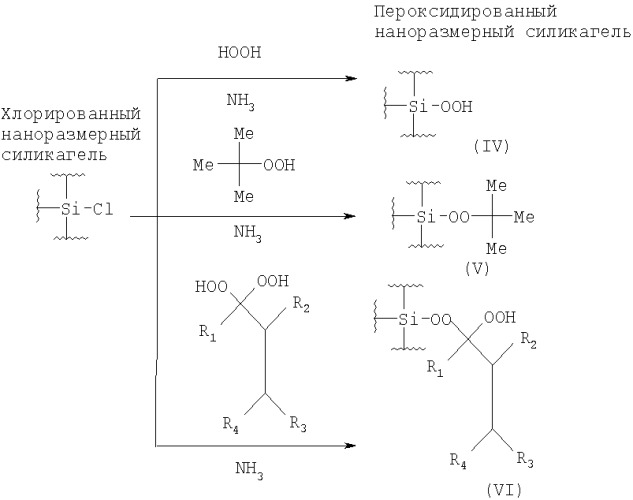
Поставленная задача достигается предлагаемым способом получения пероксидированного наноразмерного силикагеля путем взаимодействия хлорированного наноразмерного силикагеля с гидропероксидом в присутствии основания в органическом растворителе, отличительной особенностью которого является, что в качестве основания используют аммиак и процесс проводят при комнатной температуре.
Процесс проводят в органическом растворителе, например, в диэтиловом эфире или хлористом метилене при температуре 20-25°С в течение 4-6 часов. В качестве гидропероксида используют пероксид водорода (I), третбутилгидропероксид (II), геминальные бисгидропероксиды (III) из ряда, включающего 1,1-бисгидропероксициклопентан, 1,1-бисгидропероксициклогексан или геминальные бисгидропероксиды (III) общей формулы:
Процесс протекает по следующей схеме:
До настоящего времени геминальные бисгидропероксиды (III) никогда не использовали для пероксидирования силикагеля, полученные пероксиды (VI) являются новыми веществами.
Аммиак в процессе пероксидирования легко диффундирует к реакционным центрам силикагеля, что ускоряет пероксидирование и препятствует образованию в ходе синтеза кислой среды, способствующей распаду целевых пероксидов. Более высокая скорость диффузии аммиака делает результаты синтезов воспроизводимыми, не зависящими от интенсивности перемешивания реакционной массы. Ранее аммиак не использовался для пероксидирования хлорированного наноразмерного силикагеля. В предложенном процессе он выполняет две функции. Первая, как основание - акцептор хлороводорода, вторая, как катализатор замещения хлора, за счет образования активных комплексов (по типу sp3d) с атомом кремния, т.е. аммиак при пероксидировании наноразмерного силикагеля проявляет новое свойство.
Положительный результат пероксидирования при использовании аммиака был заведомо неочевиден, поскольку атомы кремния в хлорированном силикагеле могли бы образовывать с аммиаком прочные и низко реакционноспособные комплексы.
Применение предложенного метода получения наноразмерного силикагеля с использованием аммиака позволяет:
- проводить синтез при комнатной температуре,
- повысить качество целевого продукта за счет уменьшения разложения пероксидированного силикагеля в ходе синтеза и исключения водной обработки реакционной массы, которая приводит к увлажнению пероксидированного силикагеля и частичному его разложению,
- упростить процесс выделения и удаления остатков нейтрализации хлороводорода (по окончании реакции целевой продукт фильтруют, промывают метанолом и удаляют остатки летучих веществ при пониженном давлении 7-15 мм рт.ст. в течение часа),
- повысить воспроизводимость результатов реакции за счет их независимости от интенсивности перемешивания.
Изобретение иллюстрируется следующими примерами.
Пример 1. Приготовление хлорированного силикагеля.
К 1 г силикагеля с размером частиц от 7 до 500 нанометров добавляют 5 мл бензола и 4 г хлористого тионила (SOCl2), реакционную массу кипятят 48 часов. От хлорированного силикагеля отгоняют бензол, остатки хлористого тионила и другие летучие остатки в течение часа в вакууме 7-10 мм рт.ст. при температуре 50-60°С. Полученный хлорированный силикагель (~1 г) используют для пероксидирования.
Пример 2. Пероксидирование с использованием пероксида водорода (I). Получение продукта (IV).
Смешивают 1 г хлорированного силикагеля, 20 мл 6% эфирного раствора пероксида водорода и 20 мл 5% раствора аммиака в хлористом метилене. Перемешивают реакционную массу 4 часа при комнатной температуре (20°С). Пероксидированный силикагель фильтруют с использованием фильтровальной бумаги, промывают 3×3 мл метанола. Легколетучие остатки удаляют в вакууме водоструйного насоса (7-15 мм рт.ст.) при 20-25°С в течение часа. Остатки хлорида аммония, пероксида водорода и других возможных малолетучих продуктов удаляют в вакууме 0.1-0.5 мм рт.ст. при 20-25°С в течение часа. Получают ~1 г пероксидированного пероксидом водорода силикагеля (IV), содержащего по данным иодометрического титрования 6.9% активного кислорода.
Пример 3. Пероксидирование с использованием третбутилгидропероксида (II). Получение продукта (V).
Смешивают 1 г хлорированного силикагеля, 5 мл 35% эфирного раствора третбутилгидропероксида и 20 мл 5% раствора аммиака в диэтиловом эфире. Перемешивают реакционную массу 5 часов при комнатной температуре (20°С). Пероксидированный силикагель фильтруют с использованием фильтровальной бумаги, промывают 3×3 мл метанола. Легко летучие остатки удаляют в вакууме водоструйного насоса (7-15 мм. рт.ст.) при 20-25°С в течение часа. Остатки хлорида аммония, третбутилгидропероксида и других возможных малолетучих продуктов удаляют в вакууме 0.1-0.5 мм. рт.ст. при 20-25°С в течение часа. Получают ~1.05 г пероксидированного третбутилгидропероксидом силикагеля (V), содержащего по данным иодометрического титрования 6.2% активного кислорода.
Пример 5. Пероксидирование с использованием 1,1-бисгидропероксициклопентана (III). Получение одного из продуктов с общей формулой (VI).
Смешивают 1 г хлорированного силикагеля, 5 мл 20% раствора 1,1-бисгидропероксициклопентана и 20 мл 5% раствора аммиака в хлористом метилене. Перемешивают реакционную массу 6 часов при комнатной температуре (25°С). Пероксидированный силикагель фильтруют с использованием фильтровальной бумаги, промывают 3×3 мл метанола. Легколетучие остатки удаляют в вакууме водоструйного насоса (7-15 мм рт.ст.) при 20-25°С в течение часа. Остатки хлорида аммония, 1,1-бисгидропероксициклопентана и других возможных малолетучих продуктов удаляют в вакууме 0.1-0.5 мм рт.ст. при 20-25°С в течение часа. Получают ~1.1 г пероксидированного 1,1-бисгидропероксициклопентаном силикагеля (VI), содержащего по данным иодометрического титрования 5.2% активного кислорода.
Пример 6. Пероксидирование с использованием 1,1-бисгидропероксициклогексана (III). Получение одного из продуктов с общей формулой (VI).
Смешивают 1 г хлорированного силикагеля, 5 мл 20% раствора 1,1-бисгидропероксициклогексана и 20 мл 5% раствора аммиака в хлористом метилене. Перемешивают реакционную массу 6 часов при комнатной температуре (20°С). Пероксидированный силикагель фильтруют с использованием фильтровальной бумаги, промывают 3×3 мл метанола. Легколетучие остатки удаляют в вакууме водоструйного насоса (7-15 мм рт.ст.) при 20-25°С в течение часа. Остатки хлорида аммония, 1,1-бисгидропероксициклогексана и других возможных малолетучих продуктов удаляют в вакууме 0.1-0.5 мм. рт.ст. при 20-25°С в течение часа. Получают ~1.1 г пероксидированного 1,1-бисгидропероксициклогексаном силикагеля (VI), содержащего по данным иодометрического титрования 5.9% активного кислорода.
1. Способ получения пероксидированного наноразмерного силикагеля путем взаимодействия хлорированного наноразмерного силикагеля с гидропероксидом в присутствии основания в органическом растворителе, отличающийся тем, что в качестве основания используют аммиак и процесс проводят при комнатной температуре.
2. Способ по п.1, отличающийся тем, что в качестве гидропероксида используют пероксид водорода, третбутилгидропероксид, геминальные бисгидропероксиды из ряда, включающего 1,1-бисгидропероксициклопентан, 1,1-бисгидропероксициклогексан или геминальные бисгидропероксиды общей формулы: