Энантиоселективный способ получения производных сульфоксидов
Иллюстрации
Показать всеИзобретение касается энантиоселективного получения производных сульфоксидов или их солей. Способ заключается в осуществлении энантиоселективного окисления сульфида общей формулы (I), представленной ниже: , в которой А обозначает различно замещенный пиридинильный цикл и В - гетероциклический остаток, содержащий имидазопиридинильный цикл, окислителем в присутствии катализатора на основе титана(IV) и хирального лиганда, представляющего собой циклический бета- или гамма-аминоспирт, в органическом растворителе, в случае необходимости, с последующим превращением в соль при помощи основания. Технический результат: описан способ получения сульфоксидов их солей, обладающих асимметрией на уровне атома серы, дающий один или другой из энантиомеров с хорошей селективностью. 20 з.п. ф-лы.
Реферат
Настоящее изобретение касается энантиоселективного способа получения замещенных производных сульфоксидов и, более конкретно, энантиоселективного способа получения таких соединений как энантиомеры тенатопразола и других сравнимых сульфоксидов.
Известны различные производные сульфоксидов, в частности пиридинилметилсульфинилбензимидазолы, применяемые в терапии в качестве лекарств, обладающих ингибирующими свойствами по отношению к протонной помпе, то есть лекарств, которые ингибируют секрецию желудочного сока и которые применяют при лечении язв желудка и двенадцатиперстной кишки. Первым известным производным из ряда ингибиторов протонной помпы является омепразол или 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил]-1Н-бензимидазол, описанный в европейском патенте ЕР 005129, который обладает ингибирующими свойствами по отношению к секреции желудочного сока и является широко применяемым в качестве противоязвенного средства в терапии человека. Другие производные бензимидазола с подобной структурой известны под их родовыми названиями, например, рабепразол, пантопразол, лансопразол, которые обладают всей структурной аналогией и относятся к группе пиридинилметилсульфинилбензимидазолов.
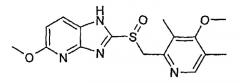
Тенатопразол, то есть 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил]имидазо[4,5-b]пиридин, описан в европейском патенте ЕР 254588. Он также является частью лекарственных средств, рассматриваемых в качестве ингибиторов протонной помпы, и он также может быть использован при лечении желудочно-пищеводного рефлюкса, кровотечений из пищеварительного тракта и диспепсий. Однако тенатопразол структурно отличается от других вышеупомянутых ингибиторов протонной помпы тем, что он содержит имидазопиридинильный цикл вместо бензимидазольного цикла.
Все упомянутые соединения представляют собой сульфоксиды, обладающие асимметрией на уровне атома серы, и могут, следовательно, находиться в форме рацемической смеси двух энантиомеров. Может быть полезным выделить их селективно в форме одного или другого из двух энантиомеров, имеющих конфигурации R и S, или (+) или (-), специфические свойства которых могут быть существенно разными. Так, в международной заявке на патент WO 2004060891 описан энантиомер S тенатопразола.
В научной литературе были описаны различные способы получения, селективно или преимущественным образом, одного или другого из энантиомеров упомянутых сульфоксидов, в частности омепразола и его энентиомера с конфигурацией S, изомепразола, а также его солей, таких как натриевая или магниевая соли.
Так, в европейском патенте ЕР 652872 описан способ получения магниевой соли энантиомера (-) омепразола через сложный эфир, содержащий хиральную ацилоксиметильную группу, разделение диастереоизомеров и сольволиз в щелочном растворе. В американском патенте US 5776765 описан способ, использующий стереоселективное биовосстановление рацемической смеси сульфоксида в соответствующий сульфид микроорганизмом, содержащим ДМСО-редуктазу (DMSO), позволяющий получить смесь, сильно обогащенную энантиомером (-) по отношению к энантиомеру (+).
Каган с соавторами (H. Kagan et al.) описали систему асимметричного окисления сульфидов в сульфоксиды, катализируемую оптически активным комплексом изопропилата титана и диэтилтартрата, используя трет-бутилгидропероксид в качестве окислителя в присутствии воды при температуре меньше 0°С [см. P. Pitchen et al., J. Am. Chem. Soc., 106, pp.8188-93(1984)]. C. Зао, О. Самюель и Г. Каган [S. Zhao, O. Samuel et H. Kagan, Tetrahedron vol. 43, pp.5135-44 (1987)] показали, что энантиоселективность может быть улучшена при использовании в тех же самых реакционных условиях гидропероксида кумола. Различные варианты метода Кагана были развиты, и, например, американский патент US 5948789 касается энантиоселективного получения различных сульфоксидов, более конкретно энантиомера (-) омепразола или его натриевых солей, окислением соответствующего сульфида («прохиральный» сульфид) окислителем в особом растворителе, таком как толуол и этилацетат, в присутствии основания, причем реакция катализируется комплексным соединением титана, полученным, исходя из соединения титана(IV) предпочтительно изопропилата титана, и хирального лиганда, выбранного среди алифатических диолов и ароматических диолов, в частности L(+)- или D(-)-диэтилтартрата, в присутствии воды. Добавление в реакционную среду основания позволяет улучшить энантиоселективность реакции окисления сульфида в сульфоксид. Способ, описанный в данном патенте, позволяет получить смесь, обогащенную одним или другим из энантиомеров (-) и (+) сообразно используемому лиганду.
Метод Кагана, упомянутый выше, а также его варианты позволяют легко получать энантиоселективным образом сульфоксиды, имеющие структуру типа бензимидазола, такие как омепразол и его энантиомеры. Напротив, в случае сульфоксидов имидазопиридинильного типа низкая растворимость сульфидов в обычных растворителях, таких как толуол, делает реакционную среду гетерогенной, что сопровождается потерей селективности и значительным образованием сульфона, порядка 30%.
Более конкретно некоторые сульфиды, в частности прохиральный сульфид тенатопразола, являются слаборастворимыми в обычных растворителях, таких как толуол и метиленхлорид, и выбор растворителя часто создает трудности. Так, в книге “Asymmetric Catalysis on Industrial Scale” H.U. Blaser, E. Schmidt, 2004 Wiley-VCH Verlag Gmbh & Co. KG, Grunstadt, ch.7, p.413 указывают, что апротонные и полярные растворители оказывают неблагоприятное воздействие на асимметричное окисление сульфидов с пиридинилметилбензимидазольной структурой в таких каталитических системах, как описанные выше.
Таким образом, остается желательным иметь в распоряжении способ, позволяющий получать энантиомеры сульфоксидов с имидазопиридинильной структурой с достаточным энантиомерным избытком, избегая образования сульфонов, в хороших условиях по выходу и чистоте, действуя в растворителях, пригодных для применения в промышленных масштабах, и обеспечивающий приемлемую производительность.
Исследования, проведенные фирмой-заявителем, позволили показать, что можно получать энантиомеры производных сульфоксидов, и в частности тенатопразола и сульфоксидов с подобной структурой, с отличным энантиомерным избытком, в хороших условиях по выходу, энантиоселективным окислением соответствующего прохирального сульфида в присутствии специфического комплекса на основе титана, без того, чтобы было необходимо добавлять в реакционную среду основание.
Таким образом, предметом настоящего изобретения является энантиоселективный способ получения производных сульфоксидов и их солей, обладающих асимметрией на уровне атома серы, дающий один или другой из энантиомеров с хорошей селективностью и удовлетворительным выходом.
Совершенно конкретно предметом изобретения является способ получения, позволяющий существенно энантиоселективным образом получать энантиомер (-) и энантиомер (+) тенатопразола и их соли. Выражение «существенно энантиоселективным образом», использованное здесь, означает, что желаемый энантиомер получают селективно или в преобладающем количестве по отношению к другому энантиомеру, то есть, что энантиомерный избыток больше или равен 90% предпочтительно больше 95% и, более конкретно, больше 98%.
В соответствии со способом согласно изобретению осуществляют энантиоселективное окисление сульфида общей формулы (I), приведенной ниже,
| A-CH2-S-B | (I) |
в которой А обозначает различно замещенный пиридинильный цикл и В - гетероциклический остаток, содержащий имидазопиридинильный цикл, окислителем в присутствии катализатора на основе титана(IV) и хирального лиганда, представляющего собой циклический бета- или гамма-аминоспирт, в органическом растворителе, в случае необходимости, с последующим превращением в соль при помощи основания.
В общей формуле (I), приведенной выше, А обозначает предпочтительно пиридинильную группу или пиридинильную группу, несущую один или несколько заместителей, выбранных среди следующих групп: линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода; линейная или разветвленная алкоксигруппа, содержащая от 1 до 6 атомов углерода; метил или этил, замещенный одним или несколькими атомами галогена; аминогруппа; алкиламино или диалкиламиногруппа, в которой алкильная часть, линейная или разветвленная, содержит от 1 до 5 атомов углерода; B обозначает имидазо-[4,5-b]-пиридинильный гетероцикл, замещенный в известных случаях одной или несколькими алкильными группами, линейными или разветвленными, содержащими от 1 до 6 атомов углерода, линейной или разветвленной алкоксигруппой, содержащей от 1 до 6 атомов углерода, и предпочтительно замещенный у одного или нескольких атомов углерода метильной, этильной, метокси или тригалогенметильной группами.
В общей формуле (I), приведенной выше, А представляет собой предпочтительно 2-пиридинильную группу, замещенную одной или несколькими метильными, этильными, метокси или трифторметильными группами, и, более конкретно, 4-метокси-3,5-диметил-2-пиридинильную группу. Предпочтительно, В представляет собой 5-метоксиимидазо-[4,5-b]-пиридинильную группу.
В рамках настоящего изобретения под «циклическим бета- или гамма-аминоспиртом» подразумевают соединение, содержащее амино- или иминогруппу и гидроксильную группу или производное, при этом две указанные группы находятся в бета- или гамма-положении одна по отношению к другой, и их несет неароматический цикл, который сам может быть объединен с другим циклом, и в известных случаях содержит один или несколько гетероатомов.
Таким образом, получают сульфоксид общей формулы
| A-CH2-SO-B | (Ia) |
в которой А и В имеют определения, приведенные выше.
Исходный прохиральный сульфид, представленный выше формулой (I), представляет собой известный продукт, который может быть получен различными способами, описанными в литературе, и, например, способами, описанными в европейских патентах ЕР 254588 и ЕР 103553.
Окислитель, используемый в способе согласно изобретению, представляет собой, предпочтительно, гидропероксид, например гидропероксид кумола или гидропероксид третичного бутила. Согласно предпочтительной форме осуществления используют гидропероксид кумола. Согласно одному варианту в качестве окислителя можно использовать пероксид водорода с высокой концентрацией, по меньшей мере 30%, или пероксид водорода, связанный в комплекс с карбамидом (КПВ (UHP) или « карбамид пероксид водорода» H2NCONH2 . H2O2), ниже также обозначаемый КПВ; как указано далее, присутствие воды имеет следствием уменьшение селективности, но данное неудобство может быть, по меньшей мере, частично компенсировано добавлением в реакционную среду обычного дегидратирующего агента, такого как сульфат магния или натрия, или подходящего молекулярного сита.
Катализатор на основе титана представляет собой важный элемент способа согласно изобретению, который позволяет содействовать реакции и получать желаемое производное с хорошим выходом. Согласно изобретению предпочтительно используют катализатор, такой как комплексное соединение титана(IV), полученное, исходя из алкоголята титана, например изопропилата титана(IV) Ti(OiPr)4 или ацетилацетоната титана. Такие подходящие катализаторы на основе титана описаны в литературе и доступны в торговле.
Выбор лиганда представляет собой другой характеристический элемент изобретения, так как он является индуктором хиральности; он позволяет селективно направлять реакцию на желаемый энантиомер. Кроме того, он обусловливает хемоселективность реакции.
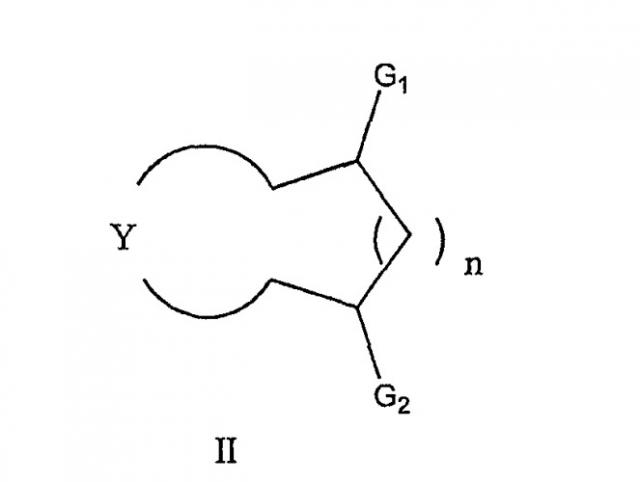
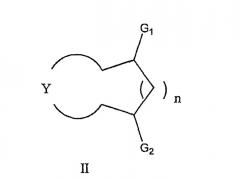
По способу согласно изобретению лиганд представляет собой циклический бета- или гамма-аминоспирт, который может быть представлен следующей общей формулой (II)
в которой G1 обозначает аминогруппу -NR1R2 или иминогруппу -N=CR1R2 и G2 обозначает группу -OR3 или наоборот; n равно 0 или 1; R1 и R2, одинаковые или разные, представляют собой, независимо один от другого, атом водорода или алкильную группу, линейную или разветвленную, содержащую от 1 до 6 атомов углерода, или арильную, гетероарильную, ацильную или сульфонильную группы, R3 обозначает атом водорода, алкильную группу, линейную или разветвленную, содержащую от 1 до 6 атомов углерода, или арильную группу, или гетероарильную группу, и Y обозначает циклический остаток.
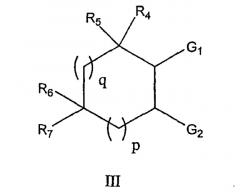
Циклический аминоспирт формулы (II) может представлять собой предпочтительно производное формулы (III), следующей ниже
в которой G1 и G2 имеют определения, приведенные выше; p и q, одинаковые или разные, равны 0, 1 или 2; R4, R5, R6 и R7, одинаковые или разные, представляют собой атом водорода или алкильную группу, линейную или разветвленную, содержащую от 1 до 6 атомов углерода, R4 и R6, и/или R5 и R7 вместе могут образовывать алифатический, ароматический или гетероароматический цикл, и R5 и R7 вместе могут образовывать простую связь или двойную связь с несущими их атомами углерода.
Предпочтительно, R4 и R6, R5 и R7 вместе образуют ароматический цикл, р равно 1 и q равно 0, чтобы образовать, например, производное типа аминоинданола.
В рамках настоящего изобретения:
- “арильная группа” обозначает, предпочтительно, моно- или полициклическую систему, включающую один или несколько ароматических циклов, среди которых можно назвать фенильную группу, нафтильную группу, тетрагидронафтильную группу, инданильную группу и бинафтильную группу; арильная группа может быть замещена 1-3 заместителями, выбранными независимо одни от других среди гидроксильной группы, алкильной группы, линейной или разветвленной, содержащей от 1 до 4 атомов углерода, такой как метил, этил, пропил или, предпочтительно, трет-бутил, нитрогруппы, (С1-С4)алкоксигруппы и атома галогена, такого как хлор, бром или иод;
- “гетероарильная группа” обозначает, предпочтительно, арильную группу, содержащую от 1 до 3 гетероатомов, таких как азот, сера или кислород, и в качестве такой гетероарильной группы можно назвать пиридинильную, пиразинильную, пиридазинильную, хинолильную, изохинолильную группы и т.д.;
- “гетероцикл” или “гетероциклическая группа” обозначает, предпочтительно, 5-членный или 6-членный цикл, содержащий от 1 до 3 гетероатомов, таких как сера, азот и кислород; данное определение, равным образом, заключает в себе бициклы, в которых гетероциклическая группа такая, как определенная перед этим, объединена с фенильной группой, циклогексановой группой или другим гетероциклом; среди гетероциклических групп можно назвать имидазолил, индолил, изоксазолил, фурил, пиразолил, тиенил и т.д.
Лиганды, предпочтительно используемые в изобретении, представляют собой напряженную циклическую неароматическую молекулярную структуру, несущую группы G1 и G2, которая может быть объединена с циклом. Проведенные исследования показали, что конформационное напряжение в лиганде указанного типа является основным параметром, благоприятствующим энантиоселективности.
Таким образом, оптически активный аминоспирт, используемый в настоящем изобретении в качестве лиганда, представляет собой, предпочтительно, бета-аминоспирт в относительной стереохимической цис-конфигурации, такой как, например, (1R, 2S)-цис-аминоинданол, 3-экзодиметиламиноборнеол и цис-2 аминоциклопентанол.
Более конкретно лиганд формулы (II) может представлять собой, в частности, (1S,2R)-(-)- или (1R,2S)-(+)-1-амино-2-инданол. Таким образом, использование данного лиганда позволяет селективно направлять реакцию окисления 5-метокси-2-[[4-метокси-3,5-диметил-2-пиридинил)метил]тио]имидазо[4,5-b]пиридина для того, чтобы селективно получить S-тенатопразол, как указано ниже.
В условиях опыта лиганд образует с металлическим катализатором асимметричный комплекс, в котором металл окислен окислителем.
Согласно одной форме осуществления способа согласно изобретению реакцию осуществляют в органическом растворителе или в смеси растворителей.
Органический растворитель является, предпочтительно, апротонным и полярным и может быть выбран среди N-метилпирролидона (N-МП)(NMP), диметилформамида (ДМФ)(DMF), диметилацетамида (ДМА)(DMA) и пиридина по отдельности или в смеси. Проведенные опыты неожиданно показали, что данные растворители, в случае асимметричного окисления сульфидов, содержащих имидазопиридинильную группу, способствуют энантиоселективности и лимитируют образование сульфонов.
Реакция окисления легко осуществляется при охлаждении или при комнатной температуре. Может быть более выгодным осуществлять реакцию при температуре, находящейся в интервале от -10°С до 30°С, предпочтительно, в интервале приблизительно от 0 до 25°С, чтобы способствовать энантиоселективности. Более высокая температура может вызывать снижение селективности. Например, в случае получения тенатопразола, исходя из соответствующего прохирального сульфида, в присутствии Ti(OiPr)4 и аминоинданола в N-МП, энантиомерный избыток уменьшается с 97 до 66%, когда температуру поддерживают в диапазоне от 20 до 40°С. Напротив, действуя при охлаждении при температуре, близкой к 0°С, его доводят до 99%.
Таким образом, каталитическая система титан/лиганд настоящего изобретения отличается от каталитических систем известных методик существующего уровня техники как в том, что касается используемого лиганда, так и в том, что касается условий осуществления реакции окисления.
Одним из преимуществ способа согласно изобретению является то, что порядок добавления реагентов и компонентов реакционной среды безразличен и заметно не сказывается ни на степени конверсии, ни на энантиоселективности. Согласно предпочтительной форме осуществления способа лиганд и катализатор на основе титана растворяют в растворителе, чтобы образовать каталитическую систему титан/лиганд, затем добавляют сульфид, в растворе в том же самом растворителе, и, наконец, добавляют окислитель. Согласно другому варианту согласно изобретению каталитическую систему титан/лиганд добавляют к сульфиду в две стадии, в начале и в ходе реакции, это значит, что новое добавление лиганда и катализатора на основе титана осуществляют во время реакции, которое, в известных случаях, сопровождается новым добавлением окислителя.
Способ согласно изобретению осуществляют, предпочтительно, в растворителе в нейтральной среде без необходимости добавления основания, но предпочтительно избегать работы в кислой среде, которая могла бы повлечь за собой разрушение конечного продукта. Проведенные опыты показали, что добавление основания к реакционной среде в условиях способа согласно изобретению не улучшает энантиоселективность и имеет тенденцию к уменьшению степени конверсии в сульфоксид. Таким образом, добавление диизопропилэтиламина имеет следствием уменьшение степени конверсии с более чем 60% до приблизительно 40%. Напротив, в известном способе, как это описано в вышеупомянутом американском патенте US 5948789, добавление основания, такого как триэтиламин и N,N-изопропилэтиламин, улучшает энантиоселективность реакции.
Кроме того, реакция окисления согласно изобретению не нуждается в присутствии воды, обычно требуемой для улучшения характеристик обычных способов. Таким образом, проведенные исследования показали, что совсем наоборот, добавление воды оказывает отрицательные воздействия на селективность реакции, способствуя образованию сульфона, на энантиоселективность, сильно ее уменьшая, и на степень конверсии, которая падает существенным образом. Более конкретно проведенные исследования показали, что присутствие воды, при этом другие условия остаются неизменными, имеет следствием уменьшение энантиомерного избытка с 99% до приблизительно 60%, в то время как содержание сульфона оказывается доведенным до более 7%.
Наконец, упрощение рабочих условий получения комплекса титан(IV)/аминоинданол является заслуживающей внимания частью выгоды настоящего изобретения. Согласно одному варианту способа согласно изобретению предварительное образование комплекса между титаном и хиральным лигандом может осуществляться в реакционной среде при комнатной температуре и не нуждается в предварительном созревании.
Способ согласно изобретению является особенно выгодным в той мере, в которой окислитель и катализатор являются широко доступными в торговле. Кроме того, катализатор может быть эффективно использован в очень малом количестве. Полученный выход энантиомера является превосходным, и, кроме того, катализатор и лиганд обычно могут быть возвращены в зону реакции в хороших условиях без потери энантиомерного избытка.
Способ согласно настоящему изобретению является особенно выгодным в случае получения энантиомеров тенатопразола, которые могут быть представлены следующей общей формулой
Так, например, следуя способу согласно изобретению, можно выгодно осуществить энантиоселективное окисление 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]тио]имидазо[4,5-b]пиридина гидропероксидом кумола или гидропероксидом третичного бутила в присутствии Ti(OiPr)4 и аминоинданола в N-МП с получением (-)-5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил]имидазо[4,5-b]пиридина, то есть тенатопразола, формула которого указана выше.
Более конкретно констатируют, что окисление вышеупомянутого сульфида позволяет получить энантиомер (-) в конфигурации S, в отличных условиях по степени чистоты и выходу, если используют катализатор на основе титана, ассоциированного с лигандом, представляющим собой (1R,2S)-цис-1-аминоиндан-2-ол, в растворе в ДМФ, N-МП, ДМА или пиридине.
Наоборот, изомер (+) в конфигурации R может быть получен также в отличных условиях по селективности и выходу, используя в качестве лиганда (1S,2R)-цис-1-аминоиндан-2-ол.
Энантиомеры S и R тенатопразола могут быть использованы в форме солей, в частности соли щелочного или щелочноземельного металла, и, например, в форме соли натрия, калия, лития, магния или кальция. Указанные соли могут быть получены, исходя из предварительно выделенного энантиомера S или R тенатопразола, реакцией солеобразования согласно обычному технологическому методу, например, действием минеральных реагентов основного характера, содержащих щелочные или щелочноземельные противоионы.
Энантиомер S тенатопразола соответствует (-)-5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]сульфинил]имидазо[4,5-b]пиридину, или (-)-тенатопразолу. Данная форма может быть определена измерениями оптического вращения согласно обычным методикам. Так, угол оптического вращения (-)-тенатопразола в диметилформамиде является левовращающим, и его температура плавления составляет 130°С (разложение).
Энантиомеры S и R тенатопразола при лечении патологий, указанных ниже, могут быть прописаны в обычных формах, приспособленных к выбранному способу введения, например пероральному приему или парентеральному введению, предпочтительно, пероральному приему или внутривенному введению.
Можно использовать, например, формы смесей в таблетках или желатиновых капсулах, содержащие один или другой из энантиомеров S и R тенатопразола в качестве действующего начала, или питьевые растворы, или эмульсии, или растворы для парентерального введения, содержащие соль тенатопразола с обычным фармацевтически приемлемым носителем. Соль энантиомера тенатопразола может быть выбрана, например, среди солей натрия, калия, лития, магния или кальция.
Энантиомеры S и R тенатопразола, полученные способом согласно настоящему изобретению, могут быть использованы для изготовления лекарств для лечения пищеварительных патологий, в частности патологий, при которых ингибирование секреции кислоты должно быть интенсивным и продолжительным, для лечения симптомов и патологических изменений желудочно-пищеводного рефлюкса, кровотечений из пищеварительного тракта, устойчивых к другим ингибиторам протонной помпы.
Дозировка определяется практикующим врачом в зависимости от состояния пациента и тяжести расстройства. Обычно она находится в интервале от 10 до 120 мг, предпочтительно, от 20 до 80 мг энантиомера S или R тенатопразола в день.
Примеры получения энантиомеров описаны ниже для того, чтобы проиллюстрировать настоящее изобретение, не ограничивая его объем патентной охраны.
Пример 1
Получение (S)-(-)-тенатопразола
(1R,2S)-(+)-1-Амино-2-инданол (22,8 мг, 0,151 ммоль), а также изопропилат титана(IV) (22 мкл, 0,076 ммоль) растворяют в безводном N-МП (0,65 мл).
Затем раствор 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]тио]имидазо[4,5-b]пиридина (100 мг, 0,303 ммоль) в N-МП добавляют к вышеупомянутому комплексному соединению при перемешивании при 20°С с последующим немедленным добавлением гидропероксида кумола (80%, 65 мкл, 0,352 ммоль).
Гомогенную смесь поддерживают при перемешивании при 20°С в течение 5 часов. Неочищенный продукт состоит из 60% сульфида, 2% сульфона и 38% сульфоксида с энантиомерным избытком (э.и.) 95% (анализ методом хиральной ВЭЖХ (HPLC)).
Энантиомерный избыток определяют жидкостной хроматографией при высоком давлении на колонке CHIRALPAK AS 10 мкм (250×4,6 мм) при 30°С.
| Элюент | н-гептан+0,01% ТФА/пропан-2-ол (45:55) |
| Расход | 1 мл/мин |
| Объем пробы | 5 мкл |
| Длина волны | 302 нм |
| Время удерживания сульфида | 4,3 мин |
| Время удерживания R-энантиомера | 6,7 мин |
| Время удерживания сульфона | 8,1 мин |
| Время удерживания S-энантиомера | 11,8 мин |
Тпл: 129-130°С
[α]20 D: -186,6 (с=0,1, ДМФ)
УФ-спектр (метанол-вода):λмакс: 272 нм (ε=6180), 315 нм (ε=24877).
ИК-спектр (KBr): 3006, 1581, 1436, 1364, 1262, 1026, 1040 и 823 см-1.
ЯМР 1Н (ДМСО d6) ((м.д.): 2,20 (с, 6Н), 3,70 (с, 3Н), 3,91 (с, 3Н), 4,69-4,85 (м, 2Н), 6,80 (д, J=8,5 Гц, 1Н), 7,99 (д, J=8,5 Гц, 1Н), 8,16 (с, Н), 13,92 (с, 1Н).
ЯМР 13С (ДМСО d6) ((м.д.): 13,2; 15,0; 56,6; 60,8; 62,6; 107,2; 129,5; 130,4; 131,9; 135,1; 150,5; 151,4; 156,9; 160,7; 163,0; 166,6.
Пример 2
Получение (R)-(+)-тенатопразола
Действуют, как в примере 1, заменяя (1R, 2S)-(+)-1-амино-2-инданол (1S, 2R)-(-)-1-амино-2-инданолом, заставляя действовать тот же самый окислитель на то же самое количество 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]тио]имидазо[4,5-b]пиридина, что в примере 1, и используя тот же самый катализатор.
Физические и спектроскопические константы (R) тенатопразола идентичны константам (S)-тенатопразола, за исключением удельной вращающей способности: [α]20 D:+185,9 (с 0,1, ДМФ).
Пример 3
Получение (S)-тенатопразола
(1R,2S)-(+)-1-Амино-2-инданол (22,8 мг, 0,151 ммоль), а также изопропилат титана(IV) (22 мкл, 0,076 ммоль) растворяют в ДМФ (1 объем). Раствор поддерживают при 0°С в течение 30 минут.
При перемешивании при 20°С добавляют раствор 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]тио]имидазо[4,5-b]пиридина (100 мг, 0,303 ммоль) в ДМФ (6 объемов) с последующим немедленным добавлением гидропероксида кумола (80%, 65 мкл, 0,352 ммоль).
Гомогенную смесь поддерживают при перемешивании при 0°С в течение 6 часов. Неочищенный продукт состоит из 60% сульфида, 0,1% сульфона и 39% сульфоксида с энантиомерным избытком (э.и.) 99% (анализ методом хиральной ВЭЖХ).
Пример 4
Получение (S)-тенатопразола
Действуют, как в примере 3, приведенном выше, но заменяя ДМФ на ДМА.
Гомогенную смесь поддерживают при перемешивании при 22°С в течение 6 часов. Неочищенный продукт состоит из 47% сульфида, 0,5% сульфона и 52% сульфоксида с энантиомерным избытком (э.и.) больше 99% (анализ методом хиральной ВЭЖХ).
Пример 5
Получение (S)-тенатопразола
5-Метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]тио]имидазо[4,5-b]пиридин (100 мг, 0,303 ммоль) солюбилизируют в безводном ДМФ. При перемешивании при 22°С добавляют изопропилат титана(IV) (22 мкл, 0,076 ммоль) и (1R, 2S)-(+)-1-амино-2-инданол (22,8 мг, 0,151 ммоль) в безводном ДМФ, после чего добавляют гидропероксид кумола (80%, 65 мкл, 0,352 ммоль).
Гомогенную смесь поддерживают при перемешивании при 22°С в течение 5 часов.
Неочищенный продукт состоит из 61% сульфида, 1% сульфона и 38% сульфоксида, то есть (S)-тенатопразола, с энантиомерным избытком (э.и.) 98% (анализ методом хиральной ВЭЖХ).
Пример 6
Получение (S)-тенатопразола
5-Метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]тио]имидазо[4,5-b]пиридин (100 мг, 0,303 ммоль) и (1R,2S)-(+)-1-амино-2-инданол (22,8 мг, 0,151 ммоль солюбилизируют в безводном ДМФ (0,65 мл); при перемешивании при 22°С добавляют изопропилат титана(IV) (22 мкл, 0,076 ммоль), после чего добавляют гидропероксид кумола (80%, 65 мкл, 0,352 ммоль).
Гомогенную смесь поддерживают при перемешивании при 22°С в течение 5 часов. Неочищенный продукт состоит из 16% сульфида, 4% сульфона и 68% сульфоксида с энантиомерным избытком (э.и.) 97% (анализ методом хиральной ВЭЖХ).
Энантиомерный избыток определяют жидкостной хроматографией при высоком давлении на колонке CHIRALPAK AS 10 мкм (250×4,6 мм) при 30°С.
Пример 7
Получение (S)-тенатопразола
5-Метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]тио]имидазо[4,5-b]пиридин (100 мг, 0,303 ммоль) солюбилизируют в безводном ДМФ (0,65 мл) и добавляют туда при перемешивании при 22°С (1R,2S)-(+)-1-амино-2-инданол (22,8 мг, 0,151 ммоль) и изопропилат титана(IV) (22 мкл, 0,076 ммоль) и в безводном ДМФ, после чего добавляют гидропероксид кумола (80%, 65 мкл, 0,352 ммоль).
Гомогенную смесь поддерживают при перемешивании при 22°С в течение 5 часов. Неочищенный продукт состоит из 56% сульфида, 2% сульфона и 42% сульфоксида с энантиомерным избытком (э.и.) 95% (анализ методом хиральной ВЭЖХ).
Пример 8
Получение (S)-тенатопразола
В N-МП при перемешивании последовательно вводят 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]тио]имидазо[4,5-b]пиридин (0,4 г), затем 0,5 экв. (1R,2S)-(+)-цис-1-амино-2-инданола и 0,25 экв. (0,091 мл) Ti(OiPr)4 при помощи стеклянного шприца объемом 100 мкл, предварительно высушенного в сушильном шкафу. Затем к раствору при 0°С при помощи стеклянного шприца (объемом 250 мкл), предварительно высушенного в сушильном шкафу, за 30 секунд за один раз добавляют 1,16 экв. (0,26 мл) гидропероксида кумола.
Гомогенный раствор поддерживают при перемешивании при 0°С в течение 6 часов. При помощи шприца, как описано выше, при 0°С за 1 раз и последовательно вновь добавляют 0,25 экв. (0,091 мл) Ti(OiPr)4, 0,5 экв. (1R,2S)-(+)-цис-1-амино-2-инданола, затем 1,16 экв. (0,26 мл) гидропероксида кумола за 30 секунд, и реакционную смесь поддерживают при перемешивании при 0°С в течение 1,75 часа и выдерживают 1 ночь в холодильнике при 5°С.По окончании реакции реакционная среда гомогенная, желто-оранжевого цвета.
Неочищенный продукт состоит из 0,5% сульфида, 1% сульфона и 90% сульфоксида с энантиомерным избытком (э.и.) 99,5% (анализ методом хиральной ВЭЖХ).
Пример 9
Получение (S)-тенатопразола
Действуют, как в примере 8, приведенном выше, заменяя N-МП на ДМФ.
После 5 часов реакции, вновь при 0°С за 1 раз и последовательно добавляют (1R,2S)-(+)-цис-1-амино-2-инданол (0,5 экв.), Ti(OiPr)4 (0,25 экв.), затем 1,16 экв. (0,26 мл) гидропероксида кумола при помощи стеклянного шприца объемом 250 мкл, предварительно высушенного в сушильном шкафу, и реакционную смесь поддерживают при перемешивании при 0°С.
Отбор проб осуществляют через 5 и 24 часа. По окончании реакции реакционная среда гомогенная, желто-оранжевого цвета.
После 5 часов и перед добавлением неочищенный продукт состоит из 62% сульфида, 0,1% сульфона и 38% сульфоксида с энантиомерным избытком (э.и.) больше 99,0% (анализ методом хиральной ВЭЖХ).
После 24 часов неочищенный продукт состоит из 13% сульфида, 2,5% сульфона и 84% сульфоксида с энантиомерным избытком (э.и.) больше 99,0% (анализ методом хиральной ВЭЖХ).
Пример 10
Получение (S)-тенатопразола
Действуют, как в примере 9, приведенном выше, заменяя ДМФ на ДМА.
После 5 часов и перед добавлением неочищенный продукт состоит из 60% сульфида, 0,8% сульфона и 38% сульфоксида с энантиомерным избытком (э.и.) больше 99,0% (анализ методом хиральной ВЭЖХ).
После 24 часов неочищенный продукт состоит из 3% сульфида, 4,7% сульфона и 90% сульфоксида с энантиомерным избытком (э.и.) больше 99,0% (анализ методом хиральной ВЭЖХ).
Пример 11
Получение (R)-тенатопразола
1.Получение эндоизоборнеола
В колбе объемом 10 мл, снабженной воронкой для добавления твердого вещества, в 4,5 мл 30%-ного NaOH растворяют камфорохинон-3-оксим. Желтую суспензию охлаждают до 0°С и обрабатывают добавлением через воронку цинкового порошка небольшими порциями в течение 30 минут.
Затем температуру поддерживают при 0°С в течение еще 10 минут. Полученную серо-желтую суспензию подогревают до 23°С и поддерживают при данной температуре в течение 15 минут до полного исчезновения желтой окраски. Серую суспензию поддерживают при перемешивании при 23°С в течение 5 минут, затем экстрагируют 5 мл простого метил-трет-бутилового эфира (МТБЭ). Органическую фазу последовательно промывают 2×2,5 мл водой, сушат над MgSO4, затем концентрируют до получения объема около 20 мл.
Тогда раствор добавляют по каплям через воронку для приливания к раствору LiAlH4 в 50 мл МТБЭ, находящемуся в колбе объемом 250 мл, снабженной холодильником, в атмосфере азота при 23°С. Серую суспензию нагревают до 40°С и поддерживают при перемешивании при 40°С в течение 18 часов. Тогда реакционную среду охлаждают до 0°С и добавляют 2 мл дистиллированной воды, так что температура не превышает 5°С. Суспензию фильтруют через целит, промывают 40 мл МТБЭ, затем 30 мл воды, затем сушат над MgSO4, фильтруют, затем концентрируют для того, чтобы получить 0,65 г белых кристаллов.
Выход чистого продукта 49%
Процентное содержание 80% (отношение цис/транс 5/1 по данным ЯМР 1Н).
Очистка эндоизоборнеола
В колбе объемом 25 мл в 8,5 мл HCl (6 М) растворяют 300 мг белых кристаллов. Раствор нагревают до 100°С и поддерживают при данной температуре при перемешивании в течение 24 часов. Каштановый раствор промывают 4×8 мл дихлорметаном. Водную фазу подщелачивают добавлением 5 мл 50%-ного NaOH (рН=12), затем экстрагируют 3×8 мл МТБЭ. Органическую фазу сушат над MgSO4, фильтруют, затем концентрируют с получением твердого вещества каштанового цвета, которое возгоняют при 80°С при 1 мм рт.ст.
Получают 120 мг белых кристаллов с процентным содержанием 90% (отношение цис/транс составляет 10/1 по данным ЯМР 1Н). Структура была подтверждена методом масс-спектрометрии.
2. Получение (R)-тенатопразола
Эндоизоборнеол (0,5 экв.) и изопропилат титана(IV) (0,25 экв.) быстро растворяют в N-МП и добавляют к 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридинил)метил]тио]имидазо[4,5-b]пиридину (100 мг, 0,303 ммоль). Через 5 секунд после добавления за 2 секунды добавляют гидропероксид кумола (1,16 экв.). Смесь поддерживают при перемешивании при 20°С в течение 5 часов.
Неочищенный продукт состоит из 71% сульфида, 5% сульфона и 24% сульфоксида с энантиомерным избытком (э.и.) 20% (энантиомер R) (анализ методом хиральной ВЭЖХ).
1. Энантиоселективный способ получения производных сульфоксидов или их солей, представленных формулой: в которой А обозначает различным образом замещенный пиридинильный цикл и В - гетероциклический остаток, содержащий имидазопиридинильный цикл, отличающийся тем, что осуществляют энантиоселективное окисление сульфида общей формулы (I), представленной ниже: в которой А и В имеют значения, указанные выше, окислителем в присутствии катализатора на основе титана(IV) и хирального лиганда, представляющего собой циклический бета- или гамма-аминоспирт, в органическом растворителе, в случае необходимости, с последующим превращением в соль при помощи основания.
2. Способ по п.1, отличающийся тем, что в общей формуле (I) А обозначает пиридинильную группу или пиридинильную группу, несущую один или несколько заместителей, выбранных среди следую