Способ определения скорости генерации супероксида
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к способу определения скорости генерации супероксида. Способ может быть использован для количественного определения супероксида в мембранных препаратах (микросом, митохондрий), обладающих цитохром с - редуктазной и цитохром с - оксидазной активностью. Кроме того, возможно его использование в медицинской биохимии для исследования роли супероксида в патогенезе нейродегенеративных заболеваний. Способ включает приготовление среды измерения, смешивание источника супероксида со средой измерения, добавление в полученную смесь субстрата окисления и мутантного цитохрома с К27Е/Е69К/К72Е/К86Е/К87Е/Е90К или К8Е/Е62К/Е69К7К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К. Спектрофотометрически проводят измерение скорости восстановления производного цитохрома с и определяют скорость генерации супероксида. Способ является более простым в сравнении с известными аналогами и позволяет определить скорость генерации супероксида с повышенной точностью. 1 табл., 4 ил.
Реферат
Изобретение относится к области биохимии, молекулярной биологии и биотехнологии. Может быть использовано для измерения скорости генерации супероксида в мембранных препаратах (микросом, митохондрий), обладающих цитохром с - редуктазной и цитохром с - оксидазной активностью, а также в медицинской биохимии для исследования роли супероксида в патогенезе нейродегенеративных заболеваний.
Цитохром с - небольшой белок с железопорфириновой группой, ковалентно присоединенной к единственной полипептидной цепи. У эукариот цитохром с локализован на поверхности внутренней мембраны митохондрий, обращенной в межмембранное пространство. Основная его функция - участие в переносе электронов от убихинол: цитохром с - оксид оредуктазы (комплекс III) на цитохром с - оксидазу (комплекс IV) дыхательной цепи. Кроме того, известна его способность окислять супероксид . Мутантные варианты цитохрома с, лишенные дыхательной функции, но сохранившие способность окислять , являются потенциальной основой для создания тест-систем определения супероксида.
В последнее время растет число теорий, связывающих «окислительный стресс» с заболеваниями и старением (Azzi A., Davies K.L.A., Kelly F. Free radical biology-terminology and critical thinking // FEBS Lett. 2004. Vol.558, pp.3-6), и соответственно растет интерес к системам, способным генерировать супероксид, предшественник соединений, вызывающих окислительный стресс (перекись водорода (Н2O2), гидроксил-радикал ). Для локализации мест генерации супероксида в клетках необходим точный метод его количественного определения.
Известен способ определения скорости генерации супероксида по окислению адреналина до адренохрома (Misra H.P., Fridovich I. The role of superoxide anion in the autoxidation of epinephrine and a simple assay for superoxide dismutase // J. Biol. Chem. 1972. Vol.247, pp.3170-3175). Адреналин имеет ограниченную специфичность к супероксиду, главным образом, за счет способности к автоокислению, поэтому при его использовании необходимо измерять ингибируемые супероксиддисмутазой скорости образования адренохрома.
Известен способ определения скорости генерации супероксида по окислению гидроэтидина (Benov L., Sztejnberg L., Fridovich I. Critical evaluation of use of hydroethidine as a measure of superoxide anion radical // Free Radio Biol Med. 1998. Vol.25, pp.826-831). Использование гидроэтидина для количественного определения продукции супероксида является неточным из-за его способности увеличивать скорость дисмутации супероксида в перекись и изменять мембранный потенциал.
Известен способ определения скорости генерации супероксида по восстановлению цитохрома с (Forman H.J., Fridovich I. Superoxide dismutase: a comparison of rate constants // Arch Biochem Biophys. 1973 Vol.158, pp.396-400). Восстановление цитохрома с неспецифично для супероксида. Аскорбат, глутатион и клеточные редуктазы могут восстанавливать цитохром с, который может быть реокислен цитохромоксидазами и пероксидазами. Эти реакции вносят искажения в скорость образования супероксида. Поскольку митохондрии содержат супероксиддисмутазу (СОД) в матриксе и межмембранном пространстве, «прямое» количественное определение продукции супероксида в интактных митохондриях практически невозможно (Grivennikova V.G., Vinogradov A.D. Generation of superoxide by mitochondrial Complex I // Biochim. Biophys. Acta. 2006. Vol.1757, pp.553-561). Вывернутые прочно-сопряженные субмитохондриальные частицы (СМЧ) (Kotlyar А.В., Vinogradov A.D., Slow active/inactive transition of the mitochondrial NADH-ubiquinone reductase // Biochim. Biophys. Acta 1990. Vol.1019, pp.151-158), лишенные ферментов матрикса, являются оптимальной экспериментальной системой для изучения генерации супероксида митохондриальной дыхательной цепью. Однако цитохром с, добавленный к митохондриальным препаратам (в частности, к СМЧ), восстанавливается в большей степени компонентами дыхательной цепи, чем супероксидом, и, следовательно, не может служить надежным агентом для количественного определения генерации супероксида.
Известен наиболее близкий к заявленному способ определения скорости генерации супероксида с помощью частично ацетилированного цитохрома с (АсС) (Azzi A., Montecucco С., Richter С.The use of acetylated ferricytochrome c for the detection of superoxide radicals produced in biological membranes // Biochem. Biophys. Res. Commun. 1975. Vol.22, pp.597-603). При ацетилировании цитохрома с уксусным ангидридом образуется достаточно гетерогенная смесь молекул цитохрома с с различным числом модифицированных лизиновых остатков. Ацетилирование снижает скорости восстановления цитохрома с митохондриальными и микросомальными редуктазами и скорость его окисления цитохромоксидазой, способность АсС к восстановлению супероксидом сохраняются. Реакционная способность цитохрома с по отношению к природным восстановителям и окислителям зависит от степени ацетилирования. При ацетилировании снижается общий положительный заряд цитохрома с, что ведет к снижению сродства к супероксиду. Неспецифическое взаимодействие АсС с с компонентами дыхательной цепи уменьшают добавлением фосфата или хлорида калия в сравнительно высоких концентрациях (до 100 мМ). Однако и данное решение не обеспечивает точность количественного определения генерации супероксида, поскольку высокие концентрации K+ вызывают частичное разобщение дыхательной цепи, что ведет к снижению истинной генерации супероксида. Перечисленные недостатки АсС приводят к низкой точности измерения генерации супероксида при использовании АсС: побочные реакции взаимодействия АсС с окислительно-восстановительными партнерами составляют 60-80%, при измерении в среде с фосфатом калия значения скорости генерации супероксида занижены в 2 раза.
Изобретение решает задачу упрощения и повышения точности способа определения скорости генерации супероксида в мембранных препаратах (микросом, митохондрий), обладающих цитохром с - редуктазной и цитохром с - оксидазной активностью, в отсутствие высоких концентраций солей, т.е в условиях, близких к нативным.
Поставленная задача достигается за счет способа определения скорости генерации супероксида, включающего приготовление среды измерения, смешивание источника супероксида со средой измерения, добавление в полученную смесь субстрата окисления и производного цитохрома с с последующим спектрофотометрическим измерением скорости восстановления производного цитохрома с и определением скорости генерации супероксида, состоящего в том, что в качестве производного цитохрома с используют мутантный цитохром с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К.
Технический результат заявленного способа заключается в упрощении и повышении точности способа определения скорости генерации супероксида в мембранных препаратах (микросом, митохондрий), обладающих цитохром с - редуктазной и цитохром с - оксидазной активностью, в отсутствии высоких концентраций солей, т.е в условиях, близких к нативным.
Рекомбинантный мутантный цитохром с лошади получают путем конструирования мутантного гена цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62КУЕ69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К с аминокислотными заменами в сайте взаимодействия с окислительно-восстановительными партнерами дыхательной цепи: убихинол: цитохром с - оксидоредуктазой (комплекс III) и цитохром с - оксидазой (комплекс IV). За счет замены положительно заряженных остатков лизина (К), окружающих гемовую впадину цитохрома с дикого типа, на отрицательные остатки глутаминовой кислоты (Е) достигается снижение способности к окислительно-восстановительным реакциям с комплексом III и комплексом IV. Используется подход направленного изменения поверхностных зарядов цитохрома с с целью «перемещения» сайта связывания от гемовой впадины к периферии. Для сохранения суммарного положительного заряда белка вне сайта взаимодействия вводятся обратные замены (Е→К).
Плазмидная ДНК pBPCYCS/3 содержит мутантный ген цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К, встроенный между сайтами рестрикции Xho I и ВаmН. I, кодирующий синтез мутантного рекомбинантного белка цитохрома с К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К, промоторы lac и trc перед геном цитохрома с, ген blа, обеспечивающий синтез β-лактамазы (устойчивость к ампициллину), ген дрожжевой гем-лигазы (CYC3), кодирующий фермент, осуществляющий лигирование рекомбинантного цитохрома с с гемом бактериальных клеток.
Плазмидной ДНК pBPCYCS/3, содержащей мутантный ген цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К, трансформируют клетки бактерий Escherichia coli штамма JM-109. Проводят экспрессию целевого белка в бактериальных клетках, его выделение и очистку помощью хроматографичеких методов (ионообменной хроматографии на MonoS и адсорбционной хроматографии на гидроксиапатите).
При переносе электронов по дыхательной цепи происходит не только четырехэлектронное восстановление молекулы кислорода до воды, но и одноэлектронное восстановление с образованием супероксида. Считают, что основным источником супероксида в дыхательной цепи является комплекс I (NADH: убихинон - оксидоредуктаза) (Brand MD, Affourtit С, Esteves TC, Green К, Lambert AJ, Miwa S, Pakay JL, Parker N. Mitochondrial superoxide: production, biological effects, and activation of uncoupling proteins // Free Radic Biol Med. 2004 Vol.37, No.6, pp.755-767). Комплекс I катализирует генерацию супероксида как при окислении NADH, так и в реакции обратного переноса электронов, которая протекает при аэробном окислении сукцината калия, когда убихинон восстановлен, а на мембране митохондрий есть потенциал. Образование супероксида в митохондриях происходит на стороне внутренней мембраны, обращенной в матрикс, поэтому измерить скорость генерации супероксида в интактных митохондриях крайне сложно или вообще невозможно из-за присутствия в матриксе митохондрий супероксиддисмутазы, превращающей супероксид в перекись водорода. В связи с этим, для измерения генерации супероксида оптимальной является система вывернутых субмитохондриальных частиц (СМЧ). Такие частицы свободны от ферментов, локализованных в матриксе митохондрий. Кроме того, активные центры компонентов дыхательной цепи в СМЧ доступны для своих субстратов. После искусственного сопряжения (с помощью антибиотика олигомицина) и активации (с помощью NADPH и малоната калия) препарат СМЧ используют для измерения скорости генерации супероксида. Однако в таком препарате всегда присутствуют незамкнутые обрывки митохондриальных мембран, содержащие комплекс III (убихинол: цитохром с - оксидоредуктазу) и комплекс IV (цитохром с - оксидазу) дыхательной цепи, доступные для взаимодействия с цитохромом с дикого типа или частично ацетилированным цитохромом с.
Скорость генерации супероксида измеряют по чувствительному к супероксиддисмутазе восстановлению мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К7Е69К/К72Е/К86Е/К87Е/Е90К, обладающего сниженной способностью к окислительно-восстановительным реакциям с компонентами дыхательной цепи. Эксперименты по подбору концентраций цитохрома с показали, что оптимальной для измерения скорости генерации супероксида является концентрация 20 мкМ как для АсС, так и для мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К.
Измеряют сукцинат: цитохром с - редуктазную активность сопряженных СМЧ сердца быка при окислении сукцината калия спектофотометрически при 550 нм по восстановлению АсС или мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К7К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К. Чувствительная к супероксиддисмутазе скорость восстановления цитохрома с (СОД-чувствительная фракция сукцинат: цитохром с - редуктазной активности) соответствует скорости генерации супероксида комплексом I в реакции обратного переноса электронов при окислении сукцината калия. Нечувствительная к супероксиддисмутазе скорость восстановления цитохрома с (СОД - нечувствительная фракция сукцинат: цитохром с - редуктазной активности) соответствует скорости восстановления цитохрома с от комплекса III (убихинол: цитохром с - оксидоредуктазы) дыхательной цепи, находящегося на обрывках митохондриальных мембран, присутствующих в препарате СМЧ.
При измерении сукцинат: цитохром с - редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия с помощью 20 мкМ АсС или мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К в среде, содержащей фосфат калия, СОД-чувствительная активность (скорость генерации супероксида) составляет 0,8-0,9 нмоль/мин на 1 мг белка СМЧ, в среде без фосфата - 1,4-1,5 нмоль/мин на 1 мг белка СМЧ, что, по-видимому, связано с повышением степени сопряженности препарата СМЧ (удаление фосфата калия из среды приводит к повышению дыхательного контроля СМЧ при окислении NADH с 2,8 до 5,5) (Vinogradov A.D., Grivennikova V.G. Generation of superoxide-radical by the NADH:ubiquinone oxidoreductase of heart mitochondria // Biochemistry (Mosc). 2005. Vol.70(2). pp.120-127) (таблица).
Вклад СОД-нечувствителыюй составляющей сукцинат: цитохром с - редуктазной активности в среде с фосфатом калия при применении 20 мкМ АсС составляет 60%, при применении 20 мкМ мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К составляет 20%, при применении 20 мкМ мутантного цитохрома с К8Е/Е62К/Е69КУК72Е/К86Е/К87Е - 15%, при применении 20 мкМ мутантного цитохрома с К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К - 10%. Вклад СОД-нечувствительной составляющей сукцинат: цитохром с - редуктазной активности при использовании АсС в среде без фосфата резко повышается до 80%, в случае мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К этот вклад составляет 35%, в случае мутантного цитохрома с К8Е/Е62К/Е69КУК72Е/К86Е/К87Е - 30%. При использовании мутантного варианта цитохрома с К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К для количественного определения скорости генерации супероксида в СМЧ в среде, не содержащей фосфат, вклад СОД-нечувствительной составляющей сукцинат: цитохром с - редуктазной активности значительно снижен (15%), при этом выявляется более 80% активности Комплекса I в реакции генерации супероксида (таблица).
Таким образом, при применении способа, основанного на восстановлении мутантного цитохрома с лошади, точность измерения скорости генерации супероксида в митохондриальных препаратах (в частности, СМЧ) в 4 раза выше по сравнению с применением способа, основанного на восстановлении АсС. Возможность проведения измерений в среде без фосфата калия обеспечивает упрощение способа измерения скорости генерации супероксида.
Изобретение иллюстрируют чертежи:
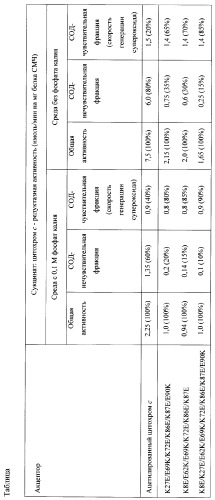
Фиг.1а). Зависимость сукцинат: цитохром с - редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия от концентрации добавленного ацетилированного цитохрома с
• - без фосфата калия, в отсутствии СОД, о - в присутствии СОД,■ - с фосфатом калия, □ - с фосфатом калия, в присутствии СОД.
Фиг.1б). СОД - чувствительная сукцинат: цитохром с - редуктазная активность (скорость генерации супероксида), измеренная с помощью ацетилированного цитохрома с
• - без фосфата калия, ■ - с фосфатом калия.
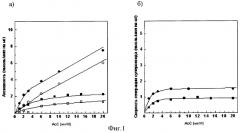
Фиг.2а. Зависимость сукцинат: цитохром с - редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия от концентрации добавленного мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К
• - без фосфата калия, в отсутствии СОД, о - в присутствии СОД,■ - с фосфатом калия, □ - с фосфатом калия, в присутствии СОД.
Фиг.2б). СОД - чувствительная сукцинат: цитохром с - редуктазная активность (скорость генерации супероксида), измеренная с помощью мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К
• - без фосфата калия, ■ - с фосфатом калия.
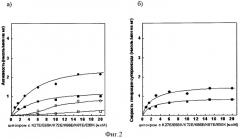
Фиг.3а). Зависимость сукцинат: цитохром с - редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия от концентрации добавленного мутантного цитохрома с лошади К8Е/Е62К/Е69К/К72Е/К86Е/К87Е
• - без фосфата калия, в отсутствии СОД, о - в присутствии СОД,■ - с фосфатом калия, □ - с фосфатом калия, в присутствии СОД.
Фиг.3б). СОД-чувствительная сукцинат: цитохром с - редуктазная активность (скорость генерации супероксида), измеренная с помощью мутантного цитохрома с лошади К8Е/Е62К/Е69К/К72Е/К86Е/К87Е
• - без фосфата калия, ■ - с фосфатом калия.
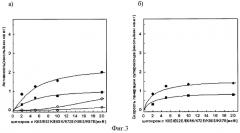
Фиг.4а). Зависимость сукцинат: цитохром с - редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия от концентрации добавленного мутантного цитохрома с лошади К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К
• - без фосфата калия, в отсутствии СОД, о - в присутствии СОД, ■ - с фосфатом калия, □ - с фосфатом калия, в присутствии СОД.
Фиг.4б). СОД-чувствительная сукцинат: цитохром с - редуктазная активность (скорость генерации супероксида), измеренная с помощью мутантного цитохрома с лошади К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К
• - без фосфата калия, ■ - с фосфатом калия.
Изобретение иллюстрируют примеры.
Определение генерации супероксида в СМЧ сердца быка с помощью мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К
1. Получение препарата митохондрий из сердца быка
Все процедуры проводят на холоду (0-4°С).
Сердца только что забитых животных охлаждают, разрезают на небольшие куски, удаляют соединительную ткань и жир и гомогенизируют механическим способом.
Гомогенат (~1 кг) промывают 5 раз тремя литрами среды, содержащей 0,9% КС1, 1 мМ ЭДТА, 5 мМ Tris-HCl (pH 7.8), и отфильтровывают промывные воды через слой плотной ткани (марли). При промывании суспензии pH среды контролируют и поддерживают добавлением небольших количеств раствора 1 М Tris. Затем гомогенат промывают средой выделения, содержащей 0,25 М сахарозы, 15 мМ ЭДТА и 10 мМ Tris-HCl (pH 7.5). К отжатому гомогенату добавляют среду выделения до объема ~ 4 л, продувают 15 мин аргоном и обрабатывают при помощи гомогенизатора «Fisher PowerGen 700» 5 раз по 1 мин со скоростью 4000 об/мин с интервалами в 1 мин при непрерывном продувании суспензии аргоном.
Гомогенат центрифугируют 13 мин при 1600 g (центрифуга «Beckman», ротор JA-10). Супернатант фильтруют, доводят до pH 7.5 раствором 1 М Tris и затем центрифугируют 15 мин при 12000 g (ротор JA-14). Осадок суспендируют в 350 мл среды, содержащей 0,25 М сахарозы и 10 мМ Tris-HCl (pH 7.8) в стеклянном гомогенизаторе Поттера с тефлоновым пестиком и доводят до pH 7.8-7.9 раствором 1 М Tris. Суспензию центрифугируют 10 мин при 17000 g. Осадок представлен двумя фракциями: нижней, более темной («тяжелые» митохондрии) и верхней, светлой, более рыхлой («легкие» митохондрии). «Легкую» фракцию отделяют встряхиванием осадка с добавлением небольших объемов среды, содержащей 0,25 М сахарозу и 10 мМ Tris-HCl (pH 7.5). «Тяжелые» митохондрии суспендируют в 0,25 М сахарозе, замораживают и хранят при -20°С.
2. Получение препарата СМЧ из митохондрии сердца быка
Препарат митохондрии, хранящийся при -20°С, размораживают и разводят раствором 0,25 М сахарозы до концентрации белка 30 мг/мл. После этого суспензию разбавляют бидистиллированной водой, до конечной концентрации 20 мг белка/мл. Затем добавляют нейтрализованный раствор К+-ЭДТА до конечной концентрации 1 мМ. В течение 20 мин суспензию митохондрии деаэрируют, пропуская аргон, чтобы удалить из среды кислород и избежать процессов перекисного окисления липидов мембран в получаемом препарате. pH суспензии доводят до 8.6 при постоянном перемешивании добавлением 1 М NH4OH. С помощью ультразвукового дезинтегратора "Soniprep 150-MSE" препарат митохондрии обрабатывают 5 раз по 30 с с перерывами в 1 мин. Процесс обработки проводят на льду, в непрерывном токе аргона. Неразрушенные митохондрии отделяют с помощью центрифугирования при 26000g в течение 15 мин при 0°С. Осадок отбрасывают, а супернатант фильтруют через плотную ткань и центрифугируют на ультрацентрифуге при 105000g в течение 1 ч при 0°С. Затем супернатант отбрасывают, а полученный осадок суспендируют в 6 мл буфера, содержащего 75 мМ сахарозы, 0,25 М КС1, 2 мМ ЭДТА и 30 мМ Tris-HCl (pH 7.5). Полученную суспензию наносят на колонку 40×3,2 см с сефадексом G-50 (coarse) и пропускают тот же буфер со скоростью 2,0 мл/мин при 25°С (в ходе этой процедуры препарат СМЧ освобождается от белкового ингибитора FoFi-АТРазы). Пропущенные через колонку СМЧ осаждают ультрацентрифугированием при 105000g в течение 1 ч при 18°С и промывают раствором 0,25 М сахарозы с последующим центрифугированием в тех же условиях. Полученный осадок суспендируют в 0,25 М сахарозы, разливают аликвотами в пластиковые пробирки и хранят в жидком азоте.
3. Сопряжение и активация СМЧ
СМЧ (120 мг), суспендированные в 0,25 М сахарозы, разбавляют стандартной средой, содержащей 0,25 М сахарозы, 50 мМ Tris-HCl (pH 8.0) и 0,2 мМ ЭДТА, до концентрации белка 5 мг/мл. При хорошем перемешивании добавляют малонат калия (конечная концентрация 0,5 мМ) и олигомицин в количестве 0,5 мкг/мг белка и инкубируют в течение 30 мин при 30°С. Затем смесь разбавляют в 10 раз стандартной средой, содержащей 1 мМ NADPH, и инкубируют при комнатной температуре в течение 45 мин при энергичном перемешивании. После этого смесь центрифугируют при 30000g и 4°С в течение 1 ч. Супернатант отбрасывают, осадки ополаскивают стандартной средой, содержавшей 0,1 мМ малоната калия, и полученные СМЧ суспендируют в той же среде до концентрации ~10 мг/мл. Препарат разливают на небольшие аликвоты (около 0,2 мл) и хранят в жидком азоте. Перед экспериментом активированные СМЧ размораживают и хранят на льду.
4. Измерение сукцинат: цитохром с - редуктазной активности СМЧ сердца быка в присутствии мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К.
СОД-нечувствительную составляющую сукцинат: цитохром с - редуктазной активности (восстановление цитохрома с от комплекса III дыхательной цепи) измеряют в среде, которая содержит 0,25М сахарозы, 50 мМ Tris-HCl (pH 8.0) и 0,2 мМ ЭДТА, СМЧ (концентрация белка 0,1 мг/мл), а также, где указано, 0,1 М фосфат калия, спектрофотометрически при 550 нм по восстановлению АсС (Sigma) или мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К. Генерацию супероксида начинают добавлением субстрата окисления - 5 мМ сукцината калия. Для измерения сукцинат: цитохрома с - редуктазной активности АсС или мутантный цитохром с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К добавляют в концентрации от 1 до 30 мкМ.
СОД-чувствительную составляющую сукцинат: цитохром с - редуктазной активности (генерацию супероксида комплексом I в реакции обратного переноса электронов) измеряют в среде, которая содержит 0,25М сахарозы, 50 мМ Tris-HCl (pH 8.0) и 0,2 мМ ЭДТА, СМЧ (концентрация белка 0,1 мг/мл), а также, где указано, 0,1 М фосфата калия, спектрофотометрически при 550 нм по чувствительному к супероксиддисмутазе (СОД, 3 ед/мл в среде измерения) восстановлению АсС или мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К.
Генерацию супероксида начинают добавлением субстрата окисления - 5 мМ сукцината калия. Для измерения сукцинат: цитохрома с - редуктазной активности АсС или мутантный цитохром с К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К добавляют в концентрации от 1 до 30 мкМ.
Показано, что оптимальной для измерения скорости генерации супероксида является концентрация 20 мкМ как для АсС, так и для мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К (фиг.1 -4.).
При измерении сукцинат: цитохром с - редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия с помощью 20 мкМ АсС в среде, содержащей 0,1 М фосфат калия, СОД-чувствительная активность (скорость генерации супероксида) составляет 0,9 нмоль/мин на 1 мг белка СМЧ, в среде без фосфата - 1,5 нмоль/мин на 1 мг белка СМЧ (фиг.1.).
При измерении сукцинат: цитохром с - редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия с помощью 20 мкМ мутантного цитохрома с лошади К27Е/Е69К/К72Е/К86Е/К87Е/Е90К в среде, содержащей фосфат калия, СОД-чувствительная активность (скорость генерации супероксида) составляет 0,8 нмоль/мин на 1 мг белка СМЧ, в среде без фосфата - 1,4 нмоль/мин на 1 мг белка СМЧ (фиг.2.).
При измерении сукцинат: цитохром с - редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия с помощью 20 мкМ мутантного цитохрома с лошади К8Е/Е62К/Е69К/К72Е/К86Е/К87Е в среде, содержащей фосфат калия, СОД-чувствительная активность (скорость генерации супероксида) составляет 0,8 нмоль/мин на 1 мг белка СМЧ, в среде без фосфата - 1,4 нмоль/мин на 1 мг белка СМЧ (фиг.3.).
При измерении сукцинат: цитохром с - редуктазной активности сопряженных СМЧ сердца быка при окислении сукцината калия с помощью 20 мкМ мутантного цитохрома с лошади К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К в среде, содержащей фосфат калия, СОД-чувствительная активность (скорость генерации супероксида) составляет 0,9 нмоль/мин на 1 мг белка СМЧ, в среде без фосфата - 1,4 нмоль/мин на 1 мг белка СМЧ (фиг.4.).
Способ определения скорости генерации супероксида, включающий приготовление среды измерения, смешивание источника супероксида со средой измерения, добавление в полученную смесь субстрата окисления и производного цитохрома с последующим спектрофотометрическим измерением скорости восстановления производного цитохрома с и определением скорости генерации супероксида, отличающийся тем, что в качестве производного цитохрома с используют мутантный цитохром с К27Е/Е69К/К72Е/К86Е/К87Е/Е90К, или К8Е/Е62К/Е69К/К72Е/К86Е/К87Е, или К8Е/К27Е/Е62К/Е69К/К72Е/К86Е/К87Е/Е90К.