Получение гамкергических нейронов in vitro из эмбриональных стволовых клеток и их применение при лечении неврологических расстройств
Иллюстрации
Показать всеИзобретение относится к области клеточной трансплантологии. Предложена обогащенная популяция клеток, где ГАМКергические нейроны получены в результате дифференцировки популяции полипотентных стволовых клеток, обогащенной нестин-положительными клетками. Высокий выход ГАМКергических нейронов обусловлен селекцией нестин-положительных клеток, повышением содержания (обогащения) нестин-положительных клеток, а затем дальнейшей дифференцировкой в присутствии цитозин-β-d-арабинофуранозида (Ara-С). Изобретение может быть использовано в качестве источника для клеточной заместительной терапии при нейродегенеративных нарушениях и нервных заболеваниях, таких как инсульт, ишемия, эпилепсия и болезнь Гентингтона. 4 н. и 33 з.п. ф-лы, 12 ил., 1 табл.
Реферат
Перекрестные ссылки на родственные заявки
Не применимо
Заявка в отношении поддержанного правительством исследования или разработки
Не применимо
Ссылка на "дополнение в виде микрофиша"
Не применимо
1. Область изобретения
Настоящее изобретение относится к улучшенному способу продуцирования нервных клеток в конечной стадии дифференцировки, таких как ГАМКергические нейроны, из полипотентных стволовых клеток, таких как мышиные эмбриональные стволовые клетки или эмбриональные стволовые клетки человека. Полученные согласно описанию настоящего изобретения ГАМКергические нейроны можно использовать в качестве отличного источника в клеточной заместительной терапии при нейродегенеративных нарушениях и нервных заболеваниях, таких, например, как инсульт, ишемия, болезнь Паркинсона, болезнь Альцгеймера, эпилепсия и болезнь Гентингтона.
2. Описание предшествующей области
Гамма-аминомасляная кислота (ГАМК) представляет собой основной тормозной нейромедиатор центральной нервной системы (ЦНС), и она широко распространена повсеместно в головном мозге и экспрессируется в межнейронных модулирующих локальных цепях. Синтезирующие ГАМК ГАМКергические нейроны представляют собой основные тормозные нейроны в ЦНС млекопитающих, и приблизительно 60-75% всех синапсов в ЦНС являются ГАМКергическими (Schwartz, R.D., 1988, Biochem. Pharmacol. 37: 3369-75). ГАМКергические нейроны локализованы в гиппокампе, мозжечке, коре головного мозга и гипоталамусе, и ГАМК связывается по меньшей мере с тремя рецепторами, включающими в себя ГАМК-А и ГАМК-Б. ГАМК-А-рецепторы опосредуют быстрые тормозные синаптические передачи, нейронную возбудимость и быстрые изменения настроения, такие как порог судорожной активности, тревога, паника и ответ на стрессы (например, ответ «нападение/бегство»). ГАМК-А-рецепторы также имеют сайты связывания бензодиазепинов, этанола, барбитуратов и нейростероидов. ГАМК-Б-рецепторы опосредуют медленные тормозные передачи и могут быть важны в памяти, настроении и боли.
Патогенез некоторых неврологических расстройств, включая некоторые формы эпилепсии, хроническую боль, тревогу и расстройства настроения, вероятно, связан со снижением ГАМКергической передачи. Например, позитрон-эмиссионное томографическое исследование (PET) показало, что пациенты с паническим расстройством имеют пониженный уровень связывания ГАМК-А-рецептора (Malizia et al., 1998, Arch. Gen. Psychiatry 55: 715-20). Кроме того, низкий уровень ГАМК в плазме может являться характеристикой подгруппы пациентов с расстройствами настроения (Brambilla et al., 2003, Mol. Psychiatry 8: 721-37). Показано, что при лечении этих нарушений эффективны определенные повышающие активность ГАМК лекарственные средства, такие как бензодиазепины, вальпроат и фенобарбитал.
Многие заболевания центральной нервной системы (ЦНС), такие как болезнь Паркинсона, болезнь Альцгеймера, рассеянный склероз, болезнь Гентингтона, боковой амиотрофический склероз, ишемия головного мозга и инсульт, характеризуются дегенерацией нейронов головного мозга и отделов спинного мозга. Дегенерирующие или поврежденные иным способом клетки или нейроны, по сути, не замещаются или не восстанавливаются организмом, что может приводить к долговременному и необратимому повреждению (During et al., 2001, Human Gene Ther. 12: 1589-1591). Инсульт или ишемия головного мозга могут происходить, когда кровяной сгусток закупоривает кровеносный сосуд или артерию, нарушая кровоток в области головного мозга, что вызывает гибель клеток головного мозга в ближайшей к месту закупорки области. При инфаркте гибель клеток головного мозга обычно настает в интервале от минут до нескольких часов после возникновения инсульта или ишемии. Гибель этих клеток может приводить к высвобождению химических соединений, вызывающих цепную реакцию, названную «ишемический каскад», подвергающую опасности клетки головного мозга в более обширной окружающей ткань головного мозга области с аномальным кровотоком. Без быстрого оказания медицинской помощи клетки головного мозга этой более обширной области также могут погибнуть, что может явиться причиной еще более серьезного и долговременного повреждения головного мозга. Если принять во внимание быстрый темп ишемического каскада, становится ясно, что «окно терапевтических возможностей» для активного лечения составляет лишь около шести часов. После этого временного промежутка восстановление тока крови и введение нейропротективных средств может оказаться недостаточным для помощи и может вызвать дальнейшее повреждение функций головного мозга (Padosch et al., 2001, Anaesthesist 50: 905-920; Nishino and Borlongan, 2000, Prog. Brain Res. 127: 461-476).
При возникновении инсульта нарушение тока крови в головном мозге оказывает вредное и потенциально смертельное воздействие на отдельные нейроны или группы нейронов. Недостаток кислорода и жизненно важных питательных веществ у большого количества нейронов в ограниченной области головного мозга в результате ишемии головного мозга может приводить к серьезной потере функциональных способностей пациента. Например, пациенты с инсультом могут испытывать потерю речи, памяти, когнитивных функций, ограниченную подвижность или даже паралич. Без адекватного кровоснабжения клетки головного мозга теряют свою способность вырабатывать энергию, в частности, аденозинтрифосфат (АТФ). Если достичь критических порогов такого недостатка энергии, клетки головного мозга повреждаются и погибают. Многие исследователи полагают, что вслед за недостатком энергии повреждение и гибель клеток головного мозга вызывают огромное количество механизмов и каждый из этих механизмов представляет собой потенциальный путь для терапевтического вмешательства.
Один из способов, посредством которого клетки головного мозга отвечают на недостаток энергии, связан с повышением концентрации внутриклеточного кальция. Такие концентрации могут приводить к опасным уровням посредством процесса, называемого эксцитотоксичность, при котором клетки головного мозга высвобождают избыточные количества глутамата, нейромедиатора, который приводит к деградации и деструкции живых клеток, локализованных в гиппокампе, коре головного мозга и таламической области головного мозга (Nishino and Borlongan, 2000, Prog. Brain Res. 127: 461-476). Кроме того, после инсульта в области гиппокампа головного мозга часто дегенерируют клетки, синтезирующие ГАМК (Nishino and Borlongan, 2000, Prog. Brain Res. 127: 461-476). На основе нейрогистопатологических и нейропсихологических исследований разработано несколько нейропротективных лекарственных средств для лечения неврологических расстройств, связанных с ишемией головного мозга или инсультом, таких как ГАМКергические агонисты, антагонисты кальция, антагонисты глутамата и антиоксиданты (Stutzmann et al., 2002, CNS Drug Rev. 8: 1-30; Rochelle et al., 2001, J. Neurochem. 77: 353-371; Blezer et al., 2002 Eur. J. Pharmacol. 444: 75-81). В настоящее время на разных стадиях разработки существуют сотни препаратов и соединений для предотвращения и экстренного инвазивного лечения инсульта (Rochelle et al., 2001, J. Neurochem. 77: 353-371). Планируется предоставить некоторые из этих препаратов на рассмотрение в FDA, и многие уже включены в последнюю фазу клинических испытаний. Обнаружено, что при лечении неврологических расстройств, связанных с ишемией головного мозга или инсультом, среди этих препаратов ГАМКергические препараты являются исключительно эффективными.
Однако, принимая во внимание многофакторную природу ишемического повреждения клеток головного мозга, специалисты по инсульту предполагают, что основанный на одном лекарственном средстве способ лечения не способен полностью защитить головной мозг во время инсульта и после него. Существует огромный интерес к разработке альтернативных способов лечения различных нейродегенеративных нарушений и нервных заболеваний, так как современные терапевтические средства не лечат адекватно связанное с ишемией головного мозга или инсультом повреждение. Только терапия на основе клеток может быть доступным средством для всестороннего лечения вызванного таким событием повреждения. Многие неврологические заболевания и состояния вызваны потерей нервных клеток в головном мозге и отделах спинного мозга. Широкий спектр таких неврологических заболеваний и состояний, включая - в качестве неограничивающих примеров - болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона и повреждение спинного мозга, могут быть излечимы посредством терапии на основе клеток. Например, пациентов с болезнью Паркинсона успешно лечили посредством трансплантации дофаминергических нейронов в головной мозг пораженных индивидов (Grisolia, 2002, Brain Res Bull 57: 823-826). Следовательно, когда у пациентов с ишемией головного мозга или инсультом поражены или повреждены продуцирующие ГАМК клетки, замещение этих поврежденных продуцирующих ГАМК клеток новыми и здоровыми продуцирующими ГАМК клетками было бы идеальной терапией при лечении ишемии головного мозга или инсульта.
Потребность в больших количествах нервных клеток, которые трудно выделить из эмбрионов или взрослых особей, является одной из основных проблем трансплантации клеток как терапевтического средства при нейродегенеративных нарушениях и нервных заболеваниях. Единственным решением этой дилеммы является доступность полипотентных стволовых клеток, которые можно применять для образования неограниченного количества типов клеток в конечной стадии дифференцировки. Полипотентные эмбриональные стволовые (ЭС) клетки представляют собой жизнеспособный альтернативный источник нервных клеток, которые можно применять для лечения различных нейродегенеративных нарушений и нервных заболеваний. ЭС клетки могут неограниченно пролиферировать в недифференцированном состоянии и являются полипотентными, что делает возможной их дифференцировку почти во все присутствующие в организме типы клеток. Так как ЭС клетки способны становиться почти всеми специализированными клетками организма, они могут замещать клетки широкого ряда тканей и органов, таких как сердце, поджелудочная железа, нервная ткань, мышца, хрящ и пр. ЭС клетки можно выделять из внутренней клеточной массы (ВКМ) бластоцисты, представляющей собой стадию эмбрионального развития, проходящую перед имплантацией. Человеческие ЭС клетки можно выделять из человеческой бластоцисты на ранней стадии эмбрионального развития, продолжающейся от 4 до 7 суток после оплодотворения. Выделенные из ВКМ ЭС клетки можно культивировать in vitro и в подходящих условиях для неограниченной пролиферации.
Линии ЭС клеток успешно созданы для ряда видов, включая мышь (Evans et al., 1981, Nature 292: 154-156), крысу (Iannaccone et al., 1994, Dev. Biol., 163: 288-292), свинью (Evans et al., 1990, Theriogenology 33: 125-128; Notarianni et al., 1990, J. Reprod. Fertil. Suppl. 41: 51-6), овцу и козу (Meinecke-Tillmann and Meinecke, 1996, J. Animal Breeding and Genetics 113: 413-426; Notarianni et al., 1991, J. Reprod. Fertil. Suppl. 43: 255-60), кролика (Giles et al., 1993, Mol. Reprod. Dev. 36: 130-138, Graves et al., 1993, Mol. Reprod. Dev. 36: 424-433), норку (Sukoyan et al., Mol. Reprod. Dev. 1992, 33: 418-431), хомяка (Doetschman et al., 1988, Dev. Biol. 127: 224-227), домашнюю птицу (Pain et al., 1996, Development 122(8): 2339-48), приматов (патент США №5843780), и человека (Thomson et al., 1998, Science 282: 1145-1147; Reubinoff et al., 2000, Nature Biotech. 18: 399-403). При введении иммунодефицитным мышам ЭС клетки человека, подобно другим ЭС клеткам млекопитающих, дифференцируются и формируют ткани всех трех зародышевых листков, доказывая свою полипотентность. Опубликованные сообщения показывают, что ЭС клетки человека поддерживали в культуре больше года, в течение которого они сохраняли полипотентность, способность к самообновлению и нормальный кариотип (Thomson et al., 1995, PNAS 92: 7844-7848).
Показано, что ЭС клетки дифференцировались в нейроны и глиальные клетки в моделях in vitro (Bain et al., 1995, Dev. Biol. 168: 342-357) и в моделях in vivo (Brustle, et al., 1999, Science 285: 754-56). Аналогично, после трансплантации стволовые клетки стадии бластулы могут дифференцироваться в дофаминергические и серотонинергические нейроны (Deacon et al., 1998, Exp. Neurol. 149: 28-41). Стволовые клетки человека или грызунов способны дифференцироваться в специфические типы нейронов при пересадке как в развивающуюся центральную нервную систему (Flax et al., 1998, Nat. Biotechnol. 16: 1033-39; Brustle et al., 1998, Nat. Biotechnol. 16: 1040-44; Reubinoff et al., 2001, Nat. Biotechnol. 19: 1034-40), так и в нейрогенные области ЦНС взрослой особи (Fricker et al., 1999, J. Neurosci. 19: 5990-6005; Shihabuddin et al., 2000, J. Neurosci. 20: 8727-35).
Сообщалось об одном способе получения продуцирующих ГАМК клеток из незрелых нервных клеток (Rubenstein et al., патент США №6602680, включенный в настоящее описание в качестве ссылки). Rubenstein et al. описали продукцию ГАМКергических клеток посредством повышения активности гена DLX в незрелых нервных клетках, например DLX1, DLX2 или DLX5. Повышение активности DLX является причиной дифференцировки незрелых нервных клеток в клетки с ГАМКергическим фенотипом. Также описаны способы получения продуцирующих ГАМК клеток из мышиных эмбриональных стволовых клеток (Hancock et al., 2000, Biochem. Biophys. Res. Commun. 271(2): 418-21, Westmoreland et al., 2001, Biochem. Biophys. Res. Commun. 284(3): 674-80; U.S. Publication №2003/0036195 Al, каждая конкретно включена в настоящее описание в качестве ссылки), но этими способами не получают высокого содержания ГАМКергических нейронов. Существует необходимость в дополнительных способах получения in vitro больших количеств ГАМКергических нейронов из полипотентных стволовых клеток, так как большие количества ГАМКергических нейронов необходимы для клеточной заместительной терапии.
Способы, посредством которых можно получать высокий выход ГАМКергических нейронов, имеют огромное клиническое значение для клеточной трансплантационной терапии, особенно для пациентов, страдающих от ишемии головного мозга или инсульта. В настоящее время доступные способы лечения являются крайне ограниченными в том, что касается лечения нейропатологии, связанной с ишемией головного мозга и инсультом, поэтому существует огромный интерес к развитию альтернативных способов лечения. Клеточная терапия требует больших количеств клеток или нейронов для лечения, которые не достижимы, если доступным источником клеток и нейронов является только эмбриональная ткань или ткань взрослой особи. Например, для изучения функционального восстановления двигательной функции необходимо пересадить в модельное животное с болезнью Паркинсона приблизительно 1 миллион клеток, продуцирующих дофаминергические нейроны (Grisolia, 2002, Brain Res. Bull. 57: 823-826). Получение такого большого количества клеток с применением эмбрионального материала вызывает множество этических проблем. Получение ГАМКергических нейронов из полипотентных стволовых клеток позволяет обеспечить потенциально неограниченную поставку ГАМКергических нейронов для применения в способах лечения на основе клеток. Однако, чтобы сделать данный источник осуществимым на практике, необходимы способы с высоким выходом ГАМКергических нейронов, особенно потому, что, вероятно, потребуются большие количества ГАМКергических нейронов для способов терапии с применением этих клеток.
Краткая сущность изобретения
Настоящее описание изобретения относится к улучшенным способам получения из полипотентных стволовых клеток, таких как эмбриональные стволовые (ЭС) клетки, нейрональных клеток-предшественников, а также глиальных клеток или нервных клеток в конечной стадии дифференцировки. В предпочтительном варианте осуществления полипотентные стволовые клетки, или ЭС клетки, представляют собой мышиные клетки. Полученные здесь клетки включают в себя в качестве неограничивающих примеров клетки с фенотипическими характеристиками нейрональных клеток-предшественников, нервных клеток, таких как ГАМКергические, дофаминергические, серотонинергические и глутаматергические нейроны, а также глиальные клетки, такие как олигодендроциты и астроциты. В настоящем описании изобретения показано, что полипотентные стволовые клетки, например мышиные ЭС клетки, могут дифференцироваться в клетки с высоким содержанием ГАМКергических нейронов (например, по меньшей мере 60%). Доля полученных способами согласно описанию ГАМКергических нейронов выше, чем в описанных ранее способах. ГАМКергические нейроны можно применять для поливалентных основанных на клетках способов лечения, например, в клеточной заместительной терапии или при лечении нейродегенеративных нарушений и нервных заболеваний, включая, например, инсульт, ишемию головного мозга, эпилепсию, болезнь Паркинсона, болезнь Гентингтона, болезнь Альцгеймера, хроническую боль, тревогу и другие расстройства настроения.
В настоящем описании представлена популяция дифференцированных клеток в культуре in vitro, полученных посредством дифференцировки полипотентных стволовых клеток, где по меньшей мере 60% дифференцированных нервных клеток представляют собой ГАМКергические нейроны, клетки, проявляющие фенотипы ГАМКергических нейронов, или клетки, продуцирующие гамма-аминомасляную кислоту (ГАМК). Предпочтительно, чтобы ГАМКергические нейроны экспрессировали GAD65, GAD67, рецептор ГАМК-А или рецептор ГАМК-Б, или их сочетание. В других вариантах осуществления по меньшей мере 30%, 35%, 40%, 45%, 50%, 55%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99% дифференцированных клеток представляют собой ГАМКергические нейроны или продуцируют ГАМК. Предпочтительно, чтобы ГАМКергические нейроны или продуцирующие ГАМК клетки были получены из ЭС клеток, более предпочтительно из человеческих или мышиных ЭС клеток. В других вариантах осуществления популяция дифференцированных клеток также содержит по меньшей мере приблизительно 15% дофаминергических нейронов, по меньшей мере приблизительно 10% глутаматергических нейронов, по меньшей мере приблизительно 10% глутаматергических нейронов, по меньшей мере приблизительно 5% серотонинергических нейронов, по меньшей мере приблизительно 5% астроцитов, или сочетание этих количеств.
Согласно изобретению также представлены способы получения дифференцированных клеточных популяций из полипотентных стволовых клеток, включающие в себя следующие этапы:
(a) наращивание культуры из полипотентных стволовых клеток;
(b) культивирование полипотентных стволовых клеток для отбора нестин-позитивных нейрональных клеток-предшественников;
(c) наращивание нестин-позитивных нейрональных клеток-предшественников; и
(d) дифференцировку нестин-позитивных клеток с образованием дифференцированной клеточной популяции посредством культивирования клеток в среде для дифференцировки, содержащей цитозин-β-d-арабинофуранозид (Ara-C).
В предпочтительном варианте осуществления полипотентные стволовые клетки представляют собой ЭС клетки, более предпочтительно человеческие или мышиные ЭС клетки.
В других вариантах осуществления описанные выше способы дополнительно включают в себя стадию культивирования полипотентных стволовых клеток со стадии (b) для формирования эмбриональных телец. Предпочтительно, чтобы эти эмбриональные тельца культивировали в условиях для отбора нестин-позитивных нейрональных клеток-предшественников, например, посредством культивирования полипотентных стволовых клеток или эмбриональных телец в бессывороточной среде предпочтительно в течение 6-10 суток. В предпочтительных вариантах осуществления бессывороточная среда представляет собой бессывороточную среду ITSFn определенного состава, предпочтительно включающую в себя один или несколько растворимых факторов, выбранных из группы, состоящей из инсулина, селенита натрия, основного фактора роста фибробластов, трансферрина и фибронектина. Предпочтительно, чтобы бессывороточная среда ITSFn определенного состава включала в себя инсулин, селенит натрия, трансферрин и фибронектин. В предпочтительных вариантах осуществления этими способами получают нейрональные клетки-предшественники, предпочтительно включающие в себя по меньшей мере приблизительно 60-75% нестин-позитивных клеток, более предпочтительно приблизительно 80-90% нестин-позитивных клеток и наиболее предпочтительно приблизительно 95-99% нестин-позитивных клеток.
В определенных вариантах осуществления указанные выше способы дополнительно включают в себя стадию наращивания нестин-позитивных нейрональных клеток-предшественников со стадии (c) в ростовой среде для клеток ЦНС предпочтительно в течение 6-10 суток. Предпочтительно, если ростовая среда для клеток ЦНС включает в себя один или несколько растворимых факторов, выбранных из группы, состоящей из добавки N2, добавки B27 и средства индукции нейронов. В предпочтительном варианте осуществления средство индукции нейронов представляет собой основной фактор роста фибробластов (bFGF). В еще одном предпочтительном варианте осуществления нестин-позитивные нейрональные клетки-предшественники вносят в культуральные чашки, предварительно покрытые поли-L-орнитином, поли-L-ламинином или их сочетанием. Нестин-позитивные нейрональные клетки-предшественники можно наращивать в культуре и последовательно пассировать в течение одного или нескольких удвоений популяций. Также эти клетки можно замораживать в жидком азоте.
Предпочтительно, чтобы нестин-позитивные нейрональные клетки-предшественники выращивали в среде для дифференцировки в течение 2 или более суток, как описано в стадии (d) указанных выше способов. Предпочтительно, чтобы среда для дифференцировки также включала в себя добавку N2, добавку B27 или обе эти добавки, но не основной фактор роста фибробластов (bFGF). В предпочтительных вариантах осуществления после этого нейрональные клетки-предшественники выращивают в среде для дифференцировки, содержащей цитозин-β-d-арабинофуранозид (Ara-C), дополнительно клетки культивируют в среде для дифференцировки без Ara-C предпочтительно в течение 8-16 суток, более предпочтительно в течение 12 суток.
Также в настоящем описании представлены способы образования ГАМКергических нейронов из нейрональных клеток-предшественников, включающие в себя обогащение нейрональных клеток-предшественников нестин-позитивными клетками и дифференцировку нестин-позитивных клеток с образованием ГАМКергических нейронов посредством культивирования клеток в присутствии Ara-C. Затем нестин-позитивные клетки культивируют в среде для дифференцировки с Ara-C, затем их предпочтительно дифференцируют в среде для дифференцировки без Ara-C. Предпочтительно, чтобы с применением этих способов по меньшей мере приблизительно 40-99% нестин-позитивных клеток дифференцировались в ГАМКергические нейроны.
В предпочтительных вариантах осуществления описанные выше способы применяют для образования дифференцированных популяций клеток, предпочтительно включающих в себя приблизительно 60-80% ГАМКергических нейронов, более предпочтительно приблизительно 75-90% ГАМКергических нейронов и наиболее предпочтительно 95-99% ГАМКергических нейронов. В других вариантах осуществления эти способы применяют для образования дифференцированных популяций клеток, предпочтительно включающих в себя приблизительно 15-30% дофаминергических нейронов, более предпочтительно приблизительно 20-40% дофаминергических нейронов и наиболее предпочтительно приблизительно 25-50% дофаминергических нейронов. В определенных вариантах осуществления эти способы применяют для образования дифференцированных популяций клеток, предпочтительно включающих в себя приблизительно 5-20% серотонинергических или глутаматергических нейронов, более предпочтительно приблизительно 10-25% серотонинергических или глутаматергических нейронов и наиболее предпочтительно приблизительно 15-30% серотонинергических или глутаматергических нейронов. В других вариантах осуществления эти способы применяют для образования дифференцированных популяций клеток, предпочтительно включающих в себя приблизительно 5-20% олигодендроцитов или астроцитов, более предпочтительно приблизительно 10-25% олигодендроцитов или астроцитов и наиболее предпочтительно приблизительно 15-30% олигодендроцитов или астроцитов.
Кроме того, настоящее изобретение представляет модель трансплантации in vitro для изучения эффективности, выживаемости и функционирования дифференцированных клеток, предпочтительно нейрональных или нервных клеток, в окружении, подобном хозяйскому, таком как окружение головного мозга. Например, описанные здесь ГАМКергические нейроны культивируют со зрелыми клетками головного мозга, предпочтительно нервными клетками, или клетками гиппокампа. Предпочтительно ГАМКергические нейроны переносят на клетки гиппокампа взрослой особи. Клетки культивируют вместе в течение по меньшей мере 3-20 суток, более предпочтительно 1 неделю, и определяют выживаемость нейрональных или нервных клеток. Предпочтительно, когда выживает по меньшей мере приблизительно 80% нейрональных или нервных клеток, более предпочтительно, когда выживает 90-99% клеток. Высокая степень выживаемости показывает, что клетки подходят для функционирования в окружении головного мозга взрослой особи, и их можно использовать для лечения нейродегенеративных нарушений или нервных заболеваний.
Также настоящее описание связано со способами лечения субъектов с нейродегенеративными нарушениями или нервными заболеваниями посредством введения субъекту нейрональных клеток-предшественников или дифференцированных нейрональных клеток, полученных из полипотентных стволовых клеток, например, как здесь описано, мышиных или человеческих ЭС клеток. Полученные здесь клетки можно применять также в клеточной заместительной терапии у человека. Например, популяцию дифференцированных нейрональных клеток можно получить следующим образом:
(a) наращивая культуру полипотентных стволовых клеток;
(b) культивируя полипотентные стволовые клетки для отбора нестин-позитивных нейрональных клеток-предшественников;
(c) наращивая нестин-позитивные нейрональные клетки-предшественники; и
(d) дифференцируя нестин-позитивные клетки для получения дифференцированной популяции клеток посредством культивирования клеток в среде для дифференцировки, включающей в себя цитозин-β-d-арабинофуранозид (Ara-C).
Согласно еще одному предпочтительному варианту осуществления дополнительно способствуют дифференцировке дифференцированных клеток со стадии (d) в среде для дифференцировки без Ara-C. В предпочтительных вариантах осуществления субъектом является пациент, более предпочтительно человек. Предпочтительно полученные из полипотентных стволовых клеток нейрональные клетки-предшественники или дифференцированные нейрональные клетки гистосовместимы с субъектом, например, если нейрональные клетки-предшественники или дифференцированные нейрональные клетки имеют, по существу, тот же геном, что и субъект.
В определенных вариантах осуществления ГАМКергические, дофаминергические, серотонинергические и глутаматергические нейроны, а также глиальные клетки, такие как олигодендроциты и астроциты, выделяют из дифференцированной нейрональной популяции клеток и вводят пациенту. В предпочтительном варианте осуществления субъекту вводят ГАМКергические нейроны. Эти клетки, а также популяции нейрональных клеток-предшественников или дифференцированных нейрональных клеток можно вводить субъекту для лечения ряда нейродегенеративных нарушений или нервных заболеваний, включая в качестве неограничивающих примеров инсульт, ишемию головного мозга, эпилепсию, болезнь Паркинсона, болезнь Гентингтона, болезнь Альцгеймера, повреждение спинного мозга, боковой амиотрофический склероз (ALS), эпилепсию и другие расстройства ЦНС, а также хроническую боль, тревожность и другие расстройства настроения. Этих субъектов также можно лечить посредством клеточной заместительной терапии. Предпочтительно клетки вводят посредством трансплантации, например посредством трансплантации желательных клеток в головной мозг субъекта.
Еще один вариант осуществления настоящего изобретения представляет собой способ лечения субъекта с нейродегенеративным расстройством или нервным заболеванием, включающий в себя следующие стадии:
(a) наращивание культуры полипотентных стволовых клеток;
(b) культивирование полипотентных стволовых клеток для отбора нестин-позитивных нейрональных клеток-предшественников;
(c) наращивание нестин-позитивных нейрональных клеток-предшественников;
(d) дифференцировку нестин-позитивных клеток для получения дифференцированной популяции клеток посредством культивирования клеток в среде для дифференцировки, включающей в себя цитозин-β-d-арабинофуранозид (Ara-C); и
(e) трансплантацию терапевтически эффективного количества дифференцированной нейрональной популяции клеток в центральную нервную систему пациента.
В предпочтительном варианте осуществления полипотентные стволовые клетки представляют собой мышиные или человеческие ЭС клетки. В других предпочтительных вариантах осуществления субъектом является пациент, более предпочтительно человек. Предпочтительно, когда дифференцированная популяция нейрональных клеток является гистосовместимой с пациентом. В еще одном варианте осуществления стадия (d) дополнительно включает в себя дифференцировку клеток в среде для дифференцировки в течение 2 или более суток и последующую дифференцировку клеток во второй, не содержащей цитозин-β-d-арабинофуранозид (Ara-C) среде для дифференцировки. В предпочтительных вариантах осуществления ГАМКергические нейроны выделяют из дифференцированной популяции нейрональных клеток и вводят субъекту, например, в головной мозг предпочтительно посредством трансплантации. В определенных вариантах осуществления нейродегенеративное расстройство или нервное заболевание выделяют из группы, состоящей из болезни Паркинсона, болезни Альцгеймера, болезни Гентингтона, деменции с тельцами Леви, рассеянного склероза, мозжечковой атаксии, прогрессирующего супрануклеарного паралича, повреждения спинного мозга, бокового амиотрофического склероза (ALS), эпилепсии, инсульта и ишемии.
В других вариантах осуществления популяцию нейрональных клеток-предшественников или дифференцированных нейрональных клеток, полученных из полипотентных стволовых клеток, как здесь описано, можно использовать для скрининга соединений, например небольших молекул и лекарственных средств, по их воздействию на популяцию клеток, особенно дифференцированных нервных или глиальных клеток, или активность этих клеток. Также соединения можно проверять на токсичность или модулирование нервных клеток. Например, соединение можно оценить посредством добавления соединения к популяции дифференцированных нервных клеток, таких как ГАМКергические нейроны, и сравнить выживаемость, морфологию, фенотип, функциональную активность или другие характеристики клеток с дифференцированными нервными клетками, культивируемыми в сходных условиях, но не подвергавшимися воздействию соединения. Соединения можно подвергать скринингу, например, чтобы определить, вызывают ли они изменения в синтезе, высвобождении или накоплении нейромедиатора клетками.
Еще один вариант осуществления настоящего описания связан со способом создания in vitro модели трансплантации нервных клеток, включающим в себя следующие стадии:
(a) выделение зрелых клеток гиппокампа;
(b) диссоциацию и культивирование клеток гиппокампа для образования культуры клеток гиппокампа; и
(c) культивирование нервных клеток на культуре клеток гиппокампа;
где оценивают выживаемость нервных клеток на культуре клеток гиппокампа. В других вариантах осуществления оценивают формирование синапсов между нервными клетками и культурой клеток гиппокампа. В одном варианте осуществления настоящего изобретения зрелые клетки гиппокампа выделяют из мыши. В определенных вариантах осуществления культивируемые на культуре клеток гиппокампа нервные клетки представляют собой, например, ГАМКергические, дофаминергические, серотонинергические или глутаматергические нейроны. В других вариантах осуществления на культуре клеток гиппокампа культивируют глиальные клетки, такие как олигодендроциты или астроциты. Культивируемые на культуре клеток гиппокампа нервные клетки или глиальные клетки можно получать с применением описанных здесь способов или же путем получения или выделения посредством других способов, хорошо известных специалистам в данной области. Предпочтительно, чтобы по меньшей мере приблизительно 50% нервных клеток, культивируемых на культуре клеток гиппокампа, выживали в течение по меньшей мере недели, более предпочтительно приблизительно 60%, 70%, 80%, 90% или 95%. В одном предпочтительном варианте осуществления после одной недели культивирования выживают более чем приблизительно 90% ГАМКергических нейронов.
Краткое описание некоторых чертежей
Следующие ниже чертежей составляют часть настоящего описания изобретения и включены в настоящее описание для дополнительной демонстрации конкретных аспектов настоящего изобретения, которое можно легче понять со ссылкой на один или несколько из этих чертежей в сочетании с детальным описанием представленных здесь конкретных вариантов осуществления.
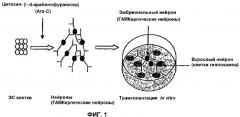
На фиг.1 показано схематическое изображение получения ГАМКергических нейронов из мышиных ЭС клеток, а также пересадка in vitro ГАМКергических нейронов с полученными из зрелого мышиного головного мозга нейронами гиппокампа.
На фиг.2 показано схематическое изображение стадий дифференцировки мышиных ЭС клеток в нейрональные клетки в конечной стадии дифференцировки, включая (1) размножение недифференцированных клеток; (2) формирование эмбриональных телец; (3) отбор нестин-позитивных клеток; (4) размножение нестин-позитивных клеток; и (5) дифференцировку нейральных предшественников в окончательно дифференцированные нейрональные клетки.
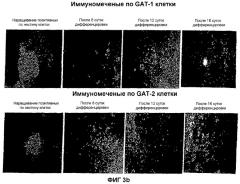
На фиг.3 показана локализация следующих маркеров посредством иммунореактивности в нейрональной популяции, полученной из мышиных ЭС клеток: (a) GAD-65 и GAD-67; (b) GAT-1 и GAT-2; (c) глутамат и ГАМК; и (d) нестин и MAP-2. Иммунореактивность изучали на 4 различных стадиях: размножение нестин-позитивных клеток на 8, 12 и 16 сутки после дифференцировки.
На фиг.4 показана солокализация ГАМК и GAD-65/GAD-67 иммунореактивности в ГАМКергических нейронах, полученных из мышиных ЭС клеток с применением описанных здесь способов. Присутствие ГАМК иммунофлуоресценции в GAD-65 и GAD-67 позитивных клетках подтверждает, что эти ГАМКергические нейроны продуцируют ГАМК.
На фиг.5 показан профиль экспрессии генов ГАМКергических нейрон-специфических факторов в мышиных ЭС клетках и на разных стадиях во время дифференцировки in vitro этих клеток в ГАМКергические нейроны. Этими стадиями являются недифференцированные мышиные ЭС клетки (Un), эмбриональные тельца (EB), нестин-отбор (N), нестин-размножение (NE), 2 сутки дифференцировки (D-2); 4 сутки дифференцировки (D-4); 8 сутки дифференцировки (D-8); 12 сутки дифференцировки (D-12); и 16 сутки дифференцировки (D-16). Анализировали экспрессию следующих ГАМКергических нейрон-специфических генов: GAD1, GAD2, VIAAT и транскриптов эмбриональной GAD1. Экспрессию GAD1 наблюдали на всех стадиях, включая недифференцированные ЭС клетки. Экспрессию GAD2 наблюдали на стадиях отбора по нестину, размножения экспрессирующих нестин клеток и всех дифференцированных стадий, но экспрессию не обнаруживали на недифференцированной стадии и стадии эмбриональных телец. Экспрессию VIAAT наблюдали только на стадиях дифференцировки, особенно на 8 сутки и 12 сутки дифференцировки. Интересно, что VIAAT не экспрессировался после 16 суток дифференцировки. Экспрессию гена эмбриональной GAD1 наблюдали на всех стадиях, за исключением недифференцированной стадии. В качестве положительного контроля на всех стадиях определяли ген домашнего хозяйства β-актин.
Фиг.6 представляет собой сравнительный анализ нейрональных популяций, полученных из мышиных ЭС клеток. Суммарные количества клеток на различных стадиях получения считали с применением морфометрического анализа. Анализируемыми стадиями получения являлись размножение (a) нестин-позитивных клеток (NE); (b) 8 сутки дифференцировки; (c) 12 сутки дифференцировки; и (d) 16 сутки дифференцировки. Клетки считали по (1) общему количеству нейронов; (2)экспрессии глутамата; (3) экспрессии ГАМК; (4) экспрессии тирозингидроксилазы (TH); и (5) экспрессии HT.
На фиг.7 показаны определяемые посредством высокоэффективной жидкостной хроматографии с обращенной фазой (RP-HPLC) уровни внеклеточной ГАМК на следующих стадиях: размножения нестин-позити