Сменный микрофлюидный модуль для автоматизированного выделения и очистки нуклеиновых кислот из биологических образцов и способ выделения и очистки нуклеиновых кислот с его использованием
Иллюстрации
Показать всеИзобретение относится к молекулярной биологии и медицине. Сменный микрофлюидный модуль для автоматизированного выделения и очистки нуклеиновых кислот из биологических образцов содержит резервуары для реагентов и реакционные объемы, микроканалы и клапана, необходимые для перемещения жидкостей внутри модуля. Модуль включает приемную камеру для ввода биологического образца, резервуар для лизиса, содержащий мембрану, резервуары для растворов лизирующего буфера, микроколонку, содержащую твердофазный сорбент для связывания нуклеиновых кислот, резервуары промывочного буфера и этанола для удаления с микроколонки остаточных белков и кристаллов соли, резервуар для элюирующего буфера, выходной порт, совместимый со стандартной микропробиркой, резервуар для сбора отходов реакций. Способ выделения и очистки нуклеиновых кислот из биологических образцов включает фильтрацию образца через мембрану, лизис задержанных на мембране клеток микроорганизмов, связывание нуклеиновых кислот на микроколонке, отмывку нуклеиновых кислот от белков и кристаллов соли, элюцию нуклеиновых кислот с микроколонки в пробирку. Все стадии выделения и очистки осуществляются в автоматическом режиме внутри микрофлюидного модуля, изолирующего образец от внешней среды. Изобретение позволяет снизить себестоимость препарата нуклеиновой кислоты. 2 н. и 12 з.п. ф-лы, 14 ил., 1 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к молекулярной биологии, микробиологии и медицине и касается сменного микрофлюидного модуля для выделения и очистки нуклеиновых кислот (НК) из биологических образцов, в котором в автоматическом режиме осуществляются все стадии выделения и очистки нуклеиновых кислот, и способа выделения и очистки НК из клеток микроорганизмов и/или вирусных частиц с использованием микрофлюидного модуля.
Уровень техники
Анализ НК необходим как для проведения широкого круга исследований в разных областях науки, так и для использования в клинической диагностике, фармакологии, медицине, биотехнологии, охране окружающей среды и др. Выделение НК (ДНК и/или РНК), как правило, является первой стадией ряда молекулярно-генетических исследований, включающих также амплификацию НК (ПЦР и другие методы), клонирование и секвенирование фрагментов генома, конструирование кДНК-библиотек и т.д. В связи с этим получение препаратов НК высокой степени очистки остается актуальной задачей. Для выделения НК используют как биологический материал (животные и растительные клетки, ткани, физиологические жидкости (кровь, слюна и др.)), так и образцы почвы, воды, пищевых продуктов. Современные требования к лабораторным методам выделения НК включают универсальность протокола для получения очищенной ДНК и РНК из различных биологических образцов, быстроту, эффективность и безопасность выполнения процедуры для персонала. Возрастают требования к чистоте получаемых препаратов и воспроизводимости процедуры.
Для концентрирования клеток микроорганизмов из биологических образцов используются следующие методики: фильтрация образца (Icuta, К., Maruo, S., Fujisawa, Т., Yamada, A. Micro Concentrator with OptoSense Micro Reactor for Biochemical IC Chip Family - 3D Composite Structure and Experimental Verification Proc. of 12th IEEE International Conference on Micro Electro Mechanical Systems (MEMS'99), Orlando, 1999: p.376-381), электрокинетическая фокусировка (C.R.Cabrera, P.Yager, Continuous concentration of bacteria in a microfluidic flow cell using electrokinetic techniques. Electrophoresis, 2001, v.22, p.355-362), микродиализ (F.Xiang, Y. Lin, J.Wen, D.W.Matson, R.D.Smith. An integrated microfabricated device for dual microdialysis and on-line ESI-ion trap mass spectrometry for analysis of complex biological samples. Anal Chem., 1999, v.71, p.1485-1490), аффинная хроматография с целью концентрирования клеток и последующей твердофазной экстракции НК (С.Yu, M.H.Davey, F.Svec, J.M.Frechet, Monolithic porous polymer for on-chip solid-phase extraction and preconcentration prepared by photoinitiated in situ polymerization within a microfluidic device. Anal Chem., 2001, v.73, p.5088-5096).
Наиболее предпочтительной является процедура фильтрации клеток через специализированную мембрану благодаря простоте, экспрессности и возможности реализации в миниатюрном устройстве. Более того, сконцентрированные клетки могут быть подвергнуты лизису непосредственно на мембране после фильтрации.
В качестве мембран для фильтрации могут быть использованы фильтры из боросиликатного стекла, целлюлозные мембраны, PTFE фильтры, мембраны из поливинилидендифторида. Однако ряд материалов является непригодным для использования в качестве фильтрующих материалов:
- фильтры из боросиликатного стекловолокна могут содержать остаточное количество воды (растворов) после окончания фильтрации, а также обладают сильным ингибирующим эффектом в отношении ПЦР;
- целлюлозные мембраны являются хрупкими и также ингибируют ПЦР;
- PTFE фильтры, в силу гидрофобных свойств, являются неприменимыми для фильтрации водных растворов.
Наиболее предпочтительными являются фильтры на основе поливинилидендифторида (PVDF фильтры). Благодаря своей гидрофильной структуре, химической инертности, механической прочности, легкости в обработке и отсутствием ингибирующего эффекта на ПЦР данный тип фильтров может быть использован для осуществления механического концентрирования и химического лизиса клеток в формате миниатюрного закрытого устройства (микрофлюидного модуля).
Основным недостатком известных методик лизиса клеток и вирусных частиц является то, что в процессе выполнения процедуры наряду с целевыми нуклеиновыми кислотами экстрагируется множество субстанций, способных к ингибированию ПЦР.
Среди основных методик физического разрушения клеток, таких как метод замораживания-оттаивания (C.R.Kuske, K.L.Banton, D.L.Adorada, P.C.Stark, K.K.Hill, P.J.Jackson, Small-Scale DNA Sample Preparation Method for Field PCR Detection of Microbial Cells and Spores in Soil. Appl Environ Microbiol, 1998, v.64, p.2463-2472), метод суспендированной гомогенизации (W.Liesack, E.Stackebrandt, Occurrence of novel groups of the domain Bacteria as revealed by analysis of genetic material isolated from an Australian terrestrial environment. J Bacteriol., 1992, v.174, p.5072-5078), метод облучения ультразвуком (Т.С.Marentis, В.Kusler, G.G.Yaralioglu, S.Liu, E.O.Haeggstrom, B.T.Khuri-Yakub. Microfluidic sonicator for real-time disruption of eukaryotic cells and bacterial spores for DNA analysis. Ultrasound Med Biol., 2005, v.31, p.1265-1277), метод растирания в жидком азоте (R.A.Hurt, X.Qiu, L.Wu, Y.Roh, A.V.Palumbo, J.M.Tiedje, J.Zhou, Simultaneous recovery of RNA and DNA from soils and sediments. Appl Environ Microbiol., 2001, v.67, p.4495-4503), наиболее используемыми являются методы замораживания-оттаивания и суспендированной гомогенизации. Однако такие подходы ограниченно реализуемы в миниатюрных микрофлюидных системах.
Химические методы лизиса используют различные солюбилизирующие и дестабилизирующие агенты, такие как поверхностно-активные вещества, например SDS (J.B.Herrick, D.N.Miller, E.L.Madsen, W.C.Ghiorse, Extraction, purification, and amplification of microbial DNA from sediments and soils. In: J.F.Burke (ed.), PCR: essential techniques. John Wiley & Sons, N.Y., 1996, p.130-133), Triton X-100, саркозил и др. (W.E.Holben, Isolation and purification of bacterial community DNA from environmental samples. In: C.J.Hurst, G.R.Knudsen, M.J.McInerney, L.D.Stetzenbach, M.V.Walter (ed.), Manual of methods in environmental microbiology. American Society for Microbiology, Washington, D.C., 1997, p.431-436), хаотропные агенты типа гуанидинтиоцианата (гидрохлорида) и перхлората натрия. Помимо этого химический лизис включает стадию высокотемпературной инкубации (60°С и более).
Ряд лизирующих процедур также основывается на использовании ферментов для разрушения клеточных стенок и мембран, таких как лизоцим, субтилизин, протеиназа К (Р.А.Rochelle, J.C.Fry, R.J.Parkes, A.J.Weightman, DNA extraction for 16S rRNA gene analysis to determine genetic diversity in deep sediment communities. FEMS Microbiol. Lett, 1992, v.100. p.59-66).
Для выделения НК разработан целый ряд методов экстракции и очистки (см., например, J.Sambrook, D.W.Russel, Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press, 2001, N.Y., v. 1, ch. 1, 2, 6, 7; Short protocols in molecular biology, Wiley, 1995). Широко известные методы выделения плазмидной и геномной ДНК включают разрушение (лизис) клеток различными методами и последующую экстракцию НК фенолом, смесью фенола с хлороформом, осаждение НК этанолом. Используют также центрифугирование в градиенте CsCl2. Для очистки НК применяют хроматографические методы. Для выделения мРНК из клеток и тканей используют экстракцию образца смесью фенол - гуанидинтиоцианат - хлороформ. Недостатками таких методов являются длительность выделения НК (не менее 3,5 ч), многостадийность процесса, необходимость применения органических растворителей, а также малый выход продукта (не более 50%, для РНК - около 7%).
Для экстракции НК из лизатов клеток микроорганизмов и/или вирусных частиц применяют гель-фильтрацию на смолах типа Sepharose/Sephadex и твердофазную экстракцию НК на кремниевых сорбентах. Твердофазная экстракция НК является предпочтительным методом, так как, помимо простоты и скорости выполнения методики, данный принцип выделения нуклеиновых кислот легко адаптируется в формат микрофлюидной системы.
В настоящее время для экстракции НК используют следующие типы сорбентов:
- силикагели;
- стекловолокнистые фильтры;
- химически модифицированное стекло.
Известен способ выделения ДНК из клинических образцов с использованием силикатного сорбента (Short protocols in molecular biology, Wiley, 1995), а также мелкодисперсного (стандартизованного по размеру) стекла (М.Beld, С.Sol, J.Goudsmit, R. Boom, Fractionation of nucleic acids into single-stranded and double-stranded forms. Nucl. Acids Res., 1996, v.24. p.2618-2619). Способ заключается в адсорбции ДНК на силикатном сорбенте в присутствии гуанидинтиоцианата с последующей промывкой и элюцией. Силикатный сорбент обладает низкой емкостью (на 1 мг мелкодисперсного стекла: адсорбируется 0,5 мкг ДНК). Данный способ позволяет выделять ДНК длиной более 40000 п.н., при этом удается элюировать с силикатного сорбента не более 50% ДНК в связи с тем, что от 50 до 60% адсорбированной ДНК необратимо связывается с мелкодисперсным стеклом. Таким образом, выход ДНК длиной не менее 40000 п.н. составляет от 40 до 50%.
Описаны методы твердофазной очистки ДНК, которые могут быть осуществлены на специализированном микрочипе или реализованы в микрожидкостном формате (Nucleic acid purification using silica gel and glass particles, патент США 5808041. Методы основаны на сорбции ДНК на частицах кварца или в системе золь-гель в присутствии хаотропных солей, с последующим удалением примесей при промывке водно-спиртовой смесью и элюированием ДНК буферным раствором, в котором можно проводить ПЦР (К.А.Wolfe, М.С.Breadmore, J.P.Ferrance, M.E.Power, J.F.Conroy, P.M.Norris, J.P.Landers, Toward a microchip-based solid-phase extraction method for isolation of nucleic acids. Electrophoresis, 2002, v.23, p.727-733). Сорбенты на основе микрочастиц кремния (сорбция в присутствии хаотропных агентов) используются также для выделения РНК из биологических образцов, содержащих ДНК и РНК (Process and kit for isolating and purifying RNA from biological sources, патент США 5155018). Известен способ выделения и очистки РНК, включающий адсорбцию на аэросиле в среде хаотропного агента, отделение сорбента и связанной с ним НК, элюцию НК с аэросила и очистку целевого продукта. (О.Г.Грибанов, А.В.Щербаков, Н.А.Перевозчикова, В.В.Дрыгин, А.А.Гусев. Простой метод выделения и очистки РНК. Биоорг.химия, 1997, т.23, с.763-765). Недостатками данных способов являются длительность, трудоемкость и недостаточно высокий выход целевого продукта (НК) (не более 50%).
Для выделения и очистки НК описано также применение гель-фильтрации (Method for separating long-chain nucleic acids, патент США 5057426) и ионообменных матриц (рН dependent ion exchange matrix and method of use in the isolation of nucleic acids, патент США 6310199; Method and system for RNA analysis by matched ion polynucleotide chromatography, патент США 6475388).
Описаны способы выделения НК с использованием металлических магнитных частиц, таких как частицы железа, цинка и др., содержащие носители, которые способны специфически сорбировать НК. Магнитные частицы с адсорбированной НК осаждаются под действием магнитного поля. Увеличение сорбционной емкости частиц достигается путем модификации их поверхности (Magnetic particles for purifying nucleic acids, патент США 6919444; Particles having a magnetic core and outer glass layer for separating biological material, патент США 6255477).
Компанией Qiagene запатентован метод последовательного выделения ДНК и РНК из одного и того же образца (Method for sequentially isolating DNA and RNA from the same nucleic acid-containing sample, WO 2004/108925), включающий добавление к образцу хаотропного агента, осаждение НК спиртом, взаимодействие с функциональной НК-связывающей поверхностью и последовательную элюцию ДНК и РНК. Метод основан на различии в кинетике связывания и элюции ДНК и РНК. Связывающей поверхностью могут являться, например, стеклянные шарики или магнитные частицы.
Все вышеописанные способы представляют собой последовательность процедур, проводимых вручную. Этапу очистки ДНК обязательно предшествует лизис клеток и осаждение белков и нерастворимых частиц, поэтому большинство процедур выделения НК включает несколько последовательных стадий центрифугирования, что приводит к увеличению времени выделения НК, увеличению стоимости процедуры, уменьшению выхода НК за счет потерь при отборе супернатанта, содержащего НК, после центрифугирования. Основными недостатками всех ручных процедур являются трудоемкость и недостаточная эффективность (недостаточно высокий выход НК). Кроме того, в некоторых методах выделения используются токсичные органические растворители (фенол и др.), что накладывает дополнительные требования к организации помещений и квалификации персонала.
В настоящее время рядом компаний разработаны автоматизированные устройства, выполняющие обработку клинических образцов и выделение из них НК. Система COBAS AmpliPrep фирмы Roche Diagnostics (США/Швейцария) предназначена для автоматического выделения ДНК и РНК из биологических жидкостей, таких как сыворотка и плазма крови, на основе технологии, использующей магнитные частицы. В сочетании с набором реагентов COBAS TaqMan® Assays система проводит быстрый автоматический ПЦР в реальном времени с полученной ДНК для детекции вирусов гепатита С, гепатита В и ВИЧ.
Автоматизированное устройство фирмы Thermo Electron (США) Thermo's KingFisher производит очистку ДНК, РНК и белков на основе перемещения магнитных частиц. Для анализа используются образцы физиологических жидкостей (кровь, плазма, моча, слюна) объемом 20-200 мкл. Аппарат рассчитан на одновременную обработку 24 образцов.
Компания Qiagen (Германия) выпускает прибор QIAsymphony SP для одновременной автоматической очистки НК из 96 образцов, например, для выделения вирусных НК или геномной ДНК из образцов крови. Технология выделения основана на применении колонок с магнитными частицами, поверхность которых содержит конъюгат никеля с агарозой. Система состоит из картриджей, заполненных необходимыми реагентами, из которых дозированно подаются растворы и ферменты для обработки клинического образца в процессе выделения НК. Картриджи в процессе выделения открываются автоматически, что сводит к минимуму риск заражения или контаминации.
Рабочая станция BioRobot MDx (Qiagen, Германия) включает 8 каналов (колонок) со сменными фильтрами. Ввод и дальнейшее продвижение образца осуществляется вакуумными насосами, стадия центрифугирования отсутствует. Вся процедура полностью управляется компьютером согласно соответствующему протоколу для выделения геномной ДНК из крови или вирусной ДНК и/или РНК из сыворотки и плазмы.
Настольная рабочая станция 'X-tractor GeneTM System' (Corbett Technologies, Австралия) представляет собой роботизированную систему, предназначенную для автоматической экстракции НК из образцов объемом до 200 мкл, полностью воспроизводящую ручное выделение НК.
Компанией Bioneer Corp. заявлено устройство для автоматической очистки ДНК (Automatic DNA purification apparatus, WO/2001/025482), состоящее из многочисленных контейнеров для растворов, каналов для прохождения жидкостей, регулируемых клапанами, вакуумного блока, штативов, шприцов для точного количественного введения и отсасывания жидкостей. Устройство также воспроизводит ручную процедуру выделения ДНК, но в автоматическом режиме.
Описана автоматизированная система-робот для идентификации биологически опасных агентов (Automatic identification of bioagents, WO/2005/009202), Isis Pharmaceuticals, США. Система состоит из двух блоков, разделенных воздушным шлюзом, в первом из которых проводится выделение и очистка ДНК, а во втором - ПЦР для идентификации агента. Для защиты от контаминации давление в первом блоке поддерживается выше, чем внешнее атмосферное давление, а во втором блоке - ниже. Система полностью автоматизирована.
Все существующие в настоящее время полностью автоматизированные устройства по подготовке клинических образцов являются сложными конструкциями, основанными на применении робототехники, что определяет их громоздкость, высокую стоимость (более 70 тыс.долл. США) и дороговизну проведения анализов и эксплуатации. Эти устройства, в основном, воспроизводят ручные способы выделения НК, но с использованием роботов: перемещение пробирок, многоканальное дозирование реактивов. Они являются закрытыми системами, не допускающими вмешательство оператора в ход процесса. При эксплуатации таких систем необходимы постоянные закупки реагентов данной фирмы, которые предназначены для данного конкретного прибора.
Из-за вышеуказанных недостатков роботизированных систем обработки образцов существует тенденция перехода от громоздких полностью интегрированных систем к небольшим гибким устройствам, которые осуществляют манипуляции с исследуемыми образцами, позволяя пользователю модифицировать компоненты устройства и регулировать процесс в соответствии со специфическими требованиями.
Существуют относительно простые и дешевые устройства для обработки образцов, содержащих НК, которые позволяют полностью и частично автоматизировать процесс. Фирмой Millipore Corporation запатентовано устройство для выделения НК из клеток, вирусных частиц и микоплазмы, состоящее из системы фильтрующих элементов (пористых мембран), через которые последовательно пропускают образец (Filter device for the isolation of a nucleic acid, EP 183242 A2). На первой пористой мембране, изготовленной из полисахарида или полиэфирсульфона, выполняется лизис клеток; полученный лизат поступает на стекловолоконный фильтр для последующей очистки и элюции НК. Фильтрующие мембраны соединены системой клапанов. Устройство может быть как одноразового, так и многоразового использования. Для одновременной обработки нескольких образцов несколько фильтрующих устройств могут быть собраны в кассету. Недостатками данного устройства являются необходимость ручного введения реагентов и наличие стадий центрифугирования.
Описан метод очистки НК путем прохождения образца через систему статических смесителей, на которых происходит лизис клеток, осаждение клеточного дебриса, осаждение НК из лизата, с последующими центрифугированием и очисткой методом ионообменной хроматографии (Methods for purifying nucleic acids, WO/2000/005358, фирма Valentis, США). К недостаткам данного способа, так же как и предыдущего, относится необходимость проведения центрифугирования.
Запатентовано устройство для выделения НК (Nucleic acid isolation, WO/2005/012521, Inivitrogen Corp., США), представляющее собой картридж, состоящий из пробирки, соединенной с фильтрующим элементом и далее с колонкой для очистки НК. Фильтрующий элемент содержит несколько слоев фильтров, колонка включает носитель, способный связывать НК, например носитель с переменным зарядом. Манипуляции с образцом осуществляются с помощью шприца или насоса. Недостатком данного метода является необходимость предварительной обработки образца перед введением его в картридж: проведение лизиса клеток, разбавление сыворотки крови и т.п.
В последние 10 лет получили распространение устройства для обработки биологических образцов и выделения НК на основе микрофлюидных или микрожидкостных систем, содержащих сеть микроканалов диаметром 100 мкм и менее, через которые пропускаются биологические образцы и растворы реагентов, а также резервуары, в которых проводится разделение компонентов, очистка, концентрирование и другие процедуры. В состав микрофлюидных систем входят также перемешивающие устройства, микродозаторы, микронасосы, фильтры и др. Описан ряд микрофлюидных устройств для получения очищенных нуклеиновых кислот, которые используют для различных целей, например для проведения ПЦР. Предложены простые микрофлюидные устройства, в которых выделение НК проводится в одну или несколько стадий, а также сложные управляемые компьютером системы, состоящие из многочисленных микроканалов, клапанов и резервуаров.
Примерами достаточно простых устройств являются микрофлюидное устройство для очистки ДНК при взаимодействии образца с диатомитом (Purification and amplification of nucleic acids in a microfluidic device, WO/2008/002725, Bio-Rad, США); микрофлюидное устройство для выделение геномной ДНК из лейкоцитов человека, в котором ДНК из образца связывается с поверхностью канала, модифицированного ДНК-связывающим реагентом (DNA purification and analysis on nanoengineered surfaces, WO/2006/081324); микрочип, в котором очистка ДНК происходит путем последовательного прохождения через серию хроматографических микроколонок, селективно сорбирующих примесные вещества, такие как белки, пептиды, липиды, пектины и др., а последняя колонка селективно связывает ДНК (DNA purification in a multi-stage, multi-phase microchip, WO/2008/058204). Недостатками таких устройств являются низкий выход НК, а также необходимость ручного введения реагентов на разных стадиях выделения и очистки.
Описано микрофлюидное устройство и метод концентрирования и очистки НК из биологических образцов (Methods for nucleic acid isolation and kits using a microfluidic device and concentration step, WO/2005/068627, 3M Innovative Properties company, США), включающее резервуар для загрузки образца и камеры для обработки и перемешивания, соединенные каналами и клапанами. Образец после загрузки подвергается действию лизирующего раствора, переходит далее в камеру для обработки, где проходит несколько стадий концентрирования и разбавления, а также дополнительный лизис и удаление раствора, содержащего ингибиторы, которые мешают проведению ПЦР с полученной ДНК. Недостатком данной системы является возможность лишь частичной очистки НК, в основном, от ингибиторов ПЦР.
Описан микрофлюидный картридж для проведения дифференцированного лизиса клеток различных типов, включающего обработку ультразвуком и лизис с использованием химических агентов, и дальнейшей частичной очистки ДНК (Microfluidic differential extraction cartridge, WO/2005/028635, Microfluidic systems, США). Данный микрофлюидик предназначен, в основном, для лизиса клеток, и с его помощью осуществляется лишь частичная очистка НК.
Предложено монолитное микрофлюидное устройство для экстракции ДНК и РНК, в основном из образцов крови (Nucleic acid purification chip, WO/2005/066343, Сингапур), состоящее из субстрата на основе кремния, входных и выходных отверстий для введения и выведения образца крови, а также буферов для обработки образца в объеме нескольких микролитров, микромешалки, камеры для лизиса, камеры, содержащей ДНК-связывающий материал и систему клапанов. Описан также метод изготовления монолитного устройства, содержащего вышеуказанные компоненты. Данное устройство позволяет выделять НК только из образца определенного типа (кровь).
Для защиты выделенной с помощью микрофлюидных систем ДНК от контаминации предложено устройство для автоматического выделения НК из биологических образцов (Automated nucleic acid isolation, WO/I 997/047967, Sarnoff Corp., Франция), состоящее из кассеты, в которой проводится химическая обработка образца, и съемного запечатанного контейнера для хранения полученной НК.
Примером более сложной микрофлюидной системы является устройство, представляющее собой совокупность модулей, в первом из которых происходит связывание и очистка целевого продукта (НК), а второй модуль является собственно микрофлюидным устройством, осуществляющим детекцию и анализ полученного продукта (Microfluidic devices, WO/2008/030631, фирма Microchip biotechnologies, США). Лизис клеток осуществляется обработкой ультразвуком в проточном режиме. Очистка ДНК осуществляется путем взаимодействия с магнитными частицами, содержащими аффинный носитель. Магнитное поле создается вращающимся магнитным блоком.
Фирмой Siemens (Германия) предложен плоский картридж (карта) для автоматического анализа ДНК или белков, содержащий систему микроканалов и микрополостей, формирующих емкости для содержащихся в них сухих реагентов, а также способ его изготовления методом литья под давлением (Arrangement for integrated and automated DNA or protein analysis in a single-use cartridge, method for producing such a cartridge and operating method for DNA or protein analysis using such a cartridge, WO/2006/042838). Сухие реагенты вносятся в открытые каналы, которые после этого заклеиваются пленкой. Картридж является одноразовым устройством. Образец вносится в готовый к анализу картридж, и результаты получают в полностью автоматическом режиме при помещении картриджа в считывающее устройство.
Описан также ряд микрофлюидных аппаратов, в которых одновременно производится выделение ДНК и ее амплификация, а в ряде устройств - и последующая детекция. Примером такой системы может служить устройство для выделения и амплификации ДНК из биологических жидкостей фирмы Micronics (США) (Method and system for microfluidic manipulation, amplification and analysis of fluids, for example, bacteria assays and antiglobulin testing, WO/2004/065010, патент США 7416892). Устройство представляет собой одноразовую микрофлюидную карту и предназначено для анализа бактерий в биологических жидкостях и диагностики некоторых заболеваний. Карта имеет встроенную фильтрующую мембрану, на которой задерживаются клетки, которые далее подвергаются лизису. Через мембрану последовательно пропускают серию растворов: растворы для отмывки, растворы, содержащие ферменты, растворы для амплификации и детекции. Проводится ПЦР-амплификация полученной ДНК в соответствующем температурном режиме, а далее ПЦР-продукт смывается с мембраны и передается на детектирующий элемент с прозрачным окошком для визуальной детекции.
Описана микрофлюидная система («лаборатория-на-чипе») для детекции некоторых возбудителей инфекционных заболеваний (Университет Пенсильвании, США). В состав системы входит коллектор образца (слюны), одноразовая пластиковая кассета (микрофлюидный чип) для обработки образца, включающая систему для проведения лизиса, экстракции НК, ПЦР, мечения ПЦР-продукта, платформа-контроллер для управления подачей реагентов, температурой, клапанами, а также лазерный сканер для считывания результатов (Z.Chen, M.G.Mauk, J.Wang, W.R.Abrams, P.L.Corstjens, R.S.Niedbala, D.Malamud, H.H.Bau, A microfluidic system for saliva-based detection of infectious diseases. Ann. N.Y.Acad. Sci., 2007, v.1098, p.429-436).
Фирмой Canon U.S. Life Sciences, США предложено устройство для анализа геномной ДНК, состоящее из картриджа, в котором проводится выделение ДНК, инжектора, с помощью которого ДНК передается на микрофлюидный чип, включающий зону для ПЦР-амплификации, зону для детекции и зону для анализа ДНК (Method and molecular diagnostic device for detection, analysis and identification of genomic DNA, WO 2007028084). Выделение ДНК происходит в реакционной камере с использованием магнитных частиц или материалов, меняющих свойства под действием электрического заряда.
Предложен полностью автоматизированный портативный микрофлюидный чип для обнаружения патогенных микроорганизмов методом ПЦР с детекцией в реальном времени (Real-time PCR detection of microorganisms using an integrated microfluidics platform, WO/2006/085948, Cornell Research Foundation, США). Микрочип включает модуль для очистки ДНК, который с помощью микроканалов соединен с модулем для ПЦР-детекции. Лизис клеток проводится в растворе, содержащем хаотропные соли; далее проводится отмывка водно-спиртовым раствором для удаления белков и липидов. Автоматическая система детекции состоит из интегрированного микропроцессора, системы клапанов и насосов, устройств для термоциклирования и флуоресцентной детекции. Детекция осуществляется методом ПЦР в реальном времени с использованием флуоресцентного красителя. Устройство можно использовать как в лабораториях, так и в полевых условиях.
Компанией CombiMatrix Corp., США, разработано миниатюрное микрофлюидное устройство, состоящее из ДНК-микрочипа, содержащего 12000 зондов, и микрофлюидного картриджа, имеющего в своем составе микрофлюидные насосы, мешалки, клапаны, микроканалы, микрорезервуары для реагентов. На чипе осуществляется электрохимический синтез олигонуклеотидных зондов. Перемешивание жидкостей в картридже осуществляется пропусканием микропузырьков, генерируемых электрохимическими микронасосами. Электрохимические насосы также используются для перекачивания жидкостей внутри картриджа. После внесения образца проводится ПЦР и гибридизация на микрочипе. Устройство полностью автономно, т.е. не требуется никаких внешних источников реагентов, насосов и т.п., что устраняет возможность контаминации образца. Устройство использовали для идентификации субтипов вируса гриппа А генотипированием участков генов гемагглютинина и нейраминидазы (R.H.Liu, M.J.Lodes, Т.Nguyen, Т.Siuda, M.Slota, H.S.Fuji, A.McShea, Validation of a fully integrated microfluidic array device for influenza A subtype identification and sequencing. Anal. Chem., 2006, v.78, p.4184-4193), а также для исследования экспрессии генов клеток лейкемии человека (R.H.Liu, Т.Nguyen, К.Schwarzkopf, H.S.Fuji, A.Petrova, T.Siuda, К.Peyvan, M.Bizak, D.Danley, A.McShea, Fully integrated miniature device for automated gene expression DNA microarray processing. Anal. Chem., 2006, v.78, p.1980-1986).
Анализ научной и патентной литературы позволяет сделать вывод, что в настоящее время существует множество способов выделения и очистки НК, некоторые из которых позволяют осуществлять автоматизацию процесса. Однако, несмотря на то что разработан ряд устройств для автоматического получения НК, не существует универсального устройства, которое позволяет быстро, воспроизводимо и с высоким выходом выделять НК из биологических образцов в полностью автоматическом режиме. Существующие автоматические роботизированные системы дороги, громоздки и сложны в использовании, а более простые системы осуществляют либо неполную очистку НК, либо выход НК недостаточен, либо они предназначены для выделения ДНК из образца определенного типа, например только из крови, слюны и др., либо проводят анализ образца на наличие одного конкретного заболевания.
В лабораториях РФ в настоящее время все процедуры выделения и очистки нуклеиновых кислот из клинического материала производятся вручную. Отсутствие недорогой и надежной аппаратуры, позволяющей автоматизировать процедуру обработки клинических образцов, создает условия повышенного риска заражения инфекционным материалом, а также приводит к возникновению ложноположительных и ложноотрицательных результатов. Последнее неизбежно сказывается на профилактике здоровья населения и эффективности лечения больных.
Таким образом, в данной области существует острая потребность в разработке устройства для автоматизированного выделения НК, которое бы выгодно отличалось от известных из уровня техники решений простотой проведения анализа, эффективностью выделения (высоким выходом) НК, а также невысокой стоимостью.
Раскрытие изобретения
Первый аспект изобретения относится к сменному микрофлюидному модулю для автоматизированного выделения и очистки нуклеиновых кислот из биологических образцов, содержащему резервуары для реагентов и реакционные объемы, микроканалы и клапана, необходимые для перемещения жидкостей внутри модуля. Микрофлюидный модуль включает:
а) приемную камеру для ввода образца;
б) резервуар для лизиса, содержащий мембрану для задерживания на ней клеток микроорганизмов и/или вирусных частиц;
в) резервуары для растворов лизирующего буфера, содержащего реагенты для эффективного разрушения клеточной стенки и/или вирусного капсида;
г) микроколонку, содержащую твердофазный сорбент для связывания нуклеиновых кислот;
д) резервуары для промывочного буфера и этанола для промывки микроколонки с целью удаления остаточных белков и кристаллов соли;
е) резервуар для элюирующего буфера для растворения нуклеиновых кислот, связанных на твердофазном сорбенте в микроколонке;
ж) выходной порт, совместимый со стандартной микропробиркой;
з) резервуар для сбора отходов реакций.
В одном из своих воплощений сменный микрофлюидный модуль характеризуется тем, что он содержит только пневматические клапана, осуществляющие коммутацию газожидкостных потоков, в то время как все необходимые электромагнитные компоненты, осуществляющие подачу давления, нагрев, перемешивание в индивидуальных резервуарах модуля, размещены в управляющей установке-контроллере.
В своем следующем воплощении микрофлюидный модуль характеризуется тем, что в резервуаре для лизиса модуль содержит металлический стержень в инертной оболочке, необходимый для осуществления перемешивания на стадии лизиса.
Наконец, еще в одном своем воплощении микрофлюидный модуль характеризуется тем, что модуль выполнен из материалов, инертных по отношению к используемым реагентам и не сорбирующих НК. Могут быть использованы материалы, такие как, например, полипропилен, оргстекло, латекс, силикон, но не ограничиваясь ими.
Другим аспектом изобретения является способ автоматизированного выделения и очистки нуклеиновых кислот из биологических образцов с использованием сменного микрофлюидного модуля, содержащего набор реагентов, необходимых для осуществления процедуры выделения НК.
Способ характеризуется тем, что все манипуляции по выделению и очистке НК выполняются внутри сменного микрофлюидного модуля, изолирующего образец от внешней среды.
Способ предусматривает следующие последовательные стадии, выполняемые в автоматическом режиме, после ввода исследуемого образца в приемную камеру микрофлюидного модуля:
а) фильтрация биологического образца через мембрану, задерживающую клетки микроорганизмов и/или вирусы;
б) лизис задержанных на мембране клеток микроорганизмов и/или вирусов;
в) связывание нуклеиновых кислот на микроколонке, содержащей твердофазный сорбент;
г) отмывка нуклеиновых кислот от белков и кристаллов соли на колонке с твердофазным сорбентом;
д) элюция нуклеиновых кислот с микроколонки в отдельную пробирку.
В одном из воплощений способ характеризуется тем, что на стадии (а) фильтрацию биологического образца осуществляют через мембрану с целью задерживания на ней микроорганизмов и вирусов. Мембрану для фильтрации выбирают из группы мембран, включающей мембраны из поливинилидендифторида, боросиликатного стекла, целлюлозные мембраны, но не ограничиваясь ими.
В своем следующем воплощении способ характеризуется тем, что лизис микроорганизмов и вирусов на мембране на стадии (б) осуществляется путем последовательной обработки реагентами, разрушающими клеточные стенки бактерий и/или оболочки вирусных частиц. В качестве ферментов для разрушения клеточных стенок и мембран используют лизоцим, субтилизин, протеиназу К и другие ферменты. Далее добавляют лизирующий буфер, содержащий хаотропный агент в высокой концентрации (3-6 моль/л). Хаотропные реагенты выбирают из группы солей гуанидина, например гуанидинтиоцианат или гуанидингидрохлорид, но не ограничиваясь ими.
В своем следующем воплощении способ характеризуется тем, что на стадии (в) осуществляют сорбцию НК на твердофазном сорбенте в присутствии раствора хаотропного агента в высокой концентрации (3-6 моль/л) путем пропускания лизата через микроколонку, содержащую твердофазный сорбент. Твердофазный сорбент выбирают из группы сорбентов, включающей силикагели, стекловолоконные фильтры, химически модифицированное стекло.
В еще одном из воплощений способ характеризуется тем, что на стадии (г) отмывку от белков и кристаллов соли проводят путем последовательного пропускания через микроколонку, содержащую связанные на твердофазном сорбенте НК, растворов промывочного буфера и этанола из соответствующих резервуаров сменного модуля, а смыв НК с микроколонки осуществляют путем пропускания элюирующего буфера, подаваемого из соответствующего резервуара микрофлюидного модуля, через микроколонку в отдельную микропробирку.
В еще одном своем воплощении способ характеризуется тем, что стадии (а)-(д) выполняются последовательно в автоматическом режиме в сменном микрофлюидном модуле, который помещается в установку-контроллер, управляемый программным обеспечением, реализующим алгоритм управления клапанами, осуществляющими перемещение растворов биологического образца и реагентов в резервуарах сменного модуля.
В качестве биологического образца для выделения и очистки НК могут быть использованы образцы сыворотки крови, плазмы крови или культуральные жидкости, содержащие клетки микроорганизмов и/или вирусные частицы.
Другие аспекты настоящего изобретения будут ясны из прилагаемых фигур, подробного описания и формулы изобретения.
Предлагаемое изобретение иллюстрируется следующими фигурами, на которых:
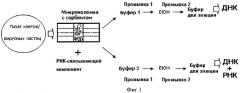
Фиг.1 представляет схему селективной экстракции НК из лизата клеток и/или вирусных частиц на микроколонке, содержащей твердофазный сорбент.
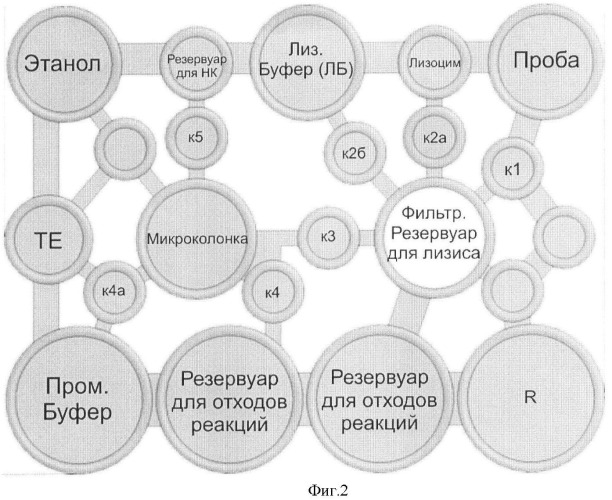
Фиг.2 представляет принципиальную схему (конфигурацию) сменного модуля с обозначением резервуаров с необходимыми реагентами, а также объемов, в которых осуществляется лизис бактериальных клеток/вирусных частиц и экстракция НК.
Обозначения: к1, к2а, к2б, к3, к4, к4а, к5 - жидкостные/воздушные клапана.
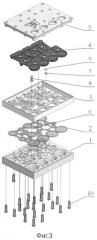
Фиг.3 представляет конструктивные элементы сменного модуля. Обозначения:
1 - основная рабочая платформа, формирующая резервуары (оргстекло);
2 - эластичная мембрана (нитрил);
3 - полукорпус (оргстекло);
4 - вставка каналообразующая, самогерметизирующаяся, с пробками, прокалываемыми для заправки модуля (латекс);
5 - верхняя крышка (оргстекло);
6 - стержень стальной в тефлоновой оболочке (мешальник);
7 - кольцо уплотнительное (латекс);
8 -мембрана (фильтр) для концентрирования клеток;
9 - цилиндр с суспензией силикагеля (микроколонка);
10 - фиксирующие клипсы.
Фиг.4А представляет фотографию сменного модуля с заправленными реагентами в сборе.
Фиг.4Б представляет элементы сменного модуля (рабочая платформа и полукорпус).
Фиг.5 представляет фотографию управляющей установки-контроллера (вид сверху) с подсоединенным сменным модулем.
Обозначения:
1 - электроклапаны;
2 - форсунки.
Фиг.6 представляет схему устройства пневмоклапанов и резервуаров для хранения растворов сменного модуля для выделения НК.
Обозначения:
1 - резервуар с раствором;
2 - каналы для перетекания раствор